医疗器械产品技术要求(防护眼罩)
医用防护口罩的技术要求简述范文

医用防护口罩的技术要求简述范文医用防护口罩是一种用于医疗环境下的口罩,其主要作用是防止病原体传播,保护医务人员和患者的健康。
为了保证医用防护口罩的有效性和安全性,有一些技术要求需要满足。
下面将对医用防护口罩的技术要求进行简述。
一、材料选择与合格标准:医用防护口罩应选用与人体皮肤接触没有不良反应、无致敏性和刺激性的材料。
具体要求如下:1.外层材料应具有防水功能,可选择无纺布材料,其防水性能应满足相关标准;2.中层材料应具有过滤功能,可选择微纤维材料(如熔喷布),其过滤效率应满足相关标准;3.内层材料应具有亲肤性,不易引起皮肤过敏或刺激。
二、结构设计与合格标准:医用防护口罩的结构设计应合乎人体工程学原理,保证佩戴舒适,同时符合以下要求:1.口罩应具有良好的密封性能,能够有效阻止外界空气和微粒进入口腔和鼻腔;2.口罩的鼻夹部分应具有可调节性,以便适应不同人的鼻梁形状;3.口罩的耳带或头带应具有良好的张力,确保可以牢固地固定在头部;4.口罩的边缘应具有良好的弹性,以适应不同脸型;5.口罩的设计应尽量避免产生眼镜起雾等问题。
三、过滤效率与防护性能:医用防护口罩的过滤效率是评价其防护性能的重要指标之一。
具体要求如下:1.对于颗粒物的过滤效率,医用防护口罩应满足特定颗粒物(如0.3微米的颗粒物)的过滤效率要求,通常要求达到95%以上;2.对于液体的防护性能,医用防护口罩应具有一定的防液性能,能够有效阻挡飞溅物进入口腔和鼻腔。
四、透气性与舒适性:医用防护口罩应具有适当的透气性,使呼吸畅通,同时具备良好的舒适性,避免对佩戴者的不良影响。
具体要求如下:1.口罩的材料应具有一定的透气性,使呼吸不受限制;2.口罩的内部设计应能有效减少热量和湿气的聚集,以减轻佩戴者的不适感;3.口罩的重量应尽量轻,以减轻佩戴者的负担。
五、耐用性与易用性:医用防护口罩应具有一定的耐用性和易用性,便于医务人员使用。
具体要求如下:1.口罩的耐用性应达到一定的标准,能够在正常使用条件下保持其性能稳定,不易破损;2.口罩的易用性应考虑到佩戴者的便利性,方便佩戴和取下,且不易滑落或褪色;3.口罩的存储和包装应符合相关要求,保证产品的质量和卫生。
详细的医疗器械产品技术要求范本

详细的医疗器械产品技术要求范本一、引言医疗器械产品的技术要求是确保产品安全、有效和质量可控的重要文件。
它详细规定了产品的性能指标、检验方法、使用说明等关键信息,为产品的研发、生产、检验和监管提供了明确的依据。
本文将为您提供一份详细的医疗器械产品技术要求范本,以供参考。
二、产品名称及型号规格(一)产品名称具体产品名称(二)型号规格列出产品的所有型号规格,包括尺寸、颜色、配置等差异三、性能指标(一)物理性能1、外观产品表面应平整、光滑,无明显划痕、裂缝、变形等缺陷。
2、尺寸产品的长、宽、高应符合设计要求,允许偏差为±具体数值。
3、重量产品的重量应在规定范围内,允许偏差为±具体数值。
(二)化学性能1、材料成分产品所使用的材料应符合相关标准,明确其化学成分和含量。
2、耐腐蚀性能产品应具有良好的耐腐蚀性能,在规定的试验条件下,不应出现腐蚀现象。
(三)电气性能1、电源要求产品的电源输入应符合具体标准,电压范围为具体数值,频率为具体数值。
2、绝缘电阻产品的绝缘电阻应大于具体数值。
3、漏电流产品的漏电流应小于具体数值。
(四)机械性能1、强度产品应具有足够的强度,能够承受正常使用和运输过程中的各种应力。
2、稳定性产品应具有良好的稳定性,在正常使用条件下不应发生倾倒或失衡现象。
(五)生物学性能1、生物相容性产品与人体接触部分应符合生物相容性要求,如无刺激、无致敏、无细胞毒性等。
2、无菌/消毒对于无菌产品,应确保产品无菌;对于非无菌产品,应明确消毒方法和消毒效果。
四、检验方法(一)物理性能检验1、外观检验采用目视法,在正常光线下距离产品具体距离处观察。
2、尺寸检验使用精度符合要求的量具进行测量。
使用精度符合要求的电子秤进行称量。
(二)化学性能检验1、材料成分检验采用化学分析方法,如光谱分析、色谱分析等。
2、耐腐蚀性能检验按照相关标准进行盐雾试验或其他腐蚀试验。
(三)电气性能检验1、电源要求检验使用符合标准的电源测试仪进行测试。
医用防护面罩

医用防护面罩1范围本标准规定了医用防护面罩(以下简称“面罩”)的材料及结构组成、技术要求、试验方法、检验规则、标志和使用说明、包装和贮存。
本标准适用于在医疗工作环境下,采用口鼻处或全面部密封结构,增加防护镜片和过滤装置,用于过滤空气中的颗粒物,阻隔飞沫、血液、体液、分泌物,对医护人员口鼻部、面部提供全方位防护的一次性使用自吸过滤式医用防护面罩产品。
2规范性引用文件下列文件对于本标准的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本标准分册。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本标准。
GB/T191-2008包装储运图示标志GB/T2410-2008透明塑料透光率和雾度的测定GB/T4745-2012纺织品防水性能的检测和评价沾水法GB/T14233.1-2008医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T16886.10-2015医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB19083-2010医用防护口罩技术要求GB/T19633.1最终灭菌医疗器械包装第1部分:材料、无菌屏障系统和包装系统的要求3术语和定义3.1过滤效率filtering efficiency在规定条件下,面罩对空气中的颗粒物滤除的百分数。
3.2密合性fit面罩周边与具体使用者面部的密合程度。
4材料及结构组成4.1材料面罩由医用聚氯乙烯(PVC)、聚丙烯(PP)和聚对苯二甲酸乙二醇酯(PET)制成;硅胶型面罩主体结构由医用硅胶制成。
4.2结构组成面罩依据面部口鼻处和眼处保护方式和效果不同进行划分:一级,口鼻防护与面部隔离型,分为充气型和免充气型,由口鼻罩体、过滤装置和防护镜片等结构组成;二级,口鼻防护与全面部密封隔离型,由口鼻罩体、面罩体和过滤装置等结构组成。
4.2.1面罩(一级)由口鼻罩体、过滤装置、防护镜片、固定带和调节帽组成;过滤装置由保护壳、过滤壳和过滤膜组成。
9产品技术要求-医用防护服非无菌型
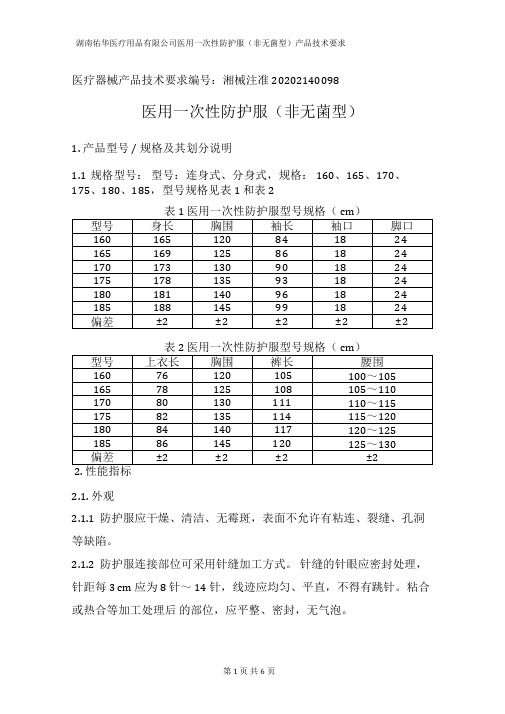
医疗器械产品技术要求编号:湘械注准20202140098医用一次性防护服(非无菌型)1. 产品型号/ 规格及其划分说明1.1规格型号:型号:连身式、分身式,规格:160、165、170、175、180、185,型号规格见表1 和表2表1 医用一次性防护服型号规格(cm)表2 医用一次性防护服型号规格(cm)2.1. 外观2.1.1防护服应干燥、清洁、无霉斑,表面不允许有粘连、裂缝、孔洞等缺陷。
2.1.2防护服连接部位可采用针缝加工方式。
针缝的针眼应密封处理,针距每3 cm 应为8 针~14 针,线迹应均匀、平直,不得有跳针。
粘合或热合等加工处理后的部位,应平整、密封,无气泡。
2.1.3装有拉链的防护服拉链不能外露,拉头应能自锁。
2.2结构2.2.1防护服由连帽上衣、裤子组成,可分为连身式结构和分身式结构。
连身式和分身式结构分别见图1 、图2 。
2.2.2防护服的结构应合理,穿脱方便,结合部位严密湖南佑华医疗用品有限公司医用一次性防护服(非无菌型)产品技术要求2.2.3袖口、脚踝口、帽子面部收口及腰部采用弹性收口。
2.3号型规格防护服号型分为160、165、170、175、180、185,号型规格详见表1 和表22.4液体阻隔功能2.4.1抗渗水性防护服关键部位静水压应不低于1.67 kPa (17cm H 20)。
2.4.2透湿量防护服材料透湿量应不小于2500g/(m2? d)2.4.3抗合成血液穿透性防护服抗合成血液穿透性应不低于表3 中2 级的要求。
表3 抗合成血液穿透性分级2.4.4防护服外侧面沾水等级应不低于3 级的要求。
2.5断裂强力防护服关键部位材料的断裂强力应不小于45N。
2.6断裂伸长率防护服关键部位材料的断裂伸长率应不小于15%。
2.7过滤效率防护服关键部位材料及接缝处对非油性颗粒的过滤效率应不小于70%。
2.8阻燃性能具有阻燃性能的防护服应符合下列要求:a)损毁长度应不大于200mm;b)续燃时间不超过15s;c)阴燃时间不超过10s。
医疗器械产品技术要求格式

医疗器械产品技术要求格式
1. 引言
医疗器械产品的技术要求是确保产品质量和安全性的重要指标。
本文将介绍医疗器械产品技术要求的格式规范。
2. 技术要求内容
医疗器械产品技术要求应包括以下内容:
2.1 产品名称和型号
在技术要求的开头应明确标注产品的名称和型号,以便快速识
别和辨认。
2.2 技术规范
技术要求应包含产品的技术规范,其中应详细说明产品的基本
参数、性能指标、使用方法等。
2.3 材料要求
对于涉及到材料的医疗器械产品,技术要求应明确规定所使用
的材料类型、材料特性、生物相容性等要求。
2.4 设计要求
技术要求应明确产品的设计要求,包括外观设计、结构设计、
功能设计等方面的要求。
还应包括产品的尺寸、重量、颜色等要求。
2.5 生产要求
技术要求应包含产品的生产要求,包括生产工艺、生产设备、生产环境等方面的要求。
2.6 质量控制要求
技术要求应明确产品的质量控制要求,包括检验方法、质量标准、质量控制流程等。
2.7 安全要求
技术要求应包含产品的安全要求,包括使用安全、运输安全、储存安全等方面的要求。
2.8 包装要求
技术要求应明确产品的包装要求,包括包装材料、包装方式、包装规格等。
2.9 标志和标签要求
技术要求应明确产品的标志和标签要求,包括产品标志、警示标识、使用说明等。
2.10 样品要求
技术要求应包含对样品的要求,包括样品数量、样品接受标准等。
3.
医疗器械产品技术要求的格式应该包含清晰明确的内容,保证产品的质量和安全性。
以上是医疗器械产品技术要求的格式规范。
医用防护口罩(KN95口罩,非国外N95口罩)产品技术要求-符合GB19083-2010医用防护口罩技术要求

医疗器械产品技术要求编号:一次性使用医用口罩(II类无菌医疗器械)依据:GB19083-2010医用防护口罩技术要求,指标无删减1.产品型号/规格及其划分说明1.1型号规格型号:***规格:***cm×***cm、***cm×***cm、***cm×***cm1.1.1型号命名说明平面耳挂式********1.2产品结构示意图……1.3型号规格划分说明……2.性能指标2.1口罩基本要求口罩应覆盖佩戴者的口鼻部,应有良好的面部密合性,表面不得有破洞、污渍,不应有呼气阀。
2.2鼻夹2.2.1口罩上应配有鼻夹。
2.2.2鼻夹应具有可调节性。
2.3口罩带2.3.1口罩带应调节方便。
2.3.2应有足够强度固定口罩位置,每根口罩带与口罩体连接点的断裂强力应不小于10N。
2.4过滤效率在气体流量为85L/min情况下,口罩对非油性颗粒过滤效率应符合表1的要求。
表1过滤效率等级等级过滤效率%1级≥952级≥993级≥99.972.5气流阻力在气体流量为85L/min情况下,口罩的吸气阻力不得超过343.2Pa(35mmH2O)。
2.6合成血液穿透将2mL合成血液以10.7Kpa(80mmHg)压力喷向口罩,口罩内侧不应出现渗透。
2.7表面抗湿性口罩表面沾水等级应不低于GB/T4745-1997中3级的测定。
2.8微生物指标2.8.1口罩应符合GB15979-2002中微生物指标的要求,见表2。
2.8.2包装标志上有灭菌或无菌字样的口罩应无菌。
表2口罩微生物指标细菌菌落综述CFU/g 大肠杆菌绿脓杆菌金黄色葡萄球菌溶血性链球菌真菌菌落综述CFU/g≤200不得检出不得检出不得检出不得检出≤100 2.9环氧乙烷残留量经环氧乙烷灭菌的口罩,其环氧乙烷残留量应不超过10μg/g。
2.10阻燃性能所用材料不应具有易燃性。
虚燃时间应不超过5s。
2.11皮肤刺激性口罩材料原发刺激计分应不超过1。
医疗器械产品技术要求
产品技术要求编号:鲁械注准20152640419
一次性使用敷料包
1. 产品型号/规格及其划分说明
1.1 规格型号为:产包、手术包、换药包
1.2 产品的组成:敷料包由手术衣(套袖)、手术单(洞巾、大产单、小产单、臀垫、会阴垫、裤腿)、手术帽、医用外科口罩、灭菌橡胶外科手套作为基本配置。
手术衣、手术单、手术帽所使用无纺布材料相同。
绑扎胶布、外科纱布敷料、纱布绷带、脐带卷、脐带绳作为可选配置。
2. 性能指标
2.1 生产要求
一次性使用敷料包的生产环境应符合YY/T 0506.1的要求。
2.2 敷料包的物理性能
2.2.1 外观
各组件外观应平整、无皱褶、无毛絮、无明显破洞等缺陷。
2.2.2 尺寸
2.2.2.1各组件的尺寸应符合表1—表6要求。
手术包组成应符合表7规定,产包组成应符合表8规定,换药包组成应符合表9规定。
表1 单位:mm
表5 单位:mm
表6 单位:mm
2.2.2.2缝制
组件缝制针距应不低于18针/10cm,应无漏针、跳针。
2.3 敷料包各组件的技术要求
2.4 无菌
一次性使用敷料包应无菌。
2.5环氧乙烷残留量
采用环氧乙烷灭菌,一次性使用敷料包环氧乙烷残留量应不大于5μg/g。
一次性使用麻醉面罩技术要求
一次性使用麻醉面罩技术要求医疗器械产品技术要求编号:一次性使用麻醉面罩1. 产品型号/规格及其划分说明1.1 规格型号1.1.1一次性使用麻醉面罩尺寸规格型号分为新生儿型、婴儿标准型、儿童标准型、成人小型、成人中型、成人大型、成人加大型,共7种规格。
1.2 划分说明1.2.1 一次性使用麻醉面罩示意图11、面罩罩壳,2、固定环,3、面罩气垫,4、气垫单向阀图1:一次性使用麻醉面罩1.2.2一次性使用麻醉面罩尺寸规格型号按照适用对象的不同来进行划分。
2. 性能指标2.1 物理指标2.1.1 外观当用正常视力或矫正视力在2.5倍放大条件下检验时,一次性使用麻醉面罩不得有毛边、毛刺、气泡及缺损等注塑缺陷,表面必须清洁无杂质,要有足够的透明度,粘接面牢固,且不得有胶粘物质。
2.1.2 尺寸2.1.2.1 一次性使用麻醉面罩气垫基本尺寸示意图2:图2:一次性使用麻醉面罩气垫麻醉面罩型号a ±2.0 b ±2.0 c ±2.0 d ±2.0 e ±2.0新生儿型61.00 40.00 47.70 26.70 12.00 婴儿标准型74.00 47.80 63.20 40.20 14.50 儿童标准型86.50 62.50 84.00 60.00 18.00 成人小型111.50 85.50 94.50 68.50 22.00成人中型120.00 89.00 94.70 63.70 35.80成人大型121.80 90.80 105.60 74.60 36.00成人加大型121.80 90.80 105.60 74.60 36.002.1.2.2 一次性使用麻醉面罩主体基本尺寸示意图3:图3:一次性使用麻醉面罩罩壳号型?A(mm)?B(mm)C±1.0(mm)D±2.0(mm)E±1.0(mm)F±1.0(mm) 新生儿型15.47±0.04 10.0 16 31.4 41.6 54.9 婴儿标准型15.47±0.04 10.0 16 36.9 61.6 68.8 儿童标准型27.0 22.37±0.04 21 44.9 74.4 83.7 成人小型27.0 22.37±0.04 21 52.9 86.6 106.5 成人中型27.0 22.37±0.04 21 56.0 88.6 116.0 成人大型27.0 22.37±0.04 21 56.0 92.4 116.0 成人加大型27.0 22.37±0.04 21 62.4 96.0 116.52.1.2.3 一次性使用麻醉面罩基本尺寸示意图4:图4:一次性使用麻醉面罩罩壳号型A ±2.0(mm) B ±2.0(mm) C±4.0(mm) 新生儿型61.00 47.70 43.50婴儿标准型74.00 63.20 51.00儿童标准型86.50 84.00 63.00成人小型111.50 94.50 75.00成人中型120.00 94.70 91.00成人大型121.80 105.60 92.00成人加大型121.80 105.60 98.502.1.2.4 一次性使用麻醉面罩的接头配合位置应符合圆锥接头相关标准(YY 1040.1-2003/ISO 5356-1:1996)的要求。
医疗器械产品技术要求模板
医疗器械产品技术要求模板为提高医疗器械技术审评的规范性和科学性,指导医疗器械注册人/备案人进行产品技术要求的编写,根据《医疗器械监督管理条例》《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》等规定,制定本指导原则。
一、适用范围本指导原则适用于申请注册或备案的医疗器械产品,包括体外诊断试剂产品。
本指导原则仅对医疗器械产品技术要求的格式和内容提出一般要求,不对具体产品的具体要求进行规定。
指导原则中给出的示例仅供参考,相关监管机构及注册人/备案人应根据具体情形进行细化。
二、基本要求(一)产品技术要求的编制应符合国家相关法律法规。
(二)产品技术要求应采用规范、通用的术语。
如涉及特殊的术语,需提供明确定义,并写入“4.术语”部分。
直接采用相关标准、指导原则中的术语或其他公认术语的,不需要在技术要求“4.术语”部分重复列明。
不应使用与上述术语名称相同但改变了原义的自定义术语。
(三)产品技术要求中检验方法各项内容的编号原则上应与性能指标各项内容的编号相对应。
(四)产品技术要求中的文字、数字、公式、单位、符号、图表等应符合相关标准化要求。
(五)如产品技术要求中的内容引用国家标准、行业标准的,应注明相应标准的编号和年代号。
三、主要内容产品技术要求的内容一般包括产品名称,型号、规格及其划分说明(必要时),性能指标,检验方法,术语(如适用)及附录(如适用)。
(一)产品名称产品技术要求中的产品名称应使用中文,并与申请注册或备案的产品名称相一致。
(二)型号、规格及其划分说明产品技术要求中应明确产品型号、规格。
对同一注册单元中存在多种型号、规格的产品,应明确不同型号、规格的划分说明(推荐采用图示和/或表格的方式),表述文本较多的内容可以在附录中列明。
对包含软件的产品,应明确软件发布版本和软件完整版本命名规则。
(三)性能指标1. 产品技术要求中的性能指标是指可进行客观判定的成品的功能性、安全性指标。
对产品安全有效性不产生实质性影响的项目可不在技术要求性能指标处列明。
医用防护口罩技术要求
医用防护口罩技术要求
随着世界各地新型冠状病毒的传播,医用防护口罩(无菌)的需求量大大增加。
医用防护口罩是一种重要的医疗器械,用于保护医务人员和患者免受病毒和细菌的感染。
为了确保医用防护口罩的有效性和安全性,有一些关键的技术要求需要遵循。
1.材料选择
2.细菌过滤效率
3.透气性能
4.合适的佩戴
5.耐用性和保护期限
6.无菌性能
7.有效的密封性
8.符合标准要求
总结:
医用防护口罩(无菌)的技术要求包括材料选择、细菌过滤效率、透气性能、合适的佩戴、耐用性和保护期限、无菌性能、有效的密封性以及符合标准要求。
这些要求是确保口罩的有效性和安全性的关键。
医用防护口罩的制造商应严格遵循这些要求,确保产品的质量和可靠性,以保护佩戴者和患者的健康安全。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
医疗器械产品技术要求
医疗器械产品技术要求编号:
防护眼罩
L O产品型号/规格及其划分说明:
1・1产品型号:
封闭型透明眼罩型号:(150≡*72≡)
1.2产品规格:
不规则单镜片水平基准长度X垂直高度:15Omm×72mm,厚度2mm;松紧带长度*宽度*厚度
40Omm*15mm*l. 5mm
1. 3产品标志:
产品标记分别由品牌代号(YY)、产品名称代号(YZ)、结构代号(T)和规格(130*72MM)四部分组成。
如下所示:
**—**—** (150mm*72mm)
-------- 结构代号:透明型结构用“T”标记:
------------- 产品名称代号:用“YZ”表示,是“眼罩”的汉语拼音首写字母: ------------------ 品牌代号:用“YY”表示•是“公司”汉语拼音首写字母。
1.4产品材料:
聚碳酸脂镜片、乙烯镜框、涤纶松紧带。
2.O性能指标:
GB/T191-2008包装储运图示标志;
GB/T 3923. 1-2013纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测
定条样法
GB/T 16886. 10-2017医疗器械生物学评价笫10部分:刺激与皮肤致敬试验
GB/14866-2006个人用眼护具技术要求
GB/T2828. 1-2012汁数抽样检验程序第1部分:按接收质量限(AQL)检查的逐批检查及抽样讣划;
GB/T2829-2002周期检验汁数抽样程序及表(适用于对过程稳定性的检验);
GB/T 9969-2008工业产品使用说明书总则;
YY0466-2009医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求。
3.0检验方法:
3.1要求:
3.1. 1产品外观:各配件表面应平整、洁净、无破损,要求表面光滑、无毛刺、无锐角,松紧带无抽丝起球,配戴后无引起眼面部不舒适感和影响正常视力的其他表面缺陷;
3.1.2外形尺寸:应符合1.2的规定,正负偏差为±0.5mm:
3.1.3视野:单镜片组成的眼而护具最小下方视野为67。
3.1.4镜片光学性能
3.1.
4.1表面质量及内在疵病
要求镜片中心范用平滑、着色均匀、没有划痕、条纹、气泡、霊斑、橘皮、霍光、异物或有损光学性能的其他缺陷。
眼罩表而光滑、无突然袭击起物、薄厚均匀,不得有起层及汽泡等缺陷。
3.1.
4.2镜面可见光透射比
无色透明镜片,可见光透射比应大于或等于0.89。
3.1.
4.3镜面颜色
镜片的颜色差、光密度(d)值不得超过0.4m。
3. 1.
4.4屈光度偏差
平光镇片屈光度偏盖为D B
3. 1.
4.5镜面平行度
平而型镜片
平面型镜片三棱镜偏差不得超过0.125A O
3. 1. 5镜而非光学性能
3. 1.5.1抗冲击性能
按GB/14866-2006之6. 2规定的方法测试符合GB/14866-2006之5. 7标准条款。
3. 1. 5 .2表面耐磨性能
按GB/14866-2006之6. 5规定的方法测试符合GB/14866-2006之5. 10标准条款。
3. 1. 5. 3防高速粒子冲击性能
按GB/14866-2006之6. 6规定的方法测试符合GB/14866-2006之5. 11标准条款。
3. 1.5. 4化学雾滴防护性能
按GB/14866-2006之6. 8规定的方法测试符合GB/14866-2006之5. 13标准条款。
3. 1. 5. 5粉尘防护性能
按GB/14866-2006之6. 9规定的方法测试符合GB/14866-2006之5. 14标准条款。
3. 1. 5. 5刺激性气体防护性能
按GB/14866-2006之6. 10规定的方法测试符合GB/14866-2006之5. 13标准条款。
3.1.6松紧带拉伸性能
按GB/T 3923. 1-2013纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定(条样法),测试符合标准要求。
3. 1.7生物安全性:
a.致敬性试验:按GB/T 16886. 10-2005中第7章规定的方法进行,应无致敬反应;
b.皮肤刺激性试验:按GB/T 16886. 10-2005中笫6章规定的方法进行,应不大于极轻微刺激反应。
3. 2试验方法:
a.外观:用目力检查,应符合3. 1.1的规定;
b.规格尺寸:用带表卡尺检测符合3.1.2的规定;
3.3检验规则:
3. 3. 1检验分类:
检验分逐批检验(出厂检验)和周期检验;
3. 3. 1. 1逐批检验:
a.通气鼻贴的逐批检验按GB/T 2828. 1-2012的要求进行;
b.通气鼻贴抽样方案采用一次抽样方案,其缺陷分类、检验项Ll、检验水平和接收质量限按表1的规定:
在下列情况之一时,一般应进行周期检验:
a.新产品投产前或产品注册时;
b.连续生产中每年不少于一次;
c.停产半年以上恢复生产时;
d.在设讣、工艺或材料有重大改变时;
e国家监督机构对产品质量进行监督检验时。
3. 3. 3. 2周期检验:
按GB/T 2829-2002规定进行,从逐批检验合格批中按规定抽取一定数量进行全性能检测,采用一次抽样方案,其缺陷分类、检查项口、抽样方案和不合格质量水平(RQL) 按表2的规定;
表2
3.3. 3. 3在验收过程中,供需双方对产品质量发生争议时,Ill供需双方协商送第三方复检或山法定质量检验机构进行仲裁检验。
4.O术语:
4.1产品分类:
按医疗器械管理分类,产品属医用高分子材料及制品,应为管理类别I类;
4.2产品组成:
山表面材料;
4.3标志、包装、运输、贮存:
4. 3. 1标志
4. 3. 1. 1小包装上应有下列标志:
a.生产企业名称;
b.产品名称;
C.注册号;
d.标准号。
4. 3. 1. 2检查合格证上应有下列标志:
a.制造丿名称;
b.产品名称、规格、数量;
c.生产批号或生产日期;
d.检验员签名或代号。
4. 3.1. 3大包装上应有下列标志:
a.生产企业名称、注册地址、生产地址、联系方式;
b.产品名称;
c.生产许可证;
d.注册号;
e.执行标准号;
f.数量;
g.生产批号和生产日期;
h.储运标志:应符合GB/T 191和YY 0466. 1中规定,箱上的字样或标志应能保证不因
历时较久模糊不清。
4.3. 2包装:
a.小包装为纸盒等,大包装为纸箱等,箱内应有检验合格证;
b.使用说明书的编写应符合GB/T 9969和《医疗器械说明书、标签和包装标识管理规
定》的规定;
4.3. 3运输:
按订货合同规定,但必须防止暴晒雨淋,小心轻放;
4. 3. 4贮存:
包装后的成品应贮存在阴凉避光,相对湿度不大于80%,无腐蚀性气体,通风良好的室内,有效期为3年。
