络合滴定指示剂培训资料
络合滴定

4、指示剂的封闭、僵化现象及消除方法
指示剂的封闭现象:化学计量点时不见指示剂变色
产生原因: 干扰离子: KNIn > KNY →指示剂无法改变颜色
消除方法:加入掩蔽剂 例如:滴定Ca2+和Mg2+时加入三乙醇胺掩蔽Fe3+,AL3+ 以消除其对EBT的封闭
待测离子: KMY < KMIn→M与In反应不可逆或过慢
1. 铬黑T(EBT) 终点:酒红→纯蓝 适宜的pH:7.0~11.0(碱性区) 缓冲体系:NH3-NH4CL 封闭离子:AL3+,Fe2+,(Cu2+,Ni2+) 掩蔽剂:三乙醇胺,KCN 2. 二甲酚橙(XO) 终点:紫红→亮黄 适宜的pH范围 <6.0(酸性区) 缓冲体系:HAc-NaAc 封闭离子:AL3+,Fe2+,(Cu2+,Co2+,Ni2+) 掩蔽剂:三乙醇胺,氟化胺
第一章
第三节
滴定分析法
络合滴定法
一 二 三 四 五 六 七
络合滴定法的概述 EDTA与金属离子的络合物及其稳定性 酸度对络合滴定的影响 络合滴定曲线 络合滴定指示剂 提高络合滴定选择性的方法 络合滴定法在水分析、垢和腐蚀产物分析中的应用
一 络合滴定法的概述
络合滴定法: 又称配位滴定法 以生成配位化合物为基础的滴定分析方法
In为有机弱酸,颜色随pH值而变化→注意控制溶液的pH值 EDTA与无色M→无色配合物,与有色M→颜色更深配合物
3、指示剂应具备的条件
1)MIn与In颜色明显不同,显色迅速,变色可逆性好 2)MIn的稳定性要适当:KMY / KMIn >102 a. KMIn太小→置换速度太快→终点提前 b. KMIn >KMY→置换难以进行→终点拖后或无终点 3) In本身性质稳定,便于储藏使用 4)MIn易溶于水,不应形成胶体或沉淀
第3章 络合滴定(2).
终点
Y
+ MIn
MY +
In
N
NIn
(2)指示剂的僵化
指示剂溶解度小,反应 慢,终点拖长。
+ N NIn
(3)指示剂的氧化变质
金属指示剂大多含有双 键,易被日光、氧化剂及空 气中的氧化还原性物质破坏, 在水溶液中不稳定。EBT、 Ca指示剂与NaCl配成固体 混合物使用.
3
体系中含有杂质 离子N,lgKNIn’ 太大,终点时不
选择方法:实验确定
依据:终点颜色变化是否敏锐 测定结果准确度是否符合要求
5
铬黑T (EBT)
EBT本身是酸碱物质
pH pH < 6.3 6.3 < pH < 11.6 pH > 11.6 型体及颜色 H2InHIn2In3指示剂络合物颜色 2H+
+ M
MIn
+
H+
适宜pH 范围:6.3 ~ 11.6
Fe2+ 测Bi
测Fe
红
黄
红
黄
20
3.6 络合滴定的方式及应用
1 、 络 合 滴 定 的 方 式
直接滴定法 返滴定法 置换滴定法 间接滴定法
2、EDTA标准溶液的配制与标定
21
(1)直接滴定法
直接滴定的条件:
(1)lg CK’ 6; (2)反应速度快:
(3)有合适的指示剂,无指示剂封闭现象; (4)在控制的pH条件下, 金属离子不发生水解;
金属指示剂颜色转变点pMep的计算
M + In MIn
K MIn '
[MIn] K MIn [M][In' ] In(H) M
络合滴定指示剂.

三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极为 稳定的络合物,这些络合物较对应的 MY络合物更 稳定,以致到达计量点时滴入过量 EDTA,也不能 夺取指示剂络合物(MIn)中的金属离子,指示剂 不能释放出来,看不到颜色的变化,这种现象叫指 示剂的封闭现象。
一、金属离子指示剂的作用原理 金属指示剂也是一种络合剂,它能与金属离子形 成与其本身显著不同颜色的络合物而指示滴定终点。 由于它能够指示出溶液中金属离子浓度的变化情况, 故也称为金属离子指示剂,简称金属指示剂。现以 EDTA 滴定 Mg2+ 离子 ( 在 pH = 10 的条件下 ) ,用铬黑 T(EBT)作指示剂为例,说明金属指示剂的变色原理。 1 . Mg2+ 与铬黑 T 反应,形成一种与铬黑 T 本身 颜色不同的络合物 Mg2++EBT=Mg—EBT
其 水 溶 液 在 pH < 8 时 为 酒 红 色 ,pH 为 813.67 时呈蓝色 ,pH 为 12-13 间与 Ca2+ 形成酒红 色络合物 , 指示剂自身呈纯蓝色。因此 , 当 pH 值介 于12-13之间用EDTA滴定Ca2+时溶液呈蓝色。 使用此指示剂测定 Ca2+ 时,如有 Mg 存在, 则颜色变化非常明显,但不影响结果,原因和钙 镁特相同。 Fe3+、A13+、Ti3+、Cu2+、Ni2+和Co2+等 离子能封闭此指示剂。应将这些离子分离或掩蔽。 如有钛、铝和少量 Fe3+ 时,可用三乙醇胺掩蔽。 Cu2+ 、 Co2+ 、 Ni2+ 可加 KCN 掩蔽。 Mn2+ 可加三 乙醇胺用空气氧化后加KCN联合掩蔽。少量Cu2+、 Pb2+可加Na2S以消除其影响。
第五章 络合滴定法-1

n ML
n
[ MLn ] n [ L]n 0 n [ L]n cM 1 1 [ L] 2 [ L]2 n [ L]n
从以上各式可知, i值的大小与络合物本身的性质及[L]的大小 有关,而与总浓度无关。
公式的应用
因此,根据上述各式, (1)只要知道和[L]值,就可以计算
原因:随着络合体数目的增多,配体 间的排斥作用增强,稳定性下降。
1 K1 ' , Kn
1 1 K 2 ' , K n ' , K n 1 K1
2. 累积形成常数
在许多络合物平衡的计算中,为了计算上的方便, 常使用累积形成常数。用符号表示。
第一级累积形成常数: 第二级累积形成常数: 第三级累积形成常数: 第四级累积形成常数:
一、络合物的形成常数
在络合反应中,络合物的形成和解
离,同处于相对的平衡状态中。其平衡
常数,以形成常数或稳定常数来表示。
(一) ML (1:1)型络合物
M
+ L = ML
[ ML] K ML [ M ][L] [ M ][L] 1 K离 [ ML] K ML
KML越大,络合物越稳定; K离越大,络合物越不稳定。
非常明显,
NH3 + H+ = NH4+
Ka
KH
KH=1/Ka=Kb/Kw 显然, KH与Ka互为倒数关系。
5、EDTA的质子化常数
对EDTA络合剂(Y)也能与溶液中的H+结合, 从而形成HY、H2Y、…H6Y等产物。
其逐级质子化反应和相应的逐级质子化常数、
累积质子化常数为:
5.2 络合滴定法

尽量使: pM’ep=pMsp
三、金属指示剂在使用中存在的问题
(一)指示剂的封闭现象
有时某些指示剂能与某些金属离子生成极 为稳定的络合物,但这些络合物较对应的 MY 络合物更稳定,以致到达计量点时滴入 过量EDTA,也不能夺取指示剂络合物(MIn) 中的金属离子,指示剂不能释放出来,看不 到颜色的变化,这种现象叫指示剂的封闭现 象。
目前,合成金属指示剂达300种以上,经 常有新的金属指示剂问世。
(一)铬黑T
铬 黑 T 属 O,O’- 二 羟 基 偶 氮 类 染 料 , 简 称 EBT 或 BT ,其化学名称是: 1-(1- 羟基 -2- 萘偶 氮)-6-硝基-2-萘酚-4-磺酸钠。
铬黑 T 的钠盐为黑褐色粉末,带有金属光泽, 使用时最适宜的 pH范围是9—11,在此条件下, 可用EDTA直接滴定Mg2+、Zn2+、Cd2+、Pb2+、 Hg2+ 等 离 子 。 对 Ca2+ 不 够 灵 敏 , 必 须 有 MgEDTA 或 Zn-EDTA 存在时,才能改善滴定终点。 一般滴定Ca2+和Mg2+的总量时常用铬黑T作指示 剂。
金属指示剂大多数是具有许多双
键的有色化合物易被日光氧化、空气
和氧化剂所分解。有些指示剂在水溶 液中不稳定,日久会变质。
举
例
如铬黑T、钙指示剂的水溶液均易氧化变质,所
以常配成固体混合物或用具有还原性的溶液来配
制溶液。
分解变质的速度与试剂的纯度也有关。一般纯度
较高时,保存时间长一些。
四、常用金属指示剂简介
(2) 酸度减小,对滴定有利,但酸度 太小,金属离子可能水解,影响滴 定,所以要控制溶液酸度。
第4章络合滴定法

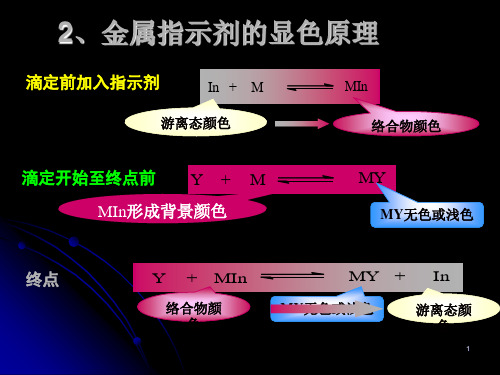
金属指示剂变色过程:
滴定前加入指示剂, M + In = MIn 溶液呈乙色
甲色 乙色
以EDTA进行滴定,滴定反应为: M + Y = MY
终点,
MIn + Y = MY + In 溶液由乙色 甲色
乙色
甲色
例:络合滴定法测定镁离子,滴定前加入铬黑T (EBT)指示剂,溶液呈紫红色:
铬黑T(蓝色) + Mg2+ = Mg2+-铬黑T(紫红色),
一、 配位反应及特征
金属离子与配位体通过配位共价键形成 的化合物——或称为配位化合物
配位键:配位原子提供一
如Ag(NH3)2Cl,K4[Fe(CN)6] 对电子与中心离子共用
Ag
2 NH 3
Ag
(
NH
3
)
2
(1: 2)
Fe 2
6CN
Fe(CN
)
4 6
(1: 6)
★ 发生络合反应的前提:
三、 EDTA络合物的特征
1.EDTA与金属离子的络合物特点
(1) EDTA与1-4价金属离子都能形成易溶性络合物; (2)形成的配合物为5个五元环结构的螯合物,稳定性高; (3)与大多数金属离子1∶1配位 (4)与无色金属离子形成无色络合物,有利于指示终点;与
有色金属离子一般生成颜色更深的络合物,应适当控制浓 度不易过大,否则指示终点困难。
第4章 络合(配位)滴定法
一 、 配位反应及特征 二、 氨羧络合剂 三、 EDTA络合物的特征 四、 EDTA的络合平衡 五、 金属指示剂 六、 提高络合滴定的选择性 七、 络合滴定的方式
分析化学 第五章 络合滴定法

滴定允许的最低pH值: lgKMY = lgKMY - lgα Y(H) lgα Y(H) = lgKMY - lgKMY
lgα
Y(H)
≤lgKMY - lgK MY =lgKMY-8 (3-29)
将金属离子的KMY代入式3-29,计算出lgαY(H), 再查 表3-11得对应的pH值,即滴定允许的最低pH值。 将金属离子的lgKMY 与其滴定允许的最低pH值绘成
b.碱土金属离子的lgKMY = 7~11; c.过渡金属、稀土金属离子和Al3+、Ce3+ 、Y3+等 的lgKMY=12~19; d.多数三价、四价金属离子及Hg2+、Sn2+等离子的 lgKMY>20 。
注意:表中数据为无副反应发生时的稳定常数。
实际测定时要采用条件稳定常数。
二、EDTA的离解平衡
综合考虑EDTA的酸效应和金属离子的络合效应等 副反应时,络合物的实际稳定程度要用条件稳定常 数KMY表示:
lgKMY = lgKMY-lgα Y(H)- lgα ≈lgKMY-lgα Y(H) = lgKMY
M
注意:在络合滴定中,酸效应对络合物稳定性的影 响较大,而络合效应的影响相对较小,因而条件稳定 常数可只考虑酸效应的影响,近似用KMY代替KMY。
K MY
Y(H)
[Y' ] [Y]
MY
[MY] [M][Y]
[Y ] [Y' ]
根据:
Y(H)
可得:
[MY] K MY K MY ' [M][Y' ] Y ( H )
考虑酸效应的条件稳定常数:
lgKMY = lgKMY - lgα
Y(H)
络合滴定法

络合滴定法(硬度的测定)一、络合滴定的原理络合滴定法是以络合反应为基础的滴定分析方法。
乙二胺四乙酸就是一种常用的络合剂。
简称EDTA 。
它是一种四元酸,微溶于水。
通常情况下,一个EDTA 分子,可与一个不同价态的离子络合,也就是说,EDTA 与金属离子1:1络合,生成易溶于水的络合物。
在络合滴定中,等当点的判别常用金属指示剂来显示。
金属指示剂本身也是一种络合剂,它与金属离子生成的络全物颜色与游离指示剂的颜色不同,而且要求它与金属离子形成的络合的稳定性略低于EDTA 和金属离子形成的络合物的稳定性,在理论终点时,指示剂由络合状态被EDTA 置换而成为游离的指示剂,根据指示剂颜色的变化就可以判断终点。
如用铬黑T (简写成HI n 2-)为指示剂测Ca 2+时Ca 2+ + HI n 2- = CaI n - + H +用EDTA (简称为H 2Y 2-)滴定过程中Ca 2+ + H 2Y 2- =CaY 2- + 2H +在终点时,溶液中游离Ca 2+都与H 2Y 2-反应了,由于CaY 2-的稳定性比CaI n 2-的稳定性高,再加入的EDTA 就会夺取CaI n -中的Ca 2+,发生如下反应H 2Y 2- +CaI n - = CaY 2-+HI N -+H +酒红色 蓝色溶液由酒红色转变为蓝色,显示终点的到来。
由于EDTA 是一种多元酸,溶液的pH 值决定EDTA 的存在形式,从而影响到络合物的稳定性。
在测硬度时,一般用缓冲溶液控制溶液的pH 值为10±0.1。
二、试剂1、C (1/2EDTA)为0.04mol/L配制:称取8g 乙二胺四乙酸二钠溶入1L 高纯水中,摇匀。
标定:称取0.4g(准确到0.2mg)于800℃灼烧至恒重的氧化锌,用少许蒸馏水湿润,滴加盐酸溶液(1+1)至样品溶解移入250mL 容量瓶中,稀释至刻度,摇匀。
取上述溶液20.00mL ,加80mL 除盐水,用10%氨水中和至pH 为7~8,加5mL 氨-氯化铵缓冲溶液(Ph =10),加5滴ρ=5g/L 铬黑T 指示剂,用C (1/2edta)=0.04mol/L 溶液滴定至溶液由紫色变纯蓝色,记录消耗EDTA 标准溶液的体积。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
M-EBT呈红色, 故EBT适宜的使 用酸度范围为 pH=8-11 。
(1)终点时颜色变化明显,对比度要大;
(2)显色反应要快,可逆性良好(防止僵化);
(3)KMIn´ 要适当(>104),KMIn´ < KMY´(lg KMY´-lg KMIn´>2 ) (4)稳定易溶于水(便于储存、使用,杜绝氧化变质)4 4
plgM S K MP g1 2 Y´( =p g lgM KC M,S gYg -P lglYK g =8M .7) - 0g .1 2 45( 2 =8.0 .25 8 0 .2 ) 5 5 .1
根据指示剂的选择原则:使指示剂变色时的pMt (pMep)尽量与pMsp接近。查附表7可知,用铬黑 T作指示剂时pMep= pMt=5.4,与pMgsp很接近,且 在此酸度下变色敏锐,故可选择铬黑T作指示剂。
第五节 络合滴定指示剂 (金属离子指示剂,简称金属指示剂)
一、作用原理
确定络合滴定终点的方法很多,常用的是 指示剂法。
金属指示剂是一种络合剂,它能与金属离子 形成与其本身显著不同颜色的络合物而指示滴 定终点。由于它能够指示出溶液中金属离子浓 度的变化情况,故也称为金属离子指示剂,简 称金属指示剂。这些金属指示剂具有酸碱指示 剂的性质。因此,使用时要注意体系的酸度。
8
8
三、使用金属指示剂中存在的问题
1.指示剂的封闭 例如:Cu2+, Co2+, Ni2+, Fe3+, Al3+ 等对铬
黑T具有封闭作用。
原因:1.KNIn>KNY 2.MIn有色物的颜色变化可逆性差(虽
KMIn<KMY),MIn不能很快地被Y破坏掉。
消除:1.干扰离子引起,加掩蔽剂或分离 2.M本身引起改返滴定法
K
' MIn
1
M
)
lg
K' MIn
lg M
pM
' ep
pM
' t
pM t lg M
lg
K
' MIn
lg M
7
7
例6-7 在pH=10.0的条件下,用0.02000mol·L1EDTA 滴定0.020mol·L-1的Mg2+,应选择何种指示剂?
解:查表得:lgKMgY=8.7,pH=10.0时, lgY(H)=0.45 此时Mg2+无副反应。 Y= Y(H)=100.45,CMg,SP= 0.02000mol·L-1
1
1
1.原理
终点置换反应
In显色反应
2
2
现以EDTA滴定Mg2+离子(在pH=10的条件下),用 铬黑T(EBT)作指示剂为例,说明金属指示剂的变色原 理。
(1)Mg2+与铬黑T反应,形成一种与铬黑T本身颜色 不同的络合物:
滴定前 Mg2+ + EBT = Mg—EBT
(蓝色) (红色)
( 2 ) 当 滴 入 EDTA 时 , 溶 液 中 游 离 的 Mg2+ 逐 步 被 EDTA 络 合 , 当 达 到 计 量 时 , 已 与 EBT 络 合 的 Mg2+ 被 EDTA夺出,释放出指示剂EBT,因而就引起溶液颜色 的变化:
9
9
2.指示剂的僵化 例如:PAN难溶于水 原因:MIn↓+ Y ↔ MY + In
指示剂或MIn溶解度小,或MIn只稍小于 MY的稳定性,导致反应慢,终点拖长或颜色变 化很不敏锐。
动力学因素,导致置换反应缓慢
消除(1)加热--加快速度
(2)有机溶剂--相似相溶
10
10
3.指示剂的氧化变质等 (在水溶液中不稳定)
[ MIn ] [ M ' ][ In
']
K
MIn
1
M In ( H )
K' MIn
1
M
lg
K '* MIn
pM
' lg [ MIn ] [ In ' ]
In(H )
[In'] [In]
M
[M '] [M ]
当 [ MIn ] =1时: [ In ' ]
pM
' t
lg
K
'* MIn
lg(
12
12
3.PAN pH1.9-12.2使用 4.Cu-PAN 广泛性指示剂
13
13
滴定终点时 Mg-EBT + EDTA= Mg-EDTA + EBT
(红色)
(蓝色)
3
3
注意:In本身就是有机弱酸或弱碱,能随pH改变而发 生颜色变化。应特别注意各种指示剂适宜的使用酸度范 围。例如,铬黑T(EBT,NaH2In)在溶液中存在如下平衡:
H2ln- = HIn2- = In3(红色) (蓝色) (橙色) pH<6 pH=8-11 pH>12
原因:金属指示剂大多含有双键,易被日光、 氧化剂及空气中的氧化还原性物质破坏 ,在水溶液中不稳定。
消除(1)可配成固体混合物(用NaCl固体稀释) (2)加盐酸羟胺
11
11
四、常用金属指示剂 掌握:颜色变化,pH范围
1.铬黑T pH6.3 -11.6使用(实际在pH9-10.5使用)
2.二甲酚橙 pH<6使用(pH<6呈黄色, pH>6.3呈红色)
In´
KMIn 1 In(H)
In(H )
[In'] [In]
变色点 M In'时 In1:此即终
pe M p ptM lg K 'M Ilng K M IlngI(n H )
为只考虑酸效应时MIn的条件稳定常数。手 册列出的一般均为此值。见P348附表7。 6
6
(2)考虑各种副反应
K '* MIn
二、In的选择
1.In选择原则:In在pM突跃范围内色变,尽量 使变色点pMt(pMep)=pMsp
2.pMep的求算:
M + In
MIn
+
Y
MY
分别处理,不能看酸效应:
M + In = MIn H
HIn
K'MI n M MIIn'n lgK'MI n pMlgM In'InH2In
