1.汽液平衡数据测定
气液相平衡实验报告

气液相平衡实验报告实验目的:探究气液相平衡的基本规律和影响因素。
实验器材:1. 恒温水浴槽2. U型玻璃管3. 气压计4. 液体试剂5. 多孔瓷芯6. 温度计7. 固体试样实验原理:气液相平衡是指在一定温度下,气体和液体之间达到平衡状态的现象。
实验中,使用U型玻璃管连接液体试剂和气压计,通过控制温度和将气态和液态物质接触,观察两相之间达到平衡时的气体压力,并推断出气液相平衡的规律。
实验步骤:1. 准备实验器材,搭建实验装置。
2. 将恒温水浴槽加热至设定温度。
3. 将液体试剂注入U型玻璃管中,保证一浸没在水中,另一端露出水面。
4. 预热液体试剂至与水浴槽温度相同。
5. 打开气压计的阀门,使其与U型玻璃管内的气体接触。
6. 观察并记录气压计读数,并等待数分钟使气液平衡达到稳定。
7. 将温度计插入水浴槽,记录水浴温度。
8. 重复以上步骤,分别在不同温度和液体试剂条件下进行多次实验。
实验结果与讨论:1. 实验结果将以表格的形式呈现,记录每次实验所得的气体压力和温度数据。
2. 根据实验数据,绘制气体压力与温度之间的图像。
3. 分析图像中的趋势,推导气液相平衡的规律。
4. 探讨温度、压力和液体性质对气液相平衡的影响。
结论:通过本实验,我们得出了气液相平衡的实验数据,并绘制出相应的图像,从图像中可以看出,随着温度的升高,气体压力也相应增加。
这说明在一定温度下,气体的压强与温度呈正相关关系。
实验还发现,不同的液体试剂在相同温度下存在着不同的气压计读数,提示不同的液体试剂在气液相平衡中具有不同的特性。
我们的实验结果验证了气液相平衡的规律,为进一步研究和应用气液相平衡的相关领域提供了实验依据和理论支持。
附注:本实验只给出了基本实验步骤和结果讨论,详细的数据和图像以及进一步的分析可参考实验记录表和附件中的实验数据。
南京工业大学化学工程与工艺专业实验》思考题答案

实验1二元体系汽液平衡数据测定1,实验测量误差及引起误差的原因答:(1)汽液两相平衡时,回流滴下来的流体速率平稳,大约每秒1~2滴,且在一段时间内温度维持不变。
2,影响汽液平衡数据测定的精确度的因素有哪些答:(2)影响准确度的因素有温度和压强,装置气密性,温度计灵敏度,折射仪读数准确性等。
实验3 二氧化碳临界现象观测及PVT关系的测定1,质面比常数K值对实验结果有何影响为什么答:任意温度任意压力下,质面比常数k均不变。
所以不会对实验结果又影响。
2,为什么测量25℃下等温线时,严格讲,出现第1个小液滴时的压力和最后一个小汽泡将消失时的压力应相等答:在出现第一个小液滴和最后一个汽泡消失过程中CO2处于汽液平衡状态。
根据相律得F=C-P+1=1-2+1=0,自由度为0,故过程中压力应为相等。
实验4 气相色谱法测定无限稀释溶液的活度系数1,无限稀释活度系数的定义是什么测定这个参数有什么作用答:定义:P29 公式(4-1),作用:通过测定两个组分的比保留体积和无限稀释下的活度系数,计算其相对挥发度.2,气相色谱基本原理是什么色谱仪有哪几个基本部分组成各起什么作用答:原理:因固定液对于样品中各组分溶解能力的差异而使其分离。
组成及作用:(1)载气系统气相色谱仪中的气路是一个载气连续运行的密闭管路系统。
整个载气系统要求载气纯净、密闭性好、流速稳定及流速测量准确。
(2)进样系统进样就是把气体或液体样品速而定量地加到色谱柱上端。
(3)分离系统分离系统的核心是色谱柱,它的作用是将多组分样品分离为单个组分。
色谱柱分为填充柱和毛细管柱两类。
(4)检测系统检测器的作用是把被色谱柱分离的样品组分根据其特性和含量转化成电信号,经放大后,由记录仪记录成色谱图。
(5)信号记录或微机数据处理系统近年来气相色谱仪主要采用色谱数据处理机。
色谱数据处理机可打印记录色谱图,并能在同一张记录纸上打印出处理后的结果,如保留时间、被测组分质量分数等。
二元系统气液平衡数据测定1
一、实验目的1. 了解和掌握用双循环汽液平衡器测定二元系统气液平衡数据的方法。
2. 了解缔合系统汽—液平衡数据的关联方法,从实验测得的T-p-x-y 数据计算各组分的活度系数。
3. 通过实验了解平衡釜的构造,掌握气液平衡数据的测定方法和技能。
4. 掌握二元系统气液平衡相图的绘制。
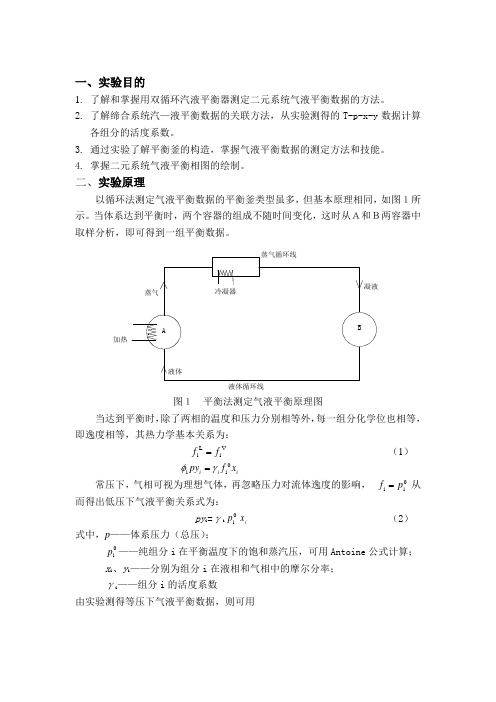
二、实验原理以循环法测定气液平衡数据的平衡釜类型虽多,但基本原理相同,如图1所示。
当体系达到平衡时,两个容器的组成不随时间变化,这时从A和B两容器中取样分析,即可得到一组平衡数据。
冷凝器凝液蒸气循环线蒸气加热液体液体循环线图1 平衡法测定气液平衡原理图BA图1 平衡法测定气液平衡原理图当达到平衡时,除了两相的温度和压力分别相等外,每一组分化学位也相等,即逸度相等,其热力学基本关系为:V i L i f f = (1) i i i x f py 0i i γφ=常压下,气相可视为理想气体,再忽略压力对流体逸度的影响,0i i p f = 从而得出低压下气液平衡关系式为:py i =γi0i p i x (2)式中,p ——体系压力(总压);0i p ——纯组分i 在平衡温度下的饱和蒸汽压,可用Antoine 公式计算; x i 、y i ——分别为组分i 在液相和气相中的摩尔分率; γi ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用i p x py i ii =γ (3) 计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为: ln γ1=-ln(x 1+Λ12x 2)+x 2(212112x x Λ+Λ -121221x x Λ+Λ) (4)ln γ2=-ln(x 2+Λ21x 1)+x 1(121221x x Λ+Λ -212112x x Λ+Λ) (5)Wilson 方程二元配偶函数Λ12和Λ21采用非线性最小二乘法,由二元气液平衡数据回归得到。
目标函数选为气相组成误差的平方和,即F =2221211((j mj j y y y y ))计实计实-+-∑=三、主要仪器设备与实验装置流程图:1.平衡釜一台 2.阿贝折射仪一台 3.超级恒温槽一台4.50-100十分之一的标准温度计一支5.所用试剂(无水甲醇、异丙醇)为分析纯试剂。
二元汽液平衡数据测定实验数据处理

二元汽液平衡数据测定实验数据处理:一、原理:以循环法测定气液平衡数据的平衡釜基本原理相同,如图1所示,体系达到平衡时,两个容器的组成不随时间变化,这时从A 和B 两容器中取样分析,即可得到一组平衡数据。
当达到平衡时,除了两相的压力和温度分别相等外,每一组分的化学位也相等,即逸度相等,其热力学基本关系为:V i L i f f = (1)i i i i i x f py ογφ=常压下,气相可视为理想气体,;再忽略压力对液体逸度的影响,οi i p f =从而得出低压下气液平衡关系为:i i i i x f py ογ= (2)式中 p ——体系压力(总压);p i 0——纯组分I 在平衡温度下饱和蒸汽压,可用安托尼(Antoine )公式计算; x i 、y i ——分别为组分I 在液相和气相中的摩尔分率; γi ——组分i 的活度系数由实验测得等压下气液平衡数据,则可用ογii i i p x py =...................................... .. (3)计算出不同组成下的活度系数。
本实验中活度系数和组成关系采用Wilson 方程关联。
Wilson 方程为:ln γ1=-ln 22121x )x Λx ++()(121x 221212112Λx Λx Λx Λ+-+ (4)ln γ2=-ln )x Λx Λx Λx Λ(x )x Λ(x 21211212122111212+-+++ (5)Wilson 方程二元配偶参数12Λ和21Λ采用非线形最小二乘法,由二元气液平衡数据回归而得.目标函数选为气相组成误差的平方和,即F=∑=-+-mj j j y y y y 1222211)()(计实计实…………………………………(6) 二、数据处理(以表1的实验数据为例子)Ⅰ.实测温度及苯的气液相组成大气压:101.33Kpa表1 苯—正庚烷混合液平衡温度及气、液相组成的测定数据组号主温度t主/(℃)辅助温度t s/(℃)气相(苯) 液相(苯)折射率y i/mol% 折射率x i/mol%1 82.0 22.0 1.4610 81.9 1.4510 74.62 83.4 23.0 1.4475 72.9 1.4361 63.63 84.8 24.0 1.4398 67.0 1.4235 53.74 86.2 25.0 1.4310 59.4 1.4155 46.85 87.6 28.1 1.4238 52.6 1.4038 38.4表2 水银温度计检定结果温度计示值(℃)80 85 90 95 100 修正值(℃)+0.08 +0.07 +0.07 +0.09 +0.08 Ⅱ.平衡温度及纯物质的饱和蒸气压的计算:①平衡温度的计算:(使用热电偶测温时略去此步骤)t实际值= t主+t校正t校正=kn(t主-t s)matlab运算结果如下:t0=[82.0 83.4 84.8 86.2 87.6];t2=[22.0 23.0 24.0 25.0 28.1];t1=0.00016*60*(t0-t2);t3=t0+t1结果:t3 = 82.5760 83.9798 85.3837 86.7875 88.1712其中t3 代表平衡温度,结果填入表3中②饱和蒸气压的计算lg P i0=A i– B i/(C i+t)式中:t—温度,℃P0—饱和蒸汽压,mmHgP i0(苯)=10^(6.87987-(1196.76/(219.161+t)))P i0(正庚烷)=10^(6.89386-(1264.37/(216.64+t)))用matlab运算结果如下t=[82.5760 83.9798 85.3837 86.7875 88.1712];for i=1:5p1(i)=10^(6.87987-(1196.76/(219.161+t(i))))p2(i)=10^(6.89386-(1264.37/(216.640+t(i))))end结果:p1 =819.6614 855.0698 891.6626 929.4612 967.9270p2 =465.8546 487.5090 509.9562 533.2131 556.9509Ⅲ.用Wilson方程计算如下:表3 平衡温度及饱和蒸气压组号平衡温度t/(℃)P i0(苯)/(mmHg)P i0(正庚烷)/(mmHg)1 82.58 819.6614 465.85462 83.98 855.0698 487.50903 85.38 891.6626 509.95624 86.79 929.4612 533.21315 88.17 967.9270 556.9509①Wilson方程参数的确定方程格式:ln Py1/P10x1= -ln(x1+λ12x2)+x2(λ12/(x1+λ12x2)- λ21/ (x2+λ21x1))ln Py2/P20x2= -ln(x2+λ21x1)+x1(λ21/(x2+λ21x1)- λ12/ (x1+λ12x2))目标函数:F=∑=-+-mjjjyyyy1222211)()(计实计实用非线性最小二乘法拟合:matlab拟合程序如下function xLsqnonlinbb0=[1,1][bb,resnorm,residual]=lsqnonlin(@Funlv,bb0)%-----------------------------------------function F=Funlv(bb)x1=[0.746 0.636 0.537 0.468 0.384];x2=[0.254 0.364 0.463 0.532 0.616];y1=[0.819 0.729 0.670 0.594 0.526];y2=[0.181 0.271 0.330 0.406 0.474];p10=[819.6614 855.0698 891.6626 929.4612 967.9270];p20=[465.8546 487.5090 509.9562 533.2131 556.9509];for i=1:5F(i)=y1(i)-p10(i)*x1(i)/760*exp(-log(x1(i)+bb(1)*x2(i))+x2(i)*(bb(1)/ (x1(i)+bb(1)*x2(i))-...bb(2)/(x2(i)+bb(2)*x1(i))));endfor i=6:10j=i-5F(i)=y2(j)-p20(j)*x2(j)/760*exp(-log(x2(j)+bb(2)*x1(j))+...x1(j)*(bb(2)/(x2(j)+bb(2)*x1(j))-bb(1)/(x1(j)+bb(1)*x2(j)))); end拟合的结果:Optimization terminated: first-order optimality less than OPTIONS.TolFun,and no negative/zero curvature detected in trust region model.bb =0.5192 1.3205resnorm =6.2205e-004residual =0.0065 -0.0026 0.0146 -0.0111 -0.0045 0.0020 0.0099 -0.0091 0.0052 -0.0016由结果可以看出,λ12=0.5192;λ21=1.3205;余差平方和F=∑=-+-mjjjyyyy1222211)()(计实计实=6.2205e-004,说明拟合的效果比较好。
二元系统气液平衡数据测定

序号:40化工原理实验报告实验名称:二元系统气液平衡数据测定学院:化学工程学院专业:化学工程与工艺班级:化工095班姓名:何小龙学号 0940201051 同组者姓名:杨飞黄云张阳指导教师:周国权日期: 2012年3月29日一、实验目的1.了解和掌握用双循环汽液平衡器测定二元系统汽液平衡数据的方法。
2.了解缔合系统汽液平衡数据的关联方法,从实验测得的T-p-x-y数据计算个组分的活度系数。
3.通过实验了解平衡釜的构造,掌握汽液平衡数据的测定方法和技能。
4.掌握二元系统平衡相图的绘制。
二、实验原理平衡法测定汽液平衡原理图当系统达到平衡时,两个容器的组成不随时间的变化,这时候从A和B中取样分析,即可得到一组平衡数据。
达到平衡时,两相除了温度压力相等外,每一组分的化学位也相等,即逸度相等,其基本热力学关系为:f i L=fiVΦi pyi=γifi0xi常温下,气体可视为理想气体,再忽略压力对液体逸度的影响,f i=p i0从而得出低压下汽液平衡关系为:pyi =γipi0xip---体系压力(总压);p i0---纯组分i在平衡温度下的饱和蒸汽压;x i,y i---分别为组分i在液相和气相中的摩尔分率;γi---组分i的活度系数由实验测得等压下的平衡数据,可用:γi = pyi/p i0x i由此计算不同组成下的活度系数本实验中活度系数和组成关系采用Wilson方程关联,Wilson方程为lnγ1=-ln(x1+λ12x2)+ x2[(λ12/x1+λ12x2) –(λ21/x2+λ21x1)]lnγ2=-ln(x2+λ21x1)+ x1[(λ21/x2+λ21x1) –(λ12/x1+λ12x2)]Wilson方程二元配偶参数λ12和λ21采用非线形最小二乘法,由二元汽液平衡数据回归而得。
目标函数选为气相组成误差的平方和,即:F=Σj=1m(y1实-y1计)2j+( y2实-y2计)2j三、实验装置与试剂1.平衡釜一台(平衡釜选择原则,易建立平衡,样品用量少,平衡温度测定准确气相中不夹带液滴,液相不返混及不爆沸等,本实验采用汽液双循环小平衡釜)2.阿贝折射仪一台3.温度计4.1ml及5ml的注射器若干四、实验步骤及注意事项1.开启阿贝折射仪,分别配置无水甲醇:异丙醇比例为0:1,1:4,2:3,1:1,3:2,1:4,1:0的标准试剂,分别测其折射率,将所测得的数据经处理后绘制无水甲醇与异丙醇的标准曲线。
二元系统气液平衡数据测定实验报告

二元系统气液平衡数据测定实验报告实验目的:1. 了解气相和液相的特性和平衡状态;2. 熟悉使用实验仪器进行二元系统气液平衡数据测定;3. 掌握气液平衡实验的数据处理方法。
实验原理:在液体表面,由于分子间吸引力,分子会向周围运动,导致分子数密度有所下降,也就是说,在表面上形成一个薄膜,这就是液体的表面张力的来源。
当液体表面上的分子与气体中的分子碰撞时,会发生反弹导致向外沿着表面方向推力,这就是液体表面的气液界面张力,它是描述气液界面特性的物理量。
气液界面上的分子密度不均匀,会导致气相和液相之间的交换。
在一种给定的温度下,当气相和液相之间的交换达到一定的平衡状态时,称为气液平衡。
在这种状态下,气相和液相的分子数密度不再发生明显的变化。
通过气液平衡实验,可以测定气液界面张力和液体和气体之间的平衡常数,从而获得二元系统气液平衡的数据。
实验仪器:1. 二元系统气液平衡实验仪器;2. 水、乙醇等液体样品;3. 高钼酸钠、酚酞等试剂。
实验步骤:1. 清洗实验仪器:将实验仪器中的气路及液路中的管道和阀门进行清洗,保证实验测量时的通气畅通和样品无杂质。
2. 调整实验仪器:将待测液体注入样品瓶中,打开气路和液路中的阀门,进行预热和抽气,直至达到平衡状态。
3. 测量实验数据:通过测定不同温度下的液体和气体的平衡常数,获得二元系统气液平衡的数据。
4. 处理数据:将实验数据进行整理分析,得出二元系统气液平衡的相关参数。
实验结果:通过实验测量,得出了二元系统气液平衡的相关数据,具体如下:1. 温度:25℃液体样品:水气体样品:空气气液界面张力:72.2 mN/m液体与气体间的平衡常数:0.872. 温度:30℃液体样品:乙醇气体样品:空气气液界面张力:28.6 mN/m液体与气体间的平衡常数:0.65实验结论:通过本次实验的测量和分析,得出了二元系统气液平衡的相关参数。
在不同的温度下,不同的液体和气体之间会发生不同程度的平衡,液体之间和气体之间的分子密度也不同。
化学吸收系统气液平衡数据的测定

实验二化学吸收系统气液平衡数据的测定A 实验目的化学吸收是工业气体净化和回收常用的方法,为了从合成氨原料气、天然气、热电厂尾气、石灰窑尾气等工业气体中脱除CO2 、H2S、SO2等酸性气体,各种催化热钾碱吸收法和有机胺溶液吸收法被广泛采用。
在化学吸收过程的开发中,相平衡数据的测定必不可少,因为它是工艺计算和设备设计的重要基础数据。
由于在这类系统的相平衡中既涉及化学平衡又涉及溶解平衡,其气液平衡数据不能用亨利定律简单描述,也很难用热力学理论准确推测,必须依靠实验。
本实验采用气相内循环动态法测定CO2—乙醇胺(MEA)水溶液系统的气液平衡数据,拟达到如下目的:(1)掌握气相内循环动态法快速测定气液相平衡数据的实验技术。
(2)学会通过相平衡数据的对比,优选吸收能力大,净化度高的化学吸收剂。
(3)加深对化学吸收相平衡理论的理解,学会用实验数据检验理论模型,建立有效的相平衡关联式。
B 实验原理气液相平衡数据的实验测定是化学吸收过程开发中必不可少的一项工作,也是评价和筛选化学吸收剂的重要依据。
气液平衡数据提供了两个重要的信息,一是气体的溶解度,二是气体平衡分压。
从工业应用的角度看,溶解度体现了溶液对气体的吸收能力,吸收能力越大,吸收操作所需的溶液循环量越小,能耗越低。
平衡分压反映了溶液对原料气的净化能力,平衡分压越低,对原料气的极限净化度越高。
因此,从热力学角度看,一个性能优良的吸收剂应具备两个特征,一是对气体的溶解度大,二是气体的平衡分压低。
由热力学理论可知,一个化学吸收过程达到相平衡就意味着系统中的化学反应和物理溶解均达到平衡状态。
若将平衡过程表示为:A(气)‖A(液)+ B(液)= M(液)定义:m 为液相反应物B的初始浓度(mol/l);为平衡时溶液的饱和度,其定义式为:mB A M 的初始浓度液相反应物组分的浓度形式存在的以反应产物=θa 为平衡时组分A 的物理溶解量。
则平衡时,被吸收组分A 在液相中的总溶解量为物理溶解量a 与化学反应量θm 之和,由化学平衡和溶解平衡的关系联立求解,进而可求得气相平衡分压m p A和与θ*的关系: 在乙醇胺(MEA )水溶液吸收CO 2系统中,主要存在如下过程:溶解过程: CO 2(g )= CO 2(l ) (1)反应过程: 5.0<θ时, -++=+R N C O O R N H R N H l CO 222)( (2)5.0>θ时, -+-+=++322222H C O R N H O H CO RNCOO (3)本实验仅讨论5.0<θ时的情况。
气液相平衡实验数据处理

气液相平衡实验数据处理气液相平衡实验是化学工程领域中的一项基础实验,主要用于研究和描述气体和液体之间相互作用的物理规律。
通过实验数据处理,我们可以得到气液相平衡实验的结果,并进行进一步的分析和解释。
一、实验原理气液相平衡实验是研究气体和液体之间相互作用的实验,主要涉及到气液相平衡的概念和原理。
在一定的温度和压力下,气体和液体之间会达到平衡状态,此时气体的溶解度与液体的蒸气压之间存在一定的关系。
通过对实验数据的处理和分析,我们可以得到气液相平衡的曲线和关系式,进而研究和描述气体和液体之间的相互作用。
二、实验步骤1.将实验装置加压至所需压力,保持稳定;2.记录实验过程中温度、压力和气体溶解度的变化;3.在实验结束后,将数据整理成表格;4.对数据进行处理和分析,得到气液相平衡曲线和关系式。
三、数据处理方法1.数据整理:将实验数据整理成表格,包括温度、压力、气体溶解度和时间等信息。
根据需要,可以对数据进行筛选和排序,以便更好地进行数据处理和分析。
2.数据拟合:采用最小二乘法等数学方法,将实验数据与气液相平衡关系式进行拟合。
通过拟合可以得到气液相平衡曲线和关系式,进而描述气体和液体之间的相互作用。
3.数据分析:对拟合得到的气液相平衡曲线和关系式进行分析,研究气体和液体之间的物理规律。
可以计算气体的溶解度和液体的蒸气压等物理量,进而得到气液相平衡的物理规律。
4.数据可视化:采用图表等方式将实验数据和处理结果进行可视化展示,以便更好地理解和解释气液相平衡实验的结果。
可以绘制气液相平衡曲线、溶解度曲线等图表,以便更好地研究和描述气体和液体之间的相互作用。
四、结论与展望通过气液相平衡实验数据的处理和分析,我们可以得到气体和液体之间的相互作用规律。
通过对数据的整理、拟合、分析和可视化展示,我们可以更好地理解和解释实验结果。
这些结果可以为化学工程领域中的其他研究提供重要的参考依据,也可以为工业生产中的气液相平衡问题提供理论支持和实践指导。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验1 二元体系汽液平衡数据测定一. 实验目的1.了解二元体系汽液相平衡数据的测定方法,掌握改进的Rose 平衡釜的使用方法,测定大气压力下乙醇(1)--环己烷(2)体系i i y x P T ---数据。
2.确定液相组分的活度系数与组成关系式中的参数,推算体系恒沸点,计算出不同液相组成下二个组分的活度系数,并进行热力学一致性检验。
3.掌握恒温浴使用方法和用阿贝折光仪分析组成的方法。
二.实验原理汽液平衡数据实验测定是在一定温度压力下,在已建立汽液相平衡的体系中,分别取出汽相和液相样品,测定其浓度。
本实验采用的是广泛使用的循环法,平衡装置利用改进的Rose 釜。
所测定的体系为乙醇(1)—环己烷(2),样品分析采用折光法。
汽液平衡数据包括i i y x P T ---。
对部分理想体系达到汽液平衡时,有以下关系式:s i i i i P x P y γ= (2-1-1)将实验测得的i i y x P T ---数据代入上式,计算出实测的i x 与i γ数据,利用i x 与i γ关系式(van Laar 方程或Wilson 方程等)关联,确定方程中参数。
根据所得的参数可计算不同浓度下的汽液平衡数据、推算共沸点及进行热力学一致性检验。
三. 实验装置和试剂实验装置见图 2-1–1,其主体为改进的Rose 平衡釜-一汽液双循环式平衡釜(见图 2-1-2)。
改进的Rose 平衡釜汽液分离部分配有50—100℃精密温度计或热电偶(配XMT —3000数显仪)测量平衡温度,沸腾器的蛇型玻璃管内插有300W电热丝,加热混合液,其加热量由可调变压器控制。
分析仪器:恒温水浴—阿贝折光仪系统,配有CS-501型超级恒温浴和四位数字折光仪。
实验试剂: 无水乙醇(分析纯), 环己烷(分析纯)四.实验步骤和分析方法1.制作乙醇(1)-- 环己烷(2)溶液折光系数与组成关系工作曲线(可由教师预先准备):(1)配制不同浓度的乙醇(1)—环己烷(2)溶液(摩尔浓度1x 为0.1,0.2,0.3,……0.9); (2)测量不同浓度的乙醇(1)—环己烷(2)溶液在30℃下的折光系数,得到一系列D n x -1数据;图2-1-2 改进的Rose 釜结构图图 2-1–1 VLE 实验装置 1-排液口 2-沸腾器 3-内加热器 4-液相取样口5-汽室 6-汽液提升管 7-汽液分离器 8-温度计套管9-汽相冷凝管 10-汽相取样口 11-混合器(3)将D n x -1数据关联回归,得到如下方程:0.051305)]n - (1.42130.10261 [0.0014705 0.74744- x 5.0D 1⨯++= (2-1-2)2.开恒温浴--折光仪系统,调节水温到30±0.1℃。
(折光仪的原理及使用方法见附录) 3.接通平衡釜冷凝器冷却水,关闭平衡釜下部考克。
向釜中加入乙醇—环己烷溶液(加到釜的刻度线,液相口能取到样品)。
4.接通电源,调节加热电压,注意釜内状态。
当釜内液体沸腾,并稳定以后,调节加热电压使冷凝管末端流下的冷凝液为80滴/分左右。
5.当沸腾温度稳定,冷凝液流量稳定(80滴/分左右),并保持30分钟以后,认为汽液平衡已经建立。
此时沸腾温度为汽液平衡温度。
由于测定时平衡釜直接通大气,平衡压力为实验时的大气压。
用福廷式水银压力计,读取大气压(见附录)。
6.同时从汽相口和液相口取汽液二相样品,取样前应先放掉少量残留在取样考克中的试剂,取样后要盖紧瓶盖,防止样品挥发。
7.测量样品的折光系数,每个样品测量二次,每次读数二次,四个数据的平均偏差应小于0.0002,按四数据的平均值,根据式(2-1-2),计算汽相或液相样品的组成。
8.改变釜中溶液组成(添加纯乙醇或纯环己烷),重复步骤4—8,进行第二组数据测定。
五.实验数据记录1.平衡釜操作记录表2-1-1 改进的Rose釜操作记录日期室温℃大气压 mmHg2. 折光系数测定及平衡数据计算结果表2-1-2 折光系数n D测定结果和汽液相平衡组成计算结果测量温度30.0℃六.实验数据处理1. 平衡温度和平衡压力的校正(参见附录)2. 由所测的折光系数计算平衡液相和汽相的组成,并与附录文献数据比较,计算平衡温 度实验值与文献值的偏差和汽相组成实验值与文献值的偏差。
3.计算活度系数1γ,2γ运用部分理想体系汽液平衡关系式(2-1-1)可得到,s P x P y 1111=γ和sP x Py 2222=γ 式中:s P 1 和sP 2,由Antoine 方程计算,其形式:226.184 T 1592.864-8.1120 P lg s 1+= (2-1-3)223.136T 1206.470-6.85146 P lg s 2+= (2-1-4)s P 1和s P 2---mmHg, T---℃。
4.由得到的活度系数1γ和2γ,计算van Laar 方程或Wilson 方程中参数 (参考文献1)。
van Laar 方程参数,按式(2-1-5)和式(2-1-6)。
21122112)ln ln 1(ln γγγx x A += (2-1-5)22211221)ln ln 1(ln γγγx x A += (2-1-6)5.用van Laar 方程或Wilson 方程,计算一系列的211γγ,x -数据,计算11x ln -γ、12ln x -γ和121x ln-γγ数据,绘出121x ln -γγ曲线,用Gibbs —Duhem 方程对所得数据进行热力学一致性检验。
其中van Laar 方程形式如下:2221112121)1(ln x A x A A +=γ, 2112221212)1(ln x A x A A +=γ(选做)6. 计算0.1013MPa 压力下的恒沸数据,或35℃下恒沸数据,并与文献值比较(选做)。
7. 计算示例某次实验记录列于表2-1-3和表2-1-4。
表2-1-3 改进的Rose 釜操作记录实验日期 室温 25℃ 大气压 758.2 mmHg表2-1-4 折光系数测定及平衡数据计算结果测量温度 30.0℃(1)温度及压力的校正 露茎校正:按附录,036.0)0.3195.64(6.600016.0)T T (n k T =-⨯⨯=-⋅⋅=环露茎∆℃99.6404.095.64T T T =+=+=露茎真实∆℃压力校正:将测量的平衡压力758.2 mmHg 下的平衡温度折算到平衡压力为760mmHg 的平衡温度,按附录,温度校正值08.0760P 7601015.273T T 0=-⨯+=真实∆℃ 65.070.0864.99)760mmHg (T =+=平衡温度℃(2)由附录,查得,6781.01=x 时,文献数据4750.01=y ,25.65=T ℃实验值与文献值偏差0047.04750.04797.01=-=∆y , 19.007.6525.65=-=∆T ℃(3)计算实验条件下的活度系数1γ ,2γ2237.137.4397606781.04797.01=⨯=γ6556.257.4627603219.05203.02=⨯=γ(4)计算van Laar 方程中参数19412.2)ln ln 1(ln 21122112=+=γγγx x A01215.2)ln ln 1(ln 22211221=+=γγγx x A(5)用van Laar 方程,计算γ-x 数据,列于表2-1-5。
表2-1-5 用van Laar Eq.,计算γ-x 数据结果经计算得到,D< J ,符合热力学一致性。
(6)估算P = 760 mmHg 下恒沸点温度和恒沸组成 可列出以下联立方程组:2221112121)1(lnx A x A A P P s +=2112221212)1(lnx A x A A P P s +=226.184 T 1592.864-8.1120 P lg s 1+= 223.136 T 1206.470-6.85146 P lg s 2+=121=+x x代入相关数据,经试差计算得,恒沸点温度0.65=T ℃, 恒沸组成477.01=x ,与附录文献数据基本符合。
七.实验结果和讨论1. 实验结果给出mmHg P 760=下平衡温度T 、乙醇液相组成1x 和相应的汽相组成1y 数据,与附录文献数据比较,分析数据精确度。
2. 讨论(1) 实验测量误差及引起误差的原因。
(2) 对实验装置及其操作提出改进建议。
(3) 对热力学一致性检验和恒沸数据推算结果进行评议。
3.思考题(1)实验中你是怎样确定汽液二相达到平衡的? (2)影响汽液平衡数据测定的精确度的因素有哪些? (3)试举出汽液平衡数据应用的例子。
八.注意事项1. 平衡釜开始加热时电压不宜过大,以防物料冲出。
2. 平衡时间应足够。
汽液相取样瓶,取样前要检查是否干燥,装样后要保持密封,因乙醇和环己烷都较易挥发。
3. 测量折光系数时,应注意使液体铺满毛玻璃板,并防止挥发。
取样分析前应注意检查滴管、取样瓶和折光仪毛玻璃板是否干燥。
九.参考文献1. 朱自强,徐汛. 化工热力学,第2版. 北京:化学工业出版社, 19912. Hala P ,et al.Vapour —Liquid Equilibrium.Oxford:Pergamon Press Ltd.,1967 3. Smith J M ,Van Ness H C ,Abott M M. Introduction to Chemical Engineering Thermodynamics. Sixth Edition .北京:化学工业出版社,20024.武文良,张雅明,等. 异丙醇-水-乙酸钾体系汽液平衡数据的测定及关联. 石油化工, 1997,26(9):610~6135.Wu W L,Zhang Y M,Lu X H et al. Modification of the Furter equation and correlaton of the vapor-liquid equilibria for mixed-solvent electrolyte systems. Fluid Phase Equilibria, 1999,154:301~3106.陈维苗,张雅明. 醇-水-醋酸钾/碘化钾体系汽液平衡(J).高校化学工程学报,2003,17(2):123~127.7.陈维苗, 张雅明. 含盐醇水体系汽液平衡研究进展. 南京工业大学学报[J],2002,24(6):99~106.8.Gamehling J, Onken H. VLE Data Collection , Aqueous-organic system Vol 1,part 1. Germany:DECHEMA, 1977。
