氯溴碘化学活泼性比较
沪科版化学高一上册-2.3 氯、溴、碘化学活泼性的比较 课件 ppt

振荡
振荡
2mLKI溶液
2mL碘水 振荡
1mLCCl4 振荡
2mLNaCl溶液
2mL溴水 振荡
1mLCCl4 振荡
2mLKI溶液
2mL碘水 振荡
1mLCCl4 振荡
2mLNaBr溶液
实验结论
☆ 1、Br2、I2不能将Cl2置换出来; ☆ 2、Cl2能置换出Br2而I2不能;
☆ 3、Cl2 、 Br2都能将I2置换出来。
活泼性( 氧化性) Cl2 > Br2 > I2
方法二、阅读归纳法
请同学们认真阅读课本P44的资料库,比较 氯、溴、碘与氢气化合的反应条件、放出或 吸收热量的多少及生成物的热稳定性,总结 出氯、溴、碘的活泼性是怎样变化的?
H2(g)+ Cl2(g) 点燃或光照 2HCl(g)+ 92.3KJ
H2(g)+ Br2(g) 500℃ 36.4KJ
2HBr(g)+
H2(g)+ I2 (g)
2HI (g) - 26.5KJ
思考:反应的难易与反应吸收或者放出热
①相似性:Cl2、Br2、I2都能与H2发生化合 反应,方程式可以概括为:H2+X2→2HX。 ②差异性:反应条件越来越高;相同物质的 量的Cl2、Br2、I2反应放出的热量越来越少; 生成物的热稳定性越来越差。
卤素单质物理性质的变化规律
单质 颜色
F2 Cl2 Br2
浅黄绿色 黄绿色 深红棕色
状态
气态 气态
密度 增
熔沸点 升
液态 大 高
I2
紫黑色
固态
作业 查阅资料了解氟气特性
思考
比较物质化学活泼性有哪些基本方法?
单质之间的相互置换反应。
在相同条件下能否与某些物质反应以及与同一物 质反应快慢。
化学苏教版高一必修一2.1氯、溴、碘及其化合物教案设计

口头交流
板书呈现
讲述要点
聆听思考回答记忆
对本节内容有个系统的归纳
五、评价方案设计
1.评价形式与工具(AB)可多选
A.课堂提问B.书面练习C.制作作品D.测验E.其他
2.评价量表内容(测试题、作业描述等)
当堂习题在投影及课本习题中
课后练习,作业本该节内容
六、备注
板书:溴、碘的提取
一:溴、碘的物理性质
知识点的划分:1.氯、溴、碘单质的物理性质。
2.氯、溴、碘之间的置换反应。
3.海水中提取溴、碘单质的基本原理和方法。
离子和碘离子的检验。
5.氯、溴、碘及其化合物的重要应用。
项目
内容
应对措施
教学重点
海水中提取溴、碘的基本原理和方法
复习氯气化学性质的和氧化还原的有关知识点,引出氯、溴、碘之间的置换反应,并且通过讨论,设计实验方案,观察实验现象,得出实验结论,并在这个理论基础上,展开在海水中如何进行提取的方法。
五:溴、碘及其化合物的应用
教学难点
溴、碘单质的性质及差异
采用类比的方式,让学生在掌握共性的基础下,对状态颜色溶解度等差异有深刻的印象,帮助理解。
二、学习者特征分析(说明学生的已有知识基础、学习习惯等信息)
学生已经学习了本专题中研究物质的实验方法,对本节课的实验设计打下了扎实的铺垫;氯气物理性质和化学性质的学习对理解溴、碘单质的性质有很大的帮助,学生从中能感受到卤族元素之间的递变性和相似性;氧化还原的提前学习,对这节课的置换反应有了很好的理解,并且再次加深对卤族元素的单质氧化性强弱的理解。
《课题名称》教学设计
基本信息
教学题目
溴、碘的提取
所选教材
氯溴碘实验报告

一、实验目的1. 了解氯、溴、碘三种元素的性质及其氧化性的强弱。
2. 掌握氯、溴、碘氧化性的比较方法。
3. 培养实验操作能力和分析问题的能力。
二、实验原理氧化性是指物质夺取其他物质电子的能力。
氯、溴、碘三种元素在周期表中同属卤族元素,其氧化性随原子序数的增加而减弱。
本实验通过比较氯、溴、碘与碘化钾、溴化钾反应,观察四氯化碳层颜色变化,来比较三种元素的氧化性强弱。
三、实验药品与仪器1. 实验药品:氯水、溴水、碘水、碘化钾溶液、溴化钾溶液、四氯化碳、淀粉碘化钾试纸。
2. 实验仪器:试管、胶头滴管、烧杯、酒精灯、石棉网。
四、实验步骤1. 将少量氯水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
2. 将少量溴水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
3. 将少量碘水滴入试管中,加入1 mL四氯化碳,振荡,静置,观察四氯化碳层颜色。
4. 将少量碘化钾溶液滴入试管中,加入氯水,振荡,静置,观察溶液颜色变化。
5. 将少量溴化钾溶液滴入试管中,加入氯水,振荡,静置,观察溶液颜色变化。
6. 将少量碘化钾溶液滴入试管中,加入溴水,振荡,静置,观察溶液颜色变化。
7. 将淀粉碘化钾试纸分别滴加氯水、溴水、碘水,观察试纸颜色变化。
五、实验结果与分析1. 氯水滴入四氯化碳中,四氯化碳层呈浅黄色;溴水滴入四氯化碳中,四氯化碳层呈橙红色;碘水滴入四氯化碳中,四氯化碳层呈紫红色。
由此可知,氯的氧化性最强,其次是溴,最后是碘。
2. 氯水滴入碘化钾溶液中,溶液颜色变为浅棕色;溴水滴入溴化钾溶液中,溶液颜色变为浅棕色;碘水滴入碘化钾溶液中,溶液颜色无变化。
由此可知,氯的氧化性大于碘,溴的氧化性大于碘。
3. 氯水滴入溴化钾溶液中,溶液颜色变为浅棕色;溴水滴入碘化钾溶液中,溶液颜色变为浅棕色。
由此可知,氯的氧化性大于溴,溴的氧化性大于碘。
4. 氯水、溴水、碘水滴加在淀粉碘化钾试纸上,试纸颜色分别变为蓝色、紫色、无色。
高一 氯,溴,碘的性质及他们相互之间的相关反应
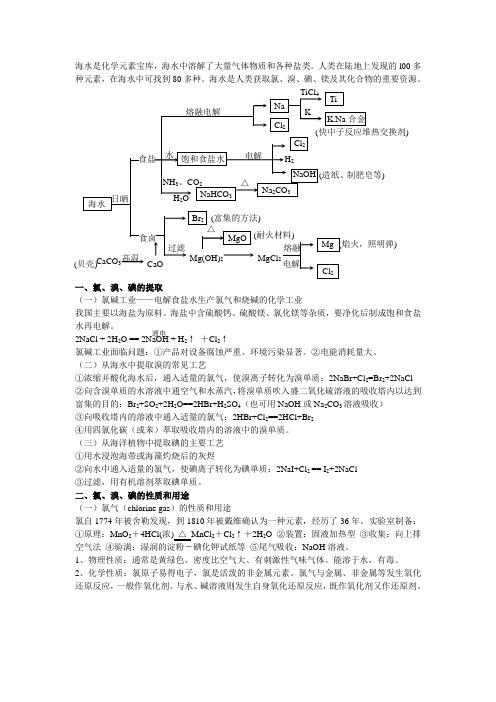
海水是化学元素宝库,海水中溶解了大量气体物质和各种盐类。
人类在陆地上发现的l00多种元素,在海水中可找到80多种。
海水是人类获取氯、溴、碘、镁及其化合物的重要资源。
一、氯、溴、碘的提取(一)氯碱工业——电解食盐水生产氯气和烧碱的化学工业我国主要以海盐为原料。
海盐中含硫酸钙、硫酸镁、氯化镁等杂质,要净化后制成饱和食盐水再电解。
2NaCl + 2H 2O == 2NaOH + H 2↑ +Cl 2↑氯碱工业面临问题:①产品对设备腐蚀严重、环境污染显著。
②电能消耗量大。
(二)从海水中提取溴的常见工艺①浓缩并酸化海水后,通入适量的氯气,使溴离子转化为溴单质:2NaBr+Cl 2=Br 2+2NaCl ②向含溴单质的水溶液中通空气和水蒸汽,将溴单质吹入盛二氧化硫溶液的吸收塔内以达到富集的目的:Br 2+SO 2+2H 2O==2HBr+H 2SO 4(也可用NaOH 或Na 2CO 3溶液吸收) ③向吸收塔内的溶液中通入适量的氯气:2HBr+Cl 2==2HCl+Br 2④用四氯化碳(或苯)萃取吸收塔内的溶液中的溴单质。
(三)从海洋植物中提取碘的主要工艺①用水浸泡海带或海藻灼烧后的灰烬②向水中通入适量的氯气,使碘离子转化为碘单质:2NaI+Cl 2 == I 2+2NaCl③过滤,用有机溶剂萃取碘单质。
二、氯、溴、碘的性质和用途(一)氯气(chlorine gas )的性质和用途氯自1774年被舍勒发现,到1810年被戴维确认为一种元素,经历了36年。
实验室制备:①原理:MnO 2+4HCl(浓) △ MnCl 2+Cl 2↑+2H 2O ②装置:固液加热型 ③收集:向上排空气法 ④验满:湿润的淀粉-碘化钾试纸等 ⑤尾气吸收:NaOH 溶液。
1、物理性质:通常是黄绿色、密度比空气大、有刺激性气味气体。
能溶于水,有毒。
2、化学性质:氯原子易得电子,氯是活泼的非金属元素。
氯气与金属、非金属等发生氧化还原反应,一般作氧化剂。
探究氯、溴、碘的化学活泼性

探究氯、溴、碘的化学活泼性一、教材分析氯、溴、碘是比较典型的、具有代表意义的非金属元素,是中学化学教材中系统地研究元素及其化合物知识的开始。
“氯、溴、碘的化学活泼性”是开发海水中卤素资源的组成部分,教材把这部分内容安排在氯气的性质及海水中提取溴和碘的后面,目的是使“氯、溴、碘活泼性的探究”能在了解氯气性质和萃取操作的基础上展开;通过对已学知识的分析,以及对初中知识的衔接,挖掘出新知识,同时,为以后学习元素周期律打下基础。
二、设计思想“氯、溴、碘的化学活泼性”在传统的教学中,大多采用讲授的方式,然后用演示实验来验证。
二期课改重视学生的全面发展,教学的意义不仅是让学生获得知识,更在于让学生去体验知识、原理的学习过程。
使学生了解自然科学研究的一般过程,培养学生的探究能力。
为此,本节课采用“引导-探究”教学模式,通过引导学生提出问题、设计实验方案、完成实验探究、得出实验结论,使学生在获得知识的同时,体会科学研究的一般过程和方法。
验证性实验不是照方抓药,探究性实验也不是放任自流,探究性实验中要充分发挥教师的指导作用,教师要为学生搭建支架,在关键处给予学生及时的点拨与启发。
三、学情分析学生在平时的学习中较少接触探究性实验,而实验方案的设计实质上是一个探索、创新的过程,对学生思维能力的要求较高,同时要求学生有一定的综合能力和迁移能力,这对于学生有一定的困难。
在探究过程中,教师可以有意识地加以引导,提高思维的严密性,提高分析问题和解决问题的能力。
四、教学目标Ⅰ.知识与技能(1)理解氯、溴、碘化学活泼性顺序。
(2)理解氯、溴、碘的原子结构和性质的相似性和差异性。
Ⅱ.过程与方法(1)通过实施探究活动,学会科学探究的基本方法。
(2)通过实验设计,提高分析问题和解决问题的能力。
(3)通过氯、溴、碘活泼性的探究实验,经历根据实验现象作出结论的过程。
Ⅲ.情感态度与价值观(1)通过原子结构与性质的分析,领略结构决定性质的思想。
知识点8——氯、溴、碘单质活泼性比较 一、知识疏理

知识点8——氯、溴、碘单质活泼性比较一、知识疏理1、卤素单质在物理性质上的主要差异和递变规律F2Cl2Br2I2颜 色:淡黄绿色 黄绿色 深棕红色 紫黑色 (颜色逐渐加深)水中溶解性: 反应 溶解(少量反应)微溶 难溶 (溶解度减小)熔 沸 点: (气态) (气态) (液态) (固态) (由低到高)2、卤素化学性质的相似性和递变性(1)相似性① 卤素单质与氯气相似,都能跟金属、非金属(如P、H2等)、水、碱等物质反应:Zn+I2ZnI2(水作催化剂)(特殊反应,反应过程中能看到紫色蒸气,这说明了什么问题?)Fe+I2 → FeI2(不能生成FeI3)(表明I2的活泼性比Cl2、Br2、F2弱)(所以,盛碘的试剂瓶不能用铁盖。
)Br2+2NaOH→NaBr+NaBrO+H2O② 化合价相似:均有-1价,除氟外,均有+1、+3、+5、+7价。
如:HF、HBrO(次溴酸)、NaIO3(碘酸钠)、HClO4(高氯酸)。
(就知道各种价态,会写不同价态的物质的化学式。
)③ 形成气态氢化物的化学式相似,可表示为HX。
HX均易溶于水,形成氢卤酸,HX在空气中均形成白雾。
(2)递变性按氟、氯、溴、碘顺序单质氧化性:逐渐减弱。
(除氟外,其它的卤素单质也有弱还原性)卤离子(X-)还原性:逐渐增强。
(F-不能被常见的氧化剂氧化。
)气态氢化物(HX)稳定性:逐渐减弱。
(会从键长解释吗?)气态氢化物(HX)还原性:逐渐增强。
(HBr、HI能被常见的氧化剂氧化)氢卤酸酸性:增强。
(只有氢氟酸是弱酸)最高价氧化物水化物(HXO4)酸性:减弱。
(氟没有含氧酸,高氯酸为无机酸中酸性最强的酸)(3)卤素间的置换反应(略)注意:F2能从熔融状态下的卤化物中置换出其他卤素,而在水溶液中F2更易与水发生反应。
3、氟的特殊性① F原子半径小,获得电子能力强,无正价,无含氧酸。
F2是氧化性最强的非金属单质。
② F2与H2反应剧烈,低温、黑暗处妈会发生爆炸。
氯、溴、碘及其化合物(jiajiao)
氯、溴、碘及其化合物随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱,主要表现:F2和所有金属都能反应. Cl2和绝大多数金属反应.Br2和较活泼金属反应. I2只和较活泼金属反应.二、性质特点(1) 卤素单质物理性质变化规律:溴是深红棕色的液体,很容易挥发,应密封保存碘是紫黑色固体,碘被加热时,不经熔化就直接变成蒸汽,蒸汽遇冷,重新凝聚成固体。
溴和碘在水中的溶解度较小,在汽油、苯、四氯化碳、酒精等有机溶剂中溶解度较大碘酒就是碘的酒精溶液,呈棕褐色。
碘遇淀粉变蓝色溴和碘在不同溶剂中所得溶液的颜色变化(2)卤素与氢气的反应随着电子层数递增,原子半径渐增大,卤素与氢气的反应的剧烈程度逐渐减弱,所生成的氢化物的稳定性也逐渐降低。
(3)卤素与水的反应氟气和水的反应:F2+H2O==HF+O2氯气,溴,碘和水反应通式:X2+H2O==HX+HXO(4)卤素单质间的置换反应实验一:将少量新制的饱和氯水分别注入盛有NaBr溶液和KI溶液的试管中,用力震荡,再注入少量四氯化碳,震荡。
观察四氯化碳层和水层的颜色的变化。
实验二:将少量溴水注入盛有KI溶液的试管中,用力震荡,再注入少量四氯化碳。
观察四氯化碳层和水层的颜色变化。
四氯化碳和水层的颜色变化,说明氯可以把溴和碘分别从溴化物和碘化物中置换出来;溴可以把碘从碘化物中置换出来2NaBr+Cl2===2NaCl+Br22KI+ Cl2===2KCl+I22KI+ Br2===2KBr+I2这说明,在氯、溴、碘这三种元素里,氯的氧化性强于溴,溴的氧化性强于碘。
实验证明,F2的氧化性比氯、溴、碘都强。
卤素离子的检验(5)Cl-、Br-、I-的检验(1)试剂:向所取待测溶液加入用稀HNO3酸化过的AgNO3溶液。
(2)现象及反应的离子方程式:Cl-+Ag+=AgCl↓(白色)Br-+Ag+=AgBr↓(浅黄色)I-+Ag+=AgI↓(黄色)溴是深红棕色液体,有刺激性气味;密度比水大;可溶于水,在水中的溶解度不大;溴水呈橙色,易挥发;溴的蒸气红棕色碘的提取单质碘的状态特殊碘是紫黑色的固体,具有金属光泽,碘易升华;与淀粉溶液变蓝,是碘含量测量滴定中的指示剂卤族元素及其化合物的特殊性归纳:①常温下溴是唯一的液态非金属单质,极易挥发,保存时用水封。
卤族元素性质
卤族元素性质
卤族元素是一类特殊的元素,它们具有特殊的性质,可以被用来弥补元素周期表中的不足。
它们具有令人惊叹的特性,能够做出令人印象深刻的事情,因此很有用,被广泛应用于各个领域。
卤族元素包括硫、氯、溴、碘、氟、氩、钾、氢、锂和镁,它们具有独特的结构,并且具有不同的性质。
它们的性质是由其原子的大小和电荷决定的,其中硫的原子半径最小,氯的电荷最大,而溴的原子最大,碘的电荷最小。
卤族元素的卤素性特性比较明显,它们很容易发生反应,但是它们的电子配位能力也比较弱。
它们具有溴的水解性,氯化物的水溶性和溴化物的酸溶性,能够形成各种电解质,这是其他元素不具有的特性。
卤族元素还具有一些独特的反应性,它们可以和酸发生反应,而不像一般的金属元素那样只和碱反应,它们还可以与去电子离子发生反应,可以用来分解有机物质。
硫族元素具有毒性,它们的毒性主要来自于它们的气态,主要是二价离子态,其特殊性质对空气迅速反应,挥发性,强烈煤气并吸收大量热量而有害。
因此,在处理这些物质时,要注意自身安全,尽量减少接触。
卤族元素在诸多领域都有重要的应用,它们可以用作抗生素、防腐剂、染料、绝缘材料、阻燃剂等,也可以用作储能的催化剂,以及燃料的添加剂,对于实现更高效的发电也是十分重要的。
从以上内容可以看出,卤族元素具有独特而具有代表性的性质,可以被应用到各个领域,它们不仅可以为化学反应和各种工业过程提供根本支持,而且可以帮助我们更好地利用自然资源以及探索更多的可能性,提高人类的生活质量。
卤族元素归纳总结
卤族元素归纳总结卤族元素是化学周期表中第17族元素,包括氟(F),氯(Cl),溴(Br),碘(I),以及短寿命的烷基(Astatine, At)。
它们属于同一元素家族,具有一些共同的性质和特点。
本文将对卤族元素的一些重要特征进行归纳总结。
一、物理性质1. 外观:卤族元素在常温下大多数呈现为气体形态,其中氟和氯是气体,溴是液体,碘是固体。
2. 颜色:氟气呈无色,氯气呈黄绿色,溴气呈红棕色,碘呈紫色。
3. 密度:卤族元素的密度逐渐增加,氟气密度最小,碘密度最大。
4. 沸点和熔点:卤族元素的沸点和熔点随原子序数的增加而增加。
二、化学性质1. 氧化性:卤族元素具有较强的氧化性,可以与金属发生反应,形成相应的卤化物。
2. 反应活性:从上至下,卤族元素的反应活性逐渐减弱,氟的反应性最强烈,碘的反应性最弱。
3. 电负性:卤族元素的电负性逐渐减小,从氟到碘,电负性依次递减。
4. 氧化态:卤族元素的氧化态多为-1,但在一些化合物中也可以表现出不同的氧化态。
三、应用领域1. 消毒杀菌:氯气和溴化物常被用于消毒杀菌,如水处理、游泳池消毒等。
2. 防腐剂:食品工业中常使用氯化钠(食盐)作为防腐剂,防止食物变质。
3. 药物制剂:碘被用作一些药物的成分,如碘酊具有消毒和抗菌作用。
4. 光敏材料:氯化银、溴化银和碘化银被广泛应用于摄影和印刷行业。
结论:卤族元素具有一些相似的物理性质和化学性质,但也存在一些差异性。
它们的主要应用领域涵盖消毒杀菌、防腐剂、药物制剂以及光敏材料等。
了解卤族元素的特点和应用对于化学研究和实际应用具有重要意义。
以上是对卤族元素的归纳总结,通过对其物理性质、化学性质以及应用领域的概括,可以更好地理解和应用这一元素家族。
对卤族元素进行系统地研究有助于进一步拓展其应用领域,并为新材料的研发提供基础。
例谈氯、溴、碘性质的比较
例谈氯、溴、碘性质的比较山东省邹平县长山中学256206 吴贵智氯、溴、碘是海水中的主要卤族元素,其中氯、溴、碘三种元素单质的性质是新课标要求的重点。
一、物理性质的比较通常情况下,氯气是黄绿色、有刺激性气味、比空气重的有毒气体,易液化,能溶于水,1体积水大约能溶解2体积的氯气;溴是常温下呈液态的唯一非金属单质,易挥发成红棕色的溴蒸气,存放液态溴时,应放在阴凉处并用水封,盛液溴或溴水的试剂瓶不能用橡皮塞;碘为紫黑色固体,易升华,盛放单质碘的试剂瓶不能用金属瓶盖。
Cl2、Br2、I2都易溶于CCl4、CS2、苯、汽油等有机溶剂,在有机溶剂中分别呈黄色、橙色和紫色。
二、化学性质的比较氯、溴、碘最外层均为7个电子,在反应中容易得1个电子达到8个电子的稳定结构,可作强氧化剂,同时由于其电子层数各不相同,所以它们的得电子能力也不相同,其氧化能力为Cl2>Br2>I2。
1、与大多数金属反应例如与金属钠反应生成NaCl、NaBr和NaI;而与变价金属铁反应是分别生成FeCl3、FeBr3和FeI2。
I2与Mg、Zn、Al等在水作催化剂作用下能迅速反应,Mg+I2==MgI2(放热,产生紫烟)。
2、与非金属反应Cl2+H2==2HCl (光照时发生爆炸)Br2+H2==2HBr (加热到500℃开始反应)I2+H2==2HI (持续加热缓慢化合,且生成的HI同时分解)3、与水反应Cl2和Br2能溶于水,而I2微溶于水,它们均能与水反应。
例如:Cl2+H2O==HCl+HClO (HClO有强氧化性,能使有色物质褪色,即漂白性)4、与碱反应Cl2+2NaOH==NaCl+NaClO+H2O (用于吸收Cl2,“84”消毒液的主要成分) 2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O (用于生产漂白粉或漂白精)5、与还原性化合物反应(1) Cl2、Br2、I2之间的置换反应按照Cl2、Br2、I2的顺序,氧化性强的能将氧化性弱的从它们的化合物中置换出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
方法二、阅读归纳法
请同学们认真阅读课本P44的资料库,比较 氯、溴、碘与氢气化合的反应条件、放出或 吸收热量的多少及生成物的热稳定性,总结 出氯、溴、碘的活泼性是怎样变化的?
H2(g)+ Cl2(g) H2(g)+ Br2(g) 36.4KJ H2(g)+ I2 (g)
点燃或光照
2HCl(g)+ 92.3KJ 2HBr(g)+
2mL碘水
1mLCCl4
振荡
振荡
2mLNaCl溶液
2mL溴水
1mLCCl4
振荡
振荡
2mLKI溶液
2mL碘水
1mLCCl4
振荡
振荡
2mLNaBr溶液
实验结论
☆ 1、Br2、I2不能将Cl2置换出来; ☆ 2、Cl2能置换出Br2而I2不能;
☆ 3、Cl2 、 Br2都能将I2置换出来。
活泼性( 氧化性) Cl2 > Br2 > I2
氯水+NaBr 溴水+NaCl 氯水+KI
碘水+NaCl 溴水+KI 碘水+NaBr
Cl2>I2
I2 > Cl2 Br2>I2 I2 >Br2
2mL新制氯水
1mLCCl4
振荡
振荡
2mLNaBr溶液
2mL溴水
1mLCCl4
振荡
振荡
2mLNaCl溶液
2mL新制氯水
1mLCCl4
振荡
振荡
2mLKI溶液
反应过程中吸收或者放出热量的多少。 生成物的稳定性。 物质的结构。
500℃
2HI (g) - 26.5KJ
思考:反应的难易与反应吸收或者放出热
①相似性:Cl2、Br2、I2都能与H2发生化合 反应,方程式可以概括为:H2+X2→2HX。 ②差异性:反应条件越来越高;相同物质的 量的Cl2、Br2、I2反应放出的热量越来越少; 生成物的热稳定性越来越差。
活泼性: Cl2>Br2>I2
3、与水反应
4、与碱溶液反应 5、与金属单质反应
卤素单质物理性质的变化规律
单质 颜色
F2
浅黄绿色 气 态
Cl2
黄绿色 气 态
Br2
深红棕色 液 态
I2
紫黑色 固态
状态 密度 熔沸点
增
升
大
高
作业 查阅资料了解氟气特性
思考
比较物质化学活泼性有哪些基本方法?
单质之间的相互置换反应。 在相同条件下能否与某些物质反应以及与同一物 质反应快慢。 反应的条件。
金属如此,非金属是否也有类似的规律呢?
氯、溴、碘化学活泼性的比较
方法一、实验探究法
实 验 设 计
◆利用下列物质: 氯水、溴水、碘水、NaCl溶液、 NaBr溶液、KI溶液、CCl4。
◆判断Cl2、Br2、I2三者的活泼性强弱。
探究氯、溴、碘单质活泼性的强弱
假 设 (可能性) Cl2> Br2 Br2 > Cl2 方 案 设 计 验 证 (操作和现象) 结 论
氯、溴、碘单质与水的反应
Cl2 +H2O HCl + HClO
( 反应程度较大)
Br2 +H2O
I2 +H2O
HBr + HBrO
(反应较微弱)
HI
+ HIO
(反应很微弱,几乎不进行)
方法三、追根溯源
结 构
?
性质
氯溴碘在周期表中的位置
思考:氯、溴、碘原子结构的异同?
氯
+17 +35 +53
2
8
7
溴
2 2
8 8
18 7 18 18 7
碘
小结
原子结构
相同点: 最外层7个电子
Cl Br I 决定
性质
易得一个电子,具氧化性。
不同点:
核电荷数递增 电子层数递增 原子半径依次增大
得电子能力逐渐减弱, 氧化性逐渐减弱。
总结----氯溴碘的相似性:
1、与某些盐溶液置换反应 2、与氢气等非金属单质反应
一、知识 Na> Mg> Al> Zn> Fe> Sn> Pb> H>Cu >Hg> Ag> Pt>Au 钾,钙,钠,镁,铝,锌,铁,锡,铅,氢,铜,汞,银,铂,金
“以强制弱”原则
根据金属活动性顺序表可以判断置换 反应是否发生。氢前面的金属可以把 酸中的氢置换出来。位置在前的金属 可把在后的金属置换出来。
