Cleanert Alumina N中性氧化铝萃取柱,1000mg_6mL,30支_包
NiNTA琼脂糖纯化树脂
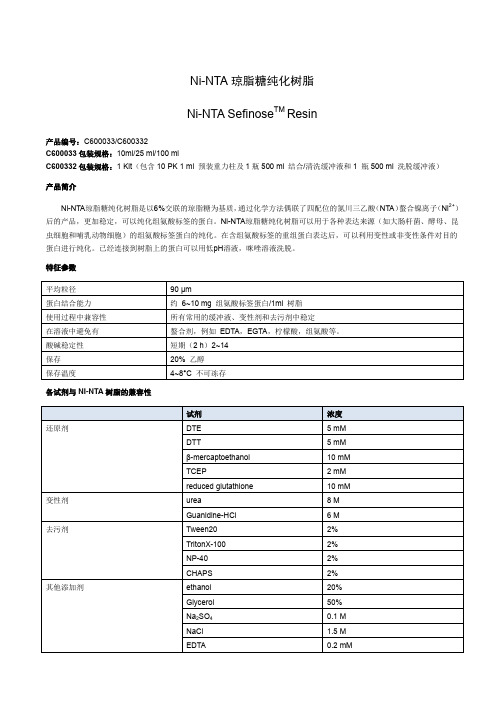
Ni-NTA琼脂糖纯化树脂是以6%交联的琼脂糖为基质,通过化学方法偶联了四配位的氮川三乙酸(NTA)螯合镍离子(Ni2+) 后的产品,更加稳定,可以纯化组氨酸标签的蛋白。Ni-NTA琼脂糖纯化树脂可以用于各种表达来源(如大肠杆菌、酵母、昆 虫细胞和哺乳动物细胞)的组氨酸标签蛋白的纯化。在含组氨酸标签的重组蛋白表达后,可以利用变性或非变性条件对目的 蛋白进行纯化。已经连接到树脂上的蛋白可以用低pH溶液,咪唑溶液洗脱。
淀完全溶解。 4. 12,000 rpm离心30 min去除剩余的不溶物。小心的将上清转移到干净的管中而不触碰下面的沉淀。
组氨酸标签蛋白纯化步骤
离心法组氨酸标签蛋白纯化步骤 可根据自身实验情况进行调整,可以再室温或是4°C进行纯化。 1. 加入适量的 Ni-NTA树脂到离心管中。离心管在3000 rpm离心2 min然后小心的去除上清。 2. 加入两倍柱体积的Binding/wash buffer 将缓冲液和树脂完全混匀。 3. 离心管在3000 rpm离心2 min 然后小心的去除上清。 4. 将蛋白提取物与Binding/wash buffer混匀,使总体积相当于两个柱体积。 5. 将上步中的混合液加入柱,在旋转振荡器混匀30 min,使混合液与树脂混匀。 6. 离心管在3000 rpm离心2 min,吸出上清,如需要可将上清留存进行下游分析。 7. 用两倍柱体积的Binding/wash buffer清洗。离心管在3000 rpm离心2 min吸出上清,如需要可将上清留存进行下游分析。. 8. 重复清洗步骤,通过测量在280 nm吸光度,直到洗出液值达到基线值。 9. 用一倍柱体积的Elution Buffer 洗脱柱上的组氨酸标签蛋白。离心管在3000 rpm离心2 min 然后小心的吸出并保存上清。
过柱的方法和技巧

关于过柱得实验方法与技巧(注意:有机溶剂对身体特有害别就是心肺;肝脏等所有过柱操作都要在通风橱里进行!!常说得过柱子应该叫柱层析分离,也叫柱色谱。
我们常用得就是以硅胶或氧化铝作固定相得吸附柱。
由于柱分得经验成分太多,所以下面我就几年来过柱得体会写些心得,希望能有所帮助。
1、柱子可以分为:加压,常压,减压压力可以增加淋洗剂得流动速度,减少产品收集得时间,但就是会减低柱子得塔板数、所以其她条件相同得时候,常压柱就是效率最高得,但就是时间也最长,比如天然化合物得分离,一个柱子几个月也就是有得。
减压柱能够减少硅胶得使用量,感觉能够节省一半甚至更多,但就是由于大量得空气通过硅胶会使溶剂挥发(有时在柱子外面有水汽凝结),以及有些比较易分解得东西可能得不到,而且还必须同时使用水泵抽气(很大得噪音,而且时间长)。
以前曾经大量得过减压柱,对它有比较深厚得感情,但就是自从尝试了加压后,就几乎再也没动过减压得念头了。
加压柱就是一种比较好得方法,与常压柱类似,只不过外加压力使淋洗剂走得快些。
压力得提供可以就是压缩空气,双连球或者小气泵(给鱼缸供气得就行)。
特别就是在容易分解得样品得分离中适用。
压力不可过大,不然溶剂走得太快就会减低分离效果。
个人觉得加压柱在普通得有机化合物得分离中就是比较适用得。
ﻫ2、关于柱子得尺寸,应该就是粗长得最好柱子长了,相应得塔板数就高。
柱子粗了,上样后样品得原点就小(反映在柱子上就就是样品层比较薄),这样相对得减小了分离得难度。
试想如果柱子十厘米,而样品就有二厘米,那么分离得难度可想而知,恐怕要用很低极性得溶剂慢慢冲了、而如果样品层只有0.5厘米,那么各组分就比较容易得到完全分离了。
当然采用粗大得柱子要牺牲比较多得硅胶与溶剂了,不过这些成本相对于产品来说也许就不算什么了(有些不环保得说,不过溶剂回收重蒸后也就减小了部分浪费)。
现在见到得柱子径高比一般在1:5~10,书中写硅胶量就是样品量得30~40倍,具体得选择要具体分析。
II 样品前处理柱

Dionex OnGuard II样品前处理柱1 前言Dionex OnGuard II样品前处理系列小柱产品包括七种功能类型,两种大小规格(1.0 cc 和2.5 cc)。
这些产品适用于对样品进行分析物的固相萃取和样品的基体去除。
所谓的样品基体去除是指利用样品中基体组分与样品前处理小柱中的固定相之间的特有结合使基体中的干扰组分保留在样品前处理小柱上,而被分析物则不被保留直接通过样品前处理小柱,从而进行后续的分析测定,这样就可消除样品基体中共存组分对测定的干扰。
对于分析物的直接固相萃取方法则是指将分析样品的溶液通过样品前处理小柱时,分析物由于特有的结合作用被直接保留在样品前处理小柱上,而样品中的基体组分则不被保留,从而通过样品前处理小柱,随后再使用合适的洗脱剂将萃取于样品前处理小柱上的被分析物洗脱下来进行后续的分析测定,这种方法也可达到分析物富集和样品基体去除的作用。
由于新的设计理念的采用,Dionex OnGuard II样品前处理系列小柱产品既具有出色的分析性能,有极大的方便了分析者的使用。
同时2.5 cc规格的样品前处理小柱具有较高的柱容量,适合于处理离子强度高的样品,这种规格的小柱也有利于降低使用成本。
另外这种柱型设计也有利于实现样品前处理过程的自动化下表简要给出了Dionex OnGuard II样品前处理系列小柱产品种类,化学结构特点和应用。
表1 Dionex OnGuard II样品前处理系列小柱及其应用柱类型和规格功能团应用示例OnGuard II A(1.0 cc, 2.5 cc)HCO3-型季胺盐强保留阴离子的去除,溶液pH的调节OnGuard II Ag(2.5 cc)Ag+型磺酸盐卤素阴离子的去除OnGuard II Ag/H(2.5 cc)Ag+型磺酸盐+磺酸卤素阴离子的去除,过量Ag+的去除OnGuard II Ba(1.0 cc, 2.5 cc)Ba2+型磺酸盐SO42-的去除OnGuard II H(1.0 cc, 2.5 cc)磺酸阳离子的去除,溶液pH的调节OnGuard II M(1.0 cc, 2.5 cc)亚氨基二乙酸基过渡金属离子去除和浓缩富集OnGuard II P(1.0 cc)聚乙烯吡咯烷酮酚类物质,偶氮染料和腐植等的去除和浓缩富集OnGuard II RP(1.0 cc, 2.5 cc)二乙烯基苯疏水性化合物的去除2Dionex OnGuard II样品前处理柱的应用2.1 Dionex OnGuard II样品前处理柱的预处理为了获得最佳的分析结果,在使用Dionex OnGuard II样品前处理柱时应该遵循如下原则。
CHEMICON 核纤维提取套件(产品编号:2900)说明书

Nuclear Extraction Kit100 ExtractionsCat. No. 2900FOR RESEARCH USE ONLYNot for use in diagnostic procedures.USA & CanadaPhone: +1(800) 437-7500 • Fax: +1 (951) 676-9209 • Europe +44 (0) 23 8026 2233 Australia +61 3 9839 2000 • Germany +49-6192-207300 • ISO Registered worldwide •*********************•*********************This page left intentionally blank .ApplicationCHEMICON®’s Nuclear Extraction Kit (Catalog No. 2900) provides a simple and convenient method for the isolation of cytoplasmic and nuclear samples from mammalian cell culture or tissue samples. The Nuclear Extraction Kit can be used in the preparation of purified proteins for use in Western blotting, Electrophoretic Mobility Shift Assays (EMSA), and in CHEMICON®’s Transcription Factor Assay product line.For Research Use Only; Not for use in diagnostic procedures.Kit Components1. Cytoplasmic Lysis Buffer, 10x: - (Part No. 90497) One vial containing10mL of a concentrated lysis buffer. Dilute to a 1x in deionized water.2. Nuclear Extraction Buffer: - (Part No. 90498) One vial containing 50mL ofa 1x nuclear extraction buffer.3. PBS Packets: - (Part No. 60093) Two pouches containing enough dryreagent to prepare 1 liter of a 1x PBS solution per pouch. Dilute packet in deionized water.4. DTT, 1M: - (Part No. 90499) One vial containing 100µL of 1MDithiothreitol. Prior to use, dilute to a final concentration of 0.5mM(1:2000) in 1x Cytoplasmic Lysis Buffer and 1x Nuclear Extraction Buffer.5. Protease Inhibitor Cocktail: - (Part No. 90492) One vial containing 100µLof protease inhibitors in DMSO for use with mammalian cell and tissueextract buffers. A mixture of protease inhibitors with broad specificity for the inhibition of serine, cysteine and aspartic acid proteases andaminopeptidases. Contains 4-(2-aminoethyl)benzenesulfonyl fluoride(AEBSF), pepstatin A, E-64, bestatin, leupeptin, and aprotinin. Contains no metal chelators (e.g. EDTA, EGTA). Prior to use, dilute 1/1000 in 1xCytoplasmic Lysis Buffer and 1x Nuclear Extraction Buffer.6. Detergent, 10%: - (Part No. 90500) One vial containing 3mL of 10%IGEPAL CA-630 (detergent). Cytoplasmic Lysis Buffer and NuclearExtraction Buffer already contain detergent, however, under certainconditions, more detergent may be required - refer to Extraction Procedure.1Materials Not Supplied1. Tissue Culture Reagents2. Cell Detachment Buffer (Trypsin) or Cell Scrapers3. Syringes, 1mL – 27 Gauge Needle4. 1.5 mL Microcentrifuge Tubes5. 50 mL Conical Tubes6. Deionized Water7. Phosphatase Inhibitor (if needed)8. Microcentrifuge, 4ºC9. Table-top Centrifuge (capable of 16,000 x g), 4ºC10. Rotator/Orbital Shaker, 4o CStorageThe Nuclear Extraction Kit is shipped and stored at -20ºC.• Cytoplasmic Lysis Buffer (10x), Nuclear Extraction Buffer (1x), 10% Detergent, and the PBS Packets can be stored at 2-8ºC.• DTT, 1M and Protease Inhibitor Cocktail must be stored at -20ºC. Avoid repeated freeze-thaw cycles.Preparation of ReagentsNote: Chill all buffers on ice prior to use.• Rehydrate PBS Packet in 1 liter of deionized water.• Dilute 10x Cytoplasmic Lysis Buffer to a 1x solution with deionized water.• Prior to use, add 0.5mM (final) DTT and 1/1000 dilution of Protease Inhibitor Cocktail to 1x Cytoplasmic Lysis Buffer and/or 1x NuclearExtraction Buffer.2Extraction ProcedureA. Cell Culture1. Grow cells to 70-90% confluency for adherent cells or about 1.5 x106/mL for suspension cells.2. If necessary, treat cells with desired method.B. Cell Disruption1. For adherent cells, wash the cells with 1x PBS solution, remove, andthen add warmed trypsin cell detachment buffer to the culture flask(s).Let the trypsin sit for approximately 2-5 minutes (depending on celltype) and shake cells off.Alternately, a cell scraper may be used instead of trypsin. Collect cellsand transfer to a clean centrifuge tube. Rinse the culture flask with twovolumes of ice cold PBS and add to centrifuge tube. Centrifuge thesample at 250 x g for 5 minutes at 4°C. Discard the supernatant andresuspend the cell pellet in 40 mL of ice-cold PBS to wash. Centrifugethe suspension at 250 x g as before. Repeat. Pour off supernatant.Note: All work done after cell trypsinization/detachment needs to beperformed on ice and/or with chilled buffers. It is imperative that thecell pellets and suspension remain as cold as possible without freezingduring the extraction process.2. Estimate the approximate volume of the cell pellet. This value will beneeded for determining the amount of buffer volume necessary fornuclear extraction. (Two T175 tissue culture flasks of confluent HeLacells will generate a cell pellet of approximately 100µL.)3. Add 5 cell pellet volumes of ice cold 1x Cytoplasmic Lysis Buffercontaining 0.5mM DTT and 1/1000 dilution or inhibitor Cocktail.4. Resuspend the cell pellet by gently inverting the tube. Avoid foamproduction. Do not vortex!5. Incubate the cell suspension on ice for 15 minutes.6. Centrifuge the cell suspension at 250 x g for 5 minutes at 4°C. Discardsupernatant and resuspend the cell pellet in two volumes of ice cold 1xCytoplasmic Lysis Buffer.3C. Cell Lysis1. Using a syringe with a small gauge needle (27 gauge), draw the cellsuspension prepared in Section B from the sample tube into the syringeand then eject the contents back into the sample tube. Repeatapproximately 5 times (drawing and ejecting). If the cells “clump” andyou are not able to draw them into the syringe, more Detergent, 10%may be added.Note: Lysis and extraction buffers already contain detergent. However,if cell clumping occurs during the lysis procedure it may be necessaryto add additional detergent to the Cytoplasmic Lysis Buffer andNuclear Extraction Buffer.2. Centrifuge the disrupted cell suspension at 8,000 x g for 20 minutes at4°C.3. The supernatant contains the cytosolic portion of the cell lysate.Transfer the supernatant to a fresh tube. To keep the cytosolic fraction,aliquot, snap-freeze and store at -80°C. Avoid repeated freeze-thawcycles.4. The remaining pellet contains the nuclear portion of the cell lysate.D. Nuclear Extraction1. Resuspend the nuclear pellet in 2/3 of the original cell pellet volume(determined in step B.2) of ice cold Nuclear Extraction Buffercontaining 0.5mM DTT and 1/1000 Protease Inhibitor Cocktail.2. Using a fresh syringe, with a 27-gauge needle, repeat Step C.1. todisrupt the nuclei, add more Detergent, 10% if necessary.Note: The nuclear extract sample can be stored at –80°C at this point ifneeded.3. Use a rotator or orbital shaker (low speed) to gently agitate the nuclearsuspension at 4°C for 30-60 minutes.4. Centrifuge the nuclear suspension at 16,000 x g for 5 minutes at 4°C.5. Transfer the supernatant to a fresh tube. This fraction is the nuclearextract.6. Determine protein concentration.Note: If additional detergent was added during cell lysis (step C.1 orD.2) it may interfere with certain methods of protein concentrationdetermination. Extract may need to be diluted 10-fold or moredepending upon final detergent concentration.7. Snap-freeze the nuclear extract in aliquots and store at –80°C. Avoidrepeated freezing and thawing of nuclear extract.4WarrantyThese products are warranted to perform as described in their labeling and in CHEMICON literature when used in accordance with their instructions. THERE ARE NO WARRANTIES, WHICH EXTEND BEYOND THIS EXPRESSED WARRANTY AND CHEMICON DISCLAIMS ANY IMPLIED WARRANTY OF MERCHANTABILITY OR WARRANTY OF FITNESS FOR PARTICULAR PURPOSE. CHEMICON ’s sole obligation and purchaser’s exclusive remedy for breach of this warranty shall be, at the option of CHEMICON , to repair or replace the products. In no event shall CHEMICON be liable for any proximate, incidental or consequential damages in connection with the products.2003: CHEMICON International, Inc. - By CHEMICON International, Inc. All rights reserved. No part of these works may be reproduced in any form without permissions in writing.5Cat No. 2900December 2003Revision A: 41599。
希森美康凝血功能CA-500标准SOP文件

Sysmex CA 500系列全自动血凝仪标准操作规程目录1. 概述 (3)2. 仪器运行条件 (6)3. 样本检测程序 (17)4. 质控检测程序 (23)5. 标准曲线制作 (29)6. 维护及耗材置换 (35)7. 附录 (49)第一部分概述1.使用目的CA-500系列全自动血凝分析仪用于凝血、抗凝、纤维蛋白溶解系统功能的检测,为出血性和血栓性疾病的诊断与鉴别诊断、溶栓及抗凝治疗的监测与疗效观察提供有价值的指标。
2.检测原理全自动血凝分析仪CA-500系列用于凝血、抗凝、纤维蛋白溶解系统因子的检测,其中CA510采用凝固法;CA530采用凝固法,发色底物法两种检测原理:CA550采用凝固法,发色底物法和免疫分析法三种检测原理。
2.1凝固法(散射光比浊法加百分比终点法)2.1.1散射光比浊法CA-500系列采用光学检测法,将血液凝固过程中的混浊度变化转换成散射光的变化后进行检测。
光源(卤素灯)发出的660nm光照射到标本,光电二极管接收90°直角方向散射光信号并转换为电信号,仪器内微机据此绘制出凝固曲线,用百分比检测法来确定凝固时间。
图1-1:光学检测系统2.1.2百分比检测法仪器把加入试剂后最初的散射光量设为0%,把反应结束后不再变化的散射光量设为100%。
将与50%散射光量相对应的时间作为凝固终点报告,因为50%的部位单位时间内散射光量的变化最为显着,纤维蛋白单体的聚合速度最快。
我们把这种方法称为“百分比终点法”。
图1-2:凝固时间的测定2.2发色底物法首先人工合成含某种活性酶裂解位点的化合物,且化合物连接上产色物质,该修饰后的化合物称作产色底物。
待检样品中含有活性酶或往样品中加入活性酶(被测物质含量同酶活性呈一定的数量关系),酶作用于裂解位点使产色物质被解离下来,在被检样品中产生颜色变化,检测透射光的变化。
根据酶活性同吸光度的变化、酶活性同所需检测物质含量间均存在一定的数量关系,由吸光度变化推算出所检测物质含量。
TLC跑经验总结

T L C跑经验总结(总14页) -本页仅作为预览文档封面,使用时请删除本页-看了MERK兄的帖子,很受启发,想起发这个帖子,希望大家把在过柱子过程中的获得的成功的或不成功的,成熟的或不成熟的经验或想法,留在这块,我们大家可以互相学习,互相交流,期待着共同的进步,共同的提高,希望大家跟帖。
谢谢!先把板子爬好其实也不是这么简单。
有时候板上很好,柱子差远了。
有同感!我感觉过柱子跟爬板,不太一样,板爬的好,过柱子时,可就没有那么幸运了。
板子爬不好,柱子一定爬不好还是先把板子爬好,板子比柱子好把握,有个参考好多了。
还是先把板子爬好,掌握好各个Rf值对,过柱是一个很好的参考,我一般在开始时选用2、3个展开剂过柱,开始用极性小的展开剂,将极性小的杂质先除名,再用极性大的。
如果我想要的那个东东的Rf值约左右(展开剂是氯仿/甲醇:10/1),那么我能否单用氯仿过柱?柱子和板有差异的话,想看的清楚一点,最好把板90度爬两次,如果不是会洗脱液中分解的话,应该会比较容易重复的!柱子情况与TLC基本上一样的,但是装柱和上样一定要搞好不然很容易跑得一塌糊涂无论干柱还是湿柱,把柱子压实分离效果才会好过柱的关键有几点:1是选择好硅胶,装柱的时候要压紧,压平,使柱子中间没有气泡;2是要选择好展开剂;最好先查查文献,看看有没有类似的色谱条件,这样做起来就事半功倍了回9楼:可以单一用氯仿做洗脱剂!效果还不错!感觉冬天过柱效果较差9楼兄弟这个不好说,因为我们大家过柱的方法不一定相同,学校一般使用常压或加压,而我们这里使用的确实减压间歇法.好的板子很重要只要你的化合物有极性区别,理论上没有分不开的柱子。
所以一定要耐心,有几分象钓鱼。
过柱子是一个经验活,主要凭感觉,因为它和您的待分离物的个数、各点间的间距、Rf值...均有关系,柱子过多了,就会感觉出一个合适的洗脱液以及极性。
但也并非无规律可循,过柱前爬板是必不可少的,试不同极性,找一个各点分离较开的极性,内径一厘米的柱子一般极性放大10倍左右,柱子越粗,极性放达越大。
axykit 报价
Plasmid DNA purification AxyPrep-96 Plasmid Kit AxyPrep-96 质粒DNA试剂盒 1×96 prep Plasmid DNA purification AxyPrep-96 Plasmid Kit AxyPrep-96 质粒DNA试剂盒 24×96 prep Plasmid DNA purification AxyPrep-96 Plasmid Kit AxyPrep-96 质粒DNA试剂盒 4×96 prep PCR clean-up PCR clean-up PCR clean-up AxyPrep-96 PCR Clean-up AxyPrep-96 Kit PCR 1×96 清洁试剂盒 prep AxyPrep-96 PCR Clean-up AxyPrep-96 Kit PCR 24×96 清洁试剂盒 prep AxyPrep-96 PCR Clean-up AxyPrep-96 Kit PCR 4×96 清洁试剂盒 prep
Plasmid DNA purification AxyPrep Midi PlasmidAxyPrep Kits 质粒中量制备试剂盒 10 prep Plasmid DNA purification AxyPrep Midi PlasmidAxyPrep Kits 质粒中量制备试剂盒 25 prep Plasmid DNA purification AxyPrep Midi PlasmidAxyPrep Kits 质粒中量制备试剂盒 2 prep
AP-MN-BF-VNA-4G AP-MN-BF-VNA-50G AP-MN-BF-VNA-VN AP-MN-BL-GDNA-250G AP-MN-BL-GDNA-4G AP-MN-BL-GDNA-50G AP-MN-BL-GDNA-AP1 AP-MN-BL-GDNA-AP2 AP-MN-BL-GDNA-TE AP-MN-BL-RNA-250G AP-MN-BL-RNA-4G AP-MN-BL-RNA-50G AP-MN-BT-GDNA-250G AP-MN-BT-GDNA-250T AP-MN-BT-GDNA-4G AP-MN-BT-GDNA-50G AP-MN-EP-150G AP-MN-EP-4G AP-MN-EP-50G AP-MN-FEP-150G AP-MN-FEP-4G AP-MN-FEP-50G AP-MN-MiRNA-250G AP-MN-MiRNA-4G AP-MN-MiRNA-50G AP-MN-MS-GDNA-250G AP-MN-MS-GDNA-4G AP-MN-MS-GDNA-50G AP-MN-MS-RNA-250G AP-MN-MS-RNA-4G AP-MN-MS-RNA-50G AP-MN-P-250G AP-MN-P-250G-RA AP-MN-P-4G AP-MN-P-500G AP-MN-P-500-S1 AP-MN-P-500-S2 AP-MN-P-500-S3 AP-MN-P-500-W2 AP-MN-P-50G AP-MX-BL-GDNA-10G AP-MX-BL-GDNA-25G AP-MX-BL-GDNA-2G AP-MX-EP-10G AP-MX-EP-25G AP-MX-EP-2G AP-MX-MS-RNA-10G AP-MX-MS-RNA-25G
液质联用法同时测定干血斑中环孢菌素A、西罗莫司、他克莫司和依维莫司药物浓度
菌素 A 浓 度 分 别 为 400、
800、
1600、
2000、
3200、
6400、
16000、
20000ng/mL,含 西 罗 莫 司、他 克 莫 司
疫抑制 剂 检 测 方 法,但 4 种 药 物 的 回 收 率 较 低
1600、
司d3(西罗 莫 司 氘 代 内 标 )和 依 维 莫 司d4 (依 维 莫
司 氘 代 内 标 )均 购 自 加 拿 大 To
r
on
t
o Re
s
e
a
r
ch
Chemi
c
a
l
s公司;甲 醇、乙 腈、甲 酸 均 为 色 谱 纯,美 国
F
i
she
rSc
i
en
t
i
f
i
c公司;盐 酸 (分 析 纯 ),上 海 润 捷 化
菌素 A、西 罗 莫 司、他 克 莫 司 和 依 维 莫 司 的 高 通 量
LC-MS/MS 方法,并根据美国 FDA 发布的《生物分
析方法验证指南》[10]对方法的线性 范 围、定 量 限、提
取回收率、精 密 度 与 准 确 度、残 留 效 应 和 稳 定 性 进
行考察,根据欧洲 EMA 发布的《生物分析方法验证
2021 年第 1 期
机设备有限 公 司;
VSD150
1A 型 氮 吹 仪,无 锡 沃 信
仪器制 造 有 限 公 司;Mi
l
l
i
-Q Advan
t
age A10 纯 水
仪,德国 Me
r
ck Mi
薄层色谱显色剂讲解
通用试剂(1) 重络酸钾-硫酸:检查一般有机物.喷洒剂:5克重络酸钾溶于100毫升40%硫酸中.薄层检查:喷洒后加热到150℃至班点出现(2) 荧光素-溴:检查不饱和化合物喷洒剂:0.1克荧光素溶于100毫升乙醇中溴试剂:5%的溴的四氯化碳溶液喷洒后处理:喷洒荧光素溶液后,放置存有溴溶液的缸内,可于紫外线分析灯下检查荧光,荧光素与溴化和成曙红(Eosin)(无萤光),而不饱和化合物则成溴加成物,保留了原有荧光;若点样较多,则呈黄色斑点,底板呈红色.(3) 碘:检查一般有机物.方法:a 层析谱放密闭缸内或瓷盘内,缸内预先放有碘结晶少许,大部分有机化合物呈棕色斑点。
B 层析谱放碘蒸气中5分钟(或喷5%碘的氯仿溶液)取出置空气中待过量的碘蒸气全部挥发后,喷1%淀粉的水溶液,斑点转成蓝色。
(4)硫酸:通用喷洒剂:5%的浓硫酸乙醇溶液,或15%浓硫酸正丁醇溶液,或浓硫酸-醋酸(1:1)喷洒后处理:空气中干燥15分钟,再热至110℃直至出现颜色或荧光。
(5)硝酸银-氢氧化铵(Tollen-Zaffaroni)试剂:检查还原性物质。
溶液I : 0.1%N硝酸银; 溶液II: 5N氢氧化铵喷洒剂: I和II以1:5混合(临用前混合)喷洒后处理: 105℃加热5~10分钟,至深黑色斑点出现.(6)磷钼酸或磷钨酸,硅钨酸:检查还原性物质,类脂体,生物碱,甾体喷洒剂: 5~10%磷钼酸或磷钨酸或硅钨酸乙醇溶液喷洒后处理: 120℃加热至斑点出现.沉淀试剂: 1克硅钨酸溶于20毫升水中,加10%盐酸至强碱性.生物碱(7)硫酸??=硫酸:检查生物碱及含碘化合物喷洒剂: 0.1克硫酸?混悬于4毫升水中,加入1克三氯醋酸,加热至沸,逐滴加入浓硫酸至澄清.喷洒后处理: 110℃加热数分钟至斑点出现.(8)碘化铋钾(Dragendorff)试剂:检查生物碱及其他含氟化合物.溶液I: 0.85克次硝酸铋溶于10毫升冰醋酸40毫升水中溶剂II: 8克碘化钾溶于20毫升水中.制备液I+II,等体积混合.可用于棕色瓶中保存较长时间,一般制备液可作沉淀试剂用.喷洒液: 制备液1毫升与2毫升醋酸,10毫升水混合即得(9).碘化汞钾(Mayer)试剂: 检查生物碱.制备液: 13.55克氯化汞和49.8克碘化钾各溶于20毫升水中,等体积混合并用水稀释至1000毫升.喷洒液: 制备液加1/10体积的17%盐酸.喷洒后处理: 观察斑点,并于紫外线荧光分析灯下检出.(10) ?酸纳-浓硫酸(Mandelin)试剂:检查生物碱.1%>酸纳的浓硫酸溶液.与多种生物碱呈不同颜色.(11)碘-碘化钾(Wagner)试剂:检查生物碱.1克碘及10克碘化钾,溶于50毫升水中,加热,加2毫升醋酸,再用水稀释至100毫升.可作纸层板显色剂,液可作沉淀试剂.酚类,鞣质(12)三氯化铁:检查酚类及??酸.喷洒剂:1~5%三氯化铁的水溶液或乙醇溶液.并加盐酸少许.??酸呈红色斑点,酚类称蓝色或绿色斑点.(13)铁氰化钾-三氯化钾:检查酚类,芳香胺类及还原性物质.喷洒剂: 1%铁氰化钾水溶液,2%三氯化铁水溶液.临用前等体积混合.喷洒后处理: 喷洒后酚性物质呈蓝色斑点.再喷2N盐酸,能使颜色加深,纸谱可用烯盐酸洗去喷洒液.(14) 4-胺基安替比林-铁氰化钾(Emerson反应): 检查酚类.喷洒剂: I . 2%4-氨基安替比林乙醇溶液;II. 8%铁氰化钾水溶液.或用0.9%4-氨基安替比林和5.4%铁氰化钾水溶液方法: 先喷洒I,再喷洒II,即显色,或再放入密闭缸中,缸内放25%氢氧化铵,即产生橙色至深红色.(15) 对氨基苯磺酸,重氮盐(Pauly试剂): 检查酚类,芳香胺类及能偶合的杂环化合物.喷洒剂: 4.5克对氨基苯磺酸,加热溶于45毫升12N盐酸中,用水稀释至500毫升,取10毫升稀释液用冰冷却,加10毫升冷4.5%亚硝酸钠水溶液,0℃放15分钟(此试剂于0℃可保存3天),用前加等体积1%碳酸钠水溶液.一般重氮化试剂,也可用联苯胺,对硝基苯胺等.(16) 对甲苯磺酸: 检查甾体,黄酮,鞣质.喷洒剂: 20%对甲苯磺酸氯仿溶液.喷洒后处理: 100℃加热数分钟,紫外线分析灯下检查荧光斑点.含氧杂环及蒽醌类*(17) 三氯化铝: 检查黄酮体.喷洒1%三氯化铝乙醇液于紫外线荧光分析灯下检示,呈黄色荧光(18)碱式醋酸铅: 检查黄酮体.喷洒剂: 饱和碱式醋酸铅(或饱和醋酸铅)水溶液.于紫外线荧光分析灯下检查荧光斑点.(19)醋酸镁: 检查蒽醌甙,甙元及黄酮体喷洒剂: 0.5%醋酸镁甲醇溶液方法: 90℃加热5分钟,呈红色至紫色斑点.(20)氢氧化钾: 检查香豆素,蒽醌甙及甙元喷洒剂: 5~10%氢氧化钾的甲醇溶液.于日光及紫外线荧光分析灯下检示斑点.萜类,甾体(21) 三氯化锑(Carr-Price试剂): 检查甾体,萜类,皂类.喷洒剂: 25克三氯化锑溶于75克氯仿中(亦可以用氯仿或四氯化碳的饱和溶液).喷洒后处理: 100℃加热5分钟,于紫外线荧光分析灯下检示荧光.(22) 五氯化锑: 检查甾体,萜类,皂甙.喷洒剂: 五氯化锑-氯仿或四氯化碳(1:4),用前新鲜配制.喷洒后处理: 120℃加热至斑点出现,并于紫外线荧光分析灯下检示.(23)香兰醛-硫酸: 检查高级醇类,酚类,甾体,萜类,芳香油.喷洒剂: 1克香兰素溶于100毫升浓硫酸,或0.5克香兰醛溶于100毫升硫酸-乙醇(4:1)中.喷洒后处理: 室温或120℃加热观察显色斑点.(24) 4-二甲氨基苯甲醛,醋酸,磷酸(E.P.试剂): 检查? Azulene 及?前体Proazulene.喷洒剂: 0.25克4-二甲氨基苯甲醛,溶于50毫升醋酸5克85%磷酸和20毫升水的混合液中(棕色瓶中保存数月) ?:烃室温即成蓝紫色斑点,>前体于80℃加热10分钟出现蓝紫色斑点.(25) 氯胺T-三氯醋酸: 检查强心甙.喷洒剂: I. 3%氯仿T水溶液新鲜制备.II. 25%三氯醋酸乙醇溶液(能保存数天).10毫升I加40毫升II,用前混合.喷洒后处理: 110℃加热7分钟,紫外线荧光分析灯下检示呈蓝色或黄色荧光.(26) 亚硝酸基铁氰化钠-氢氧化钠(Legal试剂): 检查不饱和内酯;甲基酮或活性次甲基,常用于强心甙喷洒剂: 1克亚硝基铁氰化钠溶于100毫升2N氢氧化钠-乙醇(1:1)的水溶液.显红色或紫色斑点.(27) 3,5-二硝基苯甲酸(Legal试剂): 检查强心甙,α,β-不饱和内酯.喷洒剂: 1克3,5-二硝基苯甲酸溶于50毫升甲醇,加入1N氢氧化钾50毫升.强心甙呈紫红色斑点.糖类(28) 邻苯二甲基苯胺: 检查还原糖.喷洒剂: 0.93克苯氨,1.66克邻苯二甲酸溶于100毫升水饱和的正丁醇中.喷洒后处理: 105℃加热10分钟.(29) 2,3,5-Triphenyl-tetrazolium chloride (T.T.C.):检查还原糖及其他还原物质。
总氮,过硫酸盐氧化法,方法10072(Test' N Tube TM管)(二)
总氮,过硫酸盐氧化法,方法10072(Test' N Tube TM 管)(二)干扰物质表6.3.40-3中所示的干扰物在所列的抗干扰浓度水平(mg/L)下对本测试不产生干扰。
能够产生±10%测试误差的干扰物质列在表6.3.40-4中。
表6.3.40-3 非干扰物质表6.3.40-4 干扰物质本测试是用以下物质配制的氮标准溶液举行的,有95%的回收率:、、、、。
用或烟碱酸-PTSA的加标回收率,在生活污水进出水、替代污水(D5905-96)的ASTM标准物质中的加标回收率都)95%。
在某些样品中含有的大量不含氮的有机物会由于消耗掉消解试剂中的过硫酸盐而降低了消解的效率。
假如已知样品中含有较高浓度的这种有机物,应当稀释样品,提高消解效率后再重新举行测试。
样品的采集、保存与存储 (1)样品采集时应用法清洁的玻璃或塑料容器。
采样后立刻分析得到的结果最牢靠。
(2)假如采样后不能立刻举行分析测试,请用法(2 mL浓硫酸/L水)将样品的PH值调节至2或者2以下保存。
(3)将样品置于4℃(即39oF)的条件下举行保存。
样品最长可以保存28天。
(4)测试分析前,请先将样品加热至室温,用5.0N溶液中和样品酸性,将样品的PH值调节至中性。
(5)按照样品体积增强量修正测试结果。
精确度检查办法本办法对于有机氮通常能够达到95%~100%的回收率。
本法用凯氏氮标准物质法举行精确度检查。
①配制以下三个溶液中的一个或多个溶液。
每一种溶液的浓度都相当于25mg/L N总氮标准溶液。
用试剂组件中的去离子水或者不含有任何有机物或氮的水配制这些标准溶液。
a.称取1.6208g的,用去离子水将其溶解于1000mL的容量瓶中,再用去离子水稀释至1000mL刻度线。
b.称取2.1179g的氨基乙酸对甲苯磺酸,用去离子水将其溶解于1000mL的容量瓶中,再用去离子水稀释至1000mL刻度线。
c.称取2.5295g的烟碱酸对甲苯磺酸,用去离子水将其溶解于1000mL的容量瓶中,再用去离子水稀释至1000mL刻度线。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cleanert Alumina N中性氧化铝萃取柱,1000mg/6mL,30支/包
产品包装尺寸
产品参数
图文介绍
Agela Technologies 吸附型萃取柱
·Cleanert Florisil是一种高选择性的吸附剂。
这种吸附剂主要有三种成分组成,二氧化硅(84%),氧化镁(15.5%)和硫酸钠(0.5%)。
是一种效果良好,成本经济的常用固相萃取填料。
特定为AOAC,EPA等方法设计,用于农药残留的净化﹑分离、内分泌物及油脂的分离、PCBs,PAHs,烃类中含氮化合物和抗生素物质的分离等。
常用于农残分析中去除色素,为NY761分析方法中必备的样品前处理小柱。
·Cleanert PestiCarb采用新型碳黑材料(球形)为填料,具有高净化效果,高回收率和高重现性的优良特性,广泛应用于农残分析中,特别是蔬菜水果等色素较高的样品的前处理中。
相当于Envi carb填料。
常用于农残分析中去除色素等杂质。
·Cleanert Alumina N 中性氧化铝萃取柱pH=7.5;强极性吸附剂。
表面呈中性,容易保留杂环类(含氮,磷,硫基),芳香烃和有机胺等富电子化合物。
经过特殊去活处理,以保证样品的前处理。
应用于维生素,抗菌素,芳香油,酶,糖苷,激素等的样品前处理。
广泛用于苏丹红和孔雀石绿的样品前处理。
·Cleanert Alumina A 酸性氧化铝萃取柱pH=4.5,可作为强极性吸附和中等阳离子交换剂。
经过特殊去活处理,以保证样品的回收率。
可做为中等阳离子交换剂。
·Cleanert Alumina B (碱性氧化铝萃取柱),pH=10,经过特殊去活处理,以保证样品回收率。
可用于除去有机酸,酚类等。
