羧酸及其衍生物
有机化学 第九章 羧酸及其衍生物取代酸

RCOOH..第九章 羧酸及其衍生物和取代酸(一COOH )官能团的化合物,一元饱和脂肪羧酸的通式为C n H 2n O 2 。
羧基中的羟基被其它原子或基团取代的产物称为羧酸衍生物(如酰卤、酸酐、酯、酰胺等),羧酸烃基上的氢原子被其他原子或基团取代的产物称为取代酸(如卤代酸、羟基酸、羰基酸、氨基酸等)。
羧酸是许多有机化合物氧化的最终产物,常以盐和酯的形式广泛存在于自然界,许多羧酸在生物体的代谢过程中起着重要作用。
羧酸对于人们的日常生活非常重要,也是重要的化工原料和有机合成中间体。
§9-1 羧酸一、羧酸的结构、分类和命名 1、羧酸的结构在羧酸分子中,羧基碳原子是sp 2杂化的,其未参与杂化的p 轨道与一个氧原子的p 轨道形成C=O 中的π键,而羧基中羟基氧原子上的未共用电子对与羧基中的C=O 形成p -π共轭体系,从而使羟基氧原子上的电子向C=O 转移,结果使C=O 和C —O 的键长趋于平均化。
X 光衍射测定结果表明:甲酸分子中C=O 的键长(0.123 nm )比醛、酮分子中C=O 的键长(0.120nm )略长,而C —O 的键长(0.136nm )比醇分子中C —O 的键长(0.143nm )稍短。
RCOOH羧基上的p -π共轭示意图2、羧酸的分类和命名 2.1.羧酸的分类根据分子中烃基的结构,可把羧酸分为脂肪羧酸(饱和脂肪羧酸和不饱和脂肪羧酸)、脂环羧酸(饱和脂环羧酸和不饱和脂环羧酸)、芳香羧酸等;根据分子中羧基的数目,又可把羧酸分为一元羧酸、二元羧酸、多元羧酸等。
例如:或OOCOOcCOOHHOOC HOOC CH 2COOHCH 2COOHCH 2HOOC CH 3CH C H C OOHCOOH HOOC脂肪羧酸 一元羧酸 脂环羧酸 芳香羧酸二元羧酸多元羧酸2.2.羧酸的命名羧酸的命名方法有俗名和系统命名两种。
俗名是根据羧酸的最初来源的命名。
在下面的举例中,括号中的名称即为该羧酸的俗名。
华中科技大学有机化学第十二章 羧酸及其衍生物

Kochi反应便宜,对一级,二级,三级卤化烷的产率均好。
10.3 羧酸的合成反应
1. 烯或炔烃的氧化。
2. 醇或醛的氧化。 3. 烷基苯的侧链氧化。 4. 甲基酮的氧化(卤仿反应)。 5. 腈化合物的水解。 6. 格氏试剂与二氧化碳反应。 7. 苯酚钠盐与二氧化碳反应。
9.4 羧酸衍生物的结构与命名 1.羧酸衍生物的结构 羧酸衍生物的结构通式为RCOL (L= OR , NH2, NHR , NR2, X, OCOR等).这些化合物都具有酰基(RCO),因此又称酰基化合物.它们的 结构与羧酸相似,都具有羰基的键。并与L的一对未共用电子共扼.其电 子共轭与共振式如下:
丁二酸和戊二酸在单独加热或与乙酐共热时脱水生成环酐己二酸和庚二酸受热时同时发生脱水和脱羧生成较为稳定的失羧卤化将羧酸与ago反应得羧酸的银盐然后加等摩尔的溴或碘在无水四氯化碳中回流即可失羧得到溴代或碘代烷hunsdiecker反应
第十二章 羧酸及其衍生物
分子中含有羧基(-COOH,carboxyI group)的化合物叫做羧酸 (carboxyIic acid)。羧基是羧酸的官能团,除甲酸(HCOOH)外,羧酸 可看作是烃分子中的氢原子被羧基取代的产物。
生成酸酐的反应机理是一分子羧酸对另一分子羧酸的亲核加成-消去反应
3.生成酯 羧酸和醇或在强酸(硫酸,对甲苯磺酸等)催化下分子间脱水生成酯, 这个反应叫做酯化反应(esterification)。 酯化反应是可逆反应。为了提高产率,一般采用的方法是增加某 一种反应物的用量,或不断从体系中移去某一种产物。 实验证明,羧酸酯化时生成的水分子中的氧原子一般是来自羧酸 的羟基。例如,用同位素标记的醇与羧酸反应,其结果是同位素标记 的氧原子留在酯分子中。
六、二元羧酸受热的反应 二元羧酸受热易脱水、脱羧,生成产物的结构取决于两个 羧基的相对位置。无水草酸在加热时脱羧生成甲酸。
有机化学:12 羧酸及羧酸衍生物

C
+
O C O
H
(二)羧基上羟基的取代反应
O 酰卤 O 酸酐 O O 酯 O 酰胺 R C X R C O C R R C O R R C NH2(R)
1.成酯反应
O R C OH + H OR' H
+
O R C OR' + H2O
称酯化反应 反应特点:用酸做催化剂,反应可逆,速率慢
1.成酯反应
(1)诱导效应
HCOOH > CH3COOH > CH3CH2COOH
pKa 3.77 4.76 4.88
(一)酸性
如:卤素的位置——越靠近羧基影响越大
CH3CH2CHCOOH Cl
CH3CHCH2COOH CH2CH2CH2COOH Cl Cl
pKa
2.86
4.41
4.70
卤素的数目——越多,酸性越强
RCH2COOH + RCHCOX
X RCHCOOH
X X 该反应称为赫尔-佛尔哈德-泽林斯基(Hell-VolhardZelinsky)反应。 α-位如果还有H,可以进一步发生卤代反应,直至 所有α-H全部反应完。
问:
COOH CH3COOH 1 COOH 2 H2C COOH COOH 3
CH3COOH+SOCl2
pKa
4.20
3.83
4.09
4.10
2.电子效应的影响
邻位取代:
C和 I 都发挥作用,还有空间效应,情况复杂。
除氨基外,-X、-CH3、-OH、NO2酸性都比间 位或对位取代的强。邻位有取代时,羧基与 苯环不共平面,苯环电子云向羧基偏移少。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
第十章 羧酸及其衍生物

+ H OC2H5
18
H
+
O CH3C
18
OC2H5 + H2O
酰氧断裂
12
O CH3C OH
:OH
+H
+
OH CH3C OH 加成
-H2O
HOC2H5
OH CH3 C OH HOC2H5
OH CH3 C OC2H5
: : : : : : : :
质子迁 移
-H+
O CH3 C OC2H5
1
I 羧酸
一,结构 烃基与羧基相连的物质叫羧酸:一元羧酸通式为 RCOOH;羧基( COOH)就是羧酸的官能团 RCOOH;羧基(-COOH)就是羧酸的官能团. 就是羧酸的官能团.
O
ห้องสมุดไป่ตู้
中碳为SP 杂化, OH 中碳为SP2 杂化,氧原子与羰基双键间存 在着P― 共扼.由于共扼, P―л 在着P―л共扼.由于共扼,使羧基中的羰基失去了典 型的羰基的性质(如不与NH OH作用 作用) 型的羰基的性质(如不与NH2OH作用);―OH 氧原 子上的电子云向羰基偏移,这有利于―OH氢的离解 氢的离解. 子上的电子云向羰基偏移,这有利于―OH氢的离解.
14
Br2 / P
(2)芳香环的取代反应 (2)芳香环的取代反应
COOH Br2 FeBr3
COOH
Br
5. 二元羧酸的受热反应
乙 二 酸 HOOCCOOH 丙 二 酸 HOOCCH 2COOH 丁二酸 CH 2 COOH CH 2 COOH 戊 二 酸 CH 2 CH 2COOH CH 2COOH
CH 3 COOH + C 2H 5 OH : 1 1 1 : 10
有机化学羧酸及其衍生物
Organic Chemistry
Ⅰ羧酸
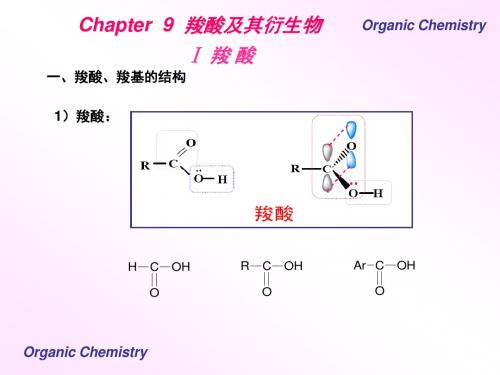
一、羧酸、羧基的结构 1)羧酸:
H
C O
OH
R
C O
OH
Ar C O
OH
Organic Chemistry
Chapter 9 羧酸及其衍生物
2)羧基的结构:
C O
R
Organic Chemistry
OH
O
..
R C O H
形式上看,羧基由羰基和羟基组成。羟基氧原子的未共用电子对所 占据的 p轨道和羰基的 π键形成 p-π共轭。羟基氧上电子云密度有所 降低,羰基碳上电子云密度有所升高。因此,羧酸中羰基对亲核试 剂的活性降低,不利于HCN等亲核试剂反应。 Organic Chemistry
对于含不饱和键的不饱和羧酸则取包括羧基和不饱和键的最长碳链为主链称某烯酸并注明不饱和键的位置命名含脂碳环羧酸和芳香羧酸时则把脂碳环和芳环当作取代基choh3乙基己酸3丙基4戊烯酸coohchcoohchcoohcoohcooh乙基丙二酸邻苯二甲酸环戊基甲酸四物理性质羧酸的沸点比相近分子质量的其它有机物要高
3—丙基—4—戊烯酸
COOH
COOH
乙基丙二酸
环戊基甲酸
邻苯二甲酸
Organic Chemistry
Chapter 9 羧酸及其衍生物
四、物理性质
羧酸的沸点比相近分子质量的其它有机物要高: 乙 丙 酸(60):117.9℃ 醛(58): 48.8℃ 8 ℃
Organic Chemistry
正丙醇(60): 97.4℃ 甲乙醚(60):
味道 沸点
酰氯和酸酐都对粘膜有刺激性,酯有香味。 酰氯、酸酐和酯由于不能形成氢键,熔沸点与分子量相近
羧酸及羧酸衍生物
水解
(1)反应特点:
+ RCOOR' H2O
① 反应可逆(酯化和水解都不能进行完全)。
② 反应速度慢,催化剂同时加速酯化和水解反应。
增大产率:① 增加反应物; ② 减少生成物。
(2)反应历程: ① 伯、仲醇:亲核加成—消除历程 醇中羟基上的氢与羧酸中的羟基结合脱水生成 酯,反应中羧酸的酰氧键断裂。
沸点(162℃)
O
+ R C OH SOCl2
沸点(79℃)
O
+ R C Cl POCl3 制备高沸点酰氯
沸点(107℃)
O
+ + R C Cl SO2 HCl
两种情况均适用
生成酰卤的反应历程
R
O
-HCl
C OH + PCl3
R
O CO
PCl2
Cl- R
O C
O PCl2
b.p. 75℃
Cl
O R C Cl + HO PCl2
攻酰基碳而发生酯化。
O
O
O
+O
+
C-OH
C-OH2
+C
C
CH3
CH3 H2SO4(浓) CH3
CH3 CH3
CH3 CH3
CH3
CH3
CH3OH CH3
CH3
OH C-O+ CCHH33
-H+ CH3
CH3
O C-OCH3
CH3
CH3
78%
CH3
CH3
(3)羧酸和醇的结构对酯化反应速率的影响 ① 羧酸α-C上支链愈多,基团愈大,酯化反应 速率愈慢。
羧酸及其衍生物
羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。
羧酸及其衍生物
RCOOR’
RCONH2
RCOOH + R’OH
RCOOH + NH3
(催化)
(催化、回流)
醇解:
RCOCl
(RCO)2O + R’OH RCOOR”
RCOOR’ + HCl
RCOOR’ + RCOOH RCOOR’ + R”OH (酯交换反应)
氨解:
RCOCl (RCO)2O + NH3 RCONH2 + HCl RCONH2 + RCOONH4
CH3COOH (C2 H5 )2 CH COOH
CH 3COOH (C2 H 5 ) 2 CH COOH
鉴定羧酸结构一个很有用的概念是中和当量,用酸碱滴定法 可测定中 和当量: 羧酸样品重量(g)× 1000 中和当量 = NNaOH× VNaOH(mL) 利用中和当量可以计算出羧酸的分子量: 羧酸分子量 = 中和当量×羧酸分子中羧基数
Δ
O
+
H2O
O HOOCCH2CH2CH2CH2COOH
Δ
+
O
CO2
+
H2O
HOOCCH2CH2CH2CH2CH2COOH
Δ
+
CO2
+
H2O
乙二酸 乙二酸也称草酸,工业上常采用甲酸钠热解法,即将甲 酸钠快速加热到400℃,制得草酸钠,再用稀硫酸酸化得到草酸。
2HCOONa
400℃ -H2
COONa COONa
羧酸的制备方法较多,常用的有氧化法、水解法和由有机金属化 合物制备等。
1.2.1由烃、醇、醛氧化
常用的氧化剂有K2Cr2O7+H2SO4, KMnO4, HNO3, CrO3 等。 芳烃支链的氧化常用于芳香族羧酸的合成:
第八章羧酸及其衍生物
(2)
解: (1) CH3COOCH2CH2N+(CH3)3OH-
解:
问题 8-7按由易到难排出下列化合物的脱羧顺序:
(1) (2) (3) (4)
解:(1)>(3)>(4)>(2)
问题 8-8命名下列化合物:
解:(1)<(3)<(2)<(4)
问题 8-3按熔点由低到高排出下列化合物的顺序:
(1)乙酸 (2)丙二酸 (3)丁二酸 (4)丙酸
解:(4)<(1)<(2)<(3)
问题 8-4按酸性强弱排出下列化合物的酸性顺序:
(1)草酸 (2)己二酸 (3)丁二酸 (4)丙二酸 (5)甲酸
第八章 羧酸及其衍生物
一、 学习要求
1. 羧酸是有机化合物酸性物质的代表,应掌握其结构和性质的关系及命名。
2. 掌握羧酸衍生物的结构和化学性质。
3. 了解羧酸衍生物的酰基取代反应机制。
4. 了解羧酸及其衍生物的分类方法和在医药卫生保健事业中的重要性。
二、 本章要点
(一) 羧酸
(二) 羧酸酸衍生物
1.结构和命名 羧酸衍生物的结构特点是均含有酰基,因此它们又称为酰基化合物,其通式用
表示。酰卤和酰胺的命名是根据酰基的名称而称为某酰卤、某酰胺;酯的命名是先酸后醇即某酸某醇酯;酸酐的名称是生成酸酐的酸后加酐,即某酸酐。
2.化学性质
(1)亲核取代反应及反应机制:羧酸衍生物的典型化学性质是水解、醇解和氨解,其取代产物可以看作羧酸衍生物中的酰基取代了水、醇(酚)中羟基氢原子和氨(伯、仲胺)中氮上的氢原子,形成羧酸、酯和酰胺,其反应通式为:
(CH3CO)2O CH3COOC2H5 CH3COCl CH3CONH2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第11章羧酸及其衍生物
11.1 基本要求
1.掌握常见的羧酸及其衍生物的命名规则。
2.掌握羧酸酸性的变化规律,羟基的取代反应、α-H的卤代以及一元和二元羧酸的脱羧反应,羧酸及其衍生物的还原反应。
3.比较羧酸衍生物的水解、醇解、氨解反应,弄清它们之间以及与羧酸之间相互转化的规律,理解和掌握亲核加成-消除的反应机理。
4.基本掌握羟基酸、α-酮酸、β-酮酸的重要化学性质。
11.2 基本内容
Ⅰ.羧酸
1.羧酸的结构和性质
羧基中的碳原子是sp2杂化,是平面构型。
其中羰基与羟基之间存在p-π共轭效应,使羰基碳原子上的电正性削弱,不利于亲核试剂的进攻(与醛、酮相比)。
同时使得羟基氧原子上的电子云密度降低,使氢原子易于解离,表现出酸性。
由于羧基的吸电子效应,还使其α-H有一定的活泼性(小于醛、酮)。
羧酸是强极性分子,其沸点大于同碳原子数的醇。
2.羧酸的化学性质
C
酸性
H
氢的反应
羰基碳原子上的亲核反应
(1)酸性
羧酸的酸性比碳酸强,可与碳酸钠或碳酸氢钠作用生成羧酸钠:
NaHCO3
RCOOH +RCOONa + CO2 + H2O
羧酸的酸性一般比无机酸弱,当向羧酸盐中加入无机酸后,羧酸又可游离出来。
RCOONa+ HCl RCOOH + NaCl
羧酸的酸性强弱受整个分子结构的影响,主要是诱导效应和共轭效应这两个因素的作用。
(a)诱导效应(I)
凡是具有-I效应的基团,即能使羧基电子云密度降低的基团,都会使羧酸的酸性增强。
酸性:ICH2COOH < BrCH2COOH < ClCH2COOH < FCH2COOH
CH3CH2CH2COOH < CH2=CHCH2COOH < HC CCH2COOH
HCOOH > CH3COOH > CH3CH2COOH > (CH3)2CHCOOH > (CH3)3CCOOH
COOH COOH
2
COOH
OCH 3
>
>
二元酸的酸性比一元酸强(一个羧基对另一个羧基呈现吸电子效应) 酸性: 草酸 < 丙二酸 < 丁二酸 < 乙酸 (b ) 共轭效应(C )
共轭效应会使该体系出现正负电荷交替分布的情况,如取代硝基苯甲酸的酸性为:
COOH
NO 2
COOH
NO 2
COOH
NO 2
>
>
(2) 羧酸衍生物的生成
RCOOH
(RCO)2O
当羧酸或醇的α-碳原子上取代基增加或增大时,酯化反应速度将明显降低,反应活性如下:
HCOOH > CH 3COOH > RCH 2COOH > R 2CHCOOH > R 3CCOOH
CH 3OH > 伯醇 > 仲醇 > 叔醇
(3) α-H 的反应
RCH 2X 2
, RCHCOOH P
(1)(2) H
2O
X
(Hell Volhard Zelinski 反应)
_
_
(4) 还原反应
RCOOH
RCH 2OH
(
5) 脱羧反应
饱和一元羧酸的碱金属盐与碱石灰共热,能失去一分子二氧化碳,生成比原羧酸少一个碳原子的烃。
α-碳上连有强的吸电子基时,脱羧反应更加易于进行。
RCH 2COOH
RCH 3 + Na 2CO 3
二元羧酸受热后,易于脱水、脱羧,生成产物的结构取决于两个羧基的相对位置。
COOH COOH
HCOOH + CO 2 (C 2~C 3的羧酸)
CH 2COOH CH 2
COOH
O O
O
+ H 2O (C 4~C 5的羧酸)
CH 2CH 2
COOH 2CH 2
COOH
O
+ H 2O (C 6~C 7的羧酸)
3.羧酸的制备 (1
)氧化法
RCH
CHR'RCOOH + R'COOH
RCH 2OH [O][O]
RCOOH CH 3COR'
Cl 2CH 2CH 3
[O]
COOH
CHCl 3
,
R ,
COOH
(2)水解法
水解
RCOOR'RCOX (RCO)2O RCONH 2RCOOH
RCN
(3)格氏试剂
RMgX + CO RC O
OMgX
H 3O
RCOOH 乙醚
Ⅱ. 羧 酸 衍
生 物
1.羧酸衍生物的化学反应
R + Nu
H
C O
Nu
H O
C O Nu
R
+ HL
亲核加成
消除
亲核取代
四面体中间体
快
羧酸衍生物加成-消除的反应活性顺序是:
R
X O R
OCOR'O R
OR'O R
O NH 2>>>
羧酸衍生物之间可以互相转化,但总是从一种不太稳定的羧酸衍生物转化为更加稳定的羧酸衍生物。
(1) 水解反应
RCOCl (RCO)2O RCOOR'RCONH 2
+
H 2O
RCOOH +
HCl RCOOH R'OH NH 3
(2) 醇解反应
RCOCl (RCO)2O RCOOR ''RCONH 2
+ R'OH
RCOOR' +
HCl RCOOH HOR''NH 3
(3) 氨解反应
RCOCl (RCO)2O RCOOR'
+ NH 3
RCONH 2 + NH 4Cl
RCOONH 4
R'OH
(4) 还原反应
RCOOR'RCOX (RCO)2O RCONH 2RCN
RCH 2OH + HX
RCH 2OH + R'CH
2OH RCH 2OH + ROH RCH 2NH 2RCH 2NH 2
RCOX
Pd -BaSO 4RCHO (Rosenmund 还原)
RCOOR'Na
25
RCH 2OH + R'OH
R'OH
(5) 与格氏试剂作用
O R C X
O R C OR'
R
C
N
O R C R''O R C R''O R
C
R''
R
C R"
R''
OH
酸酐和酰胺也能与Grignard 试剂作用,水解得到叔醇,但消耗有机金属试剂较多,在合成上价值不大,在此不作介绍。
(6) 酰胺的特殊反应
(a ) 酸性
R
C
O N H
C
O R
Gabriel 反应:
NH + KOH O
O
N K O O
+ H 2O
N K O O
N R O
O
KOH
H 2O
COOK
COOK
+ RNH
2
(b ) 脱水反应
RCOONH 4
RCONH 2
RCN
2
(c ) Hoffman 降级反应
RCONH 2 + Br 2 + 4 NaOH RNH 2 + 2NaBr + Na 2CO 3 + 2H 2O
用于制备少一个碳原子的伯胺。
Ⅲ. 取代酸
1. 醇酸的性质 (a ) 氧化
α-羟基酸中的羟基比醇中的羟基易被氧化。
OH RCCOOH
O
O - CO 2
O RCH
RCOOH
2O
(b ) 脱水
OH
2)nCOOH
CH C O
CH
O R
2O
2.醇酸的制备
(a )卤代酸的水解
OH
RCHCOOH X
RCHCOOH OH
(b )氰醇水解(用于制备α-醇酸)
H
3O
R
C
O R'
HCN
R
C OH
CN
R
C OH COOH
(c )Reformatsky 反应(用于制备β-醇酸)
3RCHCOOR'
X
O
R"
C OH R'"
CHCOOR'
R Zn
RCHCOOR'ZnBr
R"
C OH R'"
CHCOOH
R
2. 酮酸的性质
R
C
O COOH
RCHO + CO 2RCOOH + CO
R
C
CH 2O C
H 2R CCH 3O
+ CO 2
O
R。
