高中化学58个考点14、元素周期表
高考化学必背元素周期表64个-全文

高考化学必背元素周期表64个-全文化学是高考科学类的一门重要科目,其中元素周期表是化学研究的基础。
为了帮助学生掌握化学知识,以下是高考化学必须背诵的64个元素的周期表。
周期表的构成:1 1H HeL Li BeNa Mg 3 4 5 6 7 8 9 10K Ca Sc Ti V Cr Mn Fe Co NiRb Sr Y Zr Nb Mo Tc Ru Rh PdCs Ba *La Hf Ta W Re Os Ir PtFr Ra **Ac Rf Db Sg Bh Hs Mt Ds*Ce **Th Pr Nd Pm Sm Eu Gd Tb DyHo Er Tm Yb Lu化学元素:1. 氢 H2. 氦 He3. 锂 Li4. 铍 Be5. 硼 B6. 碳 C7. 氮 N8. 氧 O9. 氟 F10. 钠 Na11. 镁 Mg12. 铝 Al13. 硅 Si14. 磷 P15. 硫 S16. 氯 Cl17. 钾 K18. 钙 Ca19. 钪 Sc20. 钛 Ti21. 钒 V22. 铬 Cr23. 锰 Mn24. 铁 Fe25. 钴 Co26. 镍 Ni27. 铜 Cu28. 锌 Zn29. 镓 Ga30. 锗 Ge31. 砷 As32. 硒 Se33. 溴 Br34. 铷 Rb35. 铍 Sr36. 锶 Y37. 锆 Zr38. 铌 Nb39. 钼 Mo40. 锝 Tc41. 钌 Ru42. 铑 Rh43. 钯 Pd44. 银 Ag45. 镉 Cd46. 铟 In47. 锡 Sn48. 锑 Sb49. 碲 Te50. 碘 I51. 钡 Ba52. 铯 Cs53. 钡 Ba54. 铯 Cs55. 钡 Ba56. 锕 La78. 铌 Nb79. 钨 W80. 铼 Re81. 锇 Os82. 铱 Ir83. 铂 Pt84. 金 Au85. 汞 Hg86. 铊 Tl87. 铅 Pb88. 铋 Bi89. 钍 Th90. 镧 Pr91. 铈 Nd92. 镨 Pm93. 钕 Sm94. 铕 Eu95. 铽 Gd96. 镝 Tb97. 铒 Dy98. 铥 Ho99. 铪 Er 100. 钇 Tm 101. 铯 Yb 102. 铽 Lu以上是高考化学必背的64个元素及其位置。
高中化学元素周期表必记内容
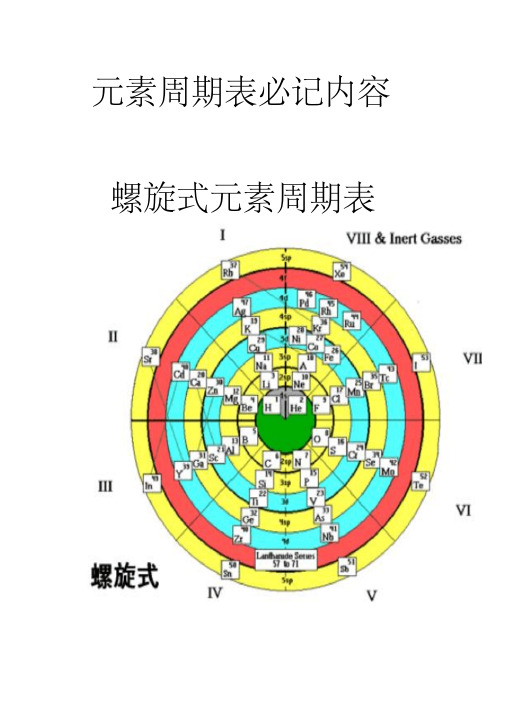
元素周期表必记内容螺旋式元素周期表短周期元素主族元素和0族元素各元素正确读音Li铍(pí) Be硼(péng) B 氢(qīng)H氦(hài) He锂(lǐ)碳(tàn) C氮(dàn) N氧(yǎng)O氟(fú) F氖(nǎi)N en) PSi磷(lí钠(nà) Na镁(měi)Mg铝(lǚ)Al硅(guī)K钙(gài) CaCl氩(yà) Ar钾(jiǎ)硫(liú)S氯(lǜ)钪(kàng)Sc钛(tài) Ti钒(fán)V铬(gè) Cr锰(měng)Mn Fe钴(gǔ)C o镍(niè) Ni铜(tóng) Cu锌(xīn)Zn 铁(tiě)Se溴(xiù)Br镓(jiā)Ge砷(shēn)As硒(xī)Ga锗(zhě)Y锆(gào)ZrSr钇(yǐ)氪(kè)Kr铷(rú)Rb锶(sī)Ru铑(lǎo)Rh铌(ní)Nb钼(mù)Mo锝(dé)Tc钌(liǎo)Sn钯(pá)Pd银(yín)Ag镉(gé)Cd铟(yīn)In锡(xī)Sb碲(dì)Te碘(diǎn)I氙(xiān)Xe铯(sè)Cs锑(tī)Hf钽(tǎn)Ta钨(wū)W钡(bèi)Ba镧(lán)La铪(hā)Ir铂(bó)Pt金(jīn)Au铼(lái)Re锇(é)Os铱(yī)Tl铅(qiān)Pb铋(bì)Bi钋(pō)Po汞(gǒng)Hg铊(tā)Ac砹(ài)At氡(dōng)Rn钫(fāng)Fr镭(léi)Ra锕(ā)Sg钅波(bō)B h钅黑(hēi)Hs 钅卢(lú)Rf钅杜(dù)Db钅喜(xǐ)钅麦(mài)Mt钅达(dá) 钅仑(lún) 镧(lán)La铈(shì)CeP m钐(shān)Sm铕(yǒu)EuNd钷(pǒ)镨(pǔ)Pr钕(nǚ)Ho铒(ěr)Er钆(gá)Gd铽(tè)Tb镝(dí)Dy钬(huǒ)Ac钍(tǔ)ThLu锕(ā)铥(diū)Tm镱(yì)Yb镥(lǔ)镤(pú)Pa铀(yóu)U镎(ná)Np钚(bù)Pu镅(méi)Am 锔(jū)Cm锫(péi)Bk锎(kāi)Cf锿(āi)Es镄(fèi)Fm钔(mén)Md锘(nuò)No铹(láo)Lr前20位元素快速记忆H He Li Be B (氢氦锂铍硼)C N O F Ne (碳氮氧氟氖)Na Mg Al Si P (钠镁铝硅磷)S Cl Ar K Ca (硫氯氩钾钙)五个五个背,比较顺口。
化学元素周期表高一知识点

化学元素周期表高一知识点化学元素周期表是化学中基本的工具之一。
它按照元素的原子序数(也称为元素的序数)和元素的电子结构来排列元素。
每个元素都具有唯一的原子序数,而且每个元素都有一组特定的化学性质。
周期表的布局:周期表通常被划分为若干个主要部分,包括主族元素(也称为A族元素)和过渡元素(也称为B族元素)。
主族元素是周期表的左侧,包括1A族到8A族元素,过渡元素则位于周期表的中心部分。
此外,周期表还包括稀有气体元素(8A族的最后一列)和镧系和锕系元素(通常放在底部的两行)。
元素符号:每个元素都用一个或两个字母的符号来表示,这些符号通常是元素名称的缩写。
例如,氧元素的符号为O,氢元素的符号为H。
这种符号体系使元素名字的表达更加简洁和方便记忆。
原子序数和电子结构:元素的原子序数表示了元素中原子的数目。
根据元素的原子序数,可以知道元素在周期表中的位置。
每个元素的电子结构描述了其外层电子的排布方式。
电子结构对于确定元素的化学性质和反应行为非常重要。
周期表中的周期性:元素周期表的主要特点是周期性。
周期性表现在元素的化学性质以及与元素位置相关的一系列属性上。
周期表中相邻元素的电子结构和性质有相似之处,形成了垂直和水平上的周期性规律。
周期表中的元素分类:根据元素的一些特定属性,可以将元素进一步分类。
主要的分类包括金属(包括碱金属、碱土金属、过渡金属等)、非金属和类金属等。
这些分类有助于我们对元素的特征和性质有更清晰的认识。
周期表的拓展:随着科学的发展,科学家们继续发现新的元素。
新发现的元素被添加到现有的周期表中,丰富了我们对元素的认识。
周期表的拓展使我们能够更好地研究和理解元素以及它们之间的相互关系。
结语:化学元素周期表是化学研究中不可或缺的工具。
通过对周期表的学习,我们可以更好地理解元素的性质和行为规律。
同时,周期表也为我们提供了研究和应用各种元素的基础。
以上是关于化学元素周期表的一些高一知识点。
通过研究和掌握这些知识,我们可以更好地理解化学世界的奥秘。
高中化学元素周期表知识点
高中化学元素周期表知识点高中化学元素周期表知识点在平常学习中,大家一定都或多或少地接触过一些化学知识,下面是店铺为大家收集的有关高中化学元素周期表知识点,仅供参考,希望能够帮助到大家。
高中化学元素周期表知识1.元素周期表的结构(1)周期(1)电子层数=周期数(2)最外层电子数=主族序数=最高正化合价(除F、O)(3)质子数=原子序数(4)∣最高正价∣+∣最低负价∣=8(对非金属元素而言,但对H不适用)注意:O无最高正价,F无正价3.元素周期表中之最原子半径最小的原子:H单质质量最轻的元素:H宇宙中含量最多的元素:H最不活泼的元素:He最轻的金属单质:Li形成化合物最多的元素:C含H质量分数最高的气态氢化物:CH4空气中含量最多的元素:N地壳中含量最高的元素:O,其次是Si地壳中含量最高的金属元素:Al,其次是Fe非金属性最强的元素:F金属性最强的元素:Cs(不考虑Fr)与水反应最剧烈的金属单质:Cs(不考虑Fr)与水反应最剧烈的非金属单质:F2最高价氧化物对应水化物酸性最强的酸:HClO4最高价氧化物对应水化物碱性最强的碱:CsOH(不考虑FrOH) 所含元素种类最多的族:ⅢB常温下呈液态的非金属单质是Br2,金属单质是Hg4.元素、核素、同位素5.原子核外电子排布规律1.在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层。
2.原子核外各电子层最多容纳2n2个电子。
3.原子最外层电子数目不超过8个(K层为最外层时不能超过2个电子)。
4.次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
注意:以上规律既相互联系,又互相制约,不能孤立片面的理解。
如M层为最外层的时候,最多为8个,而不是18个。
高一化学基础知识一、电解质和非电解质电解质:在水溶液里或熔融状态下能导电的化合物。
化学元素周期表知识点

化学元素周期表知识点化学元素周期表是指将化学元素按一定规律排列的表格。
它是化学研究的基础,对于理解化学元素的性质和规律非常重要。
本文将介绍化学元素周期表的基本结构、元素的周期性规律以及一些常用的元素的特性。
一、化学元素周期表的基本结构化学元素周期表通常按照元素的原子序数(或称为核电荷数)进行排序。
原子序数是指元素原子核中质子的数目,也等于元素的电子数目。
通常的周期表由18个纵列(也称为族)和7个横行(也称为周期)组成。
每一个元素的位置由其原子序数和周期数决定。
化学元素周期表的主要结构如下图所示:(图片仅作参考)在周期表中,元素按照升序排列。
纵列(族)由元素的性质相近而组成,每一周期表示一个能量层次。
周期表中最左侧的第一周期称为1A族或称碱金属,而最右侧的第十八周期称为18A族或称稀有气体。
二、元素的周期性规律元素周期表的排列不仅仅是有序的,还存在一定的规律。
这些规律被称为元素的周期性规律,主要包括原子半径、电离能、电负性和金属活性等方面。
1. 原子半径:随着周期数的增加,元素的原子半径逐渐减小;在同一周期中,元素的原子半径从左到右逐渐减小。
2. 电离能:随着周期数的增加,元素的第一电离能增加;在同一周期中,元素的第一电离能从左到右逐渐增加。
3. 电负性:随着周期数的增加,元素的电负性逐渐增加;在同一周期中,元素的电负性从左到右逐渐增加。
4. 金属活性:随着周期数的增加,元素的金属活性逐渐减弱;在同一周期中,元素的金属活性从左到右逐渐减弱。
以上规律的发现对于预测元素的化学性质和化合物的性质非常重要,有助于深入理解元素和化合物间的相互作用。
三、常用元素的特性除了周期性规律外,一些常见的元素拥有独特的性质和应用。
1. 氢(H):是宇宙中最常见的元素之一,是化学反应和能源制备过程中的重要原料。
2. 氧(O):是呼吸和燃烧过程中必须的元素,也是水(H2O)和许多其他化合物的组成部分。
3. 碳(C):是有机化合物的基础,构成了生物体中的许多重要化合物,如蛋白质、脂肪和碳水化合物等。
最新人教版高中化学必修2《元素周期表》知识点总结

知识·巧学一、元素周期表1.原子序数按元素在周期表中的顺序,由小到大给元素编号,这种编号叫做原子序数。
要点提示原子序数不是元素本身所具有的,是人为规定的,是人们给元素的一种编号,不是元素的性质。
2.原子序数与原子结构的关系原子:原子序数=核电荷数=质子数=核外电子数原子呈电中性,而质子带正电,核外电子带负电,且每个质子和电子所带的电量相等,所以两者的数目也必定相等。
同理可以推出:①阳离子:原子序数=核电荷数=质子数>核外电子数②阴离子:原子序数=核电荷数=质子数<核外电子数规律总结阴离子的核外电子数等于其核电荷数与其离子所带电荷数之和,阳离子核外电子数等于其核电荷数与其离子所带电荷数之差,这个规律叫做阴加阳减规律。
3.元素周期表的编排原则将电子层数相同的元素,按照原子序数递增的顺序排成横行,称为周期。
将最外层电子数相同的元素,按照电子层数递增的顺序排成纵行,称为族。
4.周期元素周期表有7个横行,即七个周期。
周期序数等于该周期元素的原子具有的电子层数。
短周期:一、二、三周期称为短周期长周期:四、五、六周期称为长周期不完全周期:第七周期,因未排满被称为不完全周期5.族元素周期表有18个纵行,共16个族。
最外层电子数=主族数主族:由短周期元素和长周期元素共同构成的族,叫做主族副族:完全由长周期元素构成的族,叫做副族。
除第8、9、10三个纵行叫做第Ⅷ族外,其余15个纵行,每个纵行称作一族。
稀有气体元素族称为0族。
Ⅷ族不是副族,0族也不是主族。
记忆要诀族序口诀:族序逐个加(即族序数从左到右逐渐递增)两A五BⅧ(两A即从ⅠA到ⅡA,五B即再从ⅢB直到ⅦB,再是Ⅷ族)族序一七零(即接着族序数又从一到七,最后一列族序数是零)两B五A零(两B即先是两个副族,五A即再是五个主族,最后是零族)6.元素周期表的结构元素周期表共有7个横行,18个纵列,112格。
其中每一格表示一种元素,格子的颜色分两种,其中蓝色部分表示非金属,橘黄色部分表示金属,绿色部分表示过渡元素;每一格均标有元素名称、化学符号、原子序数以及该元素的相对原子质量。
高一化学元素周期表知识点以及记忆口诀
高一化学元素周期表知识点以及记忆口诀知识改变命运,想要了解高中化学元素周期表的小伙伴赶紧来看看吧!下面由小编为你精心准备了“高一化学元素周期表知识点以及记忆口诀”,本文仅供参考,持续关注本站将可以持续获取更多的知识点!高一化学元素周期表知识点1、元素周期表1)周期表的编排原则:①按原子序数递增的顺序从左到右排列。
②将电子层数相同的元素排成一个横行。
③把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行。
2)周期表的结构:①七个横行,7个周期——三短(2、8、8)、三长(18、18、32)、一不完全;②18个纵行(列),16个族。
7个主族(ⅠA~ⅦA),(1、2、13~17列);7个副族(ⅠB~ⅦB),(3~12列);Ⅷ族:3个纵行,(8、9、10列);零族:稀有气体(18列);另外,周期表中有些族有特殊的名称:第ⅠA族:碱金属元素(不包括氢元素);第ⅦA族:卤族元素;0族:稀有气体元素;3)元素周期表的结构与原子结构的关系原子序数=核电荷数=质子数=核外电子数。
周期序数=原子的电子层数。
主族序数=最外层电子数=最高正价数(O、F除外)=价电子数。
非金属的负价的绝对值=8-主族序数(限ⅣA~ⅦA)。
4)由原子序数确定元素位置的规律主族元素:周期数=核外电子层数;主族的族序数=最外层电子数;确定族序数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,最后的差值即可确定。
2、元素周期律1)实质:元素的性质随着原子序数的递增呈周期性的变化。
常用规律如下:主族元素同一周期中,原子半径随着原子序数的增加而减小;同一主族中,原子半径随着原子序数的增加而增大;在同一周期中,从左到右,元素的金属性逐渐减弱,,非金属性逐渐增强;在同一族中,从上到下,元素的金属性增强,非金属性减弱;同一族的元素性质相近。
2)原子半径大小比较同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增;阴阳离子的半径大小辨别规律:具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
[精]高中化学元素周期表知识点详解
第一节元素周期表一.元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数短周期(第1、2、3周期)周期:7个(共七个横行)周期表长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素【练习】1.主族元素的次外层电子数(除氢)A.一定是8个B.一定是2个C.一定是18个D.是2个、8个或18个2.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于A.ⅢB族B.ⅢA族C.ⅠB族D.ⅠA族3.已知A元素原子的最外层电子数是次外层电子数的3倍,B元素原子的次外层电子数是最外层电子数的2倍,则A、B元素A.一定是第二周期元素B.一定是同一主族元素C.可能是二、三周期元素D.可以相互化合形成化合物二.元素的性质和原子结构(一)碱金属元素:1.原子结构相似性:最外层电子数相同,都为_______个递变性:从上到下,随着核电核数的增大,电子层数增多2.碱金属化学性质的相似性:点燃点燃4Li + O2 Li2O 2Na + O2 Na2O22 Na + 2H2O =2NaOH + H2↑ 2K + 2H2O =2KOH + H2↑2R + 2 H2O =2 ROH + H2 ↑产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有_______个电子,因此,它们的化学性质相似。
3.碱金属化学性质的递变性:递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。
所以从Li到Cs的金属性逐渐增强。
结论:1)原子结构的递变性导致化学性质的递变性。
2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
【高中化学】化学元素周期表详解
【高中化学】化学元素周期表详解
元素周期表是1869年俄国科学家门捷列夫(dmitrimendeleev)首创的,后来又经过多
名科学家多年的修订才形成当代的周期表。
元素周期表中有118种元素。
每个元素都有一个数字,其大小正好等于元素原子核中
的电子数。
这个叫做原子序数。
原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电
子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
元素周期表有7个周期和16个族。
每一水平行称为循环,每一垂直行称为族。
这七
个周期可分为短周期(1、2、3)、长周期(4、5、6)和不完整周期(7)。
共有16个家庭,分为7个主要家庭(ⅰ a-ⅶ a),7个亚家族(ⅰ B-ⅶ b)一个家庭VIII b和一个家庭零。
元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和
元素之间的内在联系。
在同一时期,从左到右,元素核心外的电子数相同,最外层的电子数依次增加,原子
半径减小(零族元素除外)。
失去电子的能力逐渐减弱,获得电子的能力逐渐增强,金属
性逐渐减弱,非金属性逐渐增强。
元素的最高正氧化数从左向右增加(除无正价元素外),最低负氧化数从左向右增加(除第一个循环和第二个循环中的O和f元素外)。
同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子序数递增,
元素金属性递增,非金属性递减。
高考元素周期表知识点
高考元素周期表知识点元素周期表是化学领域中的一项重要工具,它以一种有序的方式展示了所有已知元素的特性和属性。
对于高考化学来说,掌握元素周期表的知识点是非常重要的,因为它涉及了化学中的基础概念和原理。
本文将以逻辑性和系统性为基础,讨论高考元素周期表的相关知识点。
一、周期表的结构周期表由横行称为周期和纵列称为族组成。
周期从左到右递增,族从上到下递增。
周期表中的元素按照原子序数的大小排列,以便更好地理解元素的性质和化学行为。
周期表还包含了一些附加信息,例如元素的原子质量、化学符号和元素名称等。
二、周期表中的主要分区(一)金属、非金属和半金属周期表中的元素可以分为金属、非金属和半金属。
金属元素通常位于周期表的左侧和中间区域,具有良好的导电性、热导率和光泽。
非金属元素位于周期表的右侧,主要具有不良的导电性和光泽。
半金属元素位于金属和非金属之间,具有介于两者之间的性质。
(二)主族元素和过渡元素元素周期表中的族分为主族元素和过渡元素。
主族元素包括1A到8A族,它们的最外层电子结构决定了它们的化学性质。
过渡元素位于周期表的中部,它们的外层电子结构比较复杂,并具有特殊的化学性质。
(三)稀有气体和杂组元素稀有气体是周期表中的8A族元素,它们具有非常稳定的化学性质,很少与其他元素发生反应。
杂组元素是周期表中1B-8B族的元素,它们与稀有气体元素有相似的化学性质。
三、周期表中的特殊元素(一)碱金属碱金属位于周期表的1A族,它们具有低密度、低熔点和良好的导电性。
碱金属通常与非金属形成离子化合物,具有强烈的还原性。
(二)碱土金属碱土金属位于周期表的2A族,它们比碱金属更重,具有低密度、低熔点和较好的导电性。
碱土金属也具有良好的还原性,但比碱金属更稳定。
(三)卤族元素卤族元素位于周期表的7A族,包括氟、氯、溴、碘和砹。
它们具有高电负性和强氧化性,通常以阴离子的形式存在。
(四)过渡金属过渡金属位于周期表的3B到2B族,具有多种化合价和复杂的离子半径。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学58个考点精讲14、元素周期表1.复习重点1.周期表的结构。
理解位置、结构、性质三者之间的关系。
2.依据“位—构—性”之间的关系,会进行元素推断和确定几种元素形成化合物形式。
2.难点聚焦二、周期表1.位、构、性三者关系结构决定位置,结构决定性质,位置体现性质。
2.几个量的关系周期数=电子层数主族数=最外层电子数=最高正价数|最高正价|+|负价|=83.周期表中部分规律总结⑴最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He 除外)。
⑵在周期表中,第ⅡA与ⅢA族元素的原子序数差别有以下三种情况:①第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差15。
⑶每一周期排布元素的种类满足以下规律:设n为周期序数,则奇数周期中为2)1(2+n种,偶数周期中为2)2(2+n种。
⑷同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅣA~ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
⑸设主族元素族序数为a,周期数为b,则有:①a/b<1时,为金属元素,其最高氧化物为碱性氧化物,最高氧化物对应的水化物为碱;②a/b=1时,为两性元素(H除外),其最高氧化物为两性氧化物,最高氧化物对应的水化物为两性氢氧化物;③a/b>1时,为非金属元素,其最高氧化物为酸性氧化物,最高氧化物对应的水化物为酸。
无论是同周期还是同主族元素中,a/b的值越小,元素的金属性越强,其最高氧化物对应水化物的碱性就越强;反之,a/b的值越大,元素的非金属性越强,其最高氧化物对应水化物的酸性就越强。
⑹元素周期表中除第Ⅷ族元素以外,原子序数为奇(或偶)数的元素,元素所在族的序数及主要化合价也为奇(或偶)数。
⑺元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
⑻对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。
3.例题精讲例1今有A、B、C、D、E五种短周期元素,它们的核电荷按C、A、D、E的顺序增大。
C、D都能分别与A按原子个数比1:1或2:1形成化合物。
CB可与EA2反应生成C2A 与气态物质EB4。
⑴写出五种元素名称 A B ,C ,D ,E 。
⑵画出E的原子结构简图,写出电子式D2A2 ,EB4 。
⑶比较EA2与EB4的熔点高低< 。
⑷写出D单质与CuSO4溶液反应的离子方程。
【解析】此题的关键在于分析EB4中E元素只能是ⅣA族元素C或Si。
因B 的原子序数不最小,则B不可能为H元素,E的价态应为+4,B应为ⅦA族元素,且只能为F,如果无Cl元素,则原子序数比E还大。
而E只能为Si,即EB4为SiF4, 从CB的化合物的形式可知C为+1价,则由C2A可知A为-2价,只能为O。
能与O按原子个数比1:1或2:1形成化合物的元素只能是H或Na。
【答案】⑴氧,氟,氢,钠,硅⑵略⑶SiO2 >SiF4⑷2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑【命题意图】本题考查主族元素的化合价与原子序数的关系,以及有关元素周期表中各关系式的具体应用。
例2砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是A. HAt很稳定B. 易溶于某些有机溶剂C. AgAt不溶于水D. 是有色固体[解析]由题意,砹在周期表中与碘相邻,故它的性质与碘具有相似性,但它的非金属性应比碘弱。
HAt的稳定不如HI,故选项A错误;碘易溶于某些有机溶剂,则砹也应溶解;AgI不溶于水,则AgAt也不溶于水;碘是紫黑色固体,根据相似性砹也是有色固体。
正确选项为A。
例3:两种短周期的元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数可能是哪些?(1)m-4;(2)m+4;(3)m+8;(4)m-2;(5)m+6。
在解题中应首先根据抽象化学式XY3确定X、Y可能的化合价 XY3或XY3,依据X、Y可能的化合价找到它们在周期表中的位置 X位于ⅢA族或ⅤA,Y位于ⅦA或ⅠA,再根据它们在周期表中位置推断出具体元素进行组合,这样从抽象的化学式XY3落实到具体实例:BF3、AlF3、BCl3、AlCl3、NH3、PH3。
此时要注意思维的严谨性,记住特殊实例:PCl3、SO3。
最后再用具体实例代替抽象的XY3,逐一进行核对得出X可能的原子序数,以上答案均可能。
此类型题的特点主要集中在短周期元素的范围内进行讨论,有时还强调属于离子型或共价型化合物,主要考查思维的敏捷性和全面性。
短周期元素两两形成化合物的类型与实例归纳如下:例4:X、Y是除第一周期外的短周期元素,它们可以形成离子化合物X m Y n,且离子均具有稀有气体原子的结构,若X的原子序数为a,则Y 的核电荷数不可能是:A.a+8-m-n B.a+16-m-n C.a-m-n D.a-8+m+n根据化学式X m Y n推算X、Y两元素的化合价分别为+n、-m,此时所形成的阳离子X n+和阴离子Y m-均具有稀有气体原子的结构,所对应的稀有气体原子有以下三种情况:同一种原子,则有a-n=b+m;相差一周期,则a-n+8=b+m;相差两周期,则a-n+16=b+m。
故答案D错误。
例5:若短周期中的两元素可以形成原子个数比为2:3的化合物,则两种元素的原子序数之差不可能是:A.1 B.3 C.5 D.6根据题意,两元素可形成A2B3型化合物,A为+3价即为ⅢA族的Al或B及ⅤA族的N或P;可形成-2价的元素为ⅥA族的O或S。
ⅢA、ⅤA族元素的原子序数为奇数,ⅥA族元素的原子序数为偶数,因此其差值不可能为偶数,故答案应选D。
此题利用了短周期元素的主族序数与原子序数的关系:主族序数为奇数则原子序数为奇数;主族序数为偶数则原子序数为偶数。
4.实战演练一、选择题1、下列叙述正确的是A.同周期元素的原子半径为ⅦA族的为最大B.在周期表中零族元素的单质全部是气体C.A、ⅡA族元素的原子,其半径越大越容易失去电子D.所有主族元素的原子形成单原子离子时的最高价数都和它的族数相等2、下列说法中错误的是A.原子及其离子的核外电子层数等于该元素所在的周期数B.元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素C.除氦外的稀有气体原子的最外层电子数都是8D.同一元素的各种同位素的物理性质、化学性质均相同3、A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是( )A .A、B、C、D、E B. E、C、D、B、AC. B、A、D、C、ED. C、D、A、B、E4、短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。
A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。
下列叙述正确的是A. 原子半径A<B<C B .A的氢化物的稳定性大于C的氢化物C. B的氢化物的熔点比A氧化物高D. A与C可形成离子化合物二、填空题:5、下表标出的是元素周期表的一部分元素,回答下列问题:(1)表中用字母标出的15种元素中,化学性质最不活泼的是(用元素符号表示,下同),金属性最强的是,非金属性最强的是,常温下单质为液态的非金属元素是,属于过渡元素的是(该空用字母表示)。
(2)B,F,C气态氢化物的化学式分别为,其中以最不稳定。
(3)第三周期中原子半径最小的是。
6、有A、B、C、D、E五种主族元素,其原子的最外层电子数依次为1、2、7、6、4,原子序数按E、B、C、A、D的顺序依次增大.D的最高价氧化物的式量与气态氢化物的式量之比为1. 57∶1,且该原子核内有45个中子,A、B、C原子的次外层都有8个电子,E原子的次外层有2 个电子.(1)计算D的原子量;(2)画出D的原子结构示意图;(3)写出元素符号:A 、B 、C 、D 、E ;(4)按酸性由强到弱、碱性由弱到强的顺序写出它们最高价氧化物对应水化物的化学式;7、今有A、B、C、D四种短周期元素,它们的核电荷数依次增大.A和C,B和D分别是同主族元素,B、D两元素的质子数之和是A、C两元素的质子数之和的两倍.这四种元素中有一种元素的单质易溶解于CS2溶剂中。
则四种元素是A、B、C、D。
A和D两元素可由键形成化合物,该化合物的电子式为写出两种均含四种元素的化合物相互反应的化学方程式:。
8、有X、Y、Z三种元素,已知①它们是周期表中前20号元素,X、Y和Z均不在同一周期;②它们可以组成化合物XY2,YZ2和XZ;③X的阳离子和Z的阴离子的核外电子排布相同;④Y很难形成简单的阳离子或阴离子。
请填写下列空白:⑴X ;Y ;Z (添元素符号)。
⑵XY2与水反应的化学方程式是。
⑶在XY2,YZ2和XZ 中,含有非极性键的是,含有极性键的非极性分子是(填化学式)。
9、A、B、C、D、E、F、G为七种由短周期元素构成的微粒。
它们都有10个电子。
其结构特点如下表:其中,B的离子半径大于E的离子半径;D是极性键构成的4原子极性分子;C常用作F的检出(加热)。
请填写以下空白:(1)A微粒的结构示意图是。
(2)比较BC和EC2的碱性强弱BC EC2(填写>、<、=)。
(3)F与G 反应的离子方程式。
参考答案(二)1、C 2、AD 3、C 4、BC5、⑴Ar 、K 、F 、Br 、M⑵H2O HCl PH3 、PH3 ⑶Cl6 ⑴79 ⑵略⑶K 、Mg 、Cl 、Se 、C⑷HClO4、H2SeO4 、H2CO3 、Mg(OH)2、KOH7 H 、O 、Na 、S 、极性、共价、略、NaHSO4+NaHSO3=Na2SO4+H2O+SO2↑8 ⑴Ca 、C 、S 、⑵CaC2+2H2O →Ca(OH)2+C2H2↑⑶CaC2、CS29⑴⑵> ⑶NH4++H2O NH3·H2O+H+。
