3 立题目的与依据
化药4类申报资料清单
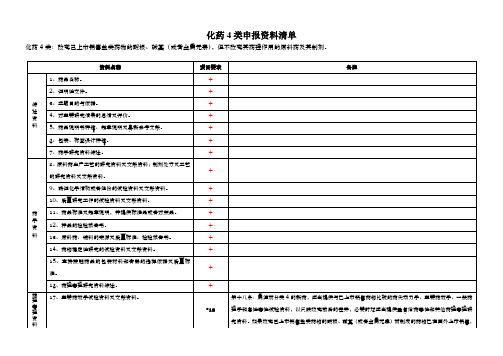
化药4类:改变己上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。
资料名称
项目要求
备注
综述资料
1、药品名称。
+
2、证明性文件。
+
3、立题目的与依据。
+
4、对主要研究结果的总结及评价。
+
5、药品说明书样稿、起草说明及最新参考文献。
+
6、包装、标签设计样稿。
+
14、药物稳定性研究的试验资料及文献资料。
+
15、直接接触药品的包装材料和容器的选择依据及质量标准。
+
16、药理毒理研究资料综述。
+
药理毒理资料注册分类4的新药,应当提供与已上市销售药物比较的药代动力学、主要药效学、一般药理学和急性毒性试验资料,以反映改变前后的差异,必要时还应当提供重复给药毒性和其他药理毒理研究资料。如果改变己上市销售盐类药物的酸根、碱基(或者金属元素)而制成的药物已在国外上市销售,则按注册分类3的申报资料要求办理。
18、一般药理学研究的试验资料及文献资料。
*18
19、急性毒性试验资料及文献资料。
*18
20、长期毒性试验资料及文献资料。
*18
21、过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激牲、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
*19
第十九条:局部用药除按所属注册分类及项目报送相应资料外,应当报送资料项目21,必要时应当进行局部吸收试验。
23、致突变试验资料及文献资料。
±
可以用文献资料代替试验资料
24、生殖毒性试验资料及文献资料。
±
可以用文献资料代替试验资料
药品注册管理办法附件1-6

附件1:中药、天然药物注册分类及申报资料要求本附件中的中药是指在我国传统医药理论指导下使用的药用物质及其制剂。
本附件中的天然药物是指在现代医药理论指导下使用的天然药用物质及其制剂。
一、注册分类及说明(一)注册分类1.未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂。
2.新发现的药材及其制剂。
3.新的中药材代用品。
4.药材新的药用部位及其制剂。
5.未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂。
6.未在国内上市销售的中药、天然药物复方制剂。
7.改变国内已上市销售中药、天然药物给药途径的制剂。
8.改变国内已上市销售中药、天然药物剂型的制剂。
9.仿制药。
(二)说明注册分类1~6的品种为新药,注册分类7、8按新药申请程序申报。
1.“未在国内上市销售的从植物、动物、矿物等物质中提取的有效成份及其制剂”是指国家药品标准中未收载的从植物、动物、矿物等物质中提取得到的天然的单一成份及其制剂,其单一成份的含量应当占总提取物的90%以上。
2.“新发现的药材及其制剂”是指未被国家药品标准或省、自治区、直辖市地方药材规范(统称“法定标准”)收载的药材及其制剂。
3.“新的中药材代用品”是指替代国家药品标准中药成方制剂处方中的毒性药材或处于濒危状态药材的未被法定标准收载的药用物质。
4.“药材新的药用部位及其制剂”是指具有法定标准药材的原动、植物新的药用部位及其制剂。
5.“未在国内上市销售的从植物、动物、矿物等物质中提取的有效部位及其制剂”是指国家药品标准中未收载的从单一植物、动物、矿物等物质中提取的一类或数类成份组成的有效部位及其制剂,其有效部位含量应占提取物的50%以上。
6.“未在国内上市销售的中药、天然药物复方制剂”包括:6.1中药复方制剂;6.2天然药物复方制剂;6.3中药、天然药物和化学药品组成的复方制剂。
中药复方制剂应在传统医药理论指导下组方。
主要包括:来源于古代经典名方的中药复方制剂、主治为证候的中药复方制剂、主治为病证结合的中药复方制剂等。
3 立题目的与依据

3 立题目的与依据化学药品6类己酮可可碱缓释片No.33、立题目的与依据一、品种简述 1、基本情况通用名称:己酮可可碱缓释片英文名称:Pentoxifylline Sustaind-release Tablets 汉语拼音:Jitongkekejian huanshipian化学名称:3,7-二氢-3,7-二甲基-1-(5-氧代己基)-1H-嘌呤-2,6-二酮结构式:分子式:C13H18N4O3 分子量:278.31理化性质:己酮可可碱为白色粉末或颗粒;有微臭,味苦。
在三氯甲烷中易溶,在水或乙醇中溶解,在乙醚中微溶。
2、药理作用及作用机制[1]己酮可可碱可以改善红细胞的变形能力,降低纤维蛋白的浓度,抑制血小板聚集,从而改善缺血组织的微循环,但对中枢神经系统无刺激作用。
3、剂型、规格本公司申报的己酮可可碱缓释片规格为0.4g,为市场已有规格。
4、适应症及用法用量[1]本品用于脑部血循环障碍如暂时性脑缺血发作,中风后遗症。
外周血循环障碍性疾病如血栓栓塞性脉管炎,间歇性跛行或静息痛。
内耳循环障碍如突发性耳聋,老年性耳鸣及耳聋。
眼部循环障碍,如糖尿病性视网膜动脉栓塞。
以下用药剂量指导适于成年人或体重超过50公斤的青少年:每次1片(相当于己酮可可碱400毫克),每日3次。
每日最大给药剂量为3片(相当于己酮可可碱1200毫克)。
对严重肾功能不全患者(肌酐清除率<10ml/min),需降低本品剂量至1化学药品6类己酮可可碱缓释片No.3正常用量的50-70%。
己酮可可碱缓释片应在餐后,用适量水,完整送服,不可嚼碎。
5、国内外上市情况己酮可可碱缓释片由赛诺菲制药1984年8月在美国上市,商品名“TRENTAL”,规格为400mg,目前有多家公司生产的产品在世界多个国家上市,国内由德国Merckle GmbH进口,商品名“瑞潘通”,但德国Merckle GmbH公司生产批件于2021年12月到期后就不再重新申请注册,因此国内无法购买到“瑞潘通”。
新药申报资料目录

附件 2:药品补充申请注册事项及申报资料要求(一)综述资料:1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书样稿、起草说明及最新参考文献。
6.包装、标签设计样稿。
(二)药学研究资料:7.药学研究资料综述。
8.药材来源及鉴定依据。
9.药材生态环境、生长特征、形态描述、栽培或培植(培育)技术、产地加工和炮制方法等。
10.药材标准草案及起草说明,并提供药品标准物质及有关资料。
11.提供植物、矿物标本,植物标本应当包括花、果实、种子等。
12.生产工艺的研究资料、工艺验证资料及文献资料,辅料来源及质量标准。
13.化学成份研究的试验资料及文献资料。
14.质量研究工作的试验资料及文献资料。
15.药品标准草案及起草说明,并提供药品标准物质及有关资料。
16.样品检验报告书。
17.药物稳定性研究的试验资料及文献资料。
18.直接接触药品的包装材料和容器的选择依据及质量标准。
(三)药理毒理研究资料:19.药理毒理研究资料综述。
20.主要药效学试验资料及文献资料。
21.一般药理研究的试验资料及文献资料。
22.急性毒性试验资料及文献资料。
23.长期毒性试验资料及文献资料。
24.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等) 刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
25.遗传毒性试验资料及文献资料。
26.生殖毒性试验资料及文献资料。
27.致癌试验资料及文献资料。
28.动物药代动力学试验资料及文献资料。
(四)临床试验资料:29.临床试验资料综述。
30.临床试验计划与方案。
31.临床研究者手册。
32. 知情同意书样稿、伦理委员会批准件。
33.临床试验报告。
(一)综述资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书、起草说明及相关参考文献。
6.包装、标签设计样稿。
(二)药学研究资料7.药学研究资料综述。
技术指导原则 ——立题目的与依据

化学药品申报资料撰写格式与内容技术指导原则——立题目的与依据撰写格式和内容(第二稿草稿)二OO五年三月目录一、概述 (2)二、资料格式和内容 (2)(一)品种基本情况 (2)(二)立题背景 (3)(三)品种的特点 (4)(四)国内外有关该品种的知识产权等情况 (6)(五)综合分析 (6)(六)参考文献 (6)三、起草说明 (6)四、著者 (9)一、概述按照《药品注册管理办法》(试行)附件2的要求,化学药品申请注册时应提供的第3项申报资料为“立题目的与依据”。
该项资料系由药品注册申请人撰写,阐明申报注册药品的研发背景、目的及依据等的技术资料。
本指导原则系根据《药品注册管理办法》(试行)的有关要求,按照药品研发的自身规律,结合目前国内化学药品研发的实际制订的。
其目的是从药品技术评价的需要出发,对申报资料“立题目的与依据”的撰写格式和内容提出一般性的原则,指导、规范该项申报资料的撰写。
药品研发的目的是满足临床治疗的需要。
因此,立题目的应着重阐述研发品种的临床需求、科学合理、经济实用和现有药物治疗的局限性等。
立题依据的阐述应基于对申报品种自身特点,临床应用的效益/风险,国内外有关该品研发、上市销售、生产使用情况,以及知识产权情况等的综合分析。
本指导原则适用于化学药品的注册申报。
不同注册分类的药品,“立题目的与依据”申报资料的撰写可参照指导原则的一般要求,并结合品种的特点,在具体内容上有所侧重或取舍。
二、资料格式和内容申报资料一般可从下述六部分来撰写:品种基本情况,立题背景,品种的特点,国内外有关该品种的知识产权等情况,综合分析,参考文献。
(一)品种基本情况1、品种的基本情况一般应包括以下内容:(1)药品名称,包括通用名、英文名、化学名、汉语拼音、拟用商品名;(2)药物的化学结构式、分子式、分子量;(3)申报药品的药理类型及作用机制;(4)制剂的剂型、规格;(5)复方制剂的组成,各组分药理作用、适应症、用法用量、主要不良反应等的概述;(6)申报的拟用于临床的适应症及用法用量,表述应明确、规范;申请增加适应症的药品,还应说明原批准的适应症及用法用量;(7)申报品种的注册分类及其依据,并明确是否为原研发品种。
化学药物立题目的与依据的撰写要求

化学药物立题目的和依据的撰写要求报告人:李眉一. 前言立题目的与依据. 国内外有关该品研发、上市销售现状及相关文献资料或者生产、使用情况,制剂研究合理性和临床使用必须性的综述——《注册管理办法》附件2立题目的与依据化学药物综述资料撰写的格式和内容的技术指导原则申报资料是申请人为了注册申请提供的文件用以证明注册申请的合法性和合理性包括:技术性文件证明性文件综述性文件棱锥图立题目的与依据对主要研究结果的总结及评价申请目的上市承诺药学研究资料综述药理毒理研究资料综述临床试验资料综述药学研究资料药理毒理研究资料临床试验资料综合综述专业综述试验资料综述性申报资料撰写的基本要求真实反映研究过程和结果系统说明研究目的和依据规范格式和内容表达方式基于研究—反映过程和结果---真实性易于审评—统一格式和内容---规范性支持注册—围绕申请目的---系统性审评者对申报资料的考察申请人的承诺审评、审查角度申请目的合理性支持申请目的的证据证据的充分性向社会承诺信息证据是否科学、系统、真实立题目的和依据研究目的试验设计真实性研究的真实性申报资料的真实性申报资料真实性问题1、未充分表达—细节说明不2、逻辑、常识—虚假痕迹3、不能证明真实性—不能溯源关联性围绕着立题依据、研究目的和试验设计这三个关键要素, 突出三者之间的重要关联常见问题:1、文献资料的堆积2、研究内容缺陷3、综合分析不充分4、资料衔接间矛盾规范性内容格式用语引用文献二、资料格式和内容. 本申报资料可从下述六部分来撰写:---品种基本情况---立题背景---品种的特点---国内外有关该品种的知识产权等情况---综合分析---参考文献(一)品种基本情况1、品种的基本情况一般应包括以下内容:. (1)药品名称,包括通用名、英文名、化学名、汉语拼音、拟用商品名;. (2)药物的化学结构式、分子式、分子量、基本理化性质;. (3)所申报药物的药理作用及作用机制;. (4)制剂的剂型、规格;(5)复方制剂的组成,各组分药理作用、适应症、用法用量、主要不良反应等的概述;. (6)拟用于临床的适应症及用法用量;申请增加适应症的药品,还应说明原批准的适应症及用法用量;. (7)所申报药品的注册分类及其依据,并明确是否为原研发品种。
中药新药研发流程图
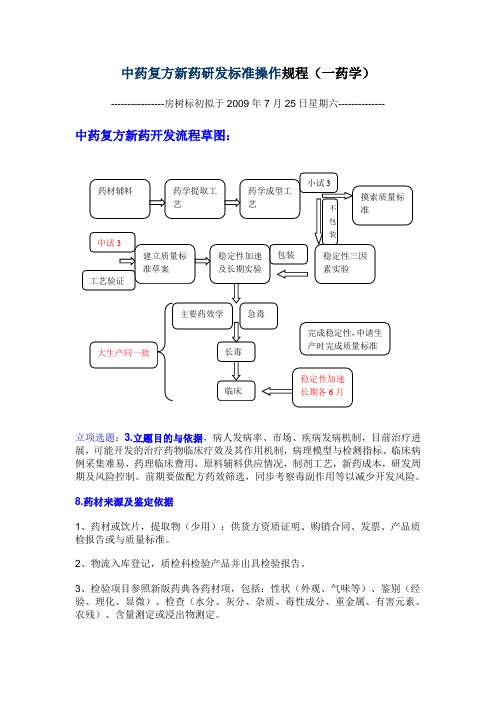
中药复方新药研发标准操作规程(一药学)----------------房树标初拟于2009年7月25日星期六--------------中药复方新药开发流程草图:立项选题:3.立题目的与依据,病人发病率、市场、疾病发病机制,目前治疗进展,可能开发的治疗药物临床疗效及其作用机制,病理模型与检测指标、临床病例采集难易,药理临床费用,原料辅料供应情况,制剂工艺,新药成本,研发周期及风险控制。
前期要做配方药效筛选,同步考察毒副作用等以减少开发风险。
8.药材来源及鉴定依据1、药材或饮片,提取物(少用):供货方资质证明、购销合同、发票、产品质检报告或与质量标准。
2、物流入库登记,质检科检验产品并出具检验报告。
3、检验项目参照新版药典各药材项,包括:性状(外观、气味等)、鉴别(经验、理化、显微)、检查(水分、灰分、杂质、毒性成分、重金属、有害元素、农残)、含量测定或浸出物测定。
9、10、11三项原料药材符合法定标准的可不提供。
12.生产工艺研究资料,工艺验证资料及文献资料,辅料来源及质量标准。
1.(12与13文献资料):文献检索包括复方中各位药材的成分、理化性质、含量测定方法、药理、药代、临床,新药制剂工艺等全面信息,为以后的药学工艺、质量标准的制定,药理模型的建立、临床方案的设计奠定科研基础。
2.辅料来源及质量标准:供货方资质证明、购销合同、发票、产品质检报告与质量标准。
物流入库登记,质检检验产品并出具检验报告。
检验项目参照新版药典各辅料项。
3.生产工艺研究资料,工艺验证资料:购进原料后,现通过实验室摸索(正交设计等摸索提取及制剂工艺)再通过实验室小试建立工艺。
注意:工艺指标选择要有意义(有效成分或指标成分),小试工艺参数最好是个范围,以便于生产条件的实现,同时也要有一个最佳工艺参数。
如提取工艺参数:溶剂量,时间、温度;直接浓缩至一定密度的浸膏,考察出膏量及有效成分含量。
可进一步考察浓缩参数:温度、压力、时间;指标可选膏的浓度。
中药6.1类新药申报所需资料

中药6.1类新药申报所需临床前资料1.药品名称。
2.证明性文件。
3.立题目的与依据。
4.对主要研究结果的总结及评价。
5.药品说明书样稿、起草说明及最新参考文献。
6.包装、标签设计样稿。
药学研究资料:7.药学研究资料综述。
8.药材来源及鉴定依据。
9.药材生态环境、生长特征、形态描述、栽培或培植(培育)技术、产地加工和炮制方法等。
10.药材标准草案及起草说明,并提供药品标准物质及有关资料。
11.提供植物、矿物标本,植物标本应当包括花、果实、种子等。
12.生产工艺的研究资料、工艺验证资料及文献资料,辅料来源及质量标准。
13.化学成份研究的试验资料及文献资料。
14.质量研究工作的试验资料及文献资料。
15.药品标准草案及起草说明,并提供药品标准物质及有关资料。
16.样品检验报告书。
17.药物稳定性研究的试验资料及文献资料。
18.直接接触药品的包装材料和容器的选择依据及质量标准。
药理毒理研究资料:19.药理毒理研究资料综述。
20.主要药效学试验资料及文献资料。
可以用文献综述代替试验研究(可以不21.一般药理研究的试验资料及文献资料。
或按规定可减免试验研究的资料用报?)22.急性毒性试验资料及文献资料。
23.长期毒性试验资料及文献资料。
24.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料。
25.遗传毒性试验资料及文献资料。
26.生殖毒性试验资料及文献资料。
27.致癌试验资料及文献资料。
药理毒理研究资料:(7)资料项目24过敏性(局部、全身(?)和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献具有法定标准的中药材、天然药物可以不提供,否则必须提供资料*资料:根据药物给药途径及制剂特点提供相应的制剂安全性试验资料。
具有依赖性倾向的新药,应提供药物依赖性试验资料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、立题目的与依据一、品种简述1、基本情况通用名称:己酮可可碱缓释片英文名称:Pentoxifylline Sustaind-release Tablets汉语拼音:Jitongkekejian huanshipian化学名称:3,7-二氢-3,7-二甲基-1-(5-氧代己基)-1H-嘌呤-2,6-二酮结构式:分子式:C13H18N4O3分子量:278.31理化性质:己酮可可碱为白色粉末或颗粒;有微臭,味苦。
在三氯甲烷中易溶,在水或乙醇中溶解,在乙醚中微溶。
2、药理作用及作用机制[1]己酮可可碱可以改善红细胞的变形能力,降低纤维蛋白的浓度,抑制血小板聚集,从而改善缺血组织的微循环,但对中枢神经系统无刺激作用。
3、剂型、规格本公司申报的己酮可可碱缓释片规格为0.4g,为市场已有规格。
4、适应症及用法用量[1]本品用于脑部血循环障碍如暂时性脑缺血发作,中风后遗症。
外周血循环障碍性疾病如血栓栓塞性脉管炎,间歇性跛行或静息痛。
内耳循环障碍如突发性耳聋,老年性耳鸣及耳聋。
眼部循环障碍,如糖尿病性视网膜动脉栓塞。
以下用药剂量指导适于成年人或体重超过50公斤的青少年:每次1片(相当于己酮可可碱400毫克),每日3次。
每日最大给药剂量为3片(相当于己酮可可碱1200毫克)。
对严重肾功能不全患者(肌酐清除率<10ml/min),需降低本品剂量至正常用量的50-70%。
己酮可可碱缓释片应在餐后,用适量水,完整送服,不可嚼碎。
5、国内外上市情况己酮可可碱缓释片由赛诺菲制药1984年8月在美国上市,商品名“TRENTAL”,规格为400mg,目前有多家公司生产的产品在世界多个国家上市,国内由德国Merckle GmbH进口,商品名“瑞潘通”,但德国Merckle GmbH公司生产批件于2008年12月到期后就不再重新申请注册,因此国内无法购买到“瑞潘通”。
目前国内只有石药集团欧意药业有限公司获得生产批件,因为无法购买原研产品,本品开发时选择了美国APOTEX CORP生产的“Pentoxifyllie Extended-release Tablets”作为被仿制品,除缓释片外,己酮可可碱还有注射液、粉针、肠溶片等剂型。
6、注册分类根据《药品注册管理办法》相关规定,我公司申报的己酮可可碱缓释片为仿制品种,属化药6类,已有国家标准品种。
原料药来源:石药集团新诺威制药股份有限公司执行质量标准:中国药典2010年版二部本次申报为片剂,没有同一原料药的其他制剂品种。
二、立题背景[2]~[3]1、流行病学2010年第六次人口普查表明,中国60岁以上老年人口已达到1.78亿,占全国人口的13.3%,是世界老龄人口最多的国家,80岁以上高龄老年人已在2000万左右。
按照国际通行的老龄社会标准,中国从1999年开始迈人老龄化社会。
目前,这个世界上人最多国家的老龄化正在加速。
2014年中国老年人将超过2亿,2025年达到3亿,2042年老年人比例将超过30%。
伴随老年人数量的快速增长,老年人慢性患病率也快速增加,疾病经济负担日益沉重,给国家、社会和家庭带来诸多不利影响。
在65 岁以上人口中,主要患有白内障、抑郁症、糖尿病、老年性痴呆疾病,而且有42%的老年人同时患有两种以上疾病。
其中以高血压、心、脑血管疾病、呼吸系统疾病的患病率较高,且有逐年增长的趋势。
根据我国部分地区调查,60岁及以上人群老年期痴呆患病率为4.2%。
2004年9月7日世界卫生组织发表“人口老龄化社会的健康隐忧”报告指出,随着全球人口的老龄化,慢性疾病给公共健康系统带来的负担越来越重。
根据对1998 年全球疾病负担的估计:慢性病占43%,中国高达60%。
慢性病发病的高发人群是成年人,导致大量劳动力损失,给家庭和社会带来巨大负担。
我国近年来卫生经费的总额逐年在增加,1990年卫生总费为747.4亿元,2000年高达5684.6亿元,人均卫生费用也由1980年的14.51元,增长到2002 年的442.6 元,并仍呈增长趋势。
过高的医疗费用支出是各级财政和家庭难以承受。
己酮可可碱用于血循环障碍的治疗,如中风后遗症,血栓栓塞性脉管炎,老年性耳鸣及耳聋,糖尿病性视网膜动脉栓塞,这些疾病大多为老年慢性病,大多是由于血液循环或体液平衡障碍所引起,局部血液循环障碍表现为:(1) 血管内成分逸出血管外:水分在组织间隙中增加时称水肿;在体腔内积聚称积液;红细胞逸出血管称出血;(2) 局部组织血管内血液含量异常:动脉血量增加称充血;静脉血量增加称瘀血;血管内血量减少称缺血;(3) 血液内出现异常物质:包括血液凝固形成的血栓以及血管内出现的空气、脂滴、羊水等异常物质阻塞局部血管。
造成血管栓塞和组织梗死。
局部血液循环障碍及其所引起的病变是疾病的基本病理改变,常出现在许多疾病过程中。
2、发病机理及临床表现短暂性脑缺血发作是指伴有局灶症状的短暂的脑血液循环障碍,以反复发作的短暂性失语、瘫痪或感觉障碍为特点,症状和体征在24小时内消失。
它是指在短时间内脑血流量减少引起的脑功能障碍,每次犯病的时间持续不久,通常是数秒钟、数分钟或数小时等,最长不超过24小时。
往往因症状来得快,消失也快,恢复后不留任何后遗症而易被人忽视。
实际上,TIA 症状虽轻,但后果严重,如不及时治疗,据统计,约有25%~40%患者,在5年内将产生严重的脑梗塞,而威胁病人生命。
因此,医学家们常常把它看成是脑血管病的先兆或危险信号。
短暂性脑缺血发作的病因绝大多数是动脉粥样硬化,由微血栓、血液动力学改变、头部血流的改变和逆流,和血液成分的改变等因素而发病。
临床表现主要为对侧肢体的无力、笨拙、使用不灵活,眩晕、共济失调、复视、言语困难、相吉困难、吞咽困难、摔倒发作、单侧或双侧视觉缺失、短暂性全脑遗忘症、单侧或双侧面部麻木、单侧或双侧感觉丧失、偏瘫或双侧肢体瘫痪甚至四肢瘫痪、记忆力障碍等。
中风后遗症是指中风(即脑血管意外)经治疗后遗留下来的口眼歪斜,语言不利,半身不遂等症状的总称。
常因本体先虚,阴阳失却平衡,气血逆乱,痰瘀阻滞,肢体失养所致。
痰瘀为本病的主要病理因素,痰瘀阻滞脉络而致肢体不能随意运动,久则患肢枯瘦,麻木不仁。
血栓闭塞性脉管炎简称脉管炎。
是指周围脉管(中、小动脉及静脉)的一种慢性持续性、进行性的血管炎症病变,导致血栓形成使血管腔闭塞。
在我国北方各省多见。
多发于男性青壮年。
病变主要累及四肢远端的中、小动脉,伴行静脉和浅表静脉也常累及,以下肢为主。
临床表现主要为:①发病早期感觉患肢发凉、怕冷、麻木,足部及小腿有酸痛。
继而出现间歇性跛行,最后发展为静息痛,尤以夜间为甚②下肢肢端皮肤呈紫红或苍白,皮温降低,皮肤乾燥,小腿肌肉萎缩,趾或足发生溃疡及干性坏疽。
足背动脉及胫后动脉的搏动消失③。
约有1/3病人可反复出现游走性血栓浅静脉炎,多位于足背和小腿浅静脉。
间歇性跛行就是病人在不走路的时候没有明显的不适,但一走路患病下肢就会出现酸胀不适感,以致不得不停下来休息,休息一段时间后这种不适感消失,又可以继续走路。
在临床上我们把这种症状称之为间歇性跛行。
其主要病因为脉管炎、腰椎管狭窄,多发于中老年人。
休息痛,是病变的中期表现,当病变发展,下肢缺血加重,不行走也发生疼痛,称为静息痛。
这种疼痛大多局限在趾或足远端,夜间尤甚,卧位时疼痛加剧,下肢垂下可有缓解,夜间静息痛或休息痛。
因睡眠时心输出量最少,下肢灌注注血量也减少,故疼痛常在夜间加重。
不论是动脉或静脉病变,都可以造成静息痛(肢体持续性疼痛),前者比后者剧烈,而且说明脉管炎的缺血加重,已接近失去代偿的程度。
大部分静息痛与局部缺血性神经炎的产生有关,而局部缺血性神经炎又多发生于闭塞性动脉硬化患者,其次为血栓闭塞性脉管炎患者。
另一种静息痛起于供应肢体的主枝动脉突然被血栓梗阻。
造成组织的急性缺氧所致。
目前普遍认为内耳供血障碍是突发性聋的主要病因,患者的听力损失程度与耳蜗血流速度、血流量和血管横截面积有关。
内耳的血液供应来自迷路动脉,内耳毛细胞生理活动耗氧量较高,对缺氧耐受差,血压或循环二氧化碳分压下降都可能引起耳蜗外淋巴氧张力减小,从而降低内耳供氧量,因此各种原因引起的耳蜗微循环功能障碍都可以造成听觉器官功能损害,引起听力下降。
其次,使用改善循环功能的药物能够促进患者听力恢复,也间接证明了循环功能障碍可能是突发性聋的发病机制。
血压过高或过低,贫血,胞动脉硬化或供血不足等,造成听中枢、听神经以及听觉器官末梢缺血缺氧而发生的耳鸣,高血脂、高血糖、高血黏度、血管硬化等几乎都会影响内耳的血液供应,进而引起听力下降。
内耳的血管管径极细,没有侧支循环。
冠心病伴有听力减退的人,耳聋往往早于冠心病症状之前出现。
视网膜动脉阻塞是指视网膜中央动脉或其分支阻塞。
视网膜中央血管为终末血管,一旦阻塞,可引起视网膜组织缺血,视力下降,是眼科致盲的急诊之一。
此病多发生在伴有心血管疾病的老年人。
发病者常有偏头痛、凝血功能障碍、炎症或感染性疾病、口服避孕药或外伤等诱因。
导致视网膜血管发生阻塞的直接原因主要为血管栓子、血管痉挛、血管壁的改变和血栓形成,以及眼压或眶压增高、眶内肿物使血管受压等。
3、预防及治疗上述疾病总的来说是由于血液循环障碍造成的,因此临床治疗可选用改善血液微循环的药物如抗血小板聚集药物、扩溶药物、抗凝药物、扩血管药物及活血化瘀中药。
己酮可可碱可以改善红细胞的变形能力,降低纤维蛋白的浓度,抑制血小板聚集,从而改善缺血组织的微循环,但对中枢神经系统无刺激作用。
己酮可可碱可以降低中性粒细胞(PMN)的粘附聚集能力,抑制PMN的膜补体c3受体的表达,增加PMN及单核细胞的变形能力,抑制白介素1(IL一1)、白介素12和细胞粘附分子等的表达,减少粒细胞氧自由基生成,减少后者造成的粒细胞凋亡。
它还可以降低肿瘤坏死因子(TNFa)的转录水平。
但它对肺泡巨噬细胞(AM)和血单核细胞有不同的影响,前者只有TNFa被抑制,而后者的粒-巨噬细胞集落刺激因子(GM-CSF)也被抑制,因此,使用己酮可可碱时必须考虑它对GN-CSF的不良影响。
己酮可可碱能增加细胞膜的三磷酸腺苷量而改善细胞膜的变形能力,制止微血管收缩和红细胞、血小板聚集,抑制过氧化物释放和血小板活化因子激发,刺激组织纤维蛋白酶原活化因子释放,提高血浆酶和抗凝血酶Ⅲ的水平,从而能降低血液粘滞度,抗凝、促纤溶、扩血管。
己酮可可碱通过抑制细胞磷酸二酯酶,减少c-AMP水解为5r-磷酸腺苷,使胞内cAMP升高,引起细胞发生相应的变化:抑制AM的ca2+内流,降低内皮细胞表面黏附性,阻止肌蛋白收缩,防止细胞间隙连接变窄,降低血管通透性,增加心肌细胞收缩力和精子糖酵解。
己酮可可碱可改善组织细胞功能恢复下降的细胞功能,改善组织供氧、供血。
