第四章 胶体化学
胶体化学第四章第四节

§4.4 阴离子表面活性剂
4.羧酸盐
(2)羧酸盐的性能与应用 如钠皂最硬、钾皂次之、胺皂最软。脂肪酸的碳链越长, 饱和度越大,凝固点越高,用其制成的肥皂越硬。硬脂酸钠除 用作肥皂外,还常用作化妆品的的乳化剂。钾皂常用作化妆用 肥皂和化妆品的乳化剂。月桂酸钾是淡黄色浆状物,易溶于水 起泡作用大,主要用于液体皂和香波生产中,也常用作乳化剂 和起泡剂。 烷基醚羧酸盐亦称聚醚羧酸盐,其化学通式为 R(OCH2CH2)nOCH2COONa,它对硬水中金属离子稳定,对 皮肤的作用缓和,能防止酶的产生。主要用作化妆品的乳化 剂、分散剂、凝胶剂和钙皂的分散剂、润湿剂等。
§4.4 阴离子表面活性剂
1、磺酸盐与磺化反应
磺酸盐的化学通式为R-SO3Na,碳链中的碳原子
数在8—20之间。磺酸盐易溶于水,在酸性溶液中 不发生水解,有良好的发泡和洗涤作用。这类表 面活性剂主要用于生产洗涤剂。 磺化反应:有机化合物分子个引入-SO3基团的反 应称为磺化反应。得到的产物是磺酸化合物
§4.4 阴离子表面活性剂
2.硫酸酯盐与硫酸盐化反应
硫酸酯盐主要有两类,即脂肪醇硫酸盐和脂肪醇 醚硫酸盐,其化学通式分别为ROSO3Na和 RO(C2H4O)nSO3Na,烃基中的碳原于数通常为8~ 18。这类表面活性别具有良好的发泡能力和洗涤 能力,在硬水中稳定,其水溶液呈中性或微碱性。 硫酸酯盐主要用于洗涤剂中。
§4.4 阴离子表面活性剂
1、磺酸盐
(2)烷基磺酸盐 现在主要采用磺氧化生产。正构烷烃链上伯碳原子与 仲碳原子上氢原子的相对活泼性的比例为1:3,因此 磺氧化法产物大部分为仲位取代物,反应式如下:
本法不需用氯气,副产物少,可简化工艺降低成本
§4.4 阴离子表面活性剂
胶体化学第四章第五节

§4.5
3. 吡啶盐
阳离子表面活性剂
吡啶盐是属于特种形式叔胺,它与高级卤代烷反 应生成与季胺盐相似的烷基吡啶盐。
式中R=C12一C18,X=Cl,Br。 例如,氯化十二烷基吡啶、氯化十六烷基吡啶、 溴化十六烷基吡啶及氯化十七酰甲胶基吡啶等均 为这种类型的阳离子表面活性剂。 它们主要用作纤维的防水剂,染色助剂和杀菌剂。
§4.5 阳离子表面活性剂
2. 季铵盐及季胺化反应 季铵盐是常用的阳离子表面活性剂,具有如下化 学结构式
式中R,Rl,R2,R3是四个相同的或不同的烷基, X是卤素原于或酸根。
§4.5
阳离子表面活性剂
2. 季铵盐及季胺化反应
( 1 )季胺化反应: 由叔胺与烷化剂作用生成季铵盐的反 应,称为季胺化反应。常用的烷化剂如表所示:
§4.5
2. 季铵盐
阳离子表面活性剂
(2)季铵盐的性质及应用 季铵盐一般都有良好的水溶性,并随其碳链长度的增加, 水溶性下降,碳原于数低于C14的易溶于水,高于C14的难溶 于水。若季铵盐的烷基中含有不饱和的基团时,能增加它 们的溶解性。克拉夫特温度与碳链长度有如下线性关系。 kraff点=a+b n 式中n为碳链长,a,b为常数。 季铵盐阳离子表面活性剂带有正电荷,对于带有负表 面电荷的纺织品、金属、玻璃、塑料、矿物、动物或人体 组织等具有强的吸着能力,易在基质表面上形成亲油性膜 或产生阳电性,故广泛用作纺织品的防水剂、柔软剂、抗 静电剂、缓蚀剂和杀茵消毒剂等。
§4.5 阳离子表面活性剂
1. 铵盐型
(2) 铵盐的性能与应用
铵盐为弱碱盐,对pH较为敏感,处在酸性条件下,形成可 溶于水的铵盐,碱性条件则游离出胺。
铵盐的物性与胺不同,一般为不挥发性的无臭固体,易溶 于水而不溶于醚、烃等有机溶剂。例如,十二胺虽是体后,加入醋 酸,生成的十二胺醋酸盐,是能溶于水的良好的表面活性剂。 脂肪族高级铵盐主要用作表面活性剂的原料。低级铵盐阳 离子表面活性剂可作为纤维软整理剂,酸性溶液的缓蚀剂等。
胶体化学第4章 表面张力 毛细作用和润湿作用
则x与y各增加dx和dy 。
Young-Laplace 公式
移动后曲面面积增量为: dAs (x dx)( y dy) xy
D'
x dx C'
o'
xdy ydx (dydx 0)
增加这额外表面所需功为
A'
D
dz
B'
C
y
o
Wf g xdy ydx
克服附加压力所作的功为 W ' psdV dV xydz
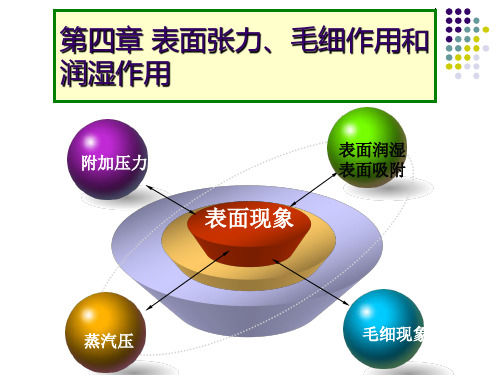
第四章 表面张力、毛细作用和 润湿作用
附加压力
表面现象
表面润湿 表面吸附
蒸汽压
毛细现象
表面张力和表面能
ps
界定:界面和表面
什么是界面?
不同相态之间,两相紧密接触、约有几个分子厚度的 过渡区,称为该两相的界面(interface)。
常见的界面有:
液体 界面 性质
气-液界面 液-液界面 液-固界面
气-固界面 固-固界面
液体界面性质的研究内容
研究对象: 液-气界面性质; 液-固界面性质; 液-液界面
基本内容: 1、物体表面会发生怎样的物理化学现象 2、物体表面分子和内部有何不同 3、界面现象对体系性质的影响
前沿热点、实际应用:
1、超临界干燥技术 2、仿生材料——超疏水、超亲水材料 3、分子子组装膜;LB膜。。。。。。
狭义的表面吉布斯自由能:
g
G ( A ) p,T ,nB
保持温度、压力和组成不变,每增加单位表面积时,
Gibbs自由能的增加值称为表面Gibbs自由能,或简称表
面自由能或表面能,用符号g 或 表示,单位为J·m-2。
等温、等压条件下,可逆的增加单位表面积时,环 境对体系所做的功转化为表面层分子的吉布斯自由能。
大学化学第4章溶液与胶体

水的离子积
通常将此平衡常数( K )称为水的离
子积( KW ),即
KW
C
(H C
)
C
(OH C
)
平
1.01014
.
KW 不随组成而变,只是温度的函数。
t/℃
5 10 15 20 25 30 50 100
K
W
/10 14
0.186 0.293 0.452 0.681 1.008 1.471 5.476
如:SO3、CO2
3、路易斯(Lewis)酸碱电子理论
与布朗斯特质子酸碱同时,路易斯提出了电子酸 碱理论:
能接受电子对的物质为酸
如:AlCl3、ZnCl2、BF3等。
能给出电子对的物质为碱
如:NH3、 Br- 、S-等。
路易斯酸碱电子理论几乎适用于所有的无机 化合物,特别是配合物,故又称为广义酸碱理论。
蒸气压
把液体置于密闭容器中,在一定温度 下,当液体的蒸发速率与蒸气的凝结速 率相等时,气、液两相达到平衡,此时 蒸气的压力叫做饱和蒸气压,简称蒸气压。
蒸汽压示意图Biblioteka 在一定温度下,若溶质是非挥发性的,则 溶剂的蒸汽压与其占据液面的比例有关。
纯溶剂
溶液
理想溶液
若溶质分子为A,溶剂分子为B。
如果分子之间A与A、A与B、B与B的作用力都 相同,则该溶液为理想溶液。
凝固点
液体的蒸气压随着温度的降低而减小。当 其等于固态的蒸气压时,液体就凝固。
此时的温度叫做凝固点。用Tf表示。在凝 固点时,通常是气、液、固三相共存。
3、具有一定的渗透压
1) 渗透现象
2) 渗透压 3) 渗透现象及应用
1) 渗透现象
06第四章胶体溶液于素华

第四章胶体溶液学习要点分散系、分散相、分散介质、表面现象、表面能、表面活性物质、吸附、孚L 化剂、乳化作用、溶胶、胶团结构、Tyndall现象、Brown运动、电泳、电渗。
聚沉值、大分子溶液、胶凝、盐析学习指南(一)分散系统分散系统,简称分散系,是由一种或几种物质以较小的颗粒分散于另一种物质中所形成的系统。
分散系中被分散的物质称为分散相,容纳分散相的物质称为分散介质。
根据物态,分散系有固态、液态与气态之分。
液体分散系按其分散相直径的大小不同可分为真溶液、胶体分散系和粗分散系三类。
分散系又可分为均相分散系和非均相分散系两大类。
均相分散系只有一个相(体系内部物理性质和化学性质均一的部分形成一相”,包括真溶液、大分子溶液。
非均相分散系的分散相和分散介质为不同的相,包括溶胶和粗分散系。
(二)表面现象我们把在任何两相界面上产生的物理化学现象总称为表面现象。
胶体的许多性质,如电学性质、稳定性、保护作用等都与表面现象有关。
如果把液体内部分子移到表面层就要克服向内的合力而做功。
这种功称为表面功,它以势能形式储存于表面分子。
单位表面上的表面自由能即增加单位表面所消耗的功,称为比表面能,比表面能在数值上等于表面张力。
根据热力学原理,表面能有自发降低的趋势。
要降低表面能,可通过两种途径:一是缩小物体的表面积;二是降低表面张力或是两者都减小。
表面活性物质分子的一端具有疏水性,另一端具有亲脂性。
如果向水中加入表面活性物质,则表面活性物质会部分地代替水分子聚集在溶液表面上,以降低表面张力,导致表面活性物质在表面层的浓度大于在溶液内部的浓度,产生正吸附。
相反,如果向水中加入某些无机盐类(如NaCl等)、糖类(单糖、双糖)以及溶于水的金属氢氧化物、淀粉等表面张力比水大的表面非活性物质,则这类物质在溶液表面层的浓度将会小于它们在溶液内部的浓度,产生负吸附。
(三)孚L状液水与油这两种液体不相溶,若使其中的一种液体的一种以细小的液滴分散于另一种不相溶的液体中,必须在振荡的同时加入一种能降低比界面能的表面活性物质,这种表面活性物质的分子在油与水两相界面上定向地排列,形成一层保护分散相液滴的薄膜,防止了液滴合并变大而分层,使体系得到一定程度的稳定性. 这种能使乳浊液稳定的的表面活性物质称为乳化剂,乳化剂所起的作用称为乳化作用。
《胶体化学》课件

胶体稳定性受多种因素影响,包括电荷平衡、添加剂浓度、温度和离子浓度等。了解这些因素对 稳定性的影响对于控制胶体性质非常重要。
胶体的表面现象及表面电荷
胶体的表面现象和表面电荷是胶体特性的重要方面。表面张力、表面活性剂 和双电层理论等是解释胶体表面现象和电荷行为的基本概念。
胶体溶液的流变性质和黏度
胶体溶液的流变性质决定了其在应用中的性能。黏度是评估胶体流动性的重 要指标,它受到浓度、温度和剪切速率等因素的影响。
胶体的分类及特点
分类多样
胶体可以根据颗粒的组成、形状和大小来进行分类,如溶胶、凝胶和乳胶等。
特点独特
胶体具有较大的比表面积、光学散射特性、颗粒间作用力以及流变性质等特点。
广泛应用
胶体在许多行业中有重要的应用,如医药、食品、化妆品和环境工程等。
胶体的制备方法及应用
1
物理方法
如凝胶法、胶体溶胶法和机械法等,用于制备各种类型的液法等,用于合成特定结构和性质的胶体。
3
应用广泛
胶体在纳米材料制备、催化剂合成、石油开发和医药领域等具有广泛的应用。
胶体的粒径测定方法
粒径测定是胶体研究中的重要任务,常用的方法包括光散射、动态光散射和 电子显微镜等。这些方法能够准确测量颗粒的尺寸和分布。
胶体稳定性的影响因素
《胶体化学》PPT课件
欢迎来到《胶体化学》PPT课件!本课程将深入探讨胶体化学的基本概念、特 点、制备方法以及在各个领域的应用。让我们一起展开这个神奇而有趣的化 学世界吧!
胶体化学的基本概念和定义
胶体是一种特殊的物质状态,它由微小的颗粒悬浮在连续介质中而形成。胶体化学研究这些颗粒 的性质、行为和相互作用。
第四章第六节重质油胶体化学结构

2.3 氢键作用对渣油胶体结构形成的贡献
氢键作用发生在与电负性较强的原子(如O、N及S等) 相连的氢和另外一个电负性较强的原于或富电子中 心之间,是大多数天然物质中的一类重要缔合力。
大部分氢键的键能在13—42kJ/mol之间(约为Л键的 1/10)。
形成渣油胶体分散相的各组分相互作用力与原油 中各组分相互作用力有很大差异,沥青质-富含杂 原子的稠环芳烃-只是部分可溶,且在稠芳环间通 过 - 键形成晶体;
天然沥青质的晶体含量不超过4-5%,而裂化渣油 中沥青质晶体含量可达20%;
溶剂化后,大部分胶体分散粒子直径约为3nm,胶 体粒子与胶质体积之比在2.5-3.5,这样,溶剂化 层量大于胶质的平均含量;胶体分散体系的亚稳 态稳定性降低,会引起大部分粒子的聚沉,最终 导致胶体分散相的聚沉。
A——溶剂的体积分数; B——溶质的体积分数。
这就是说,A、B两种物质的溶解度参数相等时,两者形 成理想溶液。一般情况下,要求:
δA-δB <1.7~2.0 (cal/cm3)1/2 若δA和δB相差太大,如超过2.0时.则会导致两者的互溶
许多学者都对沥青质的结构进行研究,其中 T.F.Yen所提出的“沥青质介晶结构”的观 点 为 大 多 数 人 所 接 受 。 XRD 2=26 存在 002峰,认为沥青质缔合体系有三个层次
1.1 沥青质的分子量
沥青质的 平均分子量随测定方法的不同, 条 件不同,测定值也不同。
(1) 谱法测分子量 ~1000
渣油中的分散相和分散介质都是复杂的混合物, 两相间各组分相互交叠。胶体分散体系的稳定 性是与体系中分散相和分散介质的相对含量及 二者的结构性质(例如芳香度、粘度、相对分 子量等)有密切关系。
胶体化学

13级物理化学 李驰
目
第一章 胶体简介
录
第二章 溶胶的制备和净化 第三章 溶胶的动力性质 第四章 溶胶的光学性质 第五章 溶胶的电学性质 第六章 溶胶的稳定性和聚沉作用
第一章 胶体简介
1.1胶体化学的产生
胶体化学的历史是从1861年 开始的,创始人是英国科学家格 雷姆(Thomas Graham),首先 提出晶体和胶体的概念,如溶胶、 凝胶、胶溶、渗析、离浆等。 1903年,德· 席格蒙迪 (Zsigmondy)发明了超显微镜, 肯定了溶胶的多相性,从而明确 了胶体化学是界面华学。 1907年,德· 奥斯特瓦尔德 (Ostwald)创办了第一个胶体化 学的专门刊物——《胶体化学和 工业杂志》,因而许多人把这一 年视为胶体化学正式成为独立学 科的一年。
第三章 溶胶的动力性质
动力性质主要指溶胶中粒子的不规则运动以及由 此而产生的扩散、渗透压以及重力场下浓度随高度的 分布平衡等性质。 布朗运动:溶胶粒子在各个方向上进行着的频繁 的无序的运动。
第四章 溶胶的光学性质
1.丁达尔效应: 光的散射 判别溶胶与溶液的最简单的 方法 2.乳化现象: 雷莱定律:I∝1/r4 AgI乳化:蓝光波长短,易于 散射,从侧面看呈蓝色。短波 长德光被散射,只剩下长波长 的红光,故透射光呈红色。
6.2溶胶的聚沉作用
1.概念:溶胶由于失去聚结稳定性进 而失去动力稳定性的整个过程。 2.主要因素:电动电位降低。
3.影响因素:电解质作用、带点符号 不同的溶胶的相互聚沉作用、电场作用。
The End
第四章 溶胶的光学性质
溶胶的光化学性质是其高度分散性和 不均匀性特点的反映。通过光学性质的研 究,不仅可以解释溶胶系统的一些光化学 现象,而且在观察胶体粒子的运动时,可 以研究它们的大小和形状以及应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
返回
二、溶胶的净化
在制备溶胶的过程中,常生成一些多余的电解质, 如制备 Fe(OH)3溶胶时生成的HCl。
少量电解质可以作为溶胶的稳定剂,但是过多的电
解质存在会使溶胶不稳定,容易聚沉,所以必须除去。 净化的方法主要有渗析法和超过滤法。
上一内容
下一内容
回主目录
上一内容 下一内容 回主目录
返回
1、溶胶的制备—分散法
超声分散法
上一内容
下一内容
回主目录
返回
1、溶胶的制备—分散法
(4)电弧法
电弧法主要用于制备金、 银、铂等金属溶胶。制备过程 包括先分散后凝聚两个过程。 将金属做成两个电极,浸在 水中,盛水的盘子放在冷浴中。 在水中加入少量NaOH 作为稳定 剂。 制备时在两电极上施加 100V 左右的直流电,调节电 极之间的距离,使之发生电火花,这时表面金属蒸发, 是分散过程,接着金属蒸气立即被水冷却而凝聚为胶粒。
亲液溶胶是热力学上稳定、可逆的体系。
上一内容
下一内容
回主目录
返回
三、胶粒的结构
例1:AgNO3 + KI→KNO3 + AgI↓ 过量的 KI 作稳定剂 胶团的结构表达式 : 胶团的图示式:
[(AgI)m n I – (n-x)K+]x– xK+
胶核
|________________________|
二、溶胶的净化
电渗析
上一内容
下一内容
回主目录
返回
二、溶胶的净化
(2)超过滤
上一内容
下一内容
回主目录
返回
第三节
溶胶的动力性质
• Brown 运动
• 胶粒的扩散
上一内容
下一内容
回主目录
返回
一、Brown运动(Brownian motion)
1、布朗运动定义
1827 年植物学家布朗(Brown)用显微镜观察到
尽快分散在含有胶溶剂的介质中,形成溶胶。
上一内容 下一内容 回主目录
返回
1、溶胶的制备—分散法
例如: Fe(OH)3(新鲜沉淀)
加FeCl3
Fe(OH)3 (溶胶)
AgCl (新鲜沉淀)
加AgNO 或KCl 3
AgCl(溶胶)
上一内容
下一内容
回主目录
返回
1、溶胶的制备—分散法
(3)超声分散法 这种方法目前只用来制备乳状液。 如图所示,将分散相和分散 介质两种不混溶的液体放在样品 管4中。样品管固定在变压器油 浴中。 在两个电极上通入高频电 流,使电极中间的石英片发生 机械振荡,使管中的两个液相 均匀地混合成乳状液。
胶粒(带负电) |________________________________| 胶团(电中性)
胶核 胶粒 胶团
上一内容
下一内容
回主目录
返回
三、胶粒的结构
例2:AgNO3 + KI→KNO3 + AgI↓ 过量的 AgNO3 作稳定剂 胶团的结构表达式: [(AgI)m n Ag+ (n-x)NO3–]x+ x NO3–
上一内容 下一内容 回主目录
返回
溶胶的制备--分散法
电弧法
上一内容
下一内容
回主目录
返回
2、溶胶的制备--凝聚法
(1)化学凝聚法
通过各种化学反应使生成物呈过饱和状态,使 初生成的难溶物微粒结合成胶粒,在少量稳定剂存 在下形成溶胶,这种稳定剂一般是某一过量的反应 物。例如:
A.复分解反应制硫化砷溶胶 2H3AsO3(稀)+ 3H2S →As2S3(溶胶)+6H2O B.水解反应制氢氧化铁溶胶 FeCl3 (稀)+3H2O (热)→ Fe(OH)3 (溶胶)+3HCl
上一内容 下一内容 回主目录
返回
2、溶胶的制备--凝聚法
C.氧化还原反应制备硫溶胶 2H2S(稀)+ SO2(g) → 2H2O +3S (溶胶)
D.离子反应制氯化银溶胶 AgNO3(稀)+ KCl(稀) → AgCl (溶胶) +KNO3
上一内容
-凝聚法
作为憎液溶胶基本质点的胶粒并非都是球形, 而胶粒的形状对胶体性质有重要影响。
质点为球形的,流动性较好;若为带状的,
则流动性较差,易产生触变现象。
上一内容
下一内容
回主目录
返回
四、胶粒的形状
例如:(1)聚苯乙烯胶乳是球形质点 (2) V2O5 溶胶是带状的质点 (3) Fe(OH)3 溶胶是丝状的质点
(3)热力学不稳定性
因为粒子小,比表面大,表面自由能高,是热力学不 稳定体系,有自发降低表面自由能的趋势,即小粒子会自 动聚结成大粒子。
上一内容 下一内容 回主目录
返回
3、按胶体溶液的稳定性分类
(2)亲液溶胶 半径落在胶体粒子范围内的大分子溶解在合适 的溶剂中,一旦将溶剂蒸发,大分子化合物凝聚,再 加入溶剂,又可形成溶胶.
上一内容
下一内容
回主目录
返回
1、溶胶的制备—分散法
盘式胶体磨
上一内容
下一内容
回主目录
返回
1、溶胶的制备—分散法
转速约每分钟1万-2万转。 A为空心转轴,与C盘相连, 向一个方向旋转,B盘向另一方 向旋转。 分散相、分散介质和稳定剂 从空心轴A处加入,从C盘与B盘的 狭缝中飞出,用两盘之间的切力 将固体粉碎,可得1000 nm左右的 粒子。
(2)物理凝聚法 A. 更换溶剂法
利用物质在不同溶剂中溶解度的显著差别来制
备溶胶,而且两种溶剂要能完全互溶。 例1.松香易溶于乙醇而难溶于水,将松香的乙醇溶
液滴入水中可制备松香的水溶胶 。
例2.将硫的丙酮溶液滴入90℃左右的热水中,丙酮
蒸发后,可得硫的水溶胶。
上一内容 下一内容 回主目录
返回
化学原理电子教案—第四章
上一内容
下一内容
回主目录
返回
第一节
胶体及其基本特性
一、分散相与分散介质 分散体系: 一种或几种 物质分散在另一种物质 中所构成的体系。 分散相(dispersed phase) :被分散的物质 分散介质(dispersing medium) :分散分散相 的物质。
上一内容 下一内容 回主目录
散体系的范围之内,并加入适当的稳定剂。制备方
法大致可分为两类: 分散法
凝聚法
上一内容
下一内容
回主目录
返回
1、溶胶的制备—分散法
(1)研磨法 用机械粉碎的方法将固体磨细。
这种方法适用于脆而易碎的物质,对于柔
韧性的物质必须先硬化后再粉碎。例如,将废 轮胎粉碎,先用液氮处理,硬化后再研磨。 胶体磨的形式很多,其分散能力因构造和 转速的不同而不同。
上一内容 下一内容 回主目录
返回
2、按分散相和介质聚集状态分类
(1)液溶胶 将液体作为分散介质所形成的溶胶。当分散 相为不同状态时,则形成不同的液溶胶: A.液-固溶胶 如油漆,AgI溶胶 如牛奶,石油原油等乳状液 如泡沫
回主目录
B.液-液溶胶
C.液-气溶胶
上一内容 下一内容
返回
2、按分散相和介质聚集状态分类
悬浮在液面上的花粉粉末不断地作不规则的运动。
后来又发现许多其它物质如煤、 化石、金属等
的粉末也都有类似的现象。
(2)固溶胶
将固体作为分散介质所形成的溶胶。当分散相为 不同状态时,则形成不同的固溶胶: A.固-固溶胶 如有色玻璃,不完全互溶的合金 B.固-液溶胶 如珍珠,某些宝石 C.固-气溶胶 如泡沫塑料,沸石分子筛
返回
上一内容
下一内容
回主目录
2、按分散相和介质聚集状态分类
(3)气溶胶 将气体作为分散介质所形成的溶胶。 当分散相为固体或液体时,形成气-固或气-液溶胶; 没有气-气溶胶,因为不同的气体混合后是单相均 一体系,不属于胶体范围.
(1)分子分散体系 分散相与分散介质以分子或离子形式彼此混溶, 没有界面,是均匀的单相,分子半径大小在10-9 m以 下 。通常把这种体系称为真溶液,如CuSO4溶液。 (2)胶体分散体系 分散相粒子的半径在1 nm~100 nm之间的体系。目 测是均匀的,但实际是多相不均匀体系。也有的将1 nm ~ 1000 nm之间的粒子归入胶体范畴。 (3)粗分散体系 当分散相粒子大于1000 nm,目测是混浊不均匀体 系,放置后会沉淀或分层,如黄河水。
化银溶胶等。 这是胶体分散体系中主要研究的内容。
上一内容 下一内容 回主目录
返回
憎液溶胶的特性
(1)特有的分散程度
粒子的大小在10-9~10-7 m之间,不能透过半透膜,渗透 压低但有较强的动力稳定性 和乳光现象。
(2)多相不均匀性
具有纳米级的粒子是由许多离子或分子聚结而成,结构 复杂,有的保持了该难溶盐的原有晶体结构,而且粒子大小 不一,与介质之间有明显的相界面,比表面很大。
A.气-固溶胶
B.气-液溶胶
上一内容 下一内容
如烟,含尘的空气
如雾,云
回主目录
返回
3、按胶体溶液的稳定性分类
(1)憎液溶胶
半径在1 nm~100 nm之间的难溶物固体粒子 分散在液体介质中,有很大的相界面,易聚沉,是
热力学上的不稳定体系。 一旦将介质蒸发掉,再加入介质就无法再形成
溶胶,是 一个不可逆体系,如氢氧化铁溶胶、碘
上一内容 下一内容 回主目录
返回
1、溶胶的制备—分散法
(2)胶溶法:将新鲜的凝聚胶粒重新分散在介质
中形成溶胶,并加入适当的稳定剂。
这种稳定剂又称胶溶剂。根据胶核所能吸附的离
子而选用合适的电解质作胶溶剂。
