铁的氧化物
铁的还原温度

铁的还原温度铁是一种常见的金属元素,其还原温度指的是将铁氧化物还原为纯铁的温度。
铁的还原温度取决于多种因素,包括氧化物的种类、还原剂的性质和温度等。
在本文中,将重点探讨铁的还原温度及其影响因素。
一、铁的氧化物种类及还原温度铁主要有两种常见氧化物,分别是二氧化铁(FeO2)和三氧化二铁(Fe2O3)。
二氧化铁的还原温度较低,约为700-900摄氏度;而三氧化二铁的还原温度较高,约为900-1100摄氏度。
这是因为三氧化二铁的晶格结构更加稳定,需要更高的能量才能将其还原为纯铁。
二、还原剂的性质对还原温度的影响还原剂是指能够给予电子或氢原子的物质,用于将金属氧化物还原为金属的过程。
常用的还原剂有碳、氢气和还原金属等。
不同的还原剂对铁的还原温度有不同的影响。
1. 碳:碳是一种常用的还原剂,常见于冶金和化学工业中。
在高温下,碳能够与铁氧化物反应生成一氧化碳(CO)或二氧化碳(CO2),从而将其还原为纯铁。
碳的还原温度较低,约为500-800摄氏度。
2. 氢气:氢气也是一种常用的还原剂,常见于氢气还原法制备金属粉末的工艺中。
氢气与铁氧化物反应生成水蒸气(H2O)或水(H2O),将其还原为纯铁。
氢气的还原温度较高,约为700-1000摄氏度。
3. 还原金属:还原金属是指具有较高还原能力的金属,如镁、铝等。
这些金属与铁氧化物反应生成金属氧化物和纯铁。
由于还原金属的还原能力较高,其还原温度通常较低,约为500-800摄氏度。
三、温度对还原反应的影响温度是影响还原反应速率和温度的重要因素。
一般来说,温度越高,反应速率越快。
在还原铁氧化物的过程中,提高温度可以增加反应的速率,降低还原温度。
这是因为高温下分子的热运动加剧,原子和分子之间的碰撞更加频繁,反应发生的可能性增加。
然而,过高的温度也会带来一些问题。
首先,高温会引起反应容器的腐蚀和变形,降低设备的寿命。
其次,高温可能导致反应副产物的生成,影响产品的纯度。
因此,在实际生产中,需要综合考虑经济性、设备性能和产品质量等因素,选择合适的还原温度。
《铁的氧化物》课件

总结
通过这份《铁的氧化物》PPT课件,您应该对铁的氧化物有了更深入的了解。继续学习和探索,掌握更多关于 这一化合物的知识,并将其应用于实际生活和工作中。
PPT课件的准备工作
在准备《铁的氧化物》PPT课件之前,需要深入研究该化合物的相关文献和资 料。收集图像、实验数据和应用案例以支持您的演示。
PPT课件的内容结构
1
定义
介绍铁的氧化物的化学结构和组成物的物理和化学性质。
3
应用
介绍铁的氧化物在工业和日常生活中的广泛应用。
PPT课件的设计要点
简洁明了
避免文字过多,重点突出, 使用清晰简明的语言。
图文并茂
使用有吸引力的图片和图表 来支持文本内容,增强可视 化效果。
配色协调
选择适合主题的配色方案, 确保整体设计效果协调统一。
PPT课件的演示技巧
• 保持流畅性:掌握自己的演讲节奏,避免结构混乱。 • 与观众互动:提问、游戏或小测验等互动形式,加强观众参与感。 • 重点强调:使用放大、高亮等手段来强调重要信息,引起观众的注意。
《铁的氧化物》PPT课件
介绍《铁的氧化物》PPT课件
本课件旨在介绍《铁的氧化物》的基本概念、性质和应用。通过清晰的结构 和生动的图像,让您深入了解这一重要的化学化合物。
PPT课件的目的
本PPT课件的目的是提供对《铁的氧化物》的全面理解。通过丰富的内容和互动元素,激发观众的兴趣,加深 对该化合物的记忆和理解。
铁的氧化物

铁的氧化物铁氧化物是指铁的氧化物,它包括氧化亚铁(FeO)、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。
Fe2O3氧化铁别名:三氧化二铁、铁红(铁锈主要成分)、铁丹物理性质相对分子质量:160相对密度(水=1):5.24熔点:1565℃存在形式:矿物:赤铁矿、赭石一般性状:红棕色粉末溶解性:不溶于水,溶于酸。
化学性质:与酸反应生成三价铁(棕黄色)和水。
是碱性氧化物。
制法在空气中灼烧亚铁化合物或氢氧化铁等可得三氧化二铁。
用途1. 其红棕色粉末为一种低级颜料,工业上称氧化铁红,用于油漆、油墨、橡胶等工业中2. 可做催化剂3. 玻璃、宝石、金属的抛光剂4.用于和CO反应炼制生铁(H2也可) Fe2O3+3CO=2Fe+3CO2(高温) Fe2O3+3H2=2Fe+3H2O(高温) 2Fe2O3+3C=4Fe+3CO2(气)(高温) Fe3O4+8Al==(高温)4Al2O3+3FeFeO(ferricoxide)氧化亚铁相对分子质量:72(71.85)物理性质:密度5.7克/cm。
存在形式:黑色(粉末)固体化学性质:与酸反应生成二价铁和水,不稳定,在空气中加热时迅速被氧化成四氧化三铁,溶于盐酸、稀硫酸生成亚铁盐。
不溶于水,不与水反应。
反应的离子方程式为:FeO + 2H+ =Fe2+ +H2O 制法:在隔绝空气条件下加热草酸亚铁制得:FeC2O4=FeO+CO+CO2Fe3O4(Fe2O3·FeO)四氧化三铁ferroferric oxide化学式:Fe3O4分子量:231.54别名:磁性氧化铁、氧化铁黑、磁铁、磁石、吸铁石矿物:磁铁矿一般性状:具有磁性的黑色晶体密度:5.18g/cm熔点:1867.5K(1594.5℃)因它具磁性又名磁性氧化铁。
难溶于水,溶于酸(Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O),不溶于碱,也不溶于乙醇、乙醚等有机溶剂。
但是天然的Fe3O4不溶于酸。
确定铁的氧化物组成的基本方法

确定铁的氧化物组成的基本方法确定铁的氧化物组成的基本方法主要有以下两种:
1.化学分析法:通过测定铁的氧化物样品中铁和氧的含量来确定铁的氧化物组成。
可以使用化学滴定法、分光光度法、原子吸收光谱法等手段,这些方法能够给出相对准确的结果,但需要较为精密的实验设备和操作技巧。
2.物理分析法:利用物理性质如颜色、密度、磁性、导电性等来推断铁的氧化物
组成。
例如,FeO是黑色粉末,密度为5.7,不导电,而Fe₂O₃是红棕色粉末,密度为5.24,可以导电。
因此,通过观察和测量这些物理性质,可以初步推断出铁的氧化
物组成。
此方法相对简单,但对于混合物或者不同结晶状况的同一种氧化物可能会有误判。
以上信息仅供参考,如需了解更多信息,建议查阅相关文献或咨询专业人士。
铁的氧化物

想一想:
为了能较长时间观察到Fe(OH)2白色沉淀的生 成,请提出改进方案。
反应物: 1. 用新配置的FeSO4溶液 2. 用不含 O2 的蒸馏水配制的 NaOH 溶 液 (除去蒸馏水中溶解的O2常采用煮沸的方法) 反应环境: (1)生成白色Fe(OH)2沉淀的操作可采用长滴管 吸取不含 O2的 NaOH溶液 , 插入 FeSO4溶液液面下 ,再挤出NaOH溶液。 (2)用植物油将反应体系与空气隔离.
结 论
明矾和硫酸铁溶液可以和悬浮于水中 的泥沙形成絮状不溶物沉降下来,使 水澄清,可用做净水剂
【本讲小结】
1.铁的三种氧化物 2.铁的两种氢氧化物的制备和性质 3. Fe2+和Fe3+在一定条件下相互转化
总结:
Fe2+ 还原剂
+氧化剂(Cl2) +还原剂(Fe)
Fe3+ 氧化剂
4.掌握Fe3+的检验方法:Fe3+遇SCN-显红色。
4、下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶
ቤተ መጻሕፍቲ ባይዱ
液没有颜色变化,再加氯水呈红色的是( √ FeO A.
B. Fe2O3 C. FeCl3
)
√ FeSO4 D.
5、为了防止试剂变质,配制FeSO4溶液时,还要加入 ( )
A. 加入Cu
B. 通入Cl2
C. √ 加入Fe 粉
D. 加入KSCN
6、要除去FeCl2溶液中的少量FeCl3,可行的办法 是( ) A. 滴入KSCN溶液 B. 通入氯气 C. 加入铜粉 D. 加入铁粉 √
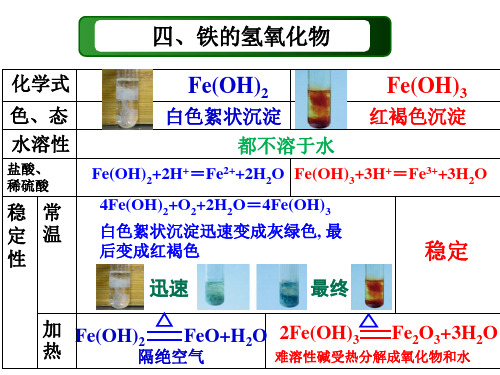
Fe(OH)2+2HCl=FeCl2+2H2O
② 有还原性,易被空气中的氧气氧化 4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁的氧化物及氢氧化物

生成Fe3O4
3Fe+4H2O(g) 〓 Fe3O4+4H2
Fe2O3
Fe3O4
Fe2O3
FeSO4
Fe3O4
铁元素在自然界的存在形态: 磁铁矿
Fe2O3
Fe3O4
一、铁的氧化物 名 称 氧化亚铁 氧化铁 四氧化三铁 俗 称 铁 红 磁性氧化铁 化学式 FeO Fe2O3 Fe3O4 色 态 黑色 粉末 红棕色粉末 黑色晶体 +2 +3 + 2,+ 3 化合价 不 溶 不 溶 水溶性 不 溶 碱性氧化物 类 型 共 与酸 都能与酸反应。如 Fe O 6 H 2 Fe 3H O
热稳定性差
请写出Fe(OH)3受热分解的化学方程式 2Fe(OH)3 Fe2O3+3H2O
Fe(OH)2受热分解能生成FeO吗? 情况复杂,不要求
练习
用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸 馏水配制的NaOH溶液反应制备。 ( 1 )用硫酸亚铁晶体配制上述 FeSO4 溶液时还需 加入 。 (2 )除去蒸馏水中溶解的 O2常采用 的方 法。 ( 3 )生成白色 Fe(OH)2 沉淀的操作是用长滴管吸 取不含O2的NaOH溶液,插入FeSO4溶液液面下,再 挤 出 NaOH 溶 液 。 这 样 操 作 的 理 由 是 。
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)3
常温较稳定, 空气中久置会 部分失水成铁锈, 受热易分解
2Fe(OH)3=Fe2O3+3H2O
稳性
+= 与盐酸反 Fe(OH) +2H+= Fe(OH) +3H 2 3 应 Fe2++2H2O Fe3++3H2O
铁氧化物MSDS

铁氧化物MSDS
1. 化学性质
铁氧化物为黑色结晶性粉末,它是由氧和铁离子组成的化合物。
化学上可表示为Fe2O3。
2. 物理性质
- 外观:黑色结晶性粉末
- 沸点:不适用
- 熔点:1565℃
- 密度:5.24 g/cm³
- 溶解性:不溶于水和有机溶剂
3. 安全信息
铁氧化物不属于危险品,正常使用下是相对安全的。
然而,以
下是需要关注的安全注意事项:
- 吸入:避免吸入铁氧化物粉末,使用时应佩戴合适的呼吸防护装备。
- 接触皮肤:长期接触可能导致皮肤干燥和刺激,应避免直接接触。
- 眼睛接触:接触铁氧化物时,应立即用大量清水冲洗眼睛,如有需要,就医检查。
- 食入:避免误食铁氧化物粉末,如有需要,立即求助医师。
4. 操作和储存
- 操作时应佩戴适当的个人防护设备,包括手套和防护眼镜。
- 铁氧化物应储存在干燥的环境中,远离火源和明火。
- 避免与氧化剂、酸类和还原剂等物质接触,以免产生危险反应。
5. 应急措施
- 紧急处理时应戴上个人防护装备,避免直接接触铁氧化物。
- 如有大量泄漏或风险,应迅速通知相关部门并进行适当的清理和处置。
本文提供的是一般的铁氧化物MSDS信息,只为参考。
在使用或处理该化合物时,请参考准确和最新的MSDS表,以确保安全操作。
以上是关于铁氧化物的MSDS文档,希望对您有所帮助。
参考文献:。
铁的氧化物、铁盐、亚铁盐
水且不溶 于水
②在FeSO4溶液上方加少量植物油或苯液封,隔绝空气
③在亚铁盐溶液上方充入保护气,如H2、N2、稀有气体等 创造无氧环境
实验室制备Fe(OH)2装置的改进
吸有NaOH溶液的长胶头滴管插到液面 以下,并在液面上覆盖一层苯或煤油 (不能用CCl4),以防止空气与Fe(OH)2 接触发生反应,如图1所示
五、铁盐、亚铁盐
Fe2+
Fe3+
溶液颜色
浅绿色
棕黄色或黄色
氧化还原性 氧化性和还原性(主)
氧化性(主)
与碱 NaOH Fe2++2OH_=Fe(OH)2 ↓ Fe3++3OH-=Fe(OH)3↓
反应 氨水 Fe2+ +2NH3·H2O=
Fe3+ +3NH3·H2O=
Fe(OH)2↓+2NH4+
Fe(OH)3↓+3NH4+
K3[Fe(CN)6] 3Fe2+ +2 [Fe(CN)6]3 ¯=Fe3[Fe(CN)6]2↓ 蓝色沉淀 ——
KMnO4
5Fe2+ +MnO4-+8H+=5Fe3++Mn2++4H2O 溶液紫红色褪去 有Cl¯不能用此法
——
淀粉KI试纸 —— 、通H2S 加铜粉
2Fe3+ +2I- =I2+2Fe2+ (试纸变蓝) —— 产生淡黄色沉淀 铜溶解,溶液变为蓝绿色
K3[Fe(CN)6] 铁氰化钾aq
KSCN溶液 硫氰化钾
赤血盐、六氰合铁酸钾 蓝色沉淀 3Fe2+ +2 [Fe(CN)6]3 ¯=Fe3[Fe(CN)6]2↓
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
名 称 化学式 颜色状态 俗 名 氧化亚铁 FeO 黑色粉末 氧化铁 Fe2O3 红棕色粉末 铁红 四氧化三铁 Fe3O4 黑色晶体
氧化铁可作外墙涂料
1、铁的氧化物
名 称 化学式 颜色状态 俗 名 化合价 溶解性 与酸反应
FeO+2HCl= FeCl2 + H2O
氧化亚铁 FeO 黑色粉末
Fe3+
科学探究: 科学探究:铝盐和铁盐的净水作用
不加试剂 加入明矾 有明显沉降溶 液半透明 加入硫酸 铁溶液 有明显沉降 溶液半透明
2min 无明显变化 浑浊 略有沉降
5min 结和硫酸铁溶液可以和悬浮于水中的泥 沙形成絮状不溶物沉降下来,使水澄清, 沙形成絮状不溶物沉降下来,使水澄清, 可用做净水剂 可用做净水剂
氧化铁 Fe2O3 红棕色粉末 铁红
四氧化三铁 Fe3O4 黑色晶体 磁性氧化铁
+2
+3
均不溶于水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
+2 、+3
Fe3O4+8HCl= 2FeCl3 + FeCl2 + 4H2O
红褐色 Fe(OH)3
Fe(OH)2转变过程
Fe
Fe2+
还原剂(Fe) 还原剂
