7.1化学反应速率 习题
高三化学练习题:化学反应速率

高三化学练习题:化学反应速率
一、单选题
1. 关于化学反应速率,以下哪个说法是正确的?
a) 反应速率越快,反应物浓度越高
b) 反应速率越慢,反应物浓度越高
c) 反应速率与反应物浓度无关
d) 反应速率与反应物浓度成反比
2. 以下哪个因素不会影响化学反应速率?
a) 温度
b) 压力
c) 光照强度
d) 催化剂
3. 哪个选项最准确地描述了催化剂在化学反应中的作用?
a) 增加反应物浓度
b) 降低反应的活化能
c) 提高反应物的反应性
d) 增加反应的产物收率
二、解答题
1. 化学反应速率的单位是什么?请列举一个常见的单位并解释其含义。
2. 请解释为什么在同等条件下,温度升高可以加快化学反应速率。
3. 简要描述催化剂在化学反应中的作用机制。
三、实验题
1. 根据以下实验现象,判断反应速率变化的原因并提出可能的解释:
实验一:用块状氢氧化钠与稀硫酸反应产生气体,反应速率很快。
实验二:用粉末状氢氧化钠与稀硫酸反应产生气体,反应速率较慢。
2. 设计一个简单的实验,以观察温度对化学反应速率的影响,并记录实验结果。
注意:在回答解答题和实验题时,请用自己的语言进行回答,不要从互联网上
直接复制粘贴答案。
以上就是高三化学练习题:化学反应速率的内容。
希望能为学生们的化学学习
提供一些帮助和思路。
祝你学习进步!。
化学反应速率和限度习题(附答案)

化学反应速率和限度习题基础巩固1.在2升的密闭容器中,发生以下反应:2A(g)+ B(g) 2C(g)+D(g) 。
若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是 ( )。
A. 1.6 molB. 2.8 molC. 2.4 molD. 1.2 mol2.在一定条件下,向1L密闭容器中加入2 mol N2和10molH2,发生反应N2+3H22NH3,2分钟末时,测得剩余氮气为1mol,下列有关该反应的反应速率的描述中不正确的是()。
A.υ(N2)= 0.5 mol/(L·min) B.υ(H2)= 1.5 mol/(L·min)C.υ(NH3)= 2 mol/(L·min) D.υ(N2)=1mol/(L·min)3.在2A+B 3C+5D反应中,表示该反应速率最快的是()。
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)4.在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L·s),则2s末NH3的浓度为()。
A.0.50mol/L B.0.60mol/LC.0.45mol/L D.0.55mol/L5.将0.5molPCl5充入体积为1L的密闭容器中,发生反应PCl5 PCl3+Cl2,一段时间后测得PCl5的浓度为0.3mol/L,且这段时间内的平均反应速率υ(PCl5)= 0.4 mol/(L·min),则这段时间为()。
A.B.C.D.6.下列情况下,反应速率相同的是()。
A.等体积0.1 mol/L HCl和0.1 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应C.等体积等浓度HCl和HNO3分别与等质量的Na2CO3粉末反应D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应7.硫代硫酸钠(Na2S2O3)与稀H2SO4溶液时发生如下反应:Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O 下列反应速率最大的是()。
化学竞赛习题及解析:化学反应速率
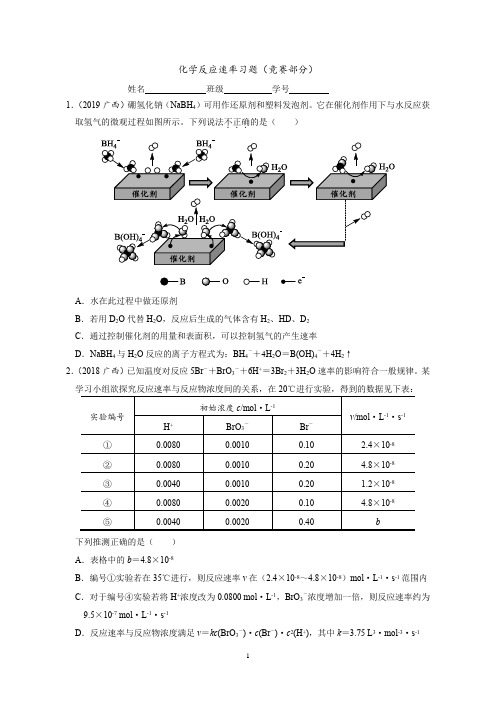
化学反应速率习题(竞赛部分)姓名班级学号1.(2019广西)硼氢化钠(NaBH4)可用作还原剂和塑料发泡剂。
它在催化剂作用下与水反应获取氢气的微观过程如图所示。
下列说法不.正确..的是()A.水在此过程中做还原剂B.若用D2O代替H2O,反应后生成的气体含有H2、HD、D2C.通过控制催化剂的用量和表面积,可以控制氢气的产生速率D.NaBH4与H2O反应的离子方程式为:BH4-+4H2O=B(OH)4-+4H2↑2.(2018广西)已知温度对反应5Br-+BrO3-+6H+=3Br2+3H2O速率的影响符合一般规律。
某学习小组欲探究反应速率与反应物浓度间的关系,在20℃进行实验,得到的数据见下表:下列推测正确的是()A.表格中的b=4.8×10-8B.编号①实验若在35℃进行,则反应速率v在(2.4×10-8~4.8×10-8)mol·L-1·s-1范围内C.对于编号④实验若将H+浓度改为0.0800 mol·L-1,BrO3-浓度增加一倍,则反应速率约为9.5×10-7 mol·L-1·s-1D.反应速率与反应物浓度满足v=kc(BrO3-)·c(Br-)·c2(H+),其中k=3.75 L3·mol-3·s-13.(2018湖北)某探究小组利用丙酮的溴代反应(CH3COCH3+Br3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。
反应速率v(Br2)通过测定溴的颜色消失所需要的时间来确定。
在一定温度下,获得如下实验数据。
分析实验数据所得出的结论错误的是()A.增大c(Br2),v(Br2)增大B.实验②和③的v(Br2)相等C.增大c(CH3COCH3),v(Br2)增大D.增大c(HCl),v(Br2)增大4.一定温度下,按下式发生分解反应:N2O52(g)+1/2O2(g)。
化学反应工程1_7章部分答案

第一章绪论习题1.1 解题思路:(1)可直接由式(1.7)求得其反应的选择性(2)设进入反应器的原料量为100 ,并利用进入原料气比例,求出反应器的进料组成(甲醇、空气、水),如下表:组分摩尔分率摩尔数根据式(1.3)和式(1.5)可得反应器出口甲醇、甲醛和二氧化碳的摩尔数、和。
并根据反应的化学计量式求出水、氧及氮的摩尔数,即可计算出反应器出口气体的组成。
习题答案:(1) 反应选择性(2) 反应器出口气体组成:第二章反应动力学基础习题2.1 解题思路:利用反应时间与组分的浓度变化数据,先作出的关系曲线,用镜面法求得反应时间下的切线,即为水解速率,切线的斜率α。
再由求得水解速率。
习题答案:水解速率习题2.3 解题思路利用式(2.10)及式(2.27)可求得问题的解。
注意题中所给比表面的单位应换算成。
利用下列各式即可求得反应速率常数值。
习题答案:(1)反应体积为基准(2)反应相界面积为基准(3)分压表示物系组成(4)摩尔浓度表示物系组成习题2.9 解题思路:是个平行反应,反应物A的消耗速率为两反应速率之和,即利用式(2.6)积分就可求出反应时间。
习题答案:反应时间习题2.11 解题思路:(1)恒容过程,将反应式简化为:用下式描述其反应速率方程:设为理想气体,首先求出反应物A的初始浓度,然后再计算反应物A的消耗速率亚硝酸乙酯的分解速率即是反应物A的消耗速率,利用化学计量式即可求得乙醇的生成速率。
(2)恒压过程,由于反应前后摩尔数有变化,是个变容过程,由式(2.49)可求得总摩尔数的变化。
这里反应物是纯A,故有:由式(2.52)可求得反应物A的瞬时浓度,进一步可求得反应物的消耗速率由化学计量关系求出乙醇的生成速率。
习题答案:(1)亚硝酸乙酯的分解速率乙醇的生成速率(2)乙醇的生成速率第三章釜式反应器习题3.1 解题思路:(1)首先要确定1级反应的速率方程式,然后利用式(3.8)即可求得反应时间。
(2)理解间歇反应器的反应时间取决于反应状态,即反应物初始浓度、反应温度和转化率,与反应器的体积大小无关习题答案:(1)反应时间t=169.6min.(2)因间歇反应器的反应时间与反应器的体积无关,故反应时间仍为169.6min.习题3.5 解题思路:(1)因为B过量,与速率常数k 合并成,故速率式变为对于恒容过程,反应物A和产物C的速率式可用式(2.6)的形式表示。
物理化学(王海荣主编)第七章化学动力学解答

上一内容 下一内容 回主目录
返回
2019/8/24
(4)有效碰撞的概率P(probability factor)
(1)从理论计算认为分子已被活化,但由于有 的分子只有在某一方向相撞才有效;
(2)有的分子从相撞到反应中间有一个能量传
递过程,若这时又与另外的分子相撞而失去能量,
则反应仍不会发生;
反应的速率由活化络合物转化成产物的速率决定。
上一内容 下一内容 回主目录
返回
2019/8/24
过渡态理论
图6.3 过渡状态理论和活化能示意图
上一内容 下一内容 回主目录
返回
2019/8/24
过渡态理论
活化络合物所具有的能量和反应物分子平均能量之差即 为反应活化能。
活化络合物不稳定 ,化学键会断裂,可能 生成产物使反应向正方 向进行,也可能生成反 应物向逆向进行。
(2)有效碰撞的能量因子
分子互碰并不是每次都发生反应,只有相 对平动能在连心线上的分量大于阈能的碰撞才 是有效的,所以绝大部分的碰撞是无效的。
要在碰撞频率项上乘以有效碰撞分数q。
q exp( Ec ) 或q exp( Ea )
RT
RT
上一内容 下一内容 回主目录
返回
2019/8/24
上一内容 下一内容 回主目录
返回
2019/8/24
有效碰撞
运动着的A分子和B分子,两者质心的投影落
在直径为 d AB 的圆截面之内,都有可能发生碰撞。
d AB称为有效碰撞直径。
d AB
BA
分子间的碰撞和有效直径
上一内容 下一内容 回主目录
返回
2019/8/24
(1)有效碰撞的碰撞频率
化学反应速率

实例: 放射性元素蜕变
t1
分子内部的重排反应及异构化反应
例:反应2N2O5 (g)→4NO2(g) + O2(g)服从速率方程式v = k c(N2O5)。设某温度时k = l.68×10-2s-1,如在一个 5.00L的容器中放入2.50molN2O5,在该温度下反应进 行1.00min,问N2O5的剩余量及O2的生成量各为多少?
1 2
O2
(
g)
H
2O (l )
rGm 285.838kJ .mol 1
2NO(g) N2O4 (g)
rGm 5.4kJ .mol 1
7.1 化学反应速率 及其表示方法
7.1.1 化学反应速率 7.1.2 反应的平均速率和瞬时速率
快!
炸药的爆炸、水溶液中的酸碱反应、感光 反应等瞬间即可完成。
(2)复合反应
由两个或多个元反应步骤完成的反应: 如, H2(g) + I2(g) =2HI(g) 实际是两步完成 I2(g) = I(g) + I(g)
H2(g) + I (g) + I(g) = HI(g) + HI(g) 通过实验可以找出速率控制步骤 A2+B → A2B A2→ 2A Slow reaction
化学反应速率
本章教学要求
1. 初步了解化学反应速率、速率方程、碰撞理论和活 化能概念;
2. 理解并会用浓度、温度、催化剂诸因素解释其对化 学反应速率的影响;
3. 初步掌握阿仑尼乌斯公式的应用,会用其求算活化 能及某温度下的反应速率;
4. 理解反应分子数和反应级数的概念,会进行基元反 应有关的简单计算;
反应 2W+X Y+Z 哪种速率表达式是正确的?
第7章 化学反应速率
§7.3 反应级数
• 速率方程式里浓度的方次叫作反应的级数。要正确写出速率 方程式表示浓度与反应速率的关系,必须由实验测定速率常 数和反应级数。 • 化学反应按反应级数可以分为一级、二级、三级以及零级反 应等。 各级反应都有特定的浓度-时间关系。确定反应级数 是研究反应速率的首要问题。
上述反应对反应物CO来说是1级反应,对反应物NO2 来说也 是1级反应,总反应为1+1=2级反应。
Question 1
反应速率表达式
反应 2W+X → Y+Z 哪种速率表达式是正确的?
a. b. c.√ d.
dc ( X ) dc (Y ) dt dt dc ( X ) dc (W ) dt dt dc ( Z ) dc (Y ) dt dt dc ( Z ) dc (W ) dt dt
d(H2O2) v=- = k (H2O2) dt k:反应速率常数,也叫比速常数,可看作浓度为1 moldm-3 时 的反应速率。k 不随浓度而变,但受温度的影响,通常温度升 高, k 增大。
例 :CO(g) + NO2(g) CO2(g) + NO(g) 反应物的浓度与初速率
甲 组 乙 组 丙 组
-
2.50103 8 60 =lg (0.40) 2.30 (C H Cl) = 0.12 mol· dm-3
2 5
k t 2.303
= - 0.92
② ③
0.010 2.50 103 t lg 3 min=25 h t =1.5 × 10 0.40 2.30 0.693 0.693 t1 / 2 3 =277 min =4.62 h k 2.50 10
2NOg O2 g 2NO2 g
化学反应速率练习题及
化学反应速率练习题及答案解析一、选择题1. (C) 分子碰撞频率增加,碰撞能量增加,有效碰撞频率增加。
2. (D) 移除产品,改变反应物浓度,改变温度。
3. (A) 温度升高。
4. (D) 活化能较高的反应物浓度增加,活化能较低的反应物浓度减少。
二、解答题1. 反应速率的表达式:r = k[A]m[B]n其中,r为反应速率;[A]和[B]分别为反应物A和B的浓度;k为速率常数;m和n为反应物A和B的反应级数。
2. a) 反应速率与浓度之间的关系可通过一级反应速率方程(r = k[A])进行解释。
当反应物浓度[A]增加时,反应速率也会随之增加。
当反应物浓度[A]减少时,反应速率也会随之减少。
b) 反应速率与温度之间的关系可通过阿伦尼乌斯方程进行解释。
阿伦尼乌斯方程:k = A * e^(-Ea/RT)其中,k为速率常数,A为阿伦尼乌斯因子,Ea为反应的活化能,R为气体常数,T为温度。
当温度T增加时,e^(-Ea/RT)的值增加,导致速率常数k增加,反应速率也会随之增加。
当温度T减少时,e^(-Ea/RT)的值减少,导致速率常数k减少,反应速率也会随之减少。
3. 反应速率与表面积之间的关系可通过催化剂的作用进行解释。
催化剂可以提高反应速率,其中一个重要原因是催化剂能够增大反应物的有效碰撞频率。
催化剂通常是以固体颗粒的形式存在,增大了反应物的表面积,使得更多的反应物分子处于活性位点上,增加了反应物之间的碰撞几率,也提高了反应速率。
4. 反应速率与反应物浓度之间的关系可通过比较反应级数进行解释。
若反应物浓度与反应速率的关系为一次方关系(m = 1),则反应级数为一级反应。
若反应物浓度与反应速率的关系为二次方关系(m = 2),则反应级数为二级反应。
若反应物浓度与反应速率的关系为三次方关系(m = 3),则反应级数为三级反应。
根据反应级数的不同,可以判断反应速率与反应物浓度的关系。
5. 反应速率与活化能之间的关系可通过阿伦尼乌斯方程进行解释。
3-5章 化学反应速率
2.3038.314 298328
Ea 102.6kJ / mol
阿仑尼乌斯公式的对数式 lnk=lnA-Ea/RT 将328K的数据代入
ln1.5103 ln A 102.6103 8.314 328
得A=3.83×1013s-1
4、解:
lg k 2 Ea (T2 T1 )
k1 2.303R T2T1
k2 1.2 k1
增加20%
第四章 化学平衡
一、选择题
1.D 2.B 3.C 4.D 5.D 二、填空题
1. 减小 增大 2. 逆反应方向 无法判断
3. 4△rGmθ(3)—2△rGmθ(2)—2△rGmθ(1)
(K3θ )4 (K1θ )2 (K 2θ )2
4. 4 逆反应 100 逆反应
1.解:平衡时
θ sp
4.99 109
8、解: 混合后 c(Mn2+)=100×0.20/200=0.10mol/dm3
c(NH3·H2O)=0.01/2=0.005mol/dm3 若不产生Mn(OH)2,
ceq (OH )
Kθ sp
ceq (Mn 2 )/cθ
1.9 1013 1.38 106 0.10
Kθ b
7、解: CaCO3 ΔfGmθ -1128.8
(KJ·mol-1)
= Ca 2+ -553.54
+ CO32-527.9
ΔrGmθ=-527.9+(-553.54)-(-1128.8) =47.36kJ/mol
ΔrGmθ=-RTlnKspθ 47.36×103=-8.314×298lnKθsp
K
lg k 2 80 103 ( 30 20 )
反应速率 化学平衡 题目
4.丙酮和碘在酸性溶液中发生如下反应: CH3COCH3+I2→CH3COCH2I+H++I-
25℃时,该反应的速率由下式决定:v=k[CH3COCH3][H+] 上述中,k=2.73×10-5L/(mol·s), • 试推测开始时反应速率和反应后期反应速率的变化情况? • 已知开始时c(I2)=0.01mol/L,c(CH3COCH)=0.1mol/L,c(H+)=
平衡时,B的物质的量 (选填一个编号)
(甲)大于2 mol (乙)等于2 mol
(丙)小于2 mol (丁)可能大于、等于或小于2mol
作出此判断的理由是
。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的
量分数是
。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器
右图是一透热性能很好的坚固容器,活塞C可左右移动。其总体积 为44.8L,现将400℃、300大气压的氢气33.6L和400℃、300大气压的 氮气11.2 L充入容器中,当两者反应达到动态平衡时,若保持混合气体 的压强仍为400℃和300大气压,求:
(1)容器是向外界放热,还是吸热? (2)试计算充入容器中氮气质量是多少克? (3)活塞C要向左倒移动的距离与容器全长之比是多大?
C.3-4-2-1
D.1-2-4-3
7.在溶液中,反应A+2B C分别在三种不同实验条件下进行,
它们的起始浓度均为c( A) 0.100mol / L c(B) 0.200mol / L
c(C) 0mol / L 。反应物A的浓度随时间的变化如下图所示。
8.合成氨工业用氢和氮在催化剂作用下直接合成,下表表示在一 定温度和压强作用下达到动态平衡时氨的含量。达到平衡时混合气 中氨的含量(体积百分比)(氮气和氢气的体积比是1︰3)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 第一节一、选择题1.(2010·海南高考)对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )A .v (W)=3v (Z)B .2v (X)=3v (Z)C .2v (X)=v (Y)D .3v (W)=2v (X)解析:用不同物质表示同一反应的反应速率时,其速率值之比等于其化学计量数之比,C 正确。
答案:C2.对于反应N 2+O 2 2NO ,在密闭容器中进行,下列条件中能使该反应的逆反应速率加快的是( )A .缩小体积使压强增大B .压强不变充入He 使体积增大C .体积不变充入He 使压强增大D .压强不变充入N 2使体积增大解析:压强增大,正、逆反应速率均增大,A 项正确;B 项压强不变,体积增大导致反应体系中物质的浓度减小,正、逆反应速率减小;C 项对反应体系中物质的浓度无影响,反应速率不变;D 项使c (NO)减小,逆反应速率减小。
答案:A3.下列关于催化剂的说法不正确的是( ) A .温度越高,催化剂的催化效果越好B .汽车排气管上的“催化转化器”能减少有害气体排放C .催化剂可以改变化学反应速率,但反应前后质量和化学性质不变D .锌与盐酸反应时,加入几滴硫酸铜溶液可加快反应速率,但硫酸铜不作催化剂 解析:某些催化剂会因温度过高而失去活性,即失去催化作用,故催化剂不是温度越高催化效果越好。
答案:A4.高温、催化剂条件下,某反应达到平衡,平衡常数K =c (CO )·c (H 2O )c (CO 2)·c (H 2)。
恒容时,温度升高,H 2浓度减小。
下列说法正确的是( )A .该反应的焓变为正值B .恒温恒容下,增大压强,H 2浓度一定减小C .升高温度,逆反应速率减小D .该反应的化学方程式为CO +H 2O 催化剂高温CO 2+H 2解析:因为该可逆反应的化学平衡常数K =c (CO )·c (H 2O )c (CO 2)·c (H 2),可得出该反应的化学方程式为CO 2(g)+H 2(g) 催化剂高温CO(g)+H 2O(g),D 项错误;由于恒容时,温度升高,氢气浓度减小,说明平衡向正反应方向移动,故正反应为吸热反应,即焓变为正值,A 项正确;该反应为反应前后气体分子数不变的反应,恒温恒容下,如充入惰性气体使压强增大,H 2浓度不变,B 项错误;升高温度,正、逆反应速率都增大,C 项错误。
答案:A5.(2012·济南检测)如图曲线a 表示放热反应X(g)+Y(g) Z(g)+M(g)+N(s)进行过程中X 的转化率随时间变化的关系,若要改变起始条件,使反应过程按b 曲线进行,可采取的措施是( )A .升高温度B .加大X 的投入量C .加催化剂D .增大体积解析:由图可知,a 、b 两曲线表示的反应中X 的转化率不变,但b 的反应速率比a 的反应速率快。
升高温度,平衡左移,X 的转化率减小,A 不正确;加大X 的投入量,X 的转化率减小,B 不正确;加催化剂能加快反应速率,但平衡不移动,X 的转化率不变,C 正确;增大体积,反应速率减小,D 不正确。
答案:C6.(2011·菏泽统考)合成氨反应:N 2(g)+3H 2(g) 2NH 3(g) ΔH =-92.4 kJ·mol -1,在反应过程中,正反应速率的变化如下图:下列说法正确的是( ) A .t 1时升高了温度 B .t 2时使用了催化剂 C .t 3时增大了压强D .t 4时降低了温度解析:升温正逆反应速率同时升高,但由于该反应是放热反应,平衡向左移动,达到新的平衡之前,正反应速率应增大,A 不对;加压,正逆反应速率同时增加,C 不对;降温,正逆反应速率瞬间即降低,D不对。
答案:B7.(2012·烟台模拟)在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列叙述中正确的是()A.反应的化学方程式为2M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率D.t1时,N的浓度是M浓度的2倍解析:由图象可知,达到平衡时,M变化的物质的量为3 mol,N变化的物质的量为5 mol,故反应的化学方程式为3M 5N,A错;t2时,M、N的物质的量相等,但正逆反应速率不相等,没有达到平衡,B错;t3时,反应达到平衡,正反应速率等于逆反应速率,C错;同一个容器中,t1时,N的物质的量是M物质的量的2倍,浓度也是M浓度的2倍,D正确。
答案:D8.(2012·厦门质检)合成氨工业对国民经济和社会发展具有重要的意义。
对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),673 K、30 MPa下,n(NH3)和n(H2)随时间t变化的关系示意图如图所示。
下列叙述中正确的是()A.c点处正反应速率和逆反应速率相等B.a点处正反应速率比b点处的大C.d点(t1时刻)和e点(t2时刻)处n(N2)不同D.t2点时刻,正反应速率大于逆反应速率解析:图象中c点尚未建立平衡,反应继续向生成NH3的方向进行,正反应速率大于逆反应速率,A项错误;反应物H2的浓度a点大于b点,反应物的浓度越大,正反应速率越大,B项正确;d、e两点为同一平衡状态,N2的物质的量相等,不再随时间的变化而改变,此时正、逆反应速率相等,因此C、D错误。
答案:B二、非选择题9.一定温度下,在2 L 的密闭容器中,X 、Y 、Z 三种气体的量随时间变化的曲线如下图所示:(1)从反应开始到10 s 时,用Z 表示的反应速率为________,X 的物质的量浓度减少了________,Y 的转化率为________。
(2)该反应的化学方程式为__________________________________________________。
(3)10 s 后的某一时刻(t 1)改变了外界条件,其速率随时间的变化图像如下图所示:则下列说法符合该图像的是________。
A .t 1时刻,增大了X 的浓度 B .t 1时刻,升高了体系温度 C .t 1时刻,缩小了容器体积D .t 1时刻,使用了催化剂解析:(1)分析图象知:Δc (Z)=1.58 mol -0 mol 2 L =0.79 mol·L -1,v (Z)=0.79 mol·L -110 s=0.079 mol·L -1·s -1,Δc (X)=1.20 mol -0.41 mol 2 L=0.395 mol·L -1。
Y 的转化率α(Y)=1.00 mol -0.21 mol1.00 mol ×100%=79.0%。
(2)由各物质转化的量:X 为0.79mol ,Y 为0.79 mol ,Z 为1.58 mol 可知方程式中各物质的化学计量数之比为1∶1∶2,则化学方程式为X(g)+Y(g) 2Z(g)。
(3)由图像可知,外界条件同等程度地增大了该反应的正、逆反应速率。
增大X 的浓度、升高体系温度均不会同等程度地改变正、逆反应速率,A 、B 错误。
由(1)中的解析可知,该反应为反应前后气体体积不变的反应,缩小容器体积或增大压强,均可同等程度地增大正、逆反应速率,C 正确。
D 使用催化剂可同等程度地改变正、逆反应速率,D 正确。
答案:(1)0.079 mol·L -1·s -1 0.395 mol·L -1 79.0%(2)X(g)+Y(g) 2Z(g) (3)CD10.在容积为2 L的密闭容器中,保持体系内温度为800℃不变,将一定量的X和Y气体混合发生反应:2X(g)+Y(g) 2Z(g)。
其中X的物质的量[n(X)]随时间的变化如下表:(1)用Y表示反应开始至达到平衡(假设30 s刚刚达到平衡)时的平均反应速率________,0~10 s与10~20 s的反应速率之比为________。
(2)根据上述数据,能否计算800℃时该反应的平衡常数K,“能”则计算K=________;“否”则说明缺少的数据:__________________________________________。
(3)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(X)=n(Z),则该反应是________(选填“吸”、“放”)热反应。
(4)在800℃时,若缩小容器的体积,达到新平衡时n(X)________(选填“>”、“=”或“<”)0.07 mol,X的转化率________(选填“增大”、“不变”或“减小”)。
(5)上述800℃时的反应达到平衡时测得放出热量a kJ。
试写出在此条件下X与Y反应的热化学方程式______________________________________________________。
解析:(1)0~30 s内,v(X)=(0.2 mol-0.07 mol)/(2 L×30 s)≈0.002 2 mol/(L·s),所以v(Y)=0.001 1 mol/(L·s)。
0~10 s与10~20 s的时间段相同、容器的容积不变,故反应速率之比等于物质的量变化之比,故为(0.2 mol-0.1 mol)∶(0.1 mol-0.08 mol)=5∶1。
(2)缺少加入的Y的量,不能确定平衡时体系中Y的浓度,故不能计算该反应的平衡常数。
(3)反应重新达到平衡时,n(X)=n(Z)=0.1 mol,X的量增加,则升高温度,平衡向逆反应方向移动,故正反应为放热反应。
(4)缩小容器体积,压强增大,平衡向正反应方向移动,X的转化率增大。
(5)尽管加入的X的物质的量为0.2 mol,但参加反应的只有0.13 mol,故1 mol X参加反应放出的热量为7.7a kJ,则该反应的热化学方程式为2X(g)+Y(g)===2Z(g) ΔH=-15.4a kJ·mol-1。
答案:(1)0.001 1 mol/(L·s)5∶1(2)缺少初始Y的物质的量(或浓度)(3)放(4)<增大(5)2X(g)+Y(g)===2Z(g)ΔH=-15.4a kJ·mol-111.(2011·合肥质检)二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。
工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:(1)利用水煤气合成二甲醚的总反应为:3H 2(g)+3CO(g) CH 3OCH 3(g)+CO 2(g) ΔH =-246.4 kJ·mol -1它可以分为两步,反应分别如下: ①4H 2(g)+2CO(g)===CH 3OCH 3(g)+H 2O(g) ΔH 1=-205.1 kJ·mol -1②CO(g)+H 2O(g)===CO 2(g)+H 2(g) ΔH 2=________。
