物质的分类及转化
人教版2019新教材高中化学必修一第一章第一节物质的分类及转化知识点梳理
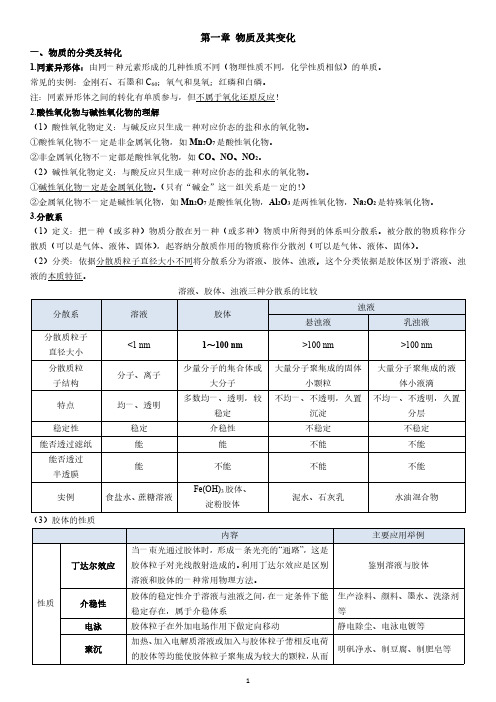
第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。
物质分类及转化

物质分类及转化
物质可以根据其化学性质和物理性质进行分类。
根据化学性质,物质可以分为元素和化合物。
元素是由同种原子组成的纯物质,例如氧气和金属铁。
化合物是由两个或更多不同种类的原子组成的纯物质,例如水和二氧化碳。
根据物理性质,物质可以分为固体、液体和气体。
固体是具有固定形状和体积的物质,例如冰和金属。
液体是具有固定体积但没有固定形状的物质,例如水和酒精。
气体是没有固定形状和体积的物质,可以自由流动,例如空气和氧气。
物质可以通过物质转化发生化学反应。
化学反应是一种将一种或多种物质转化为另一种或多种物质的过程。
这些反应可以是不可逆转的,也可以是可逆转的。
物质转化可以分为化学变化和物理变化。
化学变化是指物质发生化学反应,并产生新的物质,例如燃烧和腐烂。
物理变化是指物质改变其物理状态,但其化学组成不发生改变,例如物质的相变(如熔化和汽化)和溶解。
总的来说,物质可以通过化学反应进行分类和转化,从一个化学物质转变成另一个。
同时,根据物质的性质和形态,我们也可以对物质进行分类。
1.物质的分类及转化

3、已知某温度下四种化合物在水中及液氨中的溶 解度如下:
水中 液氨中
AgNO3 170 86
Ba(NO3)2 AgCl BaCl2 9.2 1.5×10-4 33.3 97.2 0.8 0
写出此温度下上述四种化合物在水中、液氨中能 发生复分解反应方程式。水中:_______ _,液氨中:_______。
0.0015
(1)若在放有氯化银固体的水中加入硫化钠溶液, AgCl白色固体表面变黑 可能发生的现象是 ______________________ (2)生产化肥硫酸铵的一种方法是:用石膏粉(CaSO4) 悬浮于水中,不断地通入二氧化碳与氨气;充分反 应后,立即过滤(沉淀是CaCO3),再经蒸发而得 到硫酸铵晶体。写出此反应的有关化学方程式 2NH 3+CO2+H2O+CaSO4=CaCO3↓+(NH4)2SO4 __________________________________________ 是
HAc
H++Ac-
强电解质和弱电解质
强电解质 定义 物质 类别 电离条件 电离程度 溶液中粒子 实例 弱电解质
大多数盐类、 弱酸、弱碱、 水 强酸、强碱
水或熔化 完全 离子
水 部分 分子、离子
指出下列物质中的强电解质和弱电解质:
BaCl2、H2SO4、NH3· H2O、H2O、NaOH、 Na2O、CO2、Cl2、CH3COOH、KNO3、 BaSO4、Ca(OH)2 ► BaSO4、Ca(OH)2在水中溶解度很小,溶液导 电能力非常弱,但它们是离子化合物,溶于水 部分完全电离,属于强电解质。
无机反应 ◪ 现有一些物质的溶解度(温度相同)如下表: 物质 AgCl(白) Ag2S(黑) CaSO4(白) Ca(OH)2(白)
高中化学必修一专题一:物质的分类及转化(经典实用)

高中化学必修一专题一:物质的分类及转化(经典实用)
物质的分类及转化是高中化学必修一的重要内容,该专题主要介绍了物质的分类方法和物质的转化规律。
以下是该专题的经典实用内容:
一、物质的分类方法:
1.按性质分类:可以根据物质的物理性质、化学性质、生物性
质等进行分类,如固体、液体、气体;酸、碱、盐等。
2.按组成分类:可以根据物质的基本组成单位进行分类,如元素、化合物、混合物等。
3.按来源分类:可以根据物质的来源进行分类,如天然物质和
人工合成物质等。
二、物质的转化规律:
1.物理变化:指物质在不改变其化学成分的情况下,发生形状、颜色、状态等方面的改变。
如溶解、汽化、凝固等。
2.化学变化:指物质在发生化学反应过程中,形成新的物质,
即产生化学变化。
如燃烧、酸碱中和、金属与酸反应等。
三、化学方程式:
1.化学方程式用化学符号和化学式表示化学反应的物质的种类
和数量关系。
反应物在化学方程式的左边,生成物在右边,用箭头分隔。
2.化学方程式还可以表示反应的摩尔比例关系和反应的能量变化。
四、化学反应的计算:
1.摩尔与质量的转化:可以利用化学方程式中物质的摩尔比例关系,通过已知物质的摩尔数或质量,计算其他物质的摩尔数或质量。
2.气体体积与摩尔数的关系:在一定的温度和压强下,气体的体积与物质的摩尔数成正比关系。
可以利用这一关系,计算反应物或生成物的摩尔数或体积。
必修1 第一章 第一节 物质的分类及转化
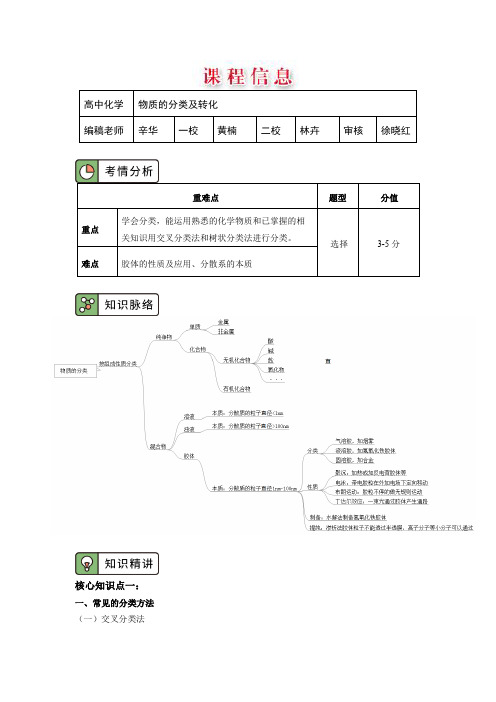
核心知识点一:一、常见的分类方法(一)交叉分类法1. 含义:根据不同的分类标准,对同一事物进行多种分类的方法,即对同一物质以不同的标准进行分类。
2. 举例(二)树状分类法1. 含义:对同类事物按照某种属性进行再分类的分类法。
2. 举例【特别提醒】物质的分类标准不同,同一种物质可能有不同的归类。
二、物质的转化1. 酸、碱、盐的性质(1酸的主要化学性质反应实例(写出化学方程式)酸与活泼金属反应Fe + H2SO4=FeSO4+H2↑酸与碱性氧化物反应Fe2O3+6HCl=2FeCl3+3H2O酸与碱反应H2SO4+Ba(OH)2=BaSO4↓+2H2O酸与某些盐反应H2SO4 + BaCl2 =BaSO4↓+ 2HCl(2反应类型举例表达式化合反应CaO+H2O=Ca(OH)2A+B=AB分解反应2H2O22H2O+O2↑AB =A+B置换反应Fe+CuSO4=FeSO4+Cu A+BC=B+AC复分解反应NaOH+HCl=NaCl+H2O AB+CD=AD+CB2. 物质的转化(1)用化学方程式表示下列转化关系。
(2)通过以上活动,你发现了什么规律?请尝试用图表示出单质、碱性氧化物、酸性氧化物、酸、碱、盐之间的转化关系。
总结:规律1-不同类物质可以相互转化规律2-同种物质具有相似的性质核心知识点二:一、分散系及其分类1. 把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫做分散系。
分散系由分散质和分散剂组成,前者属于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
2. 当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为溶液、胶体和浊液。
二、胶体1. Fe(OH)3胶体的制备(1)反应原理:FeCl3+3H2O Fe(OH)3(胶体)+3HCl(2)操作步骤向25 mL沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈现红褐色。
(3)注意事项①加热至溶液呈红褐色后停止加热;②不能用自来水,用蒸馏水,不能搅拌。
化学必修一----物质的分类与转化

第一课时 物质的分类与转化物质的分类1.物质的分类(1)根据物质的状态、性能分类①根据存在状态分为气态、液态、固态物质; ②根据物质的导电性分为导体、半导体、绝缘体; ③根据在水中的溶解性分为可溶性、微溶性、难溶性物质。
(2)根据物质的组成和性质特点分类物质⎩⎪⎪⎪⎨⎪⎪⎪⎧纯净物⎩⎪⎪⎨⎪⎪⎧ 单质⎩⎪⎨⎪⎧ 金属单质非金属单质化合物⎩⎪⎨⎪⎧无机化合物⎩⎪⎨⎪⎧ 氧化物酸碱盐有机化合物混合物:如溶液、空气等2.氧化物的分类氧化物⎩⎪⎨⎪⎧酸性氧化物:与碱反应生成盐和水的氧化物,如CO 2、SO2碱性氧化物:与酸反应生成盐和水的氧化物,如CaO 、MgO3.常见物质的分类方法(1)单一分类法是指只用一种标准对物质进行分类的方法。
如: 碱按溶解性可溶性碱:KOH 、NaOH 等难溶性碱:Cu (OH )2、Fe (OH )3等 酸按组成中是否含氧元素无氧酸:盐酸、氢硫酸等含氧酸:硫酸、硝酸等(2)交叉分类法指将被分类的对象应用多种不同的单一分类法进行分类。
如:(3)树状分类法是根据被分对象的整体与分出的类型间关系的阵列式形状(像树)来定义的。
如:1.酸性氧化物都是非金属氧化物吗?非金属氧化物都是酸性氧化物吗?提示:不是;不是。
2.碱性氧化物都是金属氧化物吗?金属氧化物都是碱性氧化物吗?提示:是;不是。
(1)氧化物按组成元素可分为金属氧化物和非金属氧化物。
从性质上可分为酸性氧化物(如CO2、SO2等)、碱性氧化物(如CaO、MgO等)、两性氧化物(如Al2O3)、不成盐氧化物(如CO、NO等)。
金属氧化物不一定都是碱性氧化物,如Al2O3是两性氧化物,而Mn2O7属于酸性氧化物。
(2)酸性氧化物可能是非金属氧化物(如CO2),也可能是金属氧化物(如Mn2O7)。
非金属氧化物不一定就是酸性氧化物(如CO、NO等)。
(3)碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Na2O2、Mn2O7等)。
物质的分类及转换

物质的分类及转换一、物质的分类物质是构成宇宙的基本单位,根据其性质和组成不同,可以将物质分为三类:元素、化合物和混合物。
1. 元素元素是由相同类型的原子组成的纯物质。
目前已知的元素有118种,包括氢、氧、铁等。
元素具有固定的化学性质,无法通过常规的物理或化学方法分解成其他物质。
2. 化合物化合物是由不同类型的原子通过化学键结合而成的物质。
化合物具有独特的化学性质,可以通过化学反应分解成更简单的物质。
例如,水是由氢和氧元素组成的化合物,可以通过电解或加热分解为氢气和氧气。
3. 混合物混合物是由两种或更多种不同物质混合而成的物质。
混合物的组成和性质可以不均匀,可以通过物理方法如过滤、蒸馏等分离成各个组成部分。
例如,空气是由氮气、氧气、水蒸气等气体组成的混合物,可以通过液化或净化过程分离出其中的组分。
二、物质的转换物质在自然界中不断发生着各种转换过程,包括物质的相变、化学反应等。
1. 相变相变是物质由一种相态转变为另一种相态的过程。
常见的相变有固态到液态的熔化、液态到气态的蒸发、气态到液态的凝结以及液态到固态的凝固等。
相变过程中,物质的化学组成不发生改变,只是其分子或原子的排列方式发生改变。
2. 化学反应化学反应是指物质之间发生化学变化的过程。
在化学反应中,原有物质的化学键被打破,新的化学键形成,导致物质的性质发生明显的变化。
化学反应可以分为合成反应、分解反应、置换反应、氧化还原反应等多种类型。
例如,燃烧是一种常见的氧化反应,燃料与氧气反应产生二氧化碳和水。
3. 核反应核反应是指原子核发生变化的过程,通常涉及到原子核的裂变或聚变。
核反应具有巨大的能量释放,是核能利用的基础。
例如,核裂变反应是指重核裂变成轻核的过程,核聚变反应是指轻核聚变成重核的过程。
4. 生物转化生物转化是指生物体内发生的各种化学反应和代谢过程。
生物转化是生命活动的基础,包括有机物的合成、分解、氧化还原等过程。
例如,光合作用是一种生物转化过程,植物利用光能将二氧化碳和水合成为有机物,释放出氧气。
物质的分类及转化

物质的分类及转化
物质转化是化学中极为重要的概念,其概念涉及物质的分类和相互转化。
该领域关乎大量的科学研究及社会管理,对于高校和高等教育具有深远的影响。
物质的分类
按照物质的组成及内部结构,物质可以分为三类:化合物、元素和混合物。
化合物是由原子组成,其内部结构受到化学键的控制,特性会因组成元素的不同而有所不同,比如水和乙醇就是两种不同的化合物;元素就是单独的组分,它们的内部结构不受外界的改变,它们的特性由其本身决定,比如氢、氧和铁都是元素;混合物就是由两种或更多的组分混合在一起的物质,它的内部结构受外界的改变,它的特性由其本身决定,但它由于混合,而呈现出特有的特性,比如混合气体、混合液体和混合固体都是由多种物质混合而成的混合物。
物质的转化
物质不仅可以分类,在高校和高等教育中,也要求学生掌握物质的转化知识。
物质的转化包括四种基本形式:化学转化、物理转化、核转化和生物转化。
化学转化是指两种物质之间在反应条件下相互转化,其中包括几类转化:分解反应、复分解反应、合成反应、氧化还原反应等;物理转化是指物质在物理作用下,改变形态和性质,但不改变其化学组成,常见的物理转化有渗透、冻结、沸腾和熔融等;核转化是指破坏原子核的稳定性而发生的核反应,常见的核转化有核衰变和核裂变等;生物转化是指物质在生物的影响下,发生的生化反应,典型的例子是光合作用,在其中物质能够实现从光合电子传递和产生氧化还原反应。
物质转化为高校和高等教育产生了重要影响,当学生能够掌握并利用物质的分类和转化时,能够更好地理解生活中的化学现象,从而获得更多的学科知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的分类及转化
【三维目标】
知识与技能:
1、学会从不同角度对常见物质进行分类。
2、掌握化学物质的分类方法,认识比较和分类等科学方法对化学研究的作用。
3、理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
4、初步了解通过化学反应实现物质相互转化的重要意义。
过程与方法:
本节关于物质的分类和转化内容正好可对初中化学中学习过的化学反应进行总结和归纳,并进行适当的拓展和提高,帮助学生更好地认识化学物质。
情感、态度与价值观:
树立学生正确的唯物主义物质观
【新课标】
能根据物质的组成和性质对物质进行分类;根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
【教学重点、难点】
物质的分类,化学反应类型
【课时安排】1课时
【教学过程】
【引言】同学们已经学习了一年的化学,我们知道化学是研究物质的一门学科;化学,也是一门中心的、实用的、创造性的科学。
可以说,人类的发展史也是一部化学的发展史。
化学世界绚丽多彩,千姿百态,目前已知物质的种类超过千万种,每年还有大量新物质不断被合成出来,现在每年新合成的化学物质已达
到了100多万种。
【过渡】如此繁多的化学物质,我们该如何去认识它们呢?一种一种地去学习,现实吗?
由于每一类物质的组成、结构和性质有相似之处,这就需要我们将众多物质进行分类,一类一类去研究,揭示出其内在的规律。
【练习】在我们的日常生活中,常会接触到下列物质:
空气乙醇硫酸铵铜碘酒碘氢气石墨食盐水请你将上述物质进行分类,并说明分类的依据。
将你的分类结果与同学交流讨论。
1根据通常的存在状态分类 2根据导电性能分类
3根据所含物质的种类分类 4根据组成纯净物是否为同种元素
5将物质分为无机物和有机物
[小结]可以从不同的角度、用不同的标准对物质进行分类。
根据物质的组成
均匀混合物:
混合物
均匀混合物:
物质非金属单质:
单质
金属单质:
纯净物有机化合物:
化合物
无机化合物氧化物:
酸:
碱:
盐:
……
7.经分析,某物质中只含一种元素,则此物质()
A.一定是一种单质
B.一定是纯净物
C.一定是混合物
D.可能是纯净物,也可能是混合物
解析:本题易错选A,原因是误认为只含一种元素的物质肯定不是化合物,一定是单质,但忽略了一种元素可能形成几种不同的单质,如H2为纯净物,金刚石和石墨混合则形成混合物,因此含一种元素的物质可能是纯净物,也可能是混合物.
答案:D。
