第四章芳烃_有机化学及实验
芳烃的性质实验报告

芳烃的性质实验报告
芳烃是一类含有苯环结构的碳氢化合物,具有特殊的化学性质。
本实验旨在通
过对芳烃的性质进行实验研究,以期深入了解其化学特性及应用价值。
首先,我们进行了对芳烃的物理性质的实验研究。
实验结果显示,芳烃具有较
高的沸点和熔点,这与其分子结构紧密相关。
此外,我们还测试了芳烃的溶解性,发现芳烃在非极性溶剂中溶解度较高,而在极性溶剂中溶解度较低,这与芳烃的分子极性有关。
接着,我们对芳烃的化学性质展开了实验研究。
在实验中,我们发现芳烃具有
较高的稳定性,不易发生化学反应。
但在适当的条件下,芳烃可以发生亲电取代反应和求核取代反应,这为芳烃的合成和改性提供了重要的理论基础。
此外,我们还对芳烃的燃烧性质进行了实验研究。
实验结果表明,芳烃在氧气
条件下可以发生完全燃烧,生成二氧化碳和水,释放大量的能量。
这为芳烃作为燃料的应用提供了重要的参考依据。
最后,我们对芳烃的环境影响进行了实验研究。
实验结果显示,芳烃在大气中
易发生光化学反应,产生有害的光化学污染物,对环境造成一定的影响。
因此,在芳烃的生产和使用过程中,需要采取相应的环保措施,减少对环境的影响。
综上所述,通过对芳烃的性质进行实验研究,我们深入了解了芳烃的物理性质、化学性质、燃烧性质以及环境影响等方面的特点。
这对于进一步的芳烃的应用和环境保护具有重要的理论和实践意义。
希望本实验能为相关领域的研究和应用提供一定的参考价值。
第四章芳烃_有机化学及实验

F.A.Kekulé (1829-1896) 德国化学家
1. 存在共轭效应 2. 环合大π键 ,稳定
KJ/mol
苯的氢化热
苯非常稳定,难以发生氧化、加成反应
2.共振结构-共振论
0.139nm
LC Pauling (1901-1994) 美国 1954,1963年 获奖
共振结构式 共振式表示方式
类
单环芳烃
型
定
义
实
CH3
例
甲苯
含一个苯环的芳烃
多个苯环共用两个以上碳原子
稠环芳烃
多环 芳烃 联苯
萘
联苯
CH 2
多个苯环以单键相连
多苯代脂 苯环之间相隔一个以上碳原子 肪烃 含有结构及性质与苯环 非苯芳烃 相似的芳烃
甲烷
薁
4.1.2 芳烃的命名
1.单环芳烃和多苯代脂肪烃的命名 如-NO2,卤素、简单烷基等作取代基, 苯为母体, 读作某(基)苯
4.2.2 芳烃分子中π电子的特性
电子分散在两个成ຫໍສະໝຸດ 碳原子核连线的 上下方,受原子核的束缚作用较小,容 易发生亲电加成反应.
电子成圆柱形对称地分布在两个碳原 子之间,受原子核约束力增加,与亲 电试剂加成反应的速度较慢.
大键非常稳定,难与亲电试剂发生 加成反应,也难发生氧化反应,而容 易发生取代反应.
SO 3H NH 2 对氨基苯磺酸 CHO Br 间溴苯甲醛 COOH NO 2 对硝基苯甲酸
CH3 o m p 对 o 邻 m 间
OH O2N NO2 NO2 2,4,6-三硝基苯酚
2. 联苯类化合物的命名 以联苯为母体来命名,读作某联苯.
3 2 O2N 4 5 6 2' 1 1' 3' 4' NO2
大学有机化学课件第四章 芳香烃

定条件下还是能加成的。
加氢:
加氯: 3.氧化反应 苯环侧链的氧化: 烃基苯侧链可被高锰酸钾或重铬酸钾的酸性或碱性溶液或稀硝酸所氧化,并在与苯环直接相连 的碳氢键开始,如果与苯环直接相连的碳上没有氢时,不被氧化。氧化时,不论烷基的长短,最后 都变为羧基,苯环不容易氧化。
苯环的氧化:
第四节 苯环的亲电取代定位规律 一、定位规律 1. 定位基在苯环上引入新的取代基时,其进入苯环的位置,主要决定于原有取代基的性质。这个原有 的取代基称为定位基。 2. 定位基类型 第一类:邻、对位定位基,使反应容易进行,并使新导入基主要进入苯环的邻、对位。 如:-NH2、-ph、- N(CH3)2 、-NHCOCH3 、-OH、- OCH3 第二类:间位定位基,使反应难于进行,并使新导入基进入苯环的间位。 + 如:-COOH 、-NO2 、- N(CH3)3 、-CF3 第三类:使反应较难进行,又使新基导入邻位或对位。 如:-F、- Cl、- Br 、-CH2Cl 二、定位规律的解释 1. -COOH 、-NO2 、- N(CH3)3 、-CF3等。 这类定位基与苯环直接连接的原子都具有一定的正电荷,吸引苯环上的电子,使苯环上的电子 云降低,使亲电取代反应较难进行。以硝基为例,硝基的π轨道和苯环构成π-π共轭体系,由于 氧、氮的电负性强于碳,使共轭体系的电子云移向硝基。诱导效应和共轭效应协同作用的结果,降 低了苯环的电子云密度,其中以邻、对位为甚,而间位相对来说降低的少一些。
+ 3H 2
二、近代物理方法测定苯的结构
+Q
应该 Q=120×3=360KJ/mol,而实际上苯的氢化热=208 KJ / mol,比理论值低 152 KJ / mol 。
1.近代物理方法测定苯的结构: (1)6 个碳组成一个平面正六边形,6 个氢与 6 个 碳都在同一个平面上。 (共平面性) (2)所有键角都是 120° (3)碳碳键键长为 0. 139nm. 2.轨道杂化理论: 苯环所有碳原子都是采用 SP2 杂化,每个碳原子以三个杂化轨道分别与相邻的碳原子和氢原子形成 三个σ键。每个碳原子的未参与杂化的 P 轨道都垂直于碳环的平面。相邻的两个 P 轨道彼此从侧面 重叠,形成一个封闭的共轭体系,这个封闭的共轭体称为大π键,由于π电子高度离域,从而使键 达到完全平均化。
有机化学第四篇芳香烃
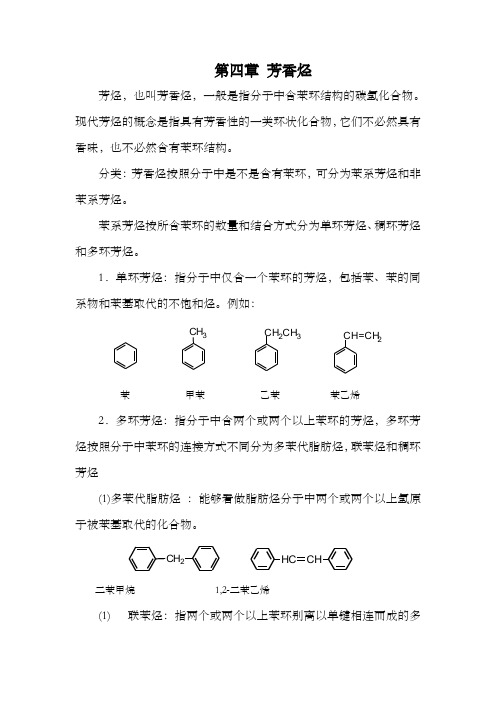
第四章芳香烃芳烃,也叫芳香烃,一般是指分子中含苯环结构的碳氢化合物。
现代芳烃的概念是指具有芳香性的一类环状化合物,它们不必然具有香味,也不必然含有苯环结构。
分类:芳香烃按照分子中是不是含有苯环,可分为苯系芳烃和非苯系芳烃。
苯系芳烃按所含苯环的数量和结合方式分为单环芳烃、稠环芳烃和多环芳烃。
1.单环芳烃:指分子中仅含一个苯环的芳烃,包括苯、苯的同系物和苯基取代的不饱和烃。
例如:CH3CH2CH3CH=CH2苯甲苯乙苯苯乙烯2.多环芳烃:指分子中含两个或两个以上苯环的芳烃,多环芳烃按照分子中苯环的连接方式不同分为多苯代脂肪烃,联苯烃和稠环芳烃(1)多苯代脂肪烃:能够看做脂肪烃分子中两个或两个以上氢原子被苯基取代的化合物。
CH2HC CH二苯甲烷1,2-二苯乙烯(1)联苯烃:指两个或两个以上苯环别离以单键相连而成的多环芳烃例如:联苯1,4-三联苯(2)稠环芳烃:两个或两个以上苯环彼此共用两个碳原子而成的多环芳烃,例如:萘蒽菲3.非苯芳烃:指分子中不含苯环的芳香烃,例如:环戊二烯负离子环庚三烯正离子第一节单环芳烃一,单环芳烃的异构现象和命名苯是最简单的单环芳烃。
单环芳烃包括苯、苯的同系物和苯基取代的不饱和烃。
1.异构现象(1)烃基苯有烃基的异构例如:CH2CH2CH3CHCH3CH3(2)二烃基苯有三种位置异构例如:RR'RRR'R'(3)三取代苯有三种位置异构例如: R R'RRR''R''R''R'R'2. 命名(1)苯基的概念芳烃分子去掉一个氢原子所剩下的基团称为芳基(Aryl)用Ar 表示。
重要的芳基有:CH 2(C 6H 5CH 2-)苄基(苯甲基),用Bz 表示苯基, 用Ph 或 表示ф(2)一元取代苯的命名a 当苯环上连的是烷基(R-),-NO 2,-X 等基团时,则以苯环为母体,叫做某基苯。
例如:CH CH 33NO 2Cl异丙基苯叔丁基苯硝基苯氯苯b 当苯环上连有-COOH ,-SO 3H ,-NH 2,-OH ,-CHO ,-CH=CH 2或R 较复杂时,则把苯环作为取代基。
有机化学41

第四章 芳 香 烃Ⅰ 学习要求1. 熟练掌握用系统命名法命名芳香烃和芳香族化合物。
2. 掌握和熟练应用芳环的亲电取代反应及侧链氧化反应。
3. 了解亲电取代反应的影响因素,熟练应用亲电取代反应定位规律判断反应的主要产物,芳环的化学活性和确定合成路线。
4. 了解芳香性的概念,掌握休克尔规则,熟练应用休克尔规则判断环状共轭烯烃有无芳香性。
Ⅱ 内容提要一.苯的结构与芳香性1.苯的分子式为C 6H 6,有较大的不饱和性。
苯分子中每个碳原子以sp 2杂化轨道与相邻的两个碳原子组成碳碳σ键,与一个氢原子组成碳氢σ键,六个碳原子和六个氢原子都在同一平面内,构成平面六边形。
六个碳原子上各自未杂化的含有单电子的且垂直于环平面p 轨道,相互轴向平行重叠形成闭合的离域大π键。
2.苯分子中碳碳键长完全平均化,形成的完全离域的闭合共轭体系,其离域能为150kJ ·mol ﹣1,使得苯环具有很好的热力学稳定性。
在通常的反应条件下,苯环的结构保持不变,不易被氧化,不易被加成,较易于发生苯环上的取代反应。
3.苯环上具有较多的π电子且具有较大的可极化性,可与缺电子的亲电试剂作用,发生亲电取代反应。
苯环上连有供电子基(致活基团)时,亲电取代反应活性增加,主要产物为邻、对位取代产物;苯环上连有吸电子基(致钝基团)时,亲电取代反应的活性降低,主要产物为间位取代产物。
4.苯分子的特定结构及特殊性质称为芳香性,芳香性是芳香烃化合物的共性,其他芳环具有和苯环相似的化学性质。
如果符合以下两点条件,则该体系具有芳香性:①具有平面环状的闭合共轭体系。
②该闭合共轭体系中离域的π电子数等于(4n + 2)个(n = 0,1,2,3…。
一般n ≤6)。
这就是休克尔(Hückel)规则。
二.芳烃的化学性质1.苯环上的亲电取代反应FeX 3NO 2S O 3H X AlCl 3R (RCO)2AlCl 3COR+ X 2+ 浓HNO + 浓H 2SO + R X+ RC OX卤代反应,反应不可逆,通常用Cl 2,Br 2。
有机化学:第四章芳香烃

治学善质疑,心灵悟真谛
2.稠环芳香烃 分子中无独立苯环,两个或多个苯环稠合。
C C
萘
C
C
C
C
蒽
C
C
C
C
菲
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
二、单环芳烃的构造异构和命名
1.苯的同系列,通式是CnH2n-6(4个不饱和度) 具有侧连异构和位置异构。
CH2CH2CH3
H3C
CH3
CH
CH2CH3
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
2)付-克烃基化反应的重排
卤代烷具有三个碳以上时,常产生重排产物。
H3C Cl
AlCl 3
CH3
+
CH3
CH3
重排由不稳定碳正离子中间体稳定性引起。
H
CH3 CH CH2
重排
CH3 CH CH3
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
没有更稳定的离子中间体产生,就没有重排产物。
5)卤代苯亲电取代生成邻对位两种产物
Br
HNO 3
H2SO 4
Cl Cl Br
FeCl 3
Br H2SO 4
+ Br Br NO 2
+ Br Br Cl
+ Br Br SO 3H
NO 2 Cl SO 3H
马敬中 华中农业大学理学院
治学善质疑,心灵悟真谛
6)硝基苯亲电取代只生成一种间位产物
NO 2
NO 2
HNO 3 H2SO 4
NO 2
Cl Cl FeCl 3
O2N
NO 2 Cl
NO 2
有机化学第四章 芳 香 烃

(2) 酰基化反应 酰基化反应的特点:产物纯、产量高。
二、氧化反应
1.苯环的氧化
苯环在激烈的条件下被氧化破坏,例如:
2. 烷基苯的氧化( 侧链氧化 ):
无论烷基侧链的长短,其氧化产物都是苯甲酸。
第五节 苯环上亲电取代反应的定位规律
一、一元取代苯的定位规律
1.邻、对位定位基(第一类定位基) 使新引入的取代基主要进入其邻位和对位,且多
第四章 芳 香 烃
第一节 芳烃的分类与命名 第二节 苯的结构 第三节 单环芳烃的物理性质 第四节 单环芳烃的化学性质 第五节 苯环上亲电取代反应的定位规律 第六节 其他芳烃
芳香化合物的定义
第一阶段:从植物胶中取得的具有芳香气味的物质称 为芳香化合物。 第二阶段:将苯和含有苯环的化合物称为芳香化合物。 第三阶段:将具有芳香性的化合物称为芳香化合物。
CH3CH2CHCH2CHCH3 CH3
COOH
SO3H
2-甲基-4-苯基己烷 苯甲酸
苯磺酸
CH3CH2CHCH2CHCH3 CH3
COO
2-甲基-4-苯基己烷 苯甲酸
第二节 苯的结构
一、苯的凯库勒式
H
H
H
1825年 法拉第发现了苯
H
H
H
1834年 经元素分析、分子量测定 分子式为 C6H6
C6H5Br 只得到一种——苯中的六个H原子完全等价
1857年 凯库勒提出碳四价(平面)
1858年 Kèkulè提出苯的结构式
凯库勒式是被广泛被接受,但仍面临下列难题:
Br
Br
1.只有一种邻二溴代苯
Br
Br
2.特殊的稳定性:
不发生加成反应 不与氧化剂反应;
第四章-2 芳烃

RCH2CH2R’
CH 3CH 2CH2CH 3
H2/Ni, or Pd, or Pt
2. 苯环氧化 用特殊催化剂V2O5,将苯氧化成顺丁烯二酸酐(简称顺 酐),是工业上合成顺酐的方法。
O
V2O5
385~400℃
顺丁烯二酸酐 (顺酐) (马来酸酐)
+ O2
O O
+ CO2
3. Birch还原(伯齐还原) 苯在液氨中用碱金属(Li,Na)和乙醇还原,通过1,4加成生成1,4-环己二烯的反应。
H Cl
Cl H Cl H
2 加氯
紫外光 + 3Cl2
H Cl H Cl H
Cl
六六六
+
H2
Ni 40℃
Ni 100℃
Pt 300℃
CH 3CH 2CH3
CH 3CH 2CH2CH 3
+
H2
+
H2
CH 3CH 2CH2CH 2CH 3
R-CC-R’ H2/Ni, or Pd, or Pt
CH3CH2CH=CH2
甲苯
乙苯
异丙苯
CH 3 CH 3
CH 3
CH 3
CH 3
CH 3
1,2-二甲苯 邻二甲苯 o-二甲苯 ortho
1,3-二甲苯 间二甲苯 m-二甲苯 meta
1,4-二甲苯 对二甲苯 p-二甲苯 para
3. 结构复杂的化合物
以苯作为取代基:
CH 2OH
COOH
CH
CH 2
苯甲醇
苯甲酸
苯乙烯
CH 3CHCH 2 CH 3
凯库勒结构:
为了解释这些性质,1865年 提出苯是碳碳链首未相连的环 状结构,环中三个单键,三个 双键相间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章芳烃一基本要求1、掌握芳烃的分类、命名和结构。
2、掌握芳烃的化学反应:氧化反应、加成反应和取代反应,重点学习芳香族化合物的亲电取代反应理论。
3、掌握芳烃亲电取代反应中的定位效应。
三类定位基的特点极其理论解释以及利用定位效应于有机合成中。
4、了解芳烃的一些物理性质和光谱特征,特别是苯环的各向异性效应在解析1HNMR谱图方面的应用。
5、了解芳香族亲电取代反应的机理和实例,学会运用付-克反应处理有机化学中的分析、合成问题。
二基本概念苯的凯库勒结构,离域结构,共振结构,休克尔规则,自由基加成,亲电取代反应,亲核取代反应,付-克反应,第一类定位基,第二类定位基,第三类定位基,共轭效应(C),诱导效应(I)。
三重点与难点提示1苯的离域结构:苯具有平面正六边形结构,每两个相邻碳原子之间的距离是一样的,分子中每个碳原子都以sp2 杂化轨道分别与一个氢和两个碳以σ键结合,3个σ键之间的夹角都是120°,每个碳还剩一个p电子,处于和苯环平面相垂直的p轨道上。
6个p轨道彼此重叠,互相贯通成圆环。
由于苯分子的这种对称性排列,电子云是平均分布在整个环上的,6个p电子发生离域形成环状大л键(见图4.1)。
图4.1苯的离域л分子轨道2、苯的共振结构共振论认为许多化合物可以用一个结构式表示其结构,例如乙烯C CHH。
但有一些化合物却不能用单一的结构式精确表示其结构。
它的真实结构是由多个共振结构式共振而成的共振杂化体。
例如,苯的真实结构可以认为主要是由下列共振结构式共振而成的共振杂化体。
共振结构式之间用双箭头“”连接。
+_共振论认为共振结构式符合下列规定:(1)各共振结构式中原子位置无任何变动,且成对或未成对的电子数也应相同,它的差别在于电子的分布。
例如:CH 3CCH 3OCH 3C CH 2OH CH 2CHCH 2CH 2CH CH 2CH 2CHCH 2CH 2CHCH 2CH 3COOCH 3COO(2)能量越低越稳定的共振结构在共振杂化体中占较大的分量,它们的贡献越大。
(3)没有正负电荷分离的共轭结构式贡献较大。
例如:CH 3COOHCH 3COHO贡献较大 贡献较小(4)原子均满足惰性气体电子构型的共轭结构式贡献较大,例如:CH 2OHCH 2OH贡献较大 贡献较小(5)如果在共振结构式中,具有结构上相似和能量上相同的两个或多个共振结构式,则不仅这些相同的共振结构式都是主要的共振结构式,而且由此共振而形成的共振杂化体也特别稳定。
(6)共振杂化体的能量比能量最低的共振结构还要低。
这种能量之间的差叫共振能(离域能)。
上述苯的共振结构中,只有前面两个能量较低,稳定性较大,其它的共振结构对苯的真实分子贡献很小,可以忽略。
所以,苯基本上只是前两个共振结构的杂化体。
3、芳烃分子中π电子的特性及休克尔规则芳烃的典型代表是苯,从结构上看,苯有三个不饱和键,它似乎应比烯烃和炔烃更具不饱和性。
但是,实际上,苯环上的6个p 轨道形成了一个大π66键,6个π 电子均匀地分布在苯环平面的上下方。
这种大π 键有一种特殊的稳定化能,如果要破坏这个大 π 键,需要提供较大的能量。
因此,苯环上的大π 键是非常稳定的。
苯环上如果发生氧化反应也会破坏苯环的闭合大π键,能量上很不利,故很难发生氧化反应。
苯分子这种特殊的结构稳定性及化学反应性能,称为芳香性。
所有的芳香化合物都有这种芳香性。
休克尔规则:“具有4n+2个π电子的单环共轭体系具有芳香性”(n 是成键轨道中简并能级的数目,在苯环中n=1) Hückel 规则的基本要素为:①π电子数为4n+2;② π电子形成共轭体系;③ 参与共轭的电子要构成一个单环。
由于构成共轭体系的必要条件是共轭轨道相互平行,因此,要求4n+2个π电子所在原子都应该共平面。
4、芳烃的质子核磁共振谱与烯烃相似,当外磁场的方向与苯环分子的平面垂直时,闭合大π键上的电子产生一个各向异性的磁场。
苯环分子平面的上下是屏蔽区(+) ,而苯环分子平面的四周是去屏蔽区(-)(见图4.4)。
与烯烃双键相比,苯环闭合大 π 键产生的各向异性的磁场强度更大,故各向异性更明显,以致苯环上的质子的去屏蔽效应更明显,其化学位移(δ=6.5~8.5 ppm )向低场移动。
H图4.4 苯环的各向异性效应苯环邻位两个质子的偶合常数一般为6~10Hz ;处于间位的两个质子通过4个键的远程偶合,其偶合常数为1~3Hz ;处于对位的两个质子的远程偶合常数(0~1Hz)更小。
5、芳烃的化学反应 A )芳烃的加成反应 (1)催化加氢芳烃比一般烃要稳定得多,只有在高温高压及存在催化剂条件下才能加氢,产物为环己烷类衍生物。
芳烃可以被碱金属液氨体系还原为1,4-环己二烯衍生物,被称为Birch 还原反应。
如萘被还原为1,4-二氢化萘。
Na, C 2H 5OH 3C 2H 5ONa 加热1,4-二氢化萘 1,2-二氢化萘其反应机理为:EtOHEtOHHHHHee(2)游离基加成芳烃(苯)在一般条件下不与卤素发生加成反应,但在光照下,可以发生游离基加成反应。
+Cl 2hvClCl ClClCl Cl六六六六六六是一种农药,它有八个异构体,但只有 异构体具有杀虫活性。
这种异构体的含量在混合物中占18%左右。
六六六是一种有效的杀虫剂,但由于它的化学性质稳定,残存毒性大,目前基本被高效的有机磷农药代替。
B ) 芳烃的氧化反应芳烃对氧化剂比较稳定。
一般情况下只发生环上取代基的氧化,只有在特殊的反应条件下才能发生开环氧化。
苯和烷烃都很难被KMnO 4氧化,但烷基取代苯上的烷基容易被KMnO 4氧化为羧基。
CH 3C(CH 3)34COOHC(CH 3)3当苄基碳原子上没有H 原子时,一般不能被氧化;苄基碳原子上只要有一个H 原子,无论碳链多长,氧化最终产物总是苯甲酸衍生物。
但如果控制反应条件,可以氧化烷基苯制备醛或者酮。
例如,异丙苯被氧化制备苯酚和丙酮是很有用的工业生产过程。
C )芳烃的取代反应 (1) 游离基取代烷基取代苯与卤素在光照或者高温下,不发生苯环上的自由基加成,而是发生苄基碳原子上的氢取代反应。
CH 2CH 3+Cl 2CHCH 3Cl反应过程是一个自由基取代过程。
反应经历了如下三个阶段:链引发阶段:ClClCl h v2链增长阶段:Cl+ HCl CH 2CH 3 +3+ Cl 23ClCHCH 3 +Cl链终止阶段:Cl+Cl 2+ClClCHCH 333CHCH 3Cl+CHCH 3CHH 3C(2) 亲电取代反应在烯烃和炔烃中,不饱和碳原子上的氢原子很难被其它原子或原子团所取代,但是,带有苯环的芳香族化合物由于具有芳香性而使芳环上的氢原子容易被其它原子或原子团取代。
不过苯环上的氢原子取代反应同烷烃中饱和碳上的氢原子取代反应有所不同。
在烷烃中,取代氢原子的基团通常是卤素自由基,而在芳环上发生的氢原子取代反应,亲电试剂(electrophilic reagent, 简写为E)通常是缺电子的正离子或者其它路易斯酸,因此,我们把芳香族化合物的芳环上发生的氢原子取代反应叫芳香族亲电取代反应。
E + H+H + E +(3)亲核取代反应一般卤代烃(如苄基卤代烃、烯丙基卤代烃、烷基卤代烃)较容易发生亲核取代反应,但芳基卤代烃由于卤原子于苯环形成p-π共轭体系,加强了碳-卤键,故碳-卤键较难断裂。
并且芳环是富电子环,不易被能提供电子对的负离子或分子(亲核试剂,nucleophilic reagent ,简写为Nu)进攻,因此,不易发生亲核取代反应,必须在常碱作用下才能发生亲核取代反应。
然而,芳环上有强吸电子基(如-NO 2)存在时,卤代芳烃较易发生亲核取代反应。
例如:ClNaNH 2,3NH 2ClNO 223HONaNO 2OHNO 2130℃ClNO NO 223ONaNO 2NO 2OHNO 2NO 2HClNO 2NO 2O 2NNa 2CO 3ONaNO 2NO 2O 2NOHNO 2NO 2O 2NH35℃6、芳香族化合物亲电取代反应理论 A )芳香族化合物亲电取代反应机理在芳环上进行亲电取代反应中,首先是亲电试剂E +进攻苯环,并很快地和苯环的π电子形成π 络合物。
π 络合物仍然还保持着苯环的结构。
然后π 络合物中亲电试剂E +进一步与苯环的一个碳原子直接连接形成中间体(σ络合物)。
σ 络合物是一个环状的碳正离子,它很快失去一个质子,重新恢复为稳定的苯环结构。
+ E++ H ++π络合物 σ 络合物为了简便起见,芳香族亲电取代反应历程通常省去形成π 络合物的一步。
反应的能量曲线如下:反应进程能量图4.7 苯亲电取代反应的能量示意图从图4.7可以看出,芳环上亲电取代反应经过了两个步骤。
第一步是形成σ 络合物,在这一步中,亲电试剂E +进攻苯环的一个碳原子,并从苯环的π 电子体系获得两个电子,E +与苯环上一个碳原子以σ 键连接,形成一个σ 络合物,这个σ络合物也叫苯基正离子。
在σ络合物中,苯环上的一个碳原子由sp 2杂化态 转化为sp 3杂化态,不再有p 轨道,这样,苯环的闭合共轭体系被破坏了,环上剩下4个π 电子,只离域于5个碳原子上,使苯环带一个单位正电荷。
这个σ络合物是一个和烯烃加成反应中生成的碳正离子相似的活性中间体。
σ络合物生成这一步的反应活化能较高,反应速度比较慢,它是决定整个反应速度的一步。
第二步是σ络合物中氢离子的离去。
在形成σ络合物的同时,苯环的闭合共轭体系被破坏,并且σ络合物又是一个正离子,内能高,不稳定,寿命短。
碳原子容易由sp 3杂化态又转化为sp 2杂化态,恢复苯环的芳香结构。
这个过程可以由失去一个质子来实现,也可以由E +重新脱落下来,前者得到产物,后者得到原来的原料。
B )芳香族化合物亲电取代反应实例 (1)卤代反应苯与Cl 2,Br 2在一般情况下不发生取代反应,但在铁或铁盐的催化作用下,苯环上的氢可被氯或溴原子取代生成相应的卤代苯,并放出卤化氢。
+ Br 2Fe 或 FeBr 3Br+ HBr实际生产中用铁粉作催化剂,卤素与铁发生如下反应:Fe + Br 2FeBr 3 铁盐的作用是作为路易斯酸与卤素形成络合物而使卤素分子极化,并进一步提供发生亲电取代反应需要的卤素正离子。
例如:Br 2 + FeBr 3Br +[FeBr 4]- BrBrFeBr 3δδ(2) 硝化反应以浓硝酸和浓硫酸(或称混酸)与苯共热,苯环上的氢原子被硝基(-NO 2)取代,生成硝基苯。
324NO 2+ H 2O50-60℃硝化反应中的亲电试剂是硝酰正离子NO 2+,它是按下式产生的。
HO+ H 2SO 4NO 2NO 2 + HSO 4-+ H 2O(3) 磺化反应苯与浓硫酸共热,苯环上的氢原子可被磺酸基取代,产物是苯磺酸。
