第6章 立体化学
有机化学第六章立体化学

其它三个基团由大到小为顺时针方向 时为R型;反时针时为S型
(R)–2–丁醇
更多示例
01
02
03
04
05
06
D–(+)–
R型
甘油醛
07
08
09
10
11
12
R型
D–(–)–
乳酸
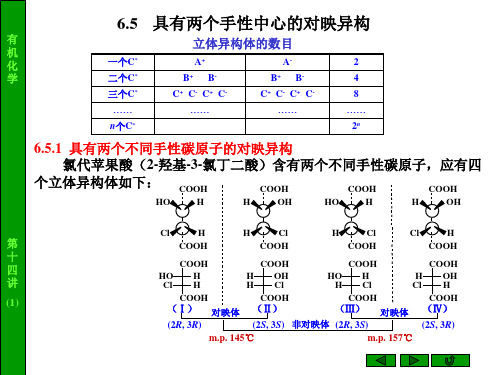
6.5 具有两个手性中心的对映异构
具有两个不同手性碳 原子的对映异构
(IV)
(2S,3S)
10% : ( 2 S , 3 S ) – 2 – 羟 基 – 3–氯丁二酸)
赤型与苏型
A
(赤型)
B
(苏型)
6.5.2 具有两个相同手性碳原子的对映 异构
(I)
(II)
(III)
对映体
(苏型)
内消旋体
(meso form)
非手性分子
非对映体 (I)
(III)
(II)
思考题
这是手性分子吗? 为什么?
它的反式异构体 是怎样的分子?
它的手性中心的 构型是什么?
内消旋酒石酸的分子模型
用
表示;
6.4.3 构型的标记法
01
D,L– 标记法
02
D–(+)–甘油 醛
03
L–(–)–甘油 醛
04
D型
05
D–(+)–甘油 醛
06
L–(+)jroet J.M. 1951
D–(–)–乳酸
10
D, L 与 左 旋 右 旋无关。
(2) R,S–标记
“次序规则”排列次序
立体选择性(stereoselectic)反应 只产生以一种立体异构体为主的反应。
第十四讲 第六章 立体化学(2)
CH3
CH3NH HO
2H 1H
CH3
H H
2 1
NHCH3 OH
CH3
CH3NH H
2H 1 OH
CH3
H HO
2 1
NHCH3 H
C6H5
C6H5
C6H5
C6H5
第
(Ⅰ)(1S, 2R) (Ⅱ)(1R, 2S) (Ⅲ)(1R, 2R) (Ⅳ)(1S, 2S)
十
对映体
对映体
四 讲
麻黄碱,熔点都是34°C,其盐酸 -麻黄碱,熔点都是118°C,其
6.11 不含手性中心化合物的对映异构
有
机 6.11.1 丙二烯型化合物
化
当丙二烯型分子两端碳原子各连接了两个不同的原子或基团时,这样
学 的化合物就可以存在一对对映体。
(1)两个双键相连
a
SP
a
CCC
b SP2
SP2
b
实例:a=苯基,b=萘基,
手性轴(a≠b时)
1935年拆分。
2, 3-戊二烯
H3C
化
HOOC
COOH HOOC
H
学
H COOH
HH
( I) 顺式
H
(II)
COOH HOOC
对映体
(III)
H
(顺反异构体)非对映体
反式
1, 2-环丙烷二甲酸有三种立体异构体,其中(I)中有1个σ,无旋光性,
无对映异构体;(II)与(III)中无σ又无 i ,均有旋光性,是对映异构体,
(II)与(III) 等量混合组成外消旋体。
3号碳有手性
(2S, 4S)
(2R, 4R)
(2R, 3R, 4S)
(整理)第六章对映异构1

第六章 对映异构一、 基本内容本章从不对称物质具有旋光性的现象出发,解释了有机化学中不对称性分子产生旋光性原因。
从立体化学的角度对分子的构型进行了阐述。
介绍了各种表示构型的方法。
主要有费歇尔投影式、纽曼投影式、楔型式及锯架式。
介绍了手性的概念及如何用对称元素来判断分子有无手性及如何表示手性碳原子的方法等问题。
在此基础上,引出了对映异构体、非对映异构体、外消旋体及内消旋体等概念。
在前面各章的基础上强调了反应过程中的立体化学问题。
二、 重点与难点本章的重点是对所学的各种概念的理解和应用,在多做练习的基础上加深对基本内容及有关立体化学知识的理解。
包括R/S 命名法、各种表示构型的方法及相互间的转换、对称元素及其操作、反应过程中的立体化学问题及对映异构体、非对映异构体、外消旋体及内消旋体等概念。
难点主要体现在对立体化学的理解上。
如表示构型的方法及相互间的转换和反应过程中的立体化学问题。
三、精选题及其解6-1 某化合物溶于乙醇,所得溶液为100 mL 溶液中含该化合物14克。
(1)取部分该溶液放在5 cm 长的盛液管中,在20 o C 用钠光作光源测得其旋光度为+2.1o ,试计算该物质的比旋光度。
(2)把同样的溶液放在10 cm 长的盛液管中,预测其旋光度。
(3)如果把10 mL 上述溶液稀释到20 mL,然后放在5 cm 长的盛液管中, 预测其旋光度。
解 比旋光度是旋光物质特有的物理常数,用下式表示:t 为测定时的温度(一般为室温,15-30 o C );λ为测定时的波长(一般采用波长为589.3 nm 的钠光,用符号D表示),在此测定条件下得出的比旋光度用[α]D 表示亦可。
(1)将旋光度α=+2.1o 带入上式,得(2)旋光度为α=+2.1o *2=+4.1o(3)旋光度为α=+2.1o /2=+1.05o1 c ( g / mL )l (10 cm)=t[ ]λαα= + 15ol (10 cm ) c ( g / mL )100 / 14+ 2.1o=c ( 14g / 100 mL )+ 2.1 o=ααD [ ]20=l (10 cm) c ( g / mL )6-2 将一葡萄糖的水溶液放在10 cm 长的盛液管中,在20 0C 测得其旋光度为+3.20,求这个溶液的浓度。
高鸿宾《有机化学》(第4版)-名校考研真题(二)(圣才出品)
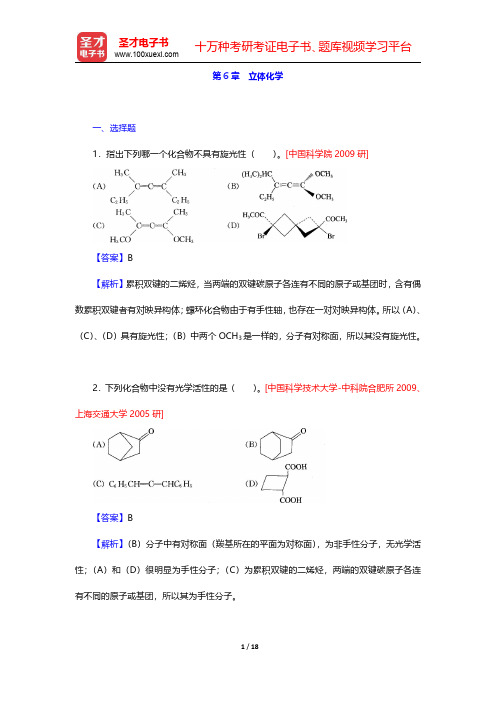
第6章立体化学一、选择题1.指出下列哪一个化合物不具有旋光性()。
[中国科学院2009研]【答案】B【解析】累积双键的二烯烃,当两端的双键碳原子各连有不同的原子或基团时,含有偶数累积双键者有对映异构体;螺环化合物由于有手性轴,也存在一对对映异构体。
所以(A)、(C)、(D)具有旋光性;(B)中两个OCH3是一样的,分子有对称面,所以其没有旋光性。
2.下列化合物中没有光学活性的是()。
[中国科学技术大学-中科院合肥所2009、上海交通大学2005研]【答案】B【解析】(B)分子中有对称面(羰基所在的平面为对称面),为非手性分子,无光学活性;(A)和(D)很明显为手性分子;(C)为累积双键的二烯烃,两端的双键碳原子各连有不同的原子或基团,所以其为手性分子。
3.顺-3-己烯与Br2加成得产物是()。
[青岛大学2009研]A.有旋光性B.外消旋体C.内消旋体D.外消旋体与内消旋体混合物【答案】B【解析】一般顺式构型、顺式加成;反式构型、反式加成得到内消旋体。
顺式构型、反式加成;反式构型、顺式加成得到外消旋体。
顺-3-己烯是顺式异构,与Br2加成是反式加成,所以得到外消旋体。
4.化合物的构型正确命名是()。
[青岛大学2009研]A.2R,3RB.2R,3SC.2S,3RD.2S,3S【答案】D【解析】二、填空题1.化合物的CCS名称是______。
[浙江大学2009研]【答案】(4R)-3,4-二甲基-1-戊烯【解析】该化合物为:,名称为3,4-二甲基-1-戊烯;其中C4为手性碳原子,,根据R、S的命名原则可知,此手性碳原子的构型为R。
三、简答题1.标出下列化合物中各手性中心的R/S构型。
[中国科学技术大学-中科院合肥所2009研]答:首先将与手性中心相连的四个原子或基团按优先级别排列,将最小的原子或基团放到距观察者最远的位置,其他三个基由大到小若为顺时针,则为R型,逆时针则为S型。
第7章卤代烃相转移催化反应邻基效应一、选择题1.下列反应物经行S N1反应时,哪一个反应速率最快?[东南大学2009研]【答案】C【解析】按进行,生成的碳正离子越稳定,反而越易进行,苄基。
《有机化学(第二版)》第6章:立体化学基础

第六章
立体化学基础
19:21
第一节 顺反异构 一、顺式和反式 二、Z—型和E—型 三、顺反异构的性质
19:21
第一节 顺反异构
1、 顺反异构
重点介绍顺反异构体的Z/E标记法。 哪些化合物存在顺反异构体:
(1). 含有 C =C 、 C =N 、 N =N 双键的化合物。
(2). 环状化合物。
顺反异构现象。
顺反异构体的命名方法: 1. 顺/反标记法:
相同的原子或基团位于双键(或环平面)的同侧为“顺 式”; 否则为“反式”。
a C=C b b b a a C=C a b b b b a a a
19:21
b a
_ 顺式 (cis )
_ 反式 (trans )
_ 顺式 (cis )
_ 反式 (trans )
2. Z / E标记法:
该法是1968年IUPAC规定的系统命名法。
规定按“次序规则”,若优先基团位于双键的同侧为 Z
式(德文Zusammen的缩写,中文意为‘在一起’);否
a C=C b (Z)
c d
a c
b d
a C=C b (E)
d c
19:21
应用举例: 含C=C双键的化合物:
H Cl _ C=C H Cl H Cl C=C Cl H
翻 转
CO O H HO H C H3
翻 转
(2) 可以旋转n180。(n>=1),但不能旋转90。或270。。
19:21
CO O H H OH C H3
旋 转180
C H3 。 HO H CO O H
19:21
旋转180 。
CO O H H OH C H3
第6章 对映异构

比旋光度 (Specific Rotation)
t
B l
:旋光度 B :质量浓度(g/ml) l :盛液管的长度(dm)
8
:光源的波长
t :测定时的温度
说明
•比旋光度[]:体现物质特性,可在手册中查到 •一般用钠灯(D)作光源,λ=589.3nm,t=20℃ •物质的旋光度,需要通过改变浓度或者改变盛液管长度 的方式测定两次,才能确定。 •溶液一般为稀溶液,否则测出的α值不准 •若溶剂不是水,则要在后面标出溶剂及相应浓度 右旋酒石酸: (乙醇, 5%)
25
CH3 C HO H CH2CH3 HO
CH3 C CH2CH3 H HO
CH2CH3 C H CH3
S
R
R
S
≡ ≡
A B C
≡
B
B
A
C
D
D
R
D A C
≡
A
D B
26
C
Fischer投影式中R、S的简便确定法: •若最小基团d在竖线上,则a,b,c顺时针旋转为R型, 逆时针为S型; •若最小基团d在横线上,则a,b,c顺时针旋转为S型, 逆时针为R型。 使用费歇尔投影式应注意的问题: •在纸面上转动180°或偶数倍,构型不变。
n
﹡
﹡
I
≡
II
III
IV
关系:对映体:III和IV
内消旋体:I和II
非对映体:I和III,II和III,I和IV,II和IV
33
内消旋体(meso):分子内部形成对映两半的化合物 (有) 内消旋体无旋光性(抵消), 不能分离成光活性物质
mp
(+)-酒石酸 (-)-酒石酸 170oc 170oc
有机化学上第六章-立体化学

第三十四页,共63页。
注意
• 外消旋体与内消旋体都没有旋光性,但 它们有本质的不同:
• 外消旋体是等量左旋体和右旋体的混合 物,可拆分;
• 内消旋体是分子内有对称面的单一化合 物,不可拆分。
第三十五页,共63页。
(六) 手性中心的产生
• 〔2〕判断分子中有无对称面和对称中心 在立体化学中有重要意义。
第九页,共63页。
(三) 手性分子的性质——光学活性
光学活性:手性分子可以使平面偏振光发生偏转的性质〔旋光性〕
(1) 偏振光
• 光是一种电磁波,光波的振动方向与其前进方向垂直。
• 普通光在所有垂直于其前进方向的平面上振动。
• 偏振光——只在一个平面上振动。
手性中心的产生与手性合成有密切关系。
(1) 第一个手性中心的产生 (自学)
产 生 第 一 手 性 碳
CH3CH2CH2CH3 Cl2
CH3*CHCH2CH3 +其 他 产 物 Cl
前 手 性 碳
外 消 旋 体
当产生第一个手性中心时,两个氢原子被取代的概率
均等,生成的对映体的量相等,产物没有旋光性,是一 个外消旋体。即从非手性反响物合成手性产物时常得到 外消旋体。
HO CH3 赤式
前后
H
H3C
Cl
HO
CH3
H
赤式 前后
前后碳旋转方向不同
前后碳旋转方向相同
“苏式〞、“赤式〞的概念在研究有机反响的立体化 学关系和反响机理时常会遇到。
第三十三页,共63页。
(2) 具有两个相同手性碳原子的对映异构
酒石酸分子中含有2个*C,可能的异构体有:
6 第六章 对映异构

1、掌握偏振光、旋光性、比旋光度、摩尔比旋光度的概念。 2、理解对称元素和对称操作,识别指定结构中的对称元素, 掌握手性和手性碳的概念。 3、掌握费歇尔投影规则和使用费歇尔投影式的原则, 以及费歇尔投影式、纽曼投影式与锯架式的转换。 4、掌握含一个手性碳化合物的对映异构现象,对映异构体、 外消旋体。 5、掌握含二个手性碳化合物的立体异构,非对映异构体、 内消旋体,画出上述异构体的纽曼投影式。 6、理解丙二烯型、螺环和有位阻联苯的对映异构的特征。 7、构型标记法,R/S标定法,D/L系。 8、理解对映异构体混合物的化学拆分基本原理。
返回教学内容
第三节
含一个手性碳原子化合物的对映异构
一.对映体(Enantiomers) 乳酸是含一个手性碳原子的典型代表:
COOH COOH
H CH3 OH H3C OH
H
-
构造相同,构型相反,互为物象关系叫对映异构体 (简称对映体) 其中一个是右旋体: []20D = + 3.8º 一对乳酸: 另一个是左旋体: []20D = - 3.8º
H
CH3
HO CH 3
H
投影
使用费歇尔投影式时应注意的操作: 1.不能离开纸面翻转——否则会改变原来的构型。 2.在纸面上转动180º ,不改变原来构型。 3.在纸面上旋转90º 或90º 的奇数倍,则改变原来构型。 4.把其中一个基团固定,其他三个基团按顺时钟方向 或反时 钟方向改变相对位置,则构型不变。 5.任何两个基团互相调换位置,则改变原来构型。
(Enantiotropy or Enantiomorphism) (旋光异构)
(Conformers or rotational isomers)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应停灾难 O
N
O
N
OO
H
酞胺呱啶酮、沙利度胺
O
O HN
N
OO
有药效
180 o
O
N OO
O N
H
O
N
OO
致畸
O NH
6.2 手性和对称性
观察如下模型将发现: 这两个模型化合物互为实物和镜像,但它们不能重合。 互为对映,称为对映异构体。
OH
CH3CHCOOH
-
COOH
COOH
H OH
CH3
总结: Fischer投影式的转换规则
1. 不能离开纸面翻转,若翻转180o,变成其对映体。 2. 不能在纸面上转动90o,270o,否则变成其对映体。 3. 可以在纸面上转动180o,构型不变。 4. 手性碳上任意两个基团调换偶数次,构型不变;任
意两个基团调换奇数次,构型改变。
写出Fischer投影式:
分子具有手性
分子能否与镜像重合
分子的对称性
6.2.2 对称因素
(1) 对称轴(旋转轴)
设想分子中有一条直线,当分子以此直线为轴旋 转360º/n后 (n=正整数),得到的分子与原来的分子相 同,这条直线就是n重对称轴。
H3C H
H CH3
具有对称轴的分子和手性无关。
C2轴
(2) 对称面(镜面)
设想分子中有一平面,它可以把分子分成互为 镜象的两半,这个平面就是对称面。
CH3
CH3
-
H OH
对映异构
左右手互为镜象
桂林风情
6.2.1 分子的手性、对映异构、对映体
一个物体若与自身镜象不能叠合,叫具有手性。
在立体化学中,不能与自身镜象重合的分子叫手性 分子,而能叠合的叫非手性分子。
-
COOH
COOH
H OH
CH3
CH3
-
H OH
乳酸的两个模型的关系象左手和右手一样,它们不能 相互叠合,但却互为镜象。乳酸分子是手性分子。
构型的表示法 — (1)透视式
COOH
C
CH3
H
OH
COOH
C
H
CH3
HO
构型的表示法 — (2)Fischer投影式
COOH
H
CH3
OH
立体结构
COOH
OH
CH3
H
COOH H C OH
CH3
锲形式
COOH HO C H
CH3
COOH
H
OH
CH3 Fischer投影式
手
COOH 性
碳
HO
H原
子
COOH
(A)
(2R,3S)-2,3-二羟基丁二酸
COOH H R OH HO R H
COOH
(B)
(2R,3R)-2,3-二羟基丁二酸
COOH HO S H
立体化学的诞生
碳链(碳架)异构
构造异构
官能团位置异构 官能团异构
同分异构
互变异构
立体异构
构型异构 构象异构
顺反异构
对映异构 光学异构
非对映异构
立体异构体的定义: 分子中的原子相互连接的次序相同,但在空间的排 列方式不同而引起的异构体。
立体化学的任务: 研究分子的三维空间结构(立体结构)及其对化合 物物理性质和化学性质的影响。
H3C H
H CH3
具有对称面的分子也不具有手性,为非手性分子。
(3) 对称中心
分子中有一中心点,通过该点所画的直线都有以 等距离达到相同的基团,则该中心点是对称中心。
COOH
CH3
H
H
H
H
H3C H
H CH3
CH3
COOH
具有对称中心的分子也不具有手性,为非手性分子。
请分析甲烷分子的对称因素
4个C3对称轴 3个C2对称轴
6.4.3 构型的标记法
(1) D / L标记法
CHO
H
OH
CHO
HO
H
CH2OH
D-(+)-甘油醛
CH2OH
L-(-)-甘油醛
以甘油醛为基础,通过化学方法合成其它化合物,如果与手性原
子相连的键没有断裂,则仍保持甘油醛的原有构型。例:
CHO
[O]
H OH
CH2OH
D-(+)-甘油醛
COOH [H]
COOH
6.3.1 旋光性 旋光性——能使偏振光的振动方向发生旋转的性质; 旋光性物质(或叫光活性物质) ——具有旋光性的物质。
右旋和左旋 —— 使偏振光振动平面向右旋转称右旋,“ + ” —— 使偏振光振动平面向左旋转称左旋,“ - ”
凡是手性分子都具有旋光性 (有些手性分子旋光度很小);而非手性分子则没有旋光性。
B. 但一个手性分子在反应过程中产生第二个手性中心时, 将会产生二个不等量的非对映体。
练习6.5 下列(A)、(B)、(C)、(D)四种化合物在哪种情况 是有旋光性的?
CH3 HO H
H OH CH3
(A)
CH3 H OH HO H
CH3
(B)
CH3 H OH H OH
CH3
(C)
CH3 HO H HO H
CH
H
H
Cl
CH
HO
H
Cl
CH
HO
CH3
与四个互不相同的基团相连的碳原子叫做不对称碳原
子或叫手性碳原子,通常用*标出手性碳原子
“手性碳”与“手性分子”
A. 含有手性碳的分子不一定是手性分子; B. 手性分子不一定要有手性碳。 C. 分子有无手性只取决于分子有没有对称面、对称
中心或交替对称轴
外消旋体 — 由等量的对映体相混合而成的混合物。 (没有旋光性)
COOH
C
CH3
H
OH
(+)-乳酸 m.p. 53oC []D= +2.6o pKa=3.79(25 oC)
COOH
C
H
CH3
HO
外消旋乳酸
()-乳酸 m.p. 53oC []D= -2.6o pKa=3.83(25 oC)
()-乳酸 m.p. 18oC []D=0 pKa=3.86(25 oC)
手性分子——既没有对称面,又没有对称中心,也没 有4重交替对称轴的分子,都不能与其镜象叠合,都 是手性分子;
对称轴的有无对分子是否具有手性没有决定作用。
手性分子的一般判断:只要一个分子既没有对称面,又 没有对称中心,就可以初步判断它是手性分子。
判定下列分子是否具有手性
Cl
H
CC
H
Cl
A
H
H
COOH
H
OH
H
OH
HO
H
COOH
左旋体 ( - )
m.p. 128 oC
COOH
HO
H
HO
H
H
OH
COOH
右旋体 ( +)
128 oC
外消旋体m.p. 155 oC
COOH
H
OH
H
OH
H
OH
COOH
内消旋体
170 oC
COOH
HO
H
H
OH
HO
H
COOH
内消旋体
152 oC
大量的实验事实证明:
A. 一个非手性分子在反应过程中产生一个手性中心时,产 物为外消旋体;
CH3CH2
D H
Br H
CH3
CH2CH3
D
H
H
Br
CH3
D H
CH3CH2
Br H
CH3
写出Fischer投影式:
COOH
H
OH
HO
H
CH3
H
H
OH
OH
H
CH3 COOH
H
OH
COOH
OH
CH3
COOH
H
OH
H
OH
CH3
CH3
H
Br
Br
H
CH3
CH3
Br
H
H
Br
CH3
H H3C
H CH3
6.4 含有一个手性碳原子的化合物的对映异构
6.4 含有一个手性碳原子的化合物的对映异构
6.4.2 构型的表示法
构型的表示法 Fischer 投影式 1.构型的表示法
19世纪下半叶和20世纪之初,在有机化学领域中,德国的 费歇尔发现了苯肼,对糖类、嘌呤类有机化合物的研究取得了 突出的成就,因而荣获1902年的诺贝尔化学奖。
他对科学发展的贡献,归纳起来,主要有以下三个方面, 一、对糖类的研究;二、对嘌呤类化合物的研究;三、对蛋白 质;主要是氨基酸、多肽的研究
6.5.2 含有两个相同手性中心化合物的构型异构
COOH
COOH
COOH
COOH
H
OH HO
H
H
OH HO
H
HO
H
H
OH
H
OH HO
H
COOH
COOH
COOH
COOH
2R, 3R (+)
Ⅰ
2S, 3S (-)
Ⅱ
2R, 3S
Ⅲ=
2S, 3R
Ⅳ
内消旋体:虽有手性碳,但却不是手性分子,没有旋光性
内消旋体与外消旋体均无旋光性,但它们的本质不同。
CC
Cl
Cl
B
CH3 CH3
CH3
C
CH3 D
判定下列分子是否具有手性
