第十二章电解与库仑分析法-
电化学分析法PPT课件
-
3
电化学分析方法的分类及特点
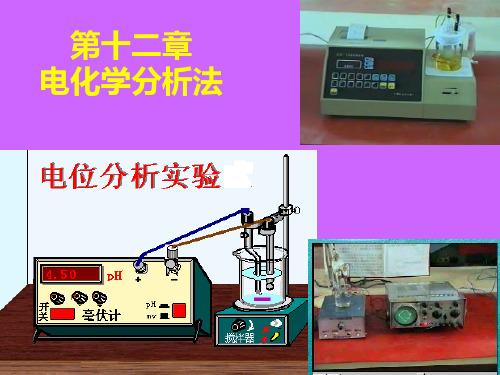
第十二章
方法名 测定的电参量 特点及用途 称
电位分 电极电位 析法
1、适用于微量组分的测定,对一价离子的测定误 差为4%,二价离子的测定误差为8%。
2、选择性好,适用于测定H+、F- Cl- K+等数十种 离子
电导分 电阻或电导 析法
1、适用于测定水的纯度(电解质总量) 2、选择性较差
库仑分 电量 析法
1、不需要标准物质,准确度高
2、适用于测定许多金属、非金属离子及一些有机 化合物
极谱与 电流-电压曲线 1、选择性好,可用于多种金属离子和有机化合物
伏安分
的测定
析法
2、适用于微量和痕量组分的测定
-
4
第十二章
电化学滴定法与化学滴定法的区别
不需用指示剂指示终点
不受溶液颜色、浑浊等的限制
第十二章 电化学分析法
-
1
第一节 概述
第十二章
[定义]
利用物质的电学、电化学性质及其变 化而建立起来的分析方法,统称为电化学分 析法。
-
2
第一节 概述
第十二章
[操作方法]
通常是将待测试液与适当的电极构成一 个化学电池,然后根据物质的组成及含量与 化学电池的某些电参量之间的计量关系进行 分析测试。
在突跃(pH、pM、pX、等的突跃)较小和 无合适指示剂的情况下,可以很方便地使用电 位滴定法。
-
5
第十二章
电化学滴定法与化学滴定法的区别
克服了用人眼判断终点造成的主观误差 提高了测定的准确度 易于实现滴定的自动化
-
6
第二节 电位法的基本概念
第十二章
定义
《电解和库仑分析法》课件

实际应用对比
深入研究电解和库仑分析法在 实际分析问题中的对比实例。
电解和库仑分析法的实验操作
1
实验器材及试剂
探索进行电解和库仑分析实验所需的仪器和试剂。
2
实验步骤和注意事项
详细描述电解和库仑分析的实验步骤及需要注意的事项。
3
实验数据处理和分析
介绍电解和库仑分析实验数据的处理方法和分析技巧。
结论与展望
《电解和库仑分析法》 PPT课件
探索电解和库仑分析法的精妙之处,开启你的化学分析之旅。
电解分析法
1
简介
了解电解分析法的基本概念和应用领域。
基本原理
2
掌握电解分析法背后的科学原理和关键
步骤。
3
分类
了解电解分析法的不同分类和各自特点。
应用实例
4
探索电解分析法在实际问题中的应用案 例和成果。
库仑分析法
1 简介
认识库仑分析法的起源和基本概念。
3 分类
探索库仑分析法的不同类型和各自特点。
2 基本原理
了解库仑分析法的理论基础和实验原理。
4 应用实例
揭示库仑分析法在各个领域中的应用案例。
电解和库仑分析法的比较
优缺点对比
比较电解和库仑分析法各自的 优点和限制,并找到适合的应 用场景。
适用范围对比
了解两种分析法在不同领域中 的使用情况和局限性。
电解和库仑分析法的意义
总结电解和库仑分析法对科学研究和实践的重要意义。
发展趋势
展望电解和库仑分析法未来发展的前景和新的研究方向。
备注
以上内容仅供参考,具体请根据课堂教学为准。
分析化学第十二章 库仑分析法

一、测量装置
滴定池是仪器的心脏,池内有一对电解电 极和一对指示电极。
在滴定池中待测组分与电生滴定剂反应, 同时由库仑放大器输出的电压加到电解电极 对上,使电解电极产生相对应的电流,因而 又产生一定量的电生滴定剂。
一、测量装置
微库仑放大器由指示电极对产生的信号与 外加偏压反向串联后加到库仑放大器的输入 端,放大器输出端加到滴定池的电解电极对 上,使之产生对应的电流流过滴定池,电解 产生出滴定剂。
极(4支);秒表。 (2)试剂 0.1 mol/L KI溶液(称取1.7g KI溶于
100 mL蒸馏水中)。
二、库仑分析仪的使用
3. 测定内容与操作步骤 (1)清洗Pt电极。 (2)连接仪器装置。 (3)调节仪器进行预“滴定”。 (4) Na2S2O3试液的测定
二、库仑分析仪的使用
4. 数据处理
二、方法原理
利用串联在电解电路中的库仑计,测量从 电解开始到待测组分解完全析出时消耗的电 量,由法拉第定律计算出被测物质的含量。
三、电荷量的测量
1.重量库仑计
主要有银库仑计,以铂坩埚为阴极,银棒 为阳极,用多孔瓷管把两极分开,坩埚内盛 有1~2mol/L的AgNO3溶液,串联到电解回 路上。
电解结束后,称量坩埚的增重,由析出银的 质量算出所消耗的电量
一、库仑分析仪
终点指示的方法有指示剂法、电位指示法、电 流指示法、电导指示法等,仪器上通常采用电位 指示法或电流指示法,所以仪器上的终点指示系 统由参比电极和指示电极组成。
不同滴定分析中的指示电极,参照电位滴定中 的指示电极选取的方法进行选择。
二、库仑分析仪的使用
以硫代硫酸钠标准溶液的标定介绍库仑分析仪 的使用方法。 1.测定原理
分析化学
库仑分析法

本章能力目标
能掌握恒电流库仑滴定的基本技术 能掌握终点指示方法及电生滴定剂的产
生方式
能操作常用库仑分析仪
第一节
基本原理
一、电解现象和电解电量 二、法拉第电解定律(库仑定律)
一、电解现象和电解电量
1. 电解现象 在电解池的两个电极上,加上一直流 电压。由于外加电压的作用,导致电极上 发生氧化-还原反应(电极反应),同时伴 随着电流流过,这一过程称为电解现象。
1.内部电生滴定剂法
内部电生滴定剂法是指电生滴定剂的 反应和滴定反应在同一电解池中进行的。 电解池内除了含有待测组分,还应含有大 量的辅助电解质。目前多数库仑滴定以此 种方法产生滴定剂。
辅助电解质: (1)要以100%的电流效率产生滴定剂,无 副反应发生。 (2)要有合适的终点指示方法。 (3)产生滴定剂与待测物之间能快速发生 定量反应。
2.电位法
选用合适的指示电极来指示滴定终, 其电极电位也随之变化。到达化学计量 点时,指示电极的电位发生突跃,从而 指示滴定终点的到达。因此,可以根据 滴定反应的类型,在电解池中另外置入 合适的指示电极和参比电极,以直流毫 伏计量(高输入阻抗)或酸度计测量电 动势或pH的变化。
例如利用库仑滴定法测定溶液中酸的 浓度时,可用pH玻璃电极为指示电解, 甘汞电极为参比电极指示终点。以N a2SO4作为电解质为例,用铂阴极为工作 电极,银阳极为辅助电极,其电极反应为: 工作电极电极反应: 2H2O +2e- →H2+2OH辅助电极电极反应: H2O + 2e- →1/2O2 + 2H+ 可以根据酸度计上的pH的突跃动指示滴定 终点。
m(Cu ) 0.5 60 24.12 63.5 0.238( g ) 2 96487
(整理)第12章电解与库仑分析法

第12章电解与库仑分析法电解与库仑分析电解分析法是一种经典的电化学分析法,它包括两种内容:电重量分析法――通过电解后直接称量电极上被测物质的质量进行分析的,常用于高含量物质的分析;电解分析法――控制一定的电解条件进行电解以达到不同物质的分离。
库仑分析法也是建立在电解过程上的分析法,它是通过测量电解过程所消耗的电量来进行分析的,主要用于微量或痕量物质的分析。
第一节电解分析法一、电解分析法的基本原理(一)电解过程中电流与电压的关系图12.1 电解装置电解装置主要由电解池(包括电极、电解溶液及搅拌器)、外加电压装置(分压器)及显示仪器三部分,如图12.1所示。
电解是利用外部电能使化学反应向非自发方向进行的过程。
在电解池的两电极上施加的直流电压达到一定值时,电极上就发生氧化还原反应,电解池中(及回路)就有电流通过,这个过程称为电解。
以在0.1mol/L HNO3 介质中电解0.1mol/LCuSO4为例,当移动分压器的滑线电阻,使施加到两铂电极上的电压(V)达到一定值时,电解就发生,即电极反应发生:与外电源负极连接的Pt电极(此时也是负极)上Cu2+被还原,此电极为阴极:Cu2+ + 2e → Cu与外电源正极连接达的Pt电极(此时也是正极)上有气体O2产生,此电极为阳极:2H2O → 4H++ O2↑ + 4e此时在外线路的电表上可以看到有电流(i)通过,若加大外电压,则电流迅速上升。
i-V关系曲线为图12.2所示。
应该注意到:电解所产生的电流(电解电流)是与电极上的反应密切相关的,电流进出电解池是通过电极反应来完成的,与电流通过一般的导体有本质的不同。
这是电解的一大特点。
(二)分解电压和析出电位图12.2 电解过程电流-电压曲线图12.2的i-V曲线中,AB段为残余电流,此时尚未观察到电极反应的明显发生,主要是充电电流,当到达一定的外加电压V(B点)时,电极反应开始发生,产生了电解电流,并随着V的增大而迅速上升为BC直线,BC线的延长线与i=0的V轴交点D所对应的电压,叫做分解电压V分。
电解与库仑分析法

第11章电解与库仑分析法【11-1】解释下列名词。
电解、理论分解电压、实际分解电压、析出电位、控制电流电解法、控制电位电解法、汞阴极电解法、死停终点法、电流效率。
答:电解:将电流通过电解质溶液或熔融态电解质,(又称电解液),在阴极和阳极上引起氧化还原反应的过程,电化学电池在外加直流电压时可发生电解过程。
理论分解电压:使被电解的物质在两个电极上产生迅速的、连续不断的电极反应时所需要的最小外加电压的最小外加电压。
实际分解电压:指使电解质在电极上分解生成电解产物所需施加的最小电压。
析出电位:物质在阴极上产生迅速的连续不断的电极反应而被还原析出时所需要的最正的阴极电位或在阳极上被氧化析出时的阴极电位;或在阳极上被氧化析出时所需要的最负阳极电位。
控制电流电解法:在恒定的电流条件下进行电解,通过称量电解前后电极上沉积的析出物的质量来进行定量分析。
控制电位电解法:控制工作电极(阴极或阳极)电位为一恒定值的条件下进行电解的分离分析方法。
汞阴极电解法:电解时以汞作阴极,铂为阳极的电解法。
死停终点法:指把两个相同的铂电极插入滴定溶液中,在两个电极之间外加一小电压,观察滴定过程中通过两个电极间的电流突变,根据电流的变化情况确定滴定终点。
电流效率:指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比,通常用符号η表示。
【11-2】什么是电解分析和库仑分析?它们的共同点是什么?不同点是什么?答:电解分析是指在外加电压的作用下通过电极反应将试液中的待测组分转变为固相析出,称量析出物的重量以求得被测组分的含量。
库仑分析是指通过测量被测物质在100%电流效率下电解所消耗的电量来进行定量分析的方法。
共同点:测定的过程中不需要基准物质和标准溶液,且都基于电解反应。
不同点:电解分析采用称量电解后铂阴极的增量来定量的,电极不一定具有100%的电流效率;库仑分析用电解过程中消耗的电量来定量,要求电极反应必须单纯,用于测定的电极反应必须具有100%的电流效率,电量全部消耗在被测物质上。
仪器分析教程(第二版)课后题部分答案

要以In-为主要存在形式, 所
以有:A=εl c 得 0.84=ε×1×10-3×1 ε=840L/mol/cm
由公式:
pka pH
lg
A (L ) A(HL) A
7.00
lg
0.588 0.840 0 0.588
6.63
3.24 计算下列化合物的λmax
CH3
(1)
参看39页表3.5
适用范围:主要用于低熔点金属,合金的分析,高含量元素的 分析,难以激发元素的分析。
电感耦合等离子体:电子和离子被电场加速,同时和气体分子、 原子等碰撞,使更多的气体电离,电子和离子各在炬管内沿 闭合回路流动,形成涡流,在管口形成火炬状的稳定的等离 子焰炬。其特性:①由于等离子焰炬具有很高的温度,所以 具有很强的激发和电离能力,能激发很难激发的元素,有很 强的离子线②具有很高的灵敏度和很好的检测限,相对检出 限可低于ng级,适用于微量和痕量分析。适用范围宽,可测 元素达70多种③稳定性好,分析结果的精密度和准确度都很 高④由于它不用电极,可避免由电极污染而带来的干扰⑤背 景发射和自吸效应很小,有很强的抗干扰能力,可进一一步 降低检出限和光谱背景。
解: (1() a)阳极:Cr2+ Cr3+ +e
=-0.41v (-)
阴极:Pb2+ +2e Pb
=-0.126v (+)
1106 1750
sin
48.2 sin 11.2
1
315.0(nm)
2.6 用dn/dλ=1.5×10-4 的60°熔融石英棱镜和刻有1200条·mm-1的光栅来色散Li的 460.20nm及460.30nm两条谱线,试计算:(1)分辨率 (2)棱镜和光栅的大小
仪器分析各章习题与答案重点讲义资料

仪器分析各章习题与答案重点讲义资料第⼀章绪论问答题1. 简述仪器分析法的特点。
第⼆章⾊谱分析法1.塔板理论的要点与不⾜是什么?2.速率理论的要点是什么?3.利⽤保留值定性的依据是什么?4.利⽤相对保留值定性有什么优点?5.⾊谱图上的⾊谱流出曲线可说明什么问题?6.什么叫死时间?⽤什么样的样品测定? .7.在⾊谱流出曲线上,两峰间距离决定于相应两组分在两相间的分配系数还是扩散速率?为什么?8.某⼀⾊谱柱从理论上计算得到的理论塔板数n很⼤,塔板⾼度H很⼩,但实际上柱效并不⾼,试分析原因。
9.某⼈制备了⼀根填充柱,⽤组分A和B为测试样品,测得该柱理论塔板数为4500,因⽽推断A和B在该柱上⼀定能得到很好的分离,该⼈推断正确吗?简要说明理由。
10.⾊谱分析中常⽤的定量分析⽅法有哪⼏种?当样品中各组分不能全部出峰或在组分中只需要定量其中⼏个组分时可选⽤哪种⽅法?11.⽓相⾊谱仪⼀般由哪⼏部分组成?各部件的主要作⽤是什么?12.⽓相⾊谱仪的⽓路结构分为⼏种?双柱双⽓路有何作⽤?13.为什么载⽓需要净化?如何净化?14.简述热导检测器的基本原理。
15.简述氢⽕焰离⼦化检测器的基本结构和⼯作原理。
16.影响热导检测器灵敏度的主要因素有哪些?分别是如何影响的?17.为什么常⽤⽓固⾊谱分离永久性⽓体?18.对⽓相⾊谱的载体有哪些要求?19.试⽐较红⾊载体和⽩⾊载体的特点。
20.对⽓相⾊谱的固定液有哪些要求?21.固定液按极性⼤⼩如何分类?22.如何选择固定液?23.什么叫聚合物固定相?有何优点?24.柱温对分离有何影响?柱温的选择原则是什么?25.根据样品的沸点如何选择柱温、固定液⽤量和载体的种类?26.⽑细管⾊谱柱与填充柱相⽐有何特点?27.为什么⽑细管⾊谱系统要采⽤分流进样和尾吹装置?28.在下列情况下⾊谱峰形将会怎样变化?(1)进样速度慢;(2)由于汽化室温度低,样品不能瞬间汽化;(3)增加柱温;(4)增⼤载⽓流速;(5)增加柱长;(6)固定相颗粒变粗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电极电位的大小决定的。原电池发生的 反应为:
负极
Cu-2e→Cu2+
正极
O2+4H++4e→2H2O源自反应方向刚好与电解反应相反。
设 溶 液 中 CuSO4 和 H+ 离 子 浓 度 均 为 lmol/L,此原电池的电动势为
U=E正-E负=1.23-0.35=0.89V
可见,电解时产生了一个极性与 电解池相反的原电池,其电动势称为 “反电动势”(E反)。因比,要使电 解顺利进行,首先要克服这个反电动 势。
电解过程
电解硫酸铜溶液, 当逐渐增加电压,达到 一定值后,电解池内与电源 “-” 极相连的阴 极上开始有Cu生成,同时在与电源“+”极相连 的阳极上有气体放出,电解池中发生了如下反 应:
阴极反应:Cu2+ + 2e = Cu
阳极反应:2H2O = O2 + 4H+ +4e
电池反应: 2Cu2+ + 2H2O = 2Cu + O2 + 4H+
按实验所控制的参数(E或i)不同, 本章的方法可分为控制电位法和控制电流 法。
控制电位法是控制电极电位在某一恒 定值,使电位有一定差值的几种离子能够 分别进行测定,因而选择性较高,但分析 时间较长;
控制电流法是控制通过电解池的电流, 一般为2~5A,电解速度较快,分析时间较 短,但选择性较差,需要有适当的指示电 解完全或电流效率100%的方法。
让我们来讨论这个(0.47V)过电压和过 电位
由于电极反应引起的电极电位偏 离平衡电位的现象,对阴极反应而 言,必须使阴极电位比其平衡电位 更负一些;对阳极反应而言,则必 须使阳极电位比其平衡电位更正一 些。电化学极化伴随产生过电位。 可分析如下:
电极材料和电极表面状态
过电位的大小与电极材料有极大 关系。例如,在不同材料的电极上, 氢析出的超电位差别很大。它25℃, 电流密度为10mA/cm2时,铅电极 上氢的过电位为1.09V,汞电极上 为1.04V,锌和镍电极上为0.78V, 而铜电极上为0.58V。
文档名
概述
• 电解分析法是将被测溶液置于电解装置 中进行电解,使被测离子在电极上以金属 或其它形式析出,由电解所增加的重量求 算出其含量的方法。这种方法实质上是重 量分析法,因而又称为电重量分析法。
• 将电解方法用于物质的分离,则为电解 分离法。
• 库仑分析法是在电解分析法的基础 上发展起来的一种分析方法。它不 是通过称量电解析出物的重量,而 是通过测量被测物质在100%电流效 率下电解所消耗的电量来进行定量 分析的方法。
B. 实际分解电压(析出电位): 实际开始发生电解反应时的电压,其值
大于理论分解电压(D点)。
• 定量关系
U外=U分+iR =[(E平(阳)+ηa)-(E平(阴)+ηc)]+iR
通常,可设iR→0,则 U外=U分=(E平(阳)+ηa)-(E平(阴)+ηc)
对于电解1mol/LCuSO4溶液,其E分 不 为 0 . 8 9 V, 而 为 1 . 3 6 V 。
过电位可分为浓差过电位和电化学 过电位两类。前者是由浓差极化产生的, 后者是由电化学极化产生的。
电化学极化:电解时,电极上有净电 流流过时,电极电位偏离其平衡电 位的现象。
浓差极化:电流流过电极,表面形成 浓度梯度。使正极电位增大,负极 电位减小。
减小浓差极化的方法: a.减小电流,增加电极面积; b.搅拌,有利于扩散
• 在阴极上,析出电位愈正者,愈 易还原;
• 在阳极上,析出电位愈负者,愈 易氧化。
• 分解电压对整个电解池而言; • 析出电位是对某一电极而言。
对可逆电极过程来说,分解电压与析 出电位关系为:
U分=E析(阳)-E析(阴)
设 溶 液 中 CuSO4 和 H+ 离 子 浓 度 均为lmol/L,此原电池的电动势为
有两个原因,一是由于电解质溶液有一 定的电阻,欲使电流通过,必须用一部分电 压克服iR(i为电解电流,R为电解回路总电 阻)电位降,一般这是很小的;二是主要用 于克服极化现象产生的阳极反应和阴极反应 的过电位(η阳和η阴)
多加的0.47V,就是用于克服iR电位 降和由于极化产生的阳极反应和阴极反 应的过电位。
如将电源切断,这时外加电压虽已经 除去,但伏特计上的指针并不回到零,而 向相反的方向偏转,这表示在两电极间仍 保持一定的电位差。这是由于在电解作用 发生时,阴极上镀上了金属铜,另一电极 则逸出氧。金属铜和溶液中的Cu2+组成一 电对,另一电极则为氧的电极。当这两电
对联接时,形成一原电池。
此原电池的反应方向是由两电对的
二、分解电压和析出电位
在铂电极上电解硫酸铜溶液。当外加 电压较小时,不能引起电极反应,几乎 没有电流或只有很小电流通过电解池。 如继续增大外加电压,电流略为增加, 直到外加电压增加至某一数值后,通过 电解池的电流明显变大。这时的电极电 位称析出电位(E析),电池上的电压称分 解电压(U分)。
• 分解电压是指被电解物质在两电极上产 生迅速的、连续不断的电极反应所需的 最小的外加电压。
理论分解电压U分为:
U分=E反
U外-U分=iR
• 析出电位是指物质在阴极上产生迅速 的、连续不断的电极反应而被还原析出 所需的最正的阴极电位,或在阳极上被 氧化时所需的最负的阳极电位。
• 要使某一物质在阴极上析出,产生迅 速的、连续不断的电极反应,阴极电位 必须比析出电位为负;如在阳极上氧化 析出,则阳极电位必须比析出电位更正。
电化学极化是由电化学反应本身的迟 缓性所引起的。一个电化学过程实际上由 许多分步过程所组成,其中最慢一步对整 个电极过程的速度起决定性的作用。在许 多情况下,电极反应这一步的速度很慢, 需要较大的活化能。
理论分解电压与实际分解电压
A. 理论分解电压: 根据能斯特方程计算,使反应进行,需
要提供的最小外加电压(D’点) 。
U=E正-E负=1.23-0.35=0.89V
对 于 电 解 1mol/LCuSO4 溶 液 , 其 E分不为0.89V, 而为1.36V。
三、过电位与过电压
过电压是指当电解以十分显著的速度速度进 行时,外加电压超过可逆电池电动势的值。过电 压η包括阳极过电位ηa和阴极过电位ηc。
η =分解电压-可逆电池电动势 η= ηa -ηc
