CCK8法检测细胞增殖预实验
cck8细胞增殖实验原理

cck8细胞增殖实验原理CCK-8细胞增殖实验原理引言:细胞增殖实验是生物学和医学研究中常用的一种实验方法,用于测定细胞的增殖能力。
CCK-8(Cell Counting Kit-8)是一种常用的细胞增殖检测试剂,通过测量细胞中的还原型CCK-8转化为溶液中的发色体,从而间接反映细胞增殖的能力。
本文将介绍CCK-8细胞增殖实验的原理及其应用。
一、CCK-8细胞增殖实验原理:CCK-8细胞增殖实验原理基于细胞代谢产物对试剂的还原作用。
CCK-8试剂中含有一种能被还原的黄色酶,当细胞活力高时,细胞内的代谢产物会将CCK-8试剂还原为有色产物。
实验原理如下:1. 细胞培养:将待测细胞接种于培养皿中,培养至适当的细胞数和状态。
2. 细胞处理:根据实际需求,对待测细胞进行处理,例如给予药物处理、基因转染等。
3. CCK-8试剂处理:将CCK-8试剂加入培养皿中,与细胞共同孵育一段时间。
4. 反应终止:孵育一段时间后,加入一种酸性溶液终止反应,阻止进一步的细胞代谢反应。
5. 测量吸光度:将培养皿中的溶液转移到微孔板中,使用酶标仪或多功能酶标仪在450 nm波长下测量吸光度。
6. 数据分析:根据吸光度值,计算细胞增殖的相对程度,比较不同处理组的细胞增殖能力。
二、CCK-8细胞增殖实验的应用:CCK-8细胞增殖实验广泛应用于生物医学研究、药物筛选、细胞毒性评价等领域。
以下列举几个常见的应用场景:1. 药物筛选:CCK-8实验可用于评估药物对细胞增殖的影响。
将细胞分为不同处理组,给予不同浓度的药物处理,通过测量吸光度值,评估药物对细胞增殖的抑制或促进作用。
2. 细胞毒性评价:CCK-8实验可用于评估化合物、材料或环境因素对细胞生存能力的影响。
通过测量吸光度值,判断待测物质对细胞的毒性程度。
3. 细胞增殖动力学研究:CCK-8实验可用于研究细胞增殖的动力学过程。
通过连续测量不同时间点的吸光度值,得到细胞增殖曲线,进一步分析细胞增殖速率和生长特性。
CCK—8法在淋巴细胞增殖检测中最佳实验条件的筛选

CCK—8法在淋巴细胞增殖检测中最佳实验条件的筛选目的筛选CCK-8法在淋巴细胞增殖检测中的最佳实验条件。
方法采用正交实验设计,对初始细胞浓度、培养时间、LPS浓度、显色时间这4个主要因素各水平对人外周血单个核细胞(PBMC)和小鼠脾细胞增殖的影响进行试验研究,对各实验组合测得的刺激指数进行方差分析。
结果CCK-8检测人PBMC 增殖试验的最佳条件:初始细胞浓度为2.5×106/mL,培养时间为48 h,LPS浓度为1 μg/mL,加入CCK-8后孵育4.5 h;检测小鼠脾细胞增殖试验的最佳条件:初始细胞浓度为5.0×106/mL,培养时间为48 h,LPS浓度为1 μg/mL,加入CCK-8后孵育4.5 h。
结论CCK-8法便捷、灵敏、重复性好,可作为检测淋巴细胞增殖的稳定方法。
本研究建立的CCK-8最佳实验条件可为免疫调节作用的药物体外筛选和免疫药理学作用的研究提供依据。
[Abstract] Objective To optimize the experimental conditions of CCK-8 in lymphocyte proliferation assays. Methods An orthogonal test was designed to investigate the influence of four major factors (cell density,culture period,concentration of LPS and duration of incubation with CCK-8)on cell proliferation of human PBMC and mouse splenocyte. ANOV A was carried out to analyze the stimulation indices of all experimental condition combinations. Results The optimal conditions for CCK-8 was as follows:for PBMC,cell density was 2.5×106/mL,culture period was 48 h,concentration of LPS was 1 μg/mL,and duration of incubation with CCK-8 was 4.5 h;and for splenocyte,cell density was 5.0×106/mL,culture period was 48 h,concentration of LPS was 1 μg/mL,and duration of incubation with CCK-8 was 4.5 h. Conclusion The optimized CCK-8 protocol is a sensitive,convenient and stable quantitative method to evaluate lymphocyte proliferation. This result can provide evidence in screening of immunomodulating drugs and investigation of their immunopharmacology.[Key words] CCK-8;PBMC;Lymphocyte proliferation;Orthogonal test檢测淋巴细胞增殖的方法主要有形态学检查法、放射性核素标记法和四氮唑盐比色法等。
cck8检测细胞增殖原理

cck8检测细胞增殖原理
CCK-8(CellCountingKit-8)是一种广泛应用于细胞增殖及细胞毒性实验中的水溶性化合物。
CCK-8试剂盒可以用于评估各种生物、药物和化学物质对细胞增殖的影响。
CCK-8的实现原理是通过测定细胞内还原性代谢活性酶(如脱氢酶)生成的水溶性形式的四氮唑盐的量,从而评估细胞增殖情况。
使用CCK-8检测细胞增殖的方法十分简单。
首先,将待测物(如药物、化学物质等)加入到细胞培养液中,让细胞在特定时间内与其接触。
然后,向培养液中加入适量的CCK-8试剂,并在紫外线或荧光光谱仪中测量吸光度。
CCK-8的加入会使细胞内代谢活性酶发生还原反应,从而产生水溶性四氮唑盐,其吸光度与细胞数量成正比。
因此,吸光度越高,细胞数量也就越多。
CCK-8检测细胞增殖的优点在于其高度灵敏和高通量的特点,能够快速、准确地测定细胞数量,同时减少检测误差和节省实验时间。
因此,CCK-8已经成为了现代细胞生物学和药物研究中不可或缺的实验工具之一。
- 1 -。
细胞增殖CCK8检测总结
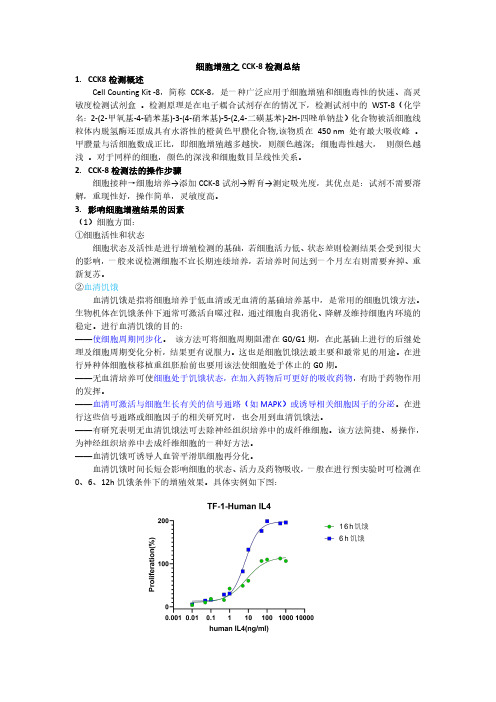
细胞增殖之CCK-8检测总结K8检测概述Cell Counting Kit-8,简称CCK-8,是一种广泛应用于细胞增殖和细胞毒性的快速、高灵敏度检测试剂盒。
检测原理是在电子耦合试剂存在的情况下,检测试剂中的WST-8(化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐)化合物被活细胞线粒体内脱氢酶还原成具有水溶性的橙黄色甲臜化合物,该物质在450nm处有最大吸收峰。
甲臜量与活细胞数成正比,即细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。
对于同样的细胞,颜色的深浅和细胞数目呈线性关系。
K-8检测法的操作步骤细胞接种→细胞培养→添加CCK-8试剂→孵育→测定吸光度,其优点是:试剂不需要溶解,重现性好,操作简单,灵敏度高。
3.影响细胞增殖结果的因素(1)细胞方面:①细胞活性和状态细胞状态及活性是进行增殖检测的基础,若细胞活力低、状态差则检测结果会受到很大的影响,一般来说检测细胞不宜长期连续培养,若培养时间达到一个月左右则需要弃掉、重新复苏。
②血清饥饿血清饥饿是指将细胞培养于低血清或无血清的基础培养基中,是常用的细胞饥饿方法。
生物机体在饥饿条件下通常可激活自噬过程,通过细胞自我消化、降解及维持细胞内环境的稳定。
进行血清饥饿的目的:——使细胞周期同步化。
该方法可将细胞周期阻滞在G0/G1期,在此基础上进行的后继处理及细胞周期变化分析,结果更有说服力。
这也是细胞饥饿法最主要和最常见的用途。
在进行异种体细胞核移植重组胚胎前也要用该法使细胞处于休止的G0期。
——无血清培养可使细胞处于饥饿状态,在加入药物后可更好的吸收药物,有助于药物作用的发挥。
——血清可激活与细胞生长有关的信号通路(如MAPK)或诱导相关细胞因子的分泌。
在进行这些信号通路或细胞因子的相关研究时,也会用到血清饥饿法。
——有研究表明无血清饥饿法可去除神经组织培养中的成纤维细胞。
该方法简捷、易操作,为神经组织培养中去成纤维细胞的一种好方法。
CCK8法检测细胞增殖预实验教学文稿

C C K8法检测细胞增殖预实验SRT-1720, EX527一定要应用在白血病细胞株起作用的浓度方可比较对293T细胞和白血病细胞株的不同影响,请重复实验。
实验日期:2015/08/22-2015/08/27实验项目:CCK8法检测细胞增殖实验地点:广西医科大学药基楼14楼生物靶向中心实验人员:高宗燕、宁海萍、李登峰实验目的:检测SRT-1720/EX527刺激293T细胞后对细胞增殖的影响主要试剂:SRT-1720,EX527,CCK8试剂盒主要仪器:酶标仪实验步骤:一、制作标准曲线(测定细胞具体数量时)1、先用细胞计数板计数所制备的细胞悬液中的细胞数量,然后接种细胞至96孔板。
2、设置4个细胞浓度梯度:0,2000,4000,8000,每组4个复孔。
3、接种后培养24小时使细胞贴壁,然后加CCK试剂培养4小时后测定OD值,制作出一条以细胞数量为横坐标(X轴),OD值为纵坐标(Y轴)的标准曲线。
根据此标准曲线可以测定出未知样品的细胞数量(试用此标准曲线的前提是实验的条件要一致,便于确定细胞的接种数量以及加入CCK后的培养时间。
)图一、标准曲线二、细胞增殖检测1、在96孔板中配置100μL的细胞悬液。
将培养板在培养箱预培养24小时(在37℃,5% CO2的条件下)。
2、向培养板加入10μL SRT-1720(终浓度3um),EX527(终浓度100um)。
3、将培养板在培养箱孵育约24h4、每孔加入10μL CCK溶液(注意不要再孔中生成气泡,它们会影响OD值的读数)。
5、将培养板在培养箱内孵育2小时。
6、用酶标仪测定在450nm处的吸光度。
图二、3um SRT1720刺激293T细胞后的细胞增殖曲线。
该曲线呈S形,符合细胞正常生长情况。
图三、100um EX527刺激293T细胞后的细胞增殖曲线。
该曲线前部分呈S形,符合细胞正常生长情况,但在进入对数期之后曲线有下滑,之后进入平台期。
分析:SRT1720为SIRT1特异性活化剂,在前期实验中对白血病细胞株的生长表现出抑制作用,此次实验中SRT1720对正常细胞(293T)的生长无明显抑制作用。
CCK-8实验步骤

CCK8检测细胞增殖/毒性的原理
Cell Counting Kit-8
●原理:该试剂中含有WST-8【化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝
基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐】,它在电子载体1-甲氧基-5-甲基吩嗪鎓硫酸二甲酯(1-Methoxy PMS)的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲瓒产物(Formazan dye)。
生成的甲瓒物的数量与活细胞的数量成正比。
因此可利用这一特性直接进行细胞增殖和毒性分析。
●方法
1、制备细胞悬液:细胞计数
2、接种到96孔板中:根据合适的铺板细胞数(每孔5000细胞),每孔约100ul 细胞悬液,同样的样本可做3个重复。
3、37℃培养箱中培养:24h-48h
4、加入10ul CCK8,孵育2-4h
5、测定450nm吸光度。
CCK-8法测定细胞的增殖能力

(1)制备细胞悬液:生长情况良好的细胞汇合率约80%的P3代HUVECs,胰酶消化方法制成细胞悬液。
(2)细胞接种:将常规培养的HUVECs细胞以2.0×103/孔,接种于96孔板中。
(3)测定A值并统计:每24小时,每组细胞任取8个孔,每孔中均加入标准制式的CCK-8液10μL。
继续放入培养箱放置2小时,取出后尽快酶联免疫检测仪上测定吸光度A值(λ=450nm)。
连续7天,检测结果绘制两组细胞的增殖曲线,所测得A值用均数±标准差表示,统计学分析每天三组所测值是否有统计学意义。
(4)注意事项:每孔细胞数量必须适量,需经过预实验,确定接种细胞数量;接种时细胞悬液需混匀;96孔板最外围一圈培养液易挥发,因此外围的孔加入PBS溶液,不作为实验检测孔;每孔加入CCK-8试剂液体量为10μL,为培养液体积1/10;加CCK-8溶液时枪头斜贴96孔板壁加入,以免产生气泡,加入试剂后轻摇96孔板,试剂与培养液应充分混匀。
cck8细胞增殖实验报告

cck8细胞增殖实验报告CCK8细胞增殖实验报告细胞增殖是生命科学研究中的重要课题之一,它关乎着生物体的生长和发育过程。
为了更好地了解细胞增殖的机理和规律,科学家们开展了一系列的实验研究。
本文将重点介绍一种常用的细胞增殖实验方法——CCK8实验,并对其原理、操作步骤及结果分析进行详细阐述。
一、CCK8实验的原理CCK8实验是一种基于细胞代谢活性的颜色反应的实验方法。
其原理基于细胞内的酶促反应,通过将CCK8试剂加入到培养皿中,可以与活细胞中的代谢产物发生反应,形成可溶性的紫色产物。
这种紫色产物的浓度与细胞数量成正比,因此可以通过测量其光密度来评估细胞的增殖情况。
二、CCK8实验的操作步骤1. 细胞培养与处理:首先,我们需要选择一种适合的细胞系进行培养。
将细胞悬浮液均匀地分布在培养皿中,并根据实验需要添加不同的处理条件,如药物处理、基因干预等。
2. CCK8试剂的加入:在培养皿中加入适量的CCK8试剂,并轻轻摇晃培养皿,使试剂均匀地分布在细胞上。
3. 孵育:将培养皿放置在恒温培养箱中,以维持适宜的温度和湿度,孵育一定的时间。
4. 光密度测量:使用酶标仪或分光光度计测量培养皿中产生的紫色产物的光密度值。
5. 数据分析:根据测得的光密度值,可以计算出细胞的增殖率,并进行统计学分析。
三、CCK8实验结果的分析CCK8实验的结果分析主要包括两个方面:对照组与实验组的比较,以及不同时间点的变化趋势。
1. 对照组与实验组的比较:首先,我们需要设立一个对照组,即未经处理的细胞。
通过与对照组进行比较,可以评估实验组的处理对细胞增殖的影响。
如果实验组的光密度值较对照组显著增加或减少,说明该处理条件对细胞增殖有明显的影响。
2. 不同时间点的变化趋势:在CCK8实验中,通常会选择不同的时间点进行测量,以了解细胞增殖的动态变化。
通过绘制时间-光密度曲线,可以观察到细胞增殖的变化趋势。
一般来说,细胞增殖呈现出指数增长的趋势,但也可能存在阶段性的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SRT-1720, EX527 —定要应用在白血病细胞株起作用的浓度方可比较对
293T细胞和白血病细胞株的不同影响,请重复实验。
实验日期:2015/08/22-2015/08/27
实验项目:CCK8法检测细胞增殖
实验地点:广西医科大学药基楼14楼生物靶向中心
实验人员:高宗燕、宁海萍、李登峰
实验目的:检测SRT-1720/EX527刺激293T细胞后对细胞增殖的影响
主要试剂:SRT-1720,EX527,CCK8试剂盒
主要仪器:酶标仪
实验步骤:
一、制作标准曲线(测定细胞具体数量时)
1、先用细胞计数板计数所制备的细胞悬液中的细胞数量,然后接种细胞至96孔板。
2、设置4个细胞浓度梯度:0, 2000,4000,8000,每组4个复孔。
3、接种后培养24小时使细胞贴壁,然后加CCK试剂培养4小时后测定OD值,制作出一条以细胞数量为
横坐标(X轴),OD值为纵坐标(Y轴)的标准曲线。
根据此标准曲线可以测定出未知样品的细胞数量(试用此标准曲线的前提是实验的条件要一致,便于确定细胞的接种数量以及加入CCK后的培养时间。
)
图一、标准曲线
二、细胞增殖检测
1、在96孔板中配置100卩泊勺细胞悬液。
将培养板在培养箱预培养24小时(在37C, 5% CO2的条件下)。
2、向培养板加入10 ^L SRT-1720(终浓度3um), EX527 (终浓度100um)。
3、将培养板在培养箱孵育约24h
4、每孔加入10卩L CCK溶液(注意不要再孔中生成气泡,它们会影响OD值的读数)。
5、将培养板在培养箱内孵育2小时。
6、用酶标仪测定在450nm处的吸光度。
图二、3um SRT1720刺激293T细胞后的细胞增殖曲线。
该曲线呈S形,符合细胞正常生长情况。
图三、100um EX527刺激293T细胞后的细胞增殖曲线。
该曲线前部分呈S形,符合细胞正常生长情况,但
在进入对数期之后曲线有下滑,之后进入平台期。
分析:
SRT1720为SIRT1特异性活化剂,在前期实验中对白血病细胞株的生长表现出抑制作用,此次实验中SRT1720对正常细胞(293T)的生长无明显抑制作用。
暗示SIRT1的活化对正常细胞的生长可能无明显影
响。
小剂量EX527为SIRT1特异性抑制剂,在前期实验中大剂量EX527对白血病细胞株的生长表现出抑制作用,而小剂量EX527无此效应,此次实验中大剂量EX527对正常细胞(293T)的生长可能有轻度抑制作用。
但不能以一次实验结果做出肯定的结论,该实验还需重复。
