不饱和羧酸和取代羧酸
合集下载
羧酸与取代羧酸

伯醇和仲醇成酯以“酰氧键断裂的机理”:
O CH3 C
-H2O
消除
OH
H+
+ OH HOC2H5
CH3 C OH
CH3
OH C OH
亲核加成 H O+C2H5
Ⅰ
Ⅱ
+ OH
-H+
CH3 C OC2H5
O CH3 C OC2H5
Ⅳ
Ⅴ
OH
+
CH3 C OH2 OC2H5
Ⅲ
11-28
伯醇和仲醇与酸成酯反应的特点: ①反应总的结果是亲核试剂醇分子中的-OR基取代了羧基中的羟基,是羧基的 亲核取代反应。 ②空间位阻对酯化反应的速度影响很大。 上述反应的中间体(Ⅱ)和 (Ⅲ)都是四面体结构,比较拥挤,如果羧酸和醇的α碳上连接的基团越多, 越大,这些中间体越不稳定,酯化反应越难进行。 酸或醇的烃基体积小、数目少,速度快。反应活性顺序如下:
11-13
问题11-2 分离苯甲酸、苯甲醇和苯酚的混合物。
COOH OH CH2OH
NaOH水溶液
水层 通CO2
溶液 H+ 晶体(苯甲酸) 晶体(苯酚)
醇层(苯甲醇)
羧酸酸性的应用: 分离、鉴别羧酸与酚
在制药工业中将羧酸制成钾盐、钠盐增加 药物的水溶性,提高药效
11-14
问题11-3 乙酸中也含有CH3CO基团,但不发生碘仿反应。为 什么?
AC
OH
性增强
O
当D为推电子基团, 酸
D C O H 性减弱
11-15
(1) 诱导效应
酸性排列顺序
HCOOH > CH3COOH >CH3CH2COOH
pKa 3.77
南昌大学有机化学16 不饱和羧酸和取代羧酸

第十六章 不饱和羧酸和取代羧酸
戴延凤博士 yfdai@
1
16.1 不饱和羧酸
一、不饱和羧酸的制法 芳醛的缩合反应
PhCHO + CH2(COOH)2
吡吡, 六六吡吡 回回
phCH
CHCO2H
PhCHO + (CH3CO)2O
PhCHO + CH3COOEt
CH3CO2Na 180 C
16.9 碳酸衍生物
20
练习: 练习: CH2COOH 1. 以丙二酸二乙酯为原料,合成 以丙二酸二乙酯为原料,
CH2COOH
T.M
(1) EtONa EtOH CH(CO Et) (1) NaOH 分 2 2 CH2(CO2Et)2 (2) ClCH2COOC2H5 CH COOC H (2) H O + 析 3
O CH2CH2OC2H5OC C COOC2H5 CH CH O2 2
C2H5ONa
CH2(CO2Et)2 O
EtONa 0.5 C
o
o
phCH
CHCO2H
5h
phCH
2h
CHCO2Et
2
二、α,β-不饱和羧酸的反应 不饱和羧酸的反应 1,4-加成(共轭体系) 加成(共轭体系) 加成
CH2 CHCOOH
狄尔斯-阿德尔反应(亲双烯体系) 狄尔斯 阿德尔反应(亲双烯体系) 阿德尔反应
三、α,β-不饱和羧酸的用途 不饱和羧酸的用途 甲基丙烯酸甲酯: 甲基丙烯酸甲酯:有机玻璃的原料 丙烯腈 丙烯腈:合成纤维原料
2 2 5
2.以丙二酸二乙酯为原料,合成 CH2CH2COOH 以丙二酸二乙酯为原料, 以丙二酸二乙酯为原料
CH2CH2COOH
戴延凤博士 yfdai@
1
16.1 不饱和羧酸
一、不饱和羧酸的制法 芳醛的缩合反应
PhCHO + CH2(COOH)2
吡吡, 六六吡吡 回回
phCH
CHCO2H
PhCHO + (CH3CO)2O
PhCHO + CH3COOEt
CH3CO2Na 180 C
16.9 碳酸衍生物
20
练习: 练习: CH2COOH 1. 以丙二酸二乙酯为原料,合成 以丙二酸二乙酯为原料,
CH2COOH
T.M
(1) EtONa EtOH CH(CO Et) (1) NaOH 分 2 2 CH2(CO2Et)2 (2) ClCH2COOC2H5 CH COOC H (2) H O + 析 3
O CH2CH2OC2H5OC C COOC2H5 CH CH O2 2
C2H5ONa
CH2(CO2Et)2 O
EtONa 0.5 C
o
o
phCH
CHCO2H
5h
phCH
2h
CHCO2Et
2
二、α,β-不饱和羧酸的反应 不饱和羧酸的反应 1,4-加成(共轭体系) 加成(共轭体系) 加成
CH2 CHCOOH
狄尔斯-阿德尔反应(亲双烯体系) 狄尔斯 阿德尔反应(亲双烯体系) 阿德尔反应
三、α,β-不饱和羧酸的用途 不饱和羧酸的用途 甲基丙烯酸甲酯: 甲基丙烯酸甲酯:有机玻璃的原料 丙烯腈 丙烯腈:合成纤维原料
2 2 5
2.以丙二酸二乙酯为原料,合成 CH2CH2COOH 以丙二酸二乙酯为原料, 以丙二酸二乙酯为原料
CH2CH2COOH
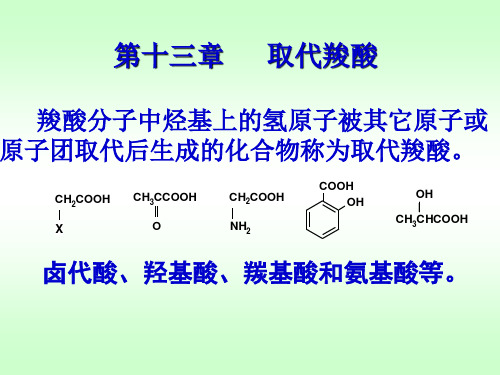
羧酸及取代羧酸

(乳酸) α–羟基丙酸
CH3 CH CH2 COOH
OH
3–羟基丁酸
β–羟基丁酸
HO CH COOH
CH2 COOH
羟基丁二酸 (苹果酸)
HO CH COOH
HO CH COOH
2,3–二羟基丁二酸 (酒石酸)
CH2 COOH HO C COOH
3–羟基C–H32–羧C基OO戊H二酸 (柠檬酸)
2、酚酸:羟基和羧基连在芳环上
CH CH COOH CH3 CH3
2,3-二甲基丁酸
(2)脂肪族二元羧酸的系统命名:选择包含两个羧基的最长
碳链作为主链,根据碳原子数称为“某二酸”。
HOOC COOH HOOC CH2 COOH HOOC CH2 CH2 COOH
乙二酸(草酸) 丙二酸 丁二酸(琥珀酸)
CH3 CH COOH
CH2 COOH 甲基丁二酸
一 、羟基酸的结构分类和命名
羟基酸分子中含有羟基和羧基,羟基酸可分为:
1、醇酸:羟基和羧基均连在脂肪链上,醇酸可根据羟基 与羧基的相对位置分为: α-羟基酸、β-羟基酸、γ-羟基酸,羟
基连在碳链末端时,称为ω–羟基酸
命名时以羧酸为母体,羟基作为取代基。(一般以俗名为主)
CH3 CH COOH
OH 2–羟基丙酸
元酸易溶。 3.熔点:有一定规律,随着分子中碳原子数目的增加呈锯齿
状的变化。乙酸熔点16.6℃,当室温低于此温度时 4.沸点:比相应的醇的沸点高。原因:通过氢键形成二聚体
羧酸的化学性质 根据羧酸的结构,它可发生的一些主要反应如下所示
脱羧反应
O
羟基被取代的反应
R CH C O H 酸性和成盐反应
H
α-氢的反应
CH3 CH CH2 COOH
OH
3–羟基丁酸
β–羟基丁酸
HO CH COOH
CH2 COOH
羟基丁二酸 (苹果酸)
HO CH COOH
HO CH COOH
2,3–二羟基丁二酸 (酒石酸)
CH2 COOH HO C COOH
3–羟基C–H32–羧C基OO戊H二酸 (柠檬酸)
2、酚酸:羟基和羧基连在芳环上
CH CH COOH CH3 CH3
2,3-二甲基丁酸
(2)脂肪族二元羧酸的系统命名:选择包含两个羧基的最长
碳链作为主链,根据碳原子数称为“某二酸”。
HOOC COOH HOOC CH2 COOH HOOC CH2 CH2 COOH
乙二酸(草酸) 丙二酸 丁二酸(琥珀酸)
CH3 CH COOH
CH2 COOH 甲基丁二酸
一 、羟基酸的结构分类和命名
羟基酸分子中含有羟基和羧基,羟基酸可分为:
1、醇酸:羟基和羧基均连在脂肪链上,醇酸可根据羟基 与羧基的相对位置分为: α-羟基酸、β-羟基酸、γ-羟基酸,羟
基连在碳链末端时,称为ω–羟基酸
命名时以羧酸为母体,羟基作为取代基。(一般以俗名为主)
CH3 CH COOH
OH 2–羟基丙酸
元酸易溶。 3.熔点:有一定规律,随着分子中碳原子数目的增加呈锯齿
状的变化。乙酸熔点16.6℃,当室温低于此温度时 4.沸点:比相应的醇的沸点高。原因:通过氢键形成二聚体
羧酸的化学性质 根据羧酸的结构,它可发生的一些主要反应如下所示
脱羧反应
O
羟基被取代的反应
R CH C O H 酸性和成盐反应
H
α-氢的反应
不饱和羧酸和取代羧酸

CH3 base CH3(CH 2)9CCO 2CH3 Br CH3(CH2)8CH=CCO2CH3
CH 3
• 2.芳醛的缩合反应(普尔金和脑文格反应)
• 三. a,β-不饱和羧酸的反应 • a,β-不饱和羧酸及其衍生物分子中含有共轭双键体系,与 a,β-不饱和醛酮相似,容易起1,4-加成反应。例如:
OHCCOOH
乙醛酸能形成稳定的水合物 (HO) 2CHCOOH
• 丙酮酸由相应的腈水解得到,能还原土伦试剂,用硝 酸氧化则生成草酸,与稀硫酸加热脱酸生成乙醛,与 浓硫酸加热则生成乙酸,这是a-酮酸的特性反应.
O O O
CH 3CCl
O
NaCN
CH 3CCN
H3O+
CH 3CCOOH
Ag(NH3)2+
O H3C C O H CH2 CH3COH + CO2 O H3C O H O CH3CCH3 + CO2 O O
有的多环β –酮酸加热时不脱羧,可能是由于脱羧生成的烯 醇含有张力很大的桥头双键,不容易生成。 β –酮酸酯是稳 定的。
• 三. γ-酮酸 • 4-戊酮酸是最简单的γ-酮酸,加热容易脱水:
2-羟基丙酸 羟基丙酸 乳酸
COOH OH
2-羟基苯甲酸 邻羟基苯甲酸 水杨酸
COOH HO OH OH
3,4,5-三羟基苯甲酸 没食子酸
COOH CHOH CHOH COOH
2,3-¶¶¶¶¶¶ ¶ ù á , '¶¶¶¶¶¶ ¶ ù á ¶¶á ¶
COOH CHOH CH2 COOH
2-¶¶¶¶¶ ¶ù á ¶¶¶¶¶ ¶ù á ¶¶¶ á
CH2COOH HO-C-COOH CH2COOH
CH 3
• 2.芳醛的缩合反应(普尔金和脑文格反应)
• 三. a,β-不饱和羧酸的反应 • a,β-不饱和羧酸及其衍生物分子中含有共轭双键体系,与 a,β-不饱和醛酮相似,容易起1,4-加成反应。例如:
OHCCOOH
乙醛酸能形成稳定的水合物 (HO) 2CHCOOH
• 丙酮酸由相应的腈水解得到,能还原土伦试剂,用硝 酸氧化则生成草酸,与稀硫酸加热脱酸生成乙醛,与 浓硫酸加热则生成乙酸,这是a-酮酸的特性反应.
O O O
CH 3CCl
O
NaCN
CH 3CCN
H3O+
CH 3CCOOH
Ag(NH3)2+
O H3C C O H CH2 CH3COH + CO2 O H3C O H O CH3CCH3 + CO2 O O
有的多环β –酮酸加热时不脱羧,可能是由于脱羧生成的烯 醇含有张力很大的桥头双键,不容易生成。 β –酮酸酯是稳 定的。
• 三. γ-酮酸 • 4-戊酮酸是最简单的γ-酮酸,加热容易脱水:
2-羟基丙酸 羟基丙酸 乳酸
COOH OH
2-羟基苯甲酸 邻羟基苯甲酸 水杨酸
COOH HO OH OH
3,4,5-三羟基苯甲酸 没食子酸
COOH CHOH CHOH COOH
2,3-¶¶¶¶¶¶ ¶ ù á , '¶¶¶¶¶¶ ¶ ù á ¶¶á ¶
COOH CHOH CH2 COOH
2-¶¶¶¶¶ ¶ù á ¶¶¶¶¶ ¶ù á ¶¶¶ á
CH2COOH HO-C-COOH CH2COOH
有机化学第十三章 取代羧酸
C HO 浓NaOH CH2OH COOH ’ COOH C anniz z aro 反 应 COOH + COOH
三
丙酮酸: 最简单的α -酮酸
CH3
O C COOH
CH3 CH3
O 浓 H2SO4 CO + CH3 COOH(脱羰) C COOH O 稀 H2SO4 CO + CH CHO (脱羧) 2 3 C COOH
OH O C6H5C=CHCCH 3 90.0%
2 乙酰乙酸乙酯的分解反应 稀OH-
O O CH3C-CH 2-COC 2H5
浓OH-
O CH3CCH3
酮式分解
O CH3C-OH + 其余 酸式分解
3 α-H的活性:被取代
O O CH3C-CH2-COC 2H5
RONa
O Na+ O CH3C-CH--COC 2H5
稀 OH -
CH3COCHC 2H5 CH3
1. 合成甲基酮 经乙酰乙酸乙酯合成:
引入基团
引入基团
CH3 CH3CO CHCH 2CH 3
CH3CO CH 2CH 3
分析:(1) 产物为甲基酮,合成时一定要经过酮式分解。 (2) 将TM的结构与丙酮进行比较,确定引入基团。 (3) 最后确定合成路线。
O C COOH
CO2
RCHO O
CO2
R
C
CH 3
四 醇酸的制备 1 α-羟基酸 羟基腈水解( “醛的化学性质”)
O R-C-R(H) + HCN
2 β-羟基酸(酯)
OH R-C-R(H) CN
H3O
+
OH α R-C-R(H) COOH
不饱和羧酸和取代羧酸

O1 C
4
C
3
C
2
OH
+ HL
1,4 加成
OH C L C C C OH L CH C
O OH
HX
XCH2CH2COOH
卤代
H2O CH2 CH COOH HCN
OHCH2CH2COOH
羟基 氰基 氨基
CNCH2CH2COOH
NH3
NH2CH2CH2COOH
CH2
CH COOH + HN(CH2CH2COOH)2
方法改进: 碱性强,位阻大的LDA使烯醇化完全,而其本身又不与酯反应
O CH3COEt + [(CH3)2CH]2NLi
-+
THF
OLi CH2 C OEt
+ [(CH3)2CH]2NH
二异丙氨基锂(LDA) Li
O (CH3)2C CH2
OH
+
O C OEt OLi
O (CH3)2CCH2COEt H2O
3. 羟基睛的水解 分子中同时含有-OH 和-CN, 如何制备?
O CH3CH2CCH3 NaHSO3, NaCN
CH3 CH3CH2C CN OH
H+ CH3 CH3CH2C COOH OH
CH2 CH2 NaCN OH Cl
CH2 CH2 H+ OH CN
CH2CH2COOH OH
4. Reformatsky 反应
COOH OH
COOH
COOH
COOH
>
OH
>
H O O C
>
OH
pKa = 2.69
OH COOH
-
羟基和羧基邻位效应;共轭
4
C
3
C
2
OH
+ HL
1,4 加成
OH C L C C C OH L CH C
O OH
HX
XCH2CH2COOH
卤代
H2O CH2 CH COOH HCN
OHCH2CH2COOH
羟基 氰基 氨基
CNCH2CH2COOH
NH3
NH2CH2CH2COOH
CH2
CH COOH + HN(CH2CH2COOH)2
方法改进: 碱性强,位阻大的LDA使烯醇化完全,而其本身又不与酯反应
O CH3COEt + [(CH3)2CH]2NLi
-+
THF
OLi CH2 C OEt
+ [(CH3)2CH]2NH
二异丙氨基锂(LDA) Li
O (CH3)2C CH2
OH
+
O C OEt OLi
O (CH3)2CCH2COEt H2O
3. 羟基睛的水解 分子中同时含有-OH 和-CN, 如何制备?
O CH3CH2CCH3 NaHSO3, NaCN
CH3 CH3CH2C CN OH
H+ CH3 CH3CH2C COOH OH
CH2 CH2 NaCN OH Cl
CH2 CH2 H+ OH CN
CH2CH2COOH OH
4. Reformatsky 反应
COOH OH
COOH
COOH
COOH
>
OH
>
H O O C
>
OH
pKa = 2.69
OH COOH
-
羟基和羧基邻位效应;共轭
16-不饱和羧酸和取代羧酸

O
成酮水解 1) OH-,H2O 2) H3O+
1) EtONa , EtOH 2) H3O+
成酸水解
O O
O O OH
例五
O
O
1) EtONa , EtOH
2) CH3CCl OEt
O
O
O
成酮水解 1) OH-,H2O 2) H3O+
O
O
OEt
H3CC O
1) EtONa , EtOH
O
O
2) H3O+
O
C CH3
O C CH2
EtONa OEt
O
O
-O
O
-
O
O
C
C
C
C
C
C
Na+
-
CH3 CH
OEt CH3 CH
OEt CH3 CH
OEt
Na+
O
O
O
-
RX
C
C
C
CH3 C
OEt
CH3 CH
H
R
O
OR
+
C
C
OEt CH3 CH
O C + NaX
OEt
C-烃化产物
O-烃化产物
Na+
O
O
-
C
C
CH3 C
n-C5H11
COOEt CH
COOEt
1) EtONa , EtOH 2) CH3I
H3C
n-C5H11
COOEt C
COOEt
NaOH , H2O H3O+
n-C5H11
CH3
成酮水解 1) OH-,H2O 2) H3O+
1) EtONa , EtOH 2) H3O+
成酸水解
O O
O O OH
例五
O
O
1) EtONa , EtOH
2) CH3CCl OEt
O
O
O
成酮水解 1) OH-,H2O 2) H3O+
O
O
OEt
H3CC O
1) EtONa , EtOH
O
O
2) H3O+
O
C CH3
O C CH2
EtONa OEt
O
O
-O
O
-
O
O
C
C
C
C
C
C
Na+
-
CH3 CH
OEt CH3 CH
OEt CH3 CH
OEt
Na+
O
O
O
-
RX
C
C
C
CH3 C
OEt
CH3 CH
H
R
O
OR
+
C
C
OEt CH3 CH
O C + NaX
OEt
C-烃化产物
O-烃化产物
Na+
O
O
-
C
C
CH3 C
n-C5H11
COOEt CH
COOEt
1) EtONa , EtOH 2) CH3I
H3C
n-C5H11
COOEt C
COOEt
NaOH , H2O H3O+
n-C5H11
CH3
第十五章不饱和羧酸和取代羧酸分析

COOH
cyclohexa-1,4-diene-1,2-dicarboxylic acid
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
三、 卤代酸 halocarboxylic acid
• 1、 卤代酸的制备: • 1)酰氯与HX NBS催化,再水解得α-卤酸; • 卤素红磷催化制备α-卤代酸。
2、卤代羧酸的性质 1)卤代羧酸的酸性 • 卤原子吸电子,酸性增强。 2)亲核取代反应(类似于卤代烃)
Br O NuR OH R OH Nu O
• Nu = 氢氧根、氰根、胺基。
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
3)用卤代羧酸制备其它取代羧
• 用不同试剂取代可以制备不同的取代羧酸。
Br O HO R Br OH O CN R Br OH O NH3 R OH R OH R H2N OH O
O HBr H5 C6 Cl NBS H5 C6 Cl Br O
H2O
Br
O
H5 C6
OH
O
Br
O
Br Br
H 5 C6 OH
P
H 5 C6
OH
华中农业大学理学院
第十五章不饱和羧酸和取代羧酸
2)β—位卤代酸的制备 α ,β-不饱和羧酸与卤化氢加成。
R HBr Br
OH O
R
OH
O
华中农业大学理学院
O
Br CH3
OH
O
AgO H2O
δ-hexanoic lactone
CH3
CH3
O O AgO H2O OH
O
ε-庚内酯 ε-heptanoic lactone
华中农业大学理学院
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HO
CH3
H
CH3
(1) B2H6 (2) H2O2 , OH
O CF3COOH
O O
OH CH3
O
CrO3
CH3
CH3
1. NaOH , EtOH 2. H3O
O CH3CH(CH2)4COH OH
练习:完成下列转化
CH3CHCH 2CH2OH CH3 CH3CHCH 2CHCOOH CH3 OH
C6H5CHO + (CH3CH2CO)2O
CH3CH2COONa
C6H5CH C COOH CH3
α–甲基肉桂酸 5). 诺文葛耳(Knoevenagel)反应
指具有活泼亚甲基的化合物,在碱性试剂存在
下和醛发生的加成-消去反应。
含有活泼亚甲基的化合物:
Y CH2 Y'
(Y 、 Y' 可为
O
CO2C2H5
③可制备β–醇酸酯,β–醇酸,α,β–不饱和羧酸。 练习:
1.
2. 答案:1.
O
+
BrCH2CO2Et
1. Zn 醚 2. H H2O
CHO
+
OH
BrCH2CO2Et
1. Zn 醚 2. H H2O
1. OH , H2O
2. H
CH2CO2C2H5
OH
2.
CHCH 2CO2C2H5
CH CHCOOH
O CH2 CH C OH +
HX
CH2 CH2 COOH X
O CH2 CH C O CH2 CH C O CH2 CH C OH + NH 3
CH2 CH2 COOH NH2
OH +
H2O
CH2 CH2 COOH OH
OH + HCN
CH2 CH2 COOH CN
2).
D–
2. 卤代酸的反应 1). 与碱反应
O R CH X C OH
O
OH H 2O H
R CH OH
C OH
α-卤代酸
O R CH X CH2 C OH
OH H 2O
H
β-卤代酸
R CH CH COOH
有 -H,在碱作用下,生成 ,β-不饱和酸。
CH2 R CH X
CH3 CH3
1. KOH , H2O 2. H
O CHCCH3 CH3
O CHCCH3 CH3
练习:以苯为原料通过 Darzer 反应合成
三. 醇酸 (hydroxy–acid) 定义: 羟基连在饱和碳原子上的羧酸。
HOOCCH CHCOOH OH OH
HOOCCH 2CHCOOH OH
酒石酸
CH3CHCOOH OH
苹果酸
COOH HOOCCH 2 C CH2COOH OH
乳酸 柠檬酸 很多醇酸作为生化过程的中间产物存在于天然 产物中,例:肌肉中:L-(+)-乳酸,葡萄糖 发酵得R-(+)-酒石酸,蔗糖发酵得D-(–)-乳 酸。
1. 醇酸的制备 1). α–卤代酸水解制备α– 醇酸 * R CH
一. 不饱和羧酸 二. 卤代酸
三. 醇 四. 酚 酸 酸
五. 羰基酸 六. β– 酮酸酯 七. 乙酰乙酸乙酯和丙二酸酯合成法 八. 碳酸衍生物
一. 不饱和羧酸 (Unsaturated carboxylic acid ) 定义:羧酸分子中含有不饱和键(双键、叁键)的羧酸。 烯酸
不饱和羧酸
炔酸 烯酸:C6H5CH
C6H5CH CH COOH
N H
CH3CHO + CH2(COOH) 例: 2
CH3CH CH COOH
(CH3)2N 例:
CHO
+
N H
CH3NO2
CH CHNO 2
(CH3)2N
CHO
+
NH HOAc
H5C2OOCCH2SO2CH3
CH CSO2CH3 COOC2H5
3. α,β– 不饱和羧酸的反应 1). 共轭加成
O
EtONa
C CH3
CHCO 2Et
O
NaOH H2O
O
H CHCO 2Na
O CH C O H
C CH3
C CH3
CO2
C CH3
CH OH
CH CHO CH3
O
例:
+
O
ClCH2CO2Et
(CH3)3COK
COOC2H5
O RCR(H) + 总之:
1. KOH , H2O 2. H
1. KOH , H2O 2. H
O CH3COC(CH 例: 3)3
LDA , THF
O
H3O
OH O CH2COC(CH 3)3
制备β– 醇酸还可用如下方法:
例:2 RCH2CHO
OH
OH RCH2CHCHCHO R OH Ag2O H
例: HOCH2CH2Cl
NaCN
RCH2CHCHCOOH R
HOCH 2CH2CN
H H2O
α,β– 二溴丁酸 2,3 – 二溴丁酸 ω– 溴戊酸 5 – 溴戊酸 性质比较特殊。
CH2CH2CH2CH2COOH Br
COOH X
1. 卤代酸的制法 1). α – 卤代酸
O
P
O
Br2
RCH2COH
O C6H5CH2CCl
RCHCOH Br
O
HBr , NB S
C6H5CHCCl Br
ROH
H2O
CH2
CH
COOH
CH3CHCOOH Br
CH3CH2COOH
4). 佩金(Perkin)反应 指芳香醛和酸酐在相应羧酸钠(或钾)盐存在 下发生的类似于羟醛缩合的反应,最终得到 α,β– 不饱和羧酸。
O O
C6H5CHO
+ CH3COCCH 3
CH3COONa
C6H5CH CH COOH
肉桂酸
Br(CH2)10COO
Br(CH2)10COOH CH COOEt 3
ω–卤代酸 (碳数在9以上)
O C
在极稀的溶液中进行
(CH2)10
O
85% 大环内酯
2). 达让(Darzer)反应
指α-卤代酸酯在醇钠或氨基钠作用下与醛 酮发生的羟醛缩合反应,产物为αβ-环氧 酸酯。
O R C R'(H)
+ ClCH2CO2Et
X
OOC
O C OH
+
OH
H 2O
* R CH
OH
O C OH
例:
H H3C
浓 OH
Br
COOH
S N2
H H2O
HO H CH3
S-2-溴丙酸
OOC
R-乳酸
HOOC
例:
H H3C
g2O 稀 OH , A
Br
邻 基 参 与 机 理
H H2O
OH H H3C
S-2-溴丙酸
S-乳酸
2). α– 羟基腈水解制备α– 醇酸
O C6H5CHC OR Br
2). β– 卤代酸
O CH2 CH C OH
+ HX
CH2 CH2 COOH X
3). γ, δ 等卤代酸用二元羧酸的单酯发生汉 斯狄克反应
O O AgNO3 , K OH ROC CH2 n COOAg ROC CH2 n COOH
Br2 , CC l4
O H+ , H2O ROC CH2 n Br
EtONa
α-氯代酸酯
O R C (H)R' CHCO 2Et
α,β-环氧酸酯
机理:
ClCH2CO2Et
EtONa
O R C R'(H)
ClCHCO 2Et
O R C CHCO 2C2H5
O R C (H)R' CHCO 2Et
R'(H) Cl
α,β- 环氧酸酯
在合成上的应用:
O C CH3 + BrCH2CO2Et
CN R C H OH
H H2O
R CHCOOH OH
3). 瑞佛尔马斯基(Reformatsky)反应 (用于制备β– 醇酸及其衍生物) 指α– 溴代酸酯与醛或酮在惰性溶剂中和锌粉 反应,产物水解得β– 醇酸酯的反应。
R O (H)R'
+
BrCH2CO2Et
1. Zn, Et2O 2. H , H2O
C6H5 C H C COOH
C6H5
CHCO 2H
H
H C C
H COOH
(E )–3–苯基丙烯酸 (Z )–3–苯基丙烯酸 (异肉桂酸) (肉桂酸)
CH3(CH2)7CH
CH( CH2)7COOH
OH
C H
C H
O
(Z )-9-十八碳烯酸 (油酸)
H C H C O OH
( E )-9-十八碳烯酸 (反油酸)
CO2CH3
1 , 3-丁二烯 丙烯酸甲酯
3-环己烯甲酸甲酯
练习: 以环戊二烯和4C以下有机物为原料合成:
HOOC COOH
COOH
COOH
解:
+
COOH
1. KMnO 4 2. H2O
HOOC
COOH
COOH
练习: 用不超过3C的有机化合物及必要的试剂合成:
COOH
O
解:2 CH3CCH3
Al2O3
比较新的制备β– 醇酸酯, β– 醇酸的方法:
O CH3COEt
