酵母菌诱变育种
用于白酒生产的耐酸酵母菌的诱变育种

紫 外 灯 所 发 射 的紫 外 线 波 长 大 约 有 8 O 为 2 5 3 7 0 引 言 埃 , 在诱变育种 的有 效波长 范 围内。紫外线 主要 是通 酵母菌是酒类 生产 中一种 重要 真菌类 微生 物 , 在 N A对紫外线 的吸 自然环境 中, 多分存 在于含 糖量高 、 偏 酸性条件下 。2 5 过改变 DHA来 引起生物效应的 。D 收 作 用 非 常 强 烈 , 特别 是碱 基 中 的 嘧 啶 , 它 比嘌 呤 更 为 3 0 o C的温度为其最适合 的生长 的温度 , 最适合 的 p H 敏感 , 紫外线可以通过很 多形式 引起 D HA 的改变 , 如 值是 5 -6 , 发酵温度一般 为 3 0 —3 4 ℃。在传 统 的白酒 D NA链 的断 裂 , D N A 分 子 链 的 断 裂 , D NA分 子 内 和分 生产 中, 在窖池 内的发酵时间一般要 2 —3 个月 。一般 子 间 的交 链 , 核 酸 和 蛋 白质 的 交 链 , 胞 嘧 啶 的 水 合 作 用 酒精会在酵母菌在发酵的前 1 —2 个月产 生 , 发酵过程 中会产生有机 酸 , 伴 随着 有机 酸 的不 断积 累 p H 逐 渐 以及胸腺 嘧啶二聚体的形成 。可见光能够对 紫外线损 N A遗传活性 的作 用进行 复活 。所 以进过诱 变后 降低 , 酵母 的生 长 繁殖会 受 到 抑制 , 发 酵 作用 不 断 减 伤 D 的微生物要被可 见光或 者是 长波 紫外线 的照 射 , 故诱 弱, 直至停止 , 这样原料就不 能充分 的利用 造成原料 浪 变 处 理 后 的样 品要 用 黑 纸 包 裹 , 且 样 品 不 能 存 放 太 久, 费 。可见选择一种耐酸性 高的酵母菌有利 于促进原 料 以免突变在黑暗 中经其它机制 得到修 复。 的充分利用 , 降低 生产 的成 本 , 提 高 白酒 的产 量 , 带 来
小议高产酒精酵母菌的紫外线诱变选育

聂世现,王钰,黄文静,季必霞0 引言石油是世界经济与发展的基本能源之一,其储备有限。
20世纪70年代世界范围发生石油危机,使利用可再生的资源(如高淀粉作物)发酵生产酒精作为生物能源的研究成为人们关注的焦点。
生物能源与石油相比具有可再生、污染小、减少温室效应等优点,能部分或全部代替汽油。
目前,燃料酒精的生产占世界酒精总产量的66%,并且还有进一步增加的趋势。
发酵法是酒精生产的重要方法,发酵法生产酒精的关键是酵母菌株,酒精酵母的优劣不仅直接影响发酵率的高低,而且会影响酒精的产量和质量。
我国酒精生产行业中普遍存在亟待解决的问题是发酵强度低,生产成本高,能耗大。
因此,高产酒精酵母的选育是提高酒精产率,节约生产能源的关键。
为了开展非粮作物甘薯等转化酒精的研究,本论文探讨了酵母菌A4原生质体制备和再生的适宜条件,并用紫外线作诱变剂,对酵母菌原生质体进行诱变处理,旨在筛选出发酵力强、酒精产量高的优良酵母菌株,为下一步以高产淀粉品种甘薯为原材料生产酒精的研究工作奠定基础。
1 材料与方法1.1 材料1.1.1 菌种酵母菌(A4)为本实验室保藏菌种。
1.1.2 培养基麦芽汁液体培养基:将麦芽汁(购于合肥市华润雪花啤酒厂)糖度调至12°Brix,过滤后121℃灭菌20min。
YPD培养基(g/L):液体培养基:酵母提取物10,蛋白胨20,葡萄糖20。
固体培养基:在YPD液体培养基中加入琼脂20,NaOH0.1。
原生质体再生培养基:在YPD固体培养基中分别添加KCl至0.7mol/L,山梨醇至0.8mol/L,甘露醇至0.8mol/L,17%的蔗糖。
以上培养基于115℃灭菌20min。
TTC上层培养基(g/L):TTC(三苯基四氮唑盐酸盐)0.5,葡萄糖5,琼脂15。
TTC下层培养基(g/L):葡萄糖10,蛋白胨2,酵母膏1.5,K2HPO41,MgSO4·7H2O4,琼脂20,pH5.5。
1.1.3 试剂缓冲液:pH6.8的柠檬酸-磷酸缓冲液。
发酵工业菌种选育 诱变育种

诱变育种具有方法简单、快速和收效显著等特点,仍是目前被广泛使用的主要育种手段。 当前发酵工业中使用的高产菌株,几乎都是通过诱变育种而大大提高了生产性能的菌株。诱变育种除能提高产量外, 还可达到改善产品质量、扩大品种和简化生产工艺等目的。
诱变育种的一般步骤
1)出发菌株的选择2)单细胞(或单孢子)悬液制备3)诱变剂和使用剂量的选择4)变异株的初筛5)变异株的复筛6)变异株稳定性试验7)菌种特性考察8)中试验证9)大型投产试验
得单细胞悬液的方法必须具有针对性,对产抱子或芽抱的微生物最好用其孢子或芽孢。
在实际工作中,要得到均匀分散的细胞悬液,通常可用无菌的玻璃珠来打散成团的细胞.然后再用脱脂棉花或滤纸过滤。
常用的物理诱变剂处理方法
常用的物理诱变剂处理方法
01
02
后培养与稀释涂布
紫外线照射
处理前先开紫外灯预热20min,使光波稳定。然后,取30ml菌悬液置于7cm培养皿中,并置于诱变箱内的磁力搅拌器上,离灯管一定距离,打开皿盖,暴露子紫外线下照射一定时间,边照射边搅拌,力求使细胞均匀吸收紫外线光波。经过紫外线诱变后的菌体转入无菌试管内,置于冰水中浸1-2h,抑制修复酶类的活性,使修复难以进行,有利于提高突变率。
1.亚硝酸诱变
在多核细胞中,仍然采用高剂量,因为在高剂量诱变时,除个别核发生突变外,其他核均被致死,可形成较纯的变异菌落,同也造成遗传物质的巨大损伤,可减少回复突变。
诱变育种的一般原则
诱变育种要求所处理的细胞必须是处于对数生长期同步生长的细胞,并且是均匀状态的单细胞悬液。
4.单袍了(或单细胞)悬液的制备
细胞的生理状态对诱变处理会产生很大的影响,细菌一般在对数生长期的诱变处理效果较好,而霉菌和放线菌的分生孢子在稍加萌发时进行诱变处理可提高诱变效率。分散状态的细胞可以均匀地接触诱变剂,避免长出不纯的菌落。
微生物诱变育种技术

微生物诱变育种技术介绍了微生物诱变育种的各种方法,对经典的诱变技术、复合诱变和新型的诱变技术等处理方法进行了比较。
对离子注入法和等离子体诱变育种等新型诱变育种技术的机理进行了阐述,并对其优缺点以及潜在的研究方向进行了论述。
标签:微生物诱变;离子注入法;等离子体诱变微生物诱变育种是一种基因突变技术,通过技术手段改变微生物的遗传结构和功能,进而筛选出具有特定性状的,优良突变型微生物。
这种育种方式,具有较高的微生物变异率,变异速度快,效率高等优点,是食品加工和医药生产等工业的首选方法。
常用的微生物诱变育种方法包括物理法、化学法和生物法等,其中物理法诱变包括:紫外诱变、X射线诱变和γ射线诱变等,化学法诱变包括烷基磺酸盐和烷基硫酸盐、亚硝基烷基化合物、次乙胺和环氧乙烷类和芥子气类),生物法包括基因转导、基因转化和转座子诱变等。
复合诱变是指采用两种及以上的诱变方法,对微生物进行诱变,制的目标菌株。
通常仅采用一种方法进行诱变,会使微生物产生抗性,从而降低突变率,复合诱变具有补充不同诱变方法之间缺陷的优势。
近些年涌现出一批创新的诱变技术,如离子注入诱变法、大气压冷等离子诱变,其中离子注入诱变法具有与复合诱变相似的特性,日趋成为研究诱变技术的主流方向。
原生质体是包含细胞膜和膜内细胞质及其他具有生命活性细胞器的生物质,对于微生物来说即去除细胞壁的细胞。
原生质体也可以作为诱变的对象,其对外界敏感度很高,因此变异率也很高。
1 经典诱变技术1.1 物理诱变1.1.1 紫外诱变DNA由以嘌呤和嘧啶为碱基的核苷酸组成,紫外线诱变可以使嘧啶形成二聚体,DNA在复制和转录时,因存在嘧啶二聚体而不能分离,进而发生变异。
该方法简单、操作安全且诱变率高,其缺点:诱变原理简单,引起的突变单一,形成的突变体类型较少,而对于基因损伤及其修复的研究却很有意义。
现在,对于细菌、酵母菌或霉菌的紫外诱变往往是对其原生质体的诱变,缺少了细胞壁对细胞的保护,紫外线可以更直接的作用于DNA,提高突变率,从而产生更多的突变体和表现型。
酵母菌选育、最适培养基筛选及菌种发酵培养

酵母菌选育、最适培养基筛选及菌种发酵培养[摘要]在无菌条件下,用紫外线对酵母菌(yeast)进行不同时长的照射诱变处理,选出合适的诱变菌种进行振荡培养。
经振荡培养后的诱变菌种运用正交试验设计的方法采用四个因素三个水平选出最适的菌种培养基,进行进一步的发酵培养。
在发酵罐中加入最适培养基成分和合适的酵母菌诱变菌种进行发酵扩培,最终获得大量的菌种和发酵产物。
[关键词]酵母菌,紫外线,最适培养基,正交试验设计,发酵培养面包酵母(Saccharomyces cerevisiae)是一种单细胞微生物,是酵母菌的一种,它含蛋白质50%左右,氨基酸含量高,富含B族维生素,还有丰富的酶系和多种经济价值很高的生理活性物质。
几千年前人类就用面包酵母发酵面包和酒类,在现代食品工业方面,广泛用作人类主食面包、馒头、包子、饼干糕点等食品的优良发酵剂和营养剂。
本实验选用的物理诱变因子为紫外线,DNA能强烈吸收紫外线,尤其是碱基中的胸腺嘧啶,从而在形成二聚体,改变DNA结构,引起基因突变。
本实验的面包酵母菌经不同时长的紫外线诱变处理,培养出的适合的诱变菌种进行最适的菌种培养基的筛选和发酵培养。
最适菌种培养基的筛选是通过正交实验设计进行的。
正交试验设计(Orthogonal experimental design)是研究多因素多水平的又一种设计方法,它是根据正交性从全面试验中挑选出部分有代表性的点进行试验,这些有代表性的点具备了“均匀分散,齐整可比”的特点,正交试验设计是分式析因设计的主要方法,是一种高效率、快速、经济的实验设计方法。
正交表是一整套规则的设计表格,用L为正交表的代号,n为试验的次数,t为水平数,c为列数,也就是可能安排最多的因素个数,本实验采用了四因素三水平进行最适培养基的筛选。
选出合适的诱变菌种和适合诱变的酵母菌生长的培养基后,便可以能过发酵罐进行发酵培养,分时段观察记录发酵过程中的PH,溶氧,菌种数。
绘制出面包酵母的生长曲线1材料与方法1.1实验材料菌种:面包酵母菌仪器:高压蒸汽灭菌锅,超净工作台,光学显微镜,恒温培养摇床,分析天平,小型发酵罐用品:枪头及1mL和0.5mL移液器,三角瓶,试管,玻璃涂棒,平皿,血球计数板,酒精灯,棉塞,试管架,盖玻片,记号笔试剂:酵母膏,蛋白胨,(NH4)SO4,葡萄糖PDA培养基,PDA液体培养基(不加琼脂):去皮马铃薯200克、葡萄糖20克、琼脂20克、自来水1000毫升、自然PH [其做法是称取200g马铃薯,洗净去皮切碎,加水1000ml煮沸半个小时,纱布过滤,再加10~20g葡萄糖和17~20g琼脂,,高压蒸气(121℃)灭菌20分钟,冷却后贮存备用。
用于白酒生产的耐酸酵母菌的诱变育种

用于白酒生产的耐酸酵母菌的诱变育种以采自白酒厂的酒糟等为原材料,经过分离纯化等一系列过程得到的酵母菌株作为出发菌种。
通过紫外线诱变处理,并采用pH=3的选择培养基作为筛选条件,得出紫外照射90~120s为最佳条件,能筛选出适合白酒厂生产工艺条件要求的酒用耐酸酵母菌株。
标签:白酒生产;酵母菌;诱变育种;耐酸酵母菌0 引言酵母菌是酒类生产中一种重要真菌类微生物,在自然环境中,多分存在于含糖量高、偏酸性条件下。
25-30℃的温度为其最适合的生长的温度,最适合的pH 值是5-6,发酵温度一般为30-34℃。
在传统的白酒生产中,在窖池内的发酵时间一般要2-3个月。
一般酒精会在酵母菌在发酵的前1-2个月产生,发酵过程中会产生有机酸,伴随着有机酸的不断积累pH逐渐降低,酵母的生长繁殖会受到抑制,发酵作用不断减弱,直至停止,这样原料就不能充分的利用造成原料浪费。
可见选择一种耐酸性高的酵母菌有利于促进原料的充分利用,降低生产的成本,提高白酒的产量,带来更大的经济效益。
近年来,随着科技发展,许多新的诱变剂被研发应用于诱变育种,但紫外线作为诱变因子进行诱变育种已经有一段历史了,诱变育种仍有很大的成功率,具有方便、经济等特点。
紫外灯所发射的紫外线波长大约有80%为2537埃,在诱变育种的有效波长范围内。
紫外线主要是通过改变DHA来引起生物效应的。
DNA对紫外线的吸收作用非常强烈,特别是碱基中的嘧啶,它比嘌呤更为敏感,紫外线可以通过很多形式引起DHA的改变,如DNA链的断裂,DNA分子链的断裂,DNA分子内和分子间的交链,核酸和蛋白质的交链,胞嘧啶的水合作用以及胸腺嘧啶二聚体的形成。
可见光能够对紫外线损伤DNA遗传活性的作用进行复活。
所以进过诱变后的微生物要被可见光或者是长波紫外线的照射,故诱变处理后的样品要用黑纸包裹,且样品不能存放太久,以免突变在黑暗中经其它机制得到修复。
1 实验部分1.1 仪器和设备DG-1多功能恒温箱(上海医疗器械厂);PHS-3C酸度计(上海虹益仪器厂);GB4027手提式压力蒸汽灭菌锅(上海柳港医用器械厂);XS-18双目显微镜(江南医疗器械厂);H2Q-R振荡器(哈尔滨东联电子公司);HH-SY21-NI4电热恒温水浴锅(北京长源实验设备厂);特种净化工作台(苏州净化设备厂)。
产酯酵母诱变育种
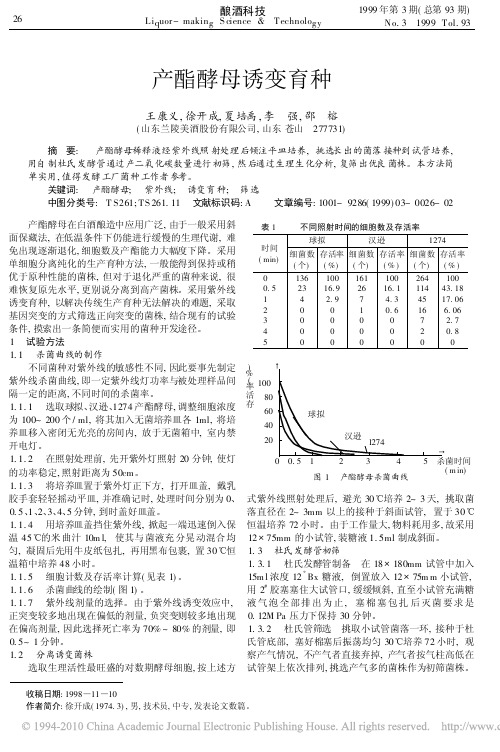
Li q uor-makin g S cience &Technolo gy酿酒科技26No.31999Tol.931999年第3期(总第93期)产酯酵母诱变育种王康义,徐开成,夏培禹,李强,邵榕(山东兰陵美酒股份有限公司,山东苍山277731)摘要:产酯酵母稀释液经紫外线照射处理后倾注平皿培养,挑选长出的菌落接种到试管培养,用自制杜氏发酵管通过产二氧化碳数量进行初筛,然后通过生理生化分析,复筛出优良菌株。
本方法简单实用,值得发酵工厂菌种工作者参考。
关键词:产酯酵母;紫外线;诱变育种;筛选中图分类号:T S261;TS 261.11文献标识码:A 文章编号:1001-9286(1999)03-0026-02 表1不同照射时间的细胞数及存活率时间(min)球拟细菌数(个)存活率(%)汉逊细菌数(个)存活率(%)1274细菌数(个)存活率(%)0 1361001611002641000.52316.92616.111443.181 4 2.97 4.34517.062 0010.616 6.063 00007 2.74 000020.85收稿日期:1998 11 10作者简介:徐开成(1974.3),男,技术员,中专,发表论文数篇。
0.512345图1产酯酵母杀菌曲线产酯酵母在白酒酿造中应用广泛,由于一般采用斜面保藏法,在低温条件下仍能进行缓慢的生理代谢,难免出现逐渐退化,细胞数及产酯能力大幅度下降。
采用单细胞分离纯化的生产育种方法,一般能得到保持或稍优于原种性能的菌株,但对于退化严重的菌种来说,很难恢复原先水平,更别说分离到高产菌株。
采用紫外线诱变育种,以解决传统生产育种无法解决的难题,采取基因突变的方式筛选正向突变的菌株,结合现有的试验条件,摸索出一条简便而实用的菌种开发途径。
1试验方法1.1杀菌曲线的制作不同菌种对紫外线的敏感性不同,因此要事先制定紫外线杀菌曲线,即一定紫外线灯功率与被处理样品间隔一定的距离,不同时间的杀菌率。
第6章-诱变育种

从自然界直接分离的菌种,一般而言其发 酵活力往往是比较低的,不能达到工业生 产的要求,因此要根据菌种的形态、生理 上的特点,改良菌种。以微生物的自然变 异为基础的生产选种的几率并不高,因为 这种变异率太小,仅为10-6~10-10。为了 加大其变异率,采用物理和化学因素促进 其诱发突变,这种以诱发突变为基础的育 种就是诱变育种,它是国内外提高菌种产 量、性能的主要手段。
费用大,并要注意安全性。 3、大部分诱变剂是致癌剂,所以在使用中必须非 常谨慎,要避免化学诱变剂与皮肤接触,,且 切勿吸入其蒸气,有人对某些诱变剂极其敏感,
甚至未直接接触就会过敏,这就更要当心。
诱变剂的选择
1.碱基类似物和羟胺具有很高的特异性,但很少使
用,回复突变率高,效果不大。 2.亚硝酸和烷化剂应用的范围较广,造成的遗传损 伤较多。其中亚硝基胍和甲基磺酸乙酯常被称为 “超诱变剂”,甲基磺酸乙酯是毒性最小的诱变
性能测定
致死率确定
出发菌株 或菌悬液
活菌计数 性能初测
菌种纯化 诱变处理 平板涂布
性能精测
制备斜面孢子
活菌计数
初筛
复筛 放大试验
传代稳定性实验
菌种保藏 并用于生产
诱变育种的基本过程:
选择选择合适的出发菌株 ↓ 制备待处理的菌悬液 ↓ 诱变处理 ↓
筛选
↓ 保藏和扩大试验
(一)出发菌株的选择
出发菌株———用来育种处理的起始菌株 ◆出发菌株应具备: ①对诱变剂的敏感性高; ②具有特定生产性状的能力或潜力; ◆出发菌株的来源;
化学诱变剂
化学因子如碱基类似物、5—氟尿嘧啶、烷化剂等。
化学诱变剂中使用最多、最有效的是烷化剂。
使用化学诱变剂的优缺点:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酵母菌原生质体融合育种第一部分:酵母菌原生质体融合育种一、基本原理进行微生物原生质体融合时,首先必须消除细胞壁,它是微生物细胞之间进行遗传物质交换的主要障碍。
在酵母属进行细胞融合时,通常采用蜗牛酶除去细胞壁,采用聚乙二醇促使细胞膜融合。
细胞膜融合之后还必须经过细胞质融合、细胞核重组、细胞壁再生等一系列过程,才能形成具有生活能力的新菌株。
融合后的细胞有两种可能:一是形成异核体,即染色体DNA 不发生重组,两种细胞的染色体共存于一个细胞内,形成异核体,这是不稳定的融合。
另一是形成重组融合子,通过连续传代、分离、纯化,可以区别这两类融合。
应该指出,即使真正的重组融合子,在传代中也有可能发生分离,产生回复或新的遗传重组体。
因此,必须经过多次分离,纯化才能获得稳定的融合子二、实验材料(一)菌种:酵母菌(二)培养基:1、完全培养基(液体CM)2、完全培养基(固体CM)在液体培养基加入2%琼脂3、基本培养基(MM)葡萄糖柠檬酸钠培养基或YNB培养基4、再生完全培养基固体完全培养基中加入0.5mol/L的蔗糖(三) 缓冲液(1) 0.1 mol/L pH 6.0 磷酸缓冲液。
(2) 高渗缓冲液,于上述缓冲液中加入0.8 mol/L 甘露醇。
(四) 原生质体稳定液(SMM)0.5 mol/L 蔗糖、20 mol/L MgC12、0.02 mol/L 顺丁烯二酸,调pH 6.5。
(五) 促融剂40%聚乙二醇 (PEG)的SMM 溶液。
(六) 器皿培养皿、移液管、试管、容量瓶、锥形瓶、离心管、玻璃棒、显微镜、离心机等。
四、试验内容(一) 原生质体的制备1.活化菌体将单倍体酿酒酵母菌Y-1 和Y-4 活化分别转接新鲜斜面。
自新鲜斜面分别挑取一环接入装有25 mL 完全培养基的锥形瓶中,30℃培养16 h 至对数期。
2.离心洗涤、收集细胞分别取5 mL 上述培养至对数生长期的酵母细胞培养液,3000 r/min 离心 10 min,弃上清液,向沉淀的菌体中加入5 mL 缓冲液,用无菌接种环,搅散菌体,振荡均匀后离心洗涤一次,再用5 mL 高渗缓冲液离心洗涤一次。
将二株菌体分别悬浮于5 mL 高渗缓冲液中,振荡均匀,分别取样0.5 mL,用生理盐水稀释至10-6,分别各取0.1 mL 10-4、10-5、10-6 稀释液。
于相应编号的完全培养基平板上(每个稀释度做两个平板),用刮棒涂布,30℃培养48h 后进行二亲株的总菌数测定。
3. 酶解脱壁各取3 mL 菌液于无菌小试管中,3000 r/min 离心10 min,弃上清液,加入3 mL 含2.0 mg 蜗牛酶的高渗缓冲液(此高渗缓冲液含有0.1%EDTA 和0.3%SH-OH)于30℃振荡保温,定时取样镜检观察至细胞变成球状原生质体为止,此时原生质体形成。
(二) 原生质体再生及剩余菌数的测定1.再生分别吸取0.5 mL 原生质体(经酶处理)加入装有4.5 mL 高渗缓冲液及4.5 mL 无菌水试管中。
经高渗缓冲液稀释至10-5;分别吸取0.1 mL 10-3、10-4、10-5。
稀释液于相应编号的再生培养基平板上,30℃培养48 h 后,进行再生菌数测定(用双层再生培养基)。
2. 未脱壁菌数测定分别取0.5 mL 原生质体至装有无菌水试管中,稀释到10-4;各取0.1 mL 10-2、10-3、10-4 的稀释液于相应编号的完全培养基平板上,30℃培养48 h 后,进行未脱壁菌数测定。
(三) 原生质体融合1. 除酶取两亲本原生质体各1 mL,混合于灭菌小试管中,2500 r/min 离心 10min,弃上清液,用高渗缓冲液离心洗涤二次,除酶。
2. 促融向上述沉淀菌体中加入0.2 mL SMM 溶液,混合后再加入1.8 mL 40%PEG,轻轻摇匀,32℃水浴保温2 min 立即用SMM 溶液适当稀释(一般为100、10-1、10-2)。
3.再生取融合后的稀释液各0.1 mL,放于冷却至45℃左右的6 mL 固体再生基本培养基试管中,迅速混匀,倒入带有底层再生培养基的平板上,每个稀释度做两次重复,30℃培养96 h,检出融合子。
4.融合子的检验用牙签桃取原生质体融合后长出的大菌落点种在基本培养基平板上,生长者为原养型即重组子。
传代稳定后转接于固体完全培养基斜面上,而亲本类型在基本培养基上是不生长的。
补充:原生质体融合育种一、方法:用水解酶除去遗传物质转移的最大障碍—细胞壁,制成由原生质膜包被的裸细胞,然后用物理、化学或生物学方法,诱导遗传特性不同的两亲本原生质体融合,经染色体交换、重组而达到杂交的目的,经筛选获得具有双亲优良性状于一体的稳定融合子。
聚乙二醇诱导和电融和聚乙二醇种内融合率可高达27%,种间的融合率也可达10%,比常规的杂交重组频率提高千倍以上。
电场诱导融合又将融合率提高10倍。
二、原生质体融合育种的特点1、杂交率高2、受接合型或致育型的限制小3、遗传物质传递更为完整4、存在着两株以上亲株同时参与融合形成融合子的可能5、有可能采用产量性状较高的菌株作融合亲株6、提高菌株产量的潜力较大7、有助于建立工业微生物转化体系三、原生质体融合育种五大步骤:Ⅰ、直接亲本及其遗传标记选择;一般把诱变系谱中筛选获得的不同正突变株作为直接亲本直接亲本都带有遗传标记Ⅱ、双亲本原生质体制备与再生(一)原生质体制备最有效和最常用的是酶法。
(处理细菌细胞壁用酶溶菌酶Lysozyme处理放线菌细胞壁用酶 Lytic Enzyme裂解酶、Lysozyme溶菌酶处理真菌用酶纤维素酶 Cellulase酵母裂解酶 Zymolyase β1,3葡聚糖酶几丁质酶 Chitinase商品酶 Novozyme234来自 Trichoderma harzianum Lywallzyme 广东微生物研究所溶壁酶 Glucuronidase 葡聚糖苷酸酶)原生质体的好坏与培养基成分、培养条件,菌龄和预处理等因素有关。
1、酶法分离原生质体的影响因素(1)培养基组成(2)菌体培养方式:丝状菌常用平板玻璃纸法,细菌和酵母菌多用振荡沉没培养法。
(3)菌体菌龄:丝状真菌以年轻的菌丝用来分离原生质体最佳。
尤其是菌丝体尖端细胞。
认为对数期的前期和对数期效果最好。
酵母菌制备原生质体时,要使菌体同步化,才能大幅度地提高制备率;放线菌制备原生质体,以对数期到静止期的转换期比较理想,不仅制备量多,而且细胞壁再生能力也比较强;细菌适合在对数期分离原生质体(4)稳定剂:高渗溶液;无机盐对丝状真菌效果较好,而糖和糖醇对酵母更为合适,细菌多使用蔗糖或NaCl,(5)酶解前的预处理:SH-化合物(如巯基乙醇)广泛应用于酵母自和某些丝状真菌中,(6)酶系和酶的浓度:真菌-0.5%蜗牛酶和0.5%纤维素酶,(7)酶的作用温度和作用pH值:通常细菌水解细胞壁的温度在 35℃左右。
一般放线菌的温度在 30~32℃。
(8)菌体密度:(9)酶解方式:酶解时保持较好的通气条件和适当振荡可促进原生质体释放和分离。
2.原生质体的鉴别(1)低渗爆破法:(2)荧光染色法:3.原生质体的收集和纯化(1)过滤法:使用沙心漏斗。
(2)密度梯度离心法:(3)界面法:(4)漂浮法:4.原虫质体的活力鉴定(1)荧光素双醋酸盐(FDA)染色法(2)酚藏花红染色法(3)伊文恩篮染色法5.原生质体的保存(1)立即进行融合或其它方式育种(2) 5%的二甲亚矾或甘油等其他保护剂,液氮。
(二)原生质体再生l、原生质体再生的影响因素①菌体生理状态②稳定剂:③酶浓度和酶作用时间④再生培养基:丝状真菌、酿酒酵母等的原生质体仅能在固体培养基上再生,在液体培养基中细胞壁再生不彻底,不能完全复原。
再生培养基要用稳定剂配制,还含有Ca2+和Mg2+,浓度和原生质体形成时的酶解液相类似,菌种不同稍有差别。
⑤残存菌体的分离,⑥原生质体密度⑦排除再生培养基上的冷凝水,⑧再生方法,2.再生率及其计算细菌原生质体再生频率在90%以上,放线菌的50~60%,真菌为20-70%。
Ⅲ、亲本原生质体诱导融合;(一)原生质体融合过程所需材料:原生质体、PEG及适量的CaCl2、MgCl2(二)原生质体融合的影响因素1.融合剂:不同种类微生物对PEG分于量的要求不尽相同。
物理融合剂:电场和激光是原生质体融合2.温度:丝状真菌适宜融合的温度约为30℃;而细菌原生质体融合的适温往往偏低,据认为4℃或20℃比37℃更好;放线菌通常在常温(约20℃)下进行融合。
总的来说在20-30℃下进行融合效果较理想。
融合处理时间从1min-1h,但大多数微生物1~10 min,3、亲株的亲和力和原生质体的活性4.无机离子:在PEG介导融合时,通常需要一定桩度的Ca2+、Mg2+有效地促进融合5.其他条件:细胞密度Ⅳ、融合重组体(称为融合子)分离;(一)融合体再生双亲融合后形成的融合体不等于重组体,以霉菌来说,可能是异核体或杂合二倍体或重组体,它们融合后营养互补,经过再生,均可在基本培养基上形成菌落。
酵母菌、细菌常用双层平板法,与融合前原生质霉菌和放线菌除了用双层平板法外,也可把原生质体直接分离到高渗培养基平板上,同样能得到再生菌落。
(二)融合体的检出与分离1.利用营养缺陷型标记选择融合体2.利用抗性选择融合体3.用灭活原生质体检出融合体4.利用荧光染色法选择融合体5.双亲对碳源利用不同而检出融合体6.融合体的其他选择方法①对昆虫的毒力测定进行融合体的选择②利用形态差异选择③生化测定指标选择融合体Ⅴ、遗传特性分析与测定;分离重组体,并试验其遗传稳定性研究(一)重组体的检出和鉴别的方法1.直接法2.间接选择法3.钝化选择法(二)融合率如采用直接法,融合率的计算公式为:融合率(%)=基本培养基上再生的菌落/完全培养基上再生的菌落数×100%如采用间接法.融合率的记算公式为:融合率(%)=重组体后代总数/所有后代总数×100%各类微生物之间融合频率差别很大.既使是同一个种的不同菌株也不一样。
霉菌、放线菌融合率约为0.1%一10%,细菌和酵母菌为10-3一10-6。
异种间融合率比同种间又低得多,如霉菌种间融合率约为0.1%一1%,酵母菌、放线菌为10-5一10-7。
(三)DNA含量及孢子形态测定1.DNA含量测定2.单倍化3.有关酶活性及孢子体积的测定4.分子生物学方法四、原生质体融合的应用1.提高产量或质量,合成新物质,新中间体2.改良菌种遗传特性3.优化菌种发酵特性4.质粒转移5.原生质体与细胞核融合6.进行遗传分析附录酵母原生质体融合试验用培养基(包括酵母单倍体原生质体融合及电场诱导酵母原生质体融合)1. 完全培养基葡萄糖 2 g蛋白胨 2 g酵母膏 1 g蒸馏水 100 mLpH 7.2100 Pa 灭菌20 min。
