遗传学实验 多倍体诱发
多倍体诱发与鉴定
4 冲洗:用70%酒精冲洗三次,保存在70%酒精中
备用。 5 解离:固定好的材料转入解离液中,解离10分钟。 解离好的材料用蒸馏水冲洗2—3次。 6 染色:染色前一定要先将材料捣碎,染色时最好 还要边捣边染,用改良石炭酸品红溶液染色10mih,使 组织染色充分。 7 压片:盖上盖玻片后,用带橡皮头的铅笔轻轻敲 打,使细胞均匀分散。 8 镜检:经镜检挑选染色体分散良好的细胞拍照。
四、 实验方法 (步骤1-4需课前准备好) 1 设置对照组:用清水培养大蒜3-5天,待根长至约0.5厘米长后 再在室温下连续培养72小时,然后再放入4摄氏度的培养箱中24小时 作取材前处理。 2 诱导 物理法:用清水培养大蒜3-5天,待根长至约0.5厘米长时,分别 放入0℃、4℃、8℃的培养箱中培养24小时取出,在室温条件下继续 培养48小时,最后再放入4℃的培养箱中24小时作取材前处理。 化学法:用清水培养大蒜3-5天,待根长至约0.5厘米长时转入 0.1%秋水仙素溶液中培养24小时取出,再转入清水中继续培养48小 时,然后用0.1%秋水仙素溶液处理3小时作取材前处理,直到根尖膨 大为止,诱导后细胞为多倍体细胞。 3 固定:切取已做好前处理的大蒜的膨大根尖,水洗后投入卡 诺氏固定液中固定,固定时间以2小时为宜。
黑麦:观察根尖形态是否发生变 化,若发生变化及时记录变化情况。
2、绘制显微镜下观察的二倍体和四倍体图像。
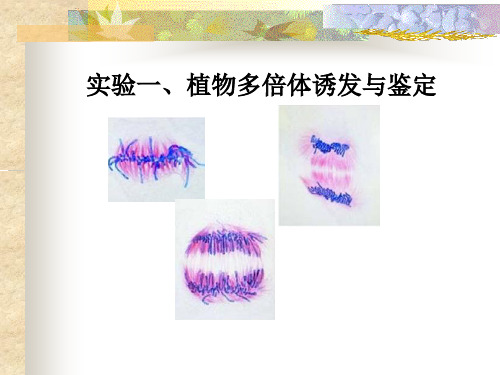
实验一、植物多倍体诱发与鉴定
一、实验目的 1、掌握人工诱导多倍体的原理,及其在遗传育种中 的意义。
2、掌握用物理法(不同温度处理)和化学法(秋水
仙素)诱发多倍体的方法
二、实验材料:大蒜根尖(2n=16)
三、实验试剂: 70%酒精、0.1%秋水仙素、卡诺氏固定液(无水乙醇3份、冰乙酸1份混合 配制即成)、解离液(95%乙醇3份、浓盐酸1份混合配制即成)、改良品红 改良苯酚品红染液的配制: 原液A:取3克碱性品红溶于100毫升70%酒精中(可长期保存)。 原液B:取A液10毫升加入90毫升5%苯酚水溶液中(2周内使用)。 原液C:取B液55毫升加入6毫升的冰醋酸和6毫升38%的甲醛(可长期保存)。 染色液:取C液10-20毫升,加入90-80毫升45%醋酸和1.5克山梨醇。配成的 10%~20%的石炭酸品红液,放置2周后使用,染色效果显著,该染色液的浓 度可根据需要而变更,淡染或长时间染色可用 2~10%的浓度,浓染可用 30% 浓度,再用 45%乙酸分色。(可普遍用于植物组织的压片法和涂片法,使用23年不变质。山梨醇为助渗剂,兼有稳定染色液的作用。如果没有山梨醇,也 能染色,但效果稍差。 实验用具:标签、载玻片、盖玻片、镊子、解剖针、培养皿、显微镜、试 剂瓶、酒精灯、吸水纸、培养箱、带橡皮的铅笔。
遗传学实验 植物多倍体的诱发

四、实验方法
(二)小麦、玉米多倍体植株诱发——从种子开始
4、当根长出后及时转入装有自来水的250mL烧 杯的纱网上进行水培2-3周。 记录。每种植物每组至少取10株,测量植 株地上部分高度和鲜重,根长、根数和鲜重。 观察植株叶表皮气孔形态和数目的变化(该 性状作为辅助指标)。 注意处理组与对照组的对比分析。
遗传学实验
6
四、实验方法
(一)大蒜根尖多倍体细胞诱发
1、发根:在50mL烧杯中加适量自来水,将大蒜鳞 基置烧杯上,底部浸入水中。 2、秋水仙素处理:约3天后(根长1~1.5cm),将 根尖浸于0.1%秋水仙素溶液中48h。由于培养时间 较长,需要添加秋水仙素溶液。以未处理作为对照。 3、复苏:自来水冲根尖4-5次充分除去秋水仙素, 再用自来水培养根尖至2.5cm以上。
2012/10/14
遗传学实验
11
Think About It…
1、经秋水仙素处理的植物种子在生长发 育上有何特点? 2、用秋水仙素处理干种子时,为何前期 浓度较高,后期浓度较低? 3、比较玉米和小麦对秋水仙素反应的差 异?
遗传学实验
12
五、实验要求和注意事项
1、本实验为综合性性实验。两人一组进行实验。 2、由于实验周期长,要求每组同学们在每一环节 都要认真操作,否则最后得不到观察的实验材料, 也得不到有效的实验数据用于分析。 3、为了实验安全,在进行秋水仙素处理时统一在 实验室内进行,后期水培管理可以自行安排,注意 水分管理。 4、对实验的数据要求进行统计分析,比较分析处 理组与对照组之间植株生长的差异性。 5、待水培2-3周后,实验室集中取材测定与分析。
遗传学实验 5
三、试剂、材料
1、器皿及仪器:培养皿(Φ=9cm)、 250mL烧杯(带纱网),50mL烧杯,水浴锅, 盖玻片、载玻片、解剖针、显微镜等。 2、试剂:0.1%秋水仙素、0.025%秋水仙素 、卡诺氏固定液、70%乙醇、0.1M盐酸、改 良卡宝品红染色液。 3、材料:大蒜鳞基、小麦种子、玉米种子
不同植物同源多倍体的诱发与鉴定实验设计

不同植物同源多倍体的诱发与鉴定实验设计引言:植物的多倍化是指由于染色体加倍而产生的具有多个完整染色体组的个体。
不同植物的同源多倍体(autopolyploid)可以通过各种实验诱发和鉴定,本文将就多种诱发和鉴定方法进行阐述。
一、诱发同源多倍体的方法1. 化学诱导:可以通过化学物质诱导多倍化,如染色体稳定化剂Colchicine、Oryzalin等。
将适宜的浓度的诱导剂溶液喷洒到植株的叶片上,使其通过气孔进入植物体内,引发多倍化。
2. 温度诱导:某些植物的花粉直接暴露在高温中,能够诱发染色体变异,进而产生同源多倍体。
诱导温度通常为35-36℃,持续时间为数小时。
3. 辐射诱导:辐射可以直接或间接地引发染色体变异,造成多倍化。
常用的辐射源包括 X 射线、γ 射线、紫外线等。
4. 细胞学处理:通过细胞培养技术,可以利用化学物质、温度或辐射等对植物细胞进行处理,再通过诱导分化和植株再生获得多倍化植株。
二、鉴定同源多倍体的方法1. 核型分析:利用生物学核型技术,可以观察染色体数目和结构是否有变化。
常用的核型分析方法有染色体计数法和比较基因组杂交法。
2. 组织学观察:通过石蜡切片技术,观察植物组织的细胞形态和染色体数目。
不同倍化水平的同源多倍体在细胞外观和染色体数目上会有明显差异。
3. 分子标记分析:利用分子标记技术,如RAPD、SSR等,可以对同源多倍体的基因组进行分析,寻找遗传多样性和差异。
4. 表型观察:观察同源多倍体在形态、生理和生殖方面的变化,通过与野生型或同源单倍体进行比较,寻找差异。
结论:通过化学诱导、温度诱导、辐射诱导和细胞学处理等方法可以实现同源多倍体的诱发,而通过核型分析、组织学观察、分子标记分析和表型观察等方法可以对诱发的同源多倍体进行鉴定。
这些方法的综合应用可以帮助我们更好地理解同源多倍体的形成机制和遗传特征,为植物进化和育种工作提供理论和实践上的指导。
参考文献:1. 黄凤林, 柯华军, 林一明. 植物同源多倍体的诱导及鉴定[J].热带农业科学, 2007, 27(3): 202-207.2. 吴访苏, 韦佳伟, 郭少婵, 等. 植物染色体工程方法优化及染色体在植物生产中的应用[J]. 生物技术通讯, 2020, 31(6): 716-721.3. Li H, Li W, Hu G, et al. Advances on Induction and Identification of Autotetraploid Plants[J]. Molecular Plant Breeding, 2021, 19(4): 1929-1937.4. Jiang J, Gill B S. Different Species-Specific Chromosome Translocations in Triticum timopheevii and Triticum turgidumSupport the D-RNA Model for Nonhomologous Chromosome Synapsis[J]. Genetics, 1994, 15(1): 215-227.。
多倍体的诱发与鉴定多倍体的诱发与鉴定多倍体的诱发与...

实验六多倍体的诱发与鉴定多倍体:三倍和三倍以上的整倍体19世纪末世纪末,,狄.弗里斯普通月见草特别大的变异型(巨型月见草巨型月见草))2n=142n=28染色体数目变异可以导致遗传性状的变化染色体数目变异可以导致遗传性状的变化。
巨大型特征烟草的叶片气孔整倍体:体细胞染色体数为染色体组整倍数的个体。
非整倍体:体细胞染色体数增加一条或几条和减少一条或几条。
一、实验目的初步掌握秋水仙碱诱发多倍体的原理与方法原理与方法;;观察同源多倍体植物观察同源多倍体植物((器官器官))形态特征与细胞学特点态特征与细胞学特点。
二、实验原理人工诱发多倍体最有效的方法是秋水仙碱处理,秋水仙碱的作用是阻止纺锤丝的形成与活动阻止纺锤丝的形成与活动。
当秋水仙碱水溶液渗入分生组织正在分裂的细胞时仙碱水溶液渗入分生组织正在分裂的细胞时,,纺锤丝就不能形成或被破坏就不能形成或被破坏,,有丝分裂就停留在中期状态有丝分裂就停留在中期状态。
每个染色体的两个姊妹染色单体虽然彼此分开了每个染色体的两个姊妹染色单体虽然彼此分开了,,却不能向两极移动不能向两极移动,,不能形成两个子核不能形成两个子核,,于是该分生细胞的染色体数目就加倍了胞的染色体数目就加倍了。
当染色体已经加倍了的细胞不再接受秋水仙碱处理时胞不再接受秋水仙碱处理时,,它就又恢复正常的有丝分裂分裂,,结果形成多倍体组织结果形成多倍体组织。
秋水仙碱诱发多倍体的原理多倍体的鉴定形态育性细胞学观察三、试材与用品试材::经加倍处理的黑麦根尖•试材显微镜、、载玻片载玻片、、盖用品::恒温水浴锅恒温水浴锅、、显微镜•用品、胶头玻璃棒、碱性品红染胶头玻璃棒、镊子、、镊子玻片玻片、、1M盐酸。
盐酸。
醋酸、、45%醋酸液、0.2%秋水仙碱秋水仙碱、四、步骤与方法实验步骤种子发芽黑麦根尖染色体加倍处理十字压片制染色体临时片观察1.1.种子发芽种子发芽将吸水纸铺在培养皿中选取均匀选取均匀、、饱满饱满、、有发芽力的黑麦种子倒入培养皿中 实验方法倒入清水浸泡浸种14~18小时室温催芽36hr左右,根长至种子发芽种子发芽,0.5~1cM2.黑麦根尖染色体加倍处理把吸水纸盖在已经发芽的黑麦种子上倒入0.2%的秋水仙碱加倍处理约26小时根尖分生区以下明显增粗洗净根尖把洗净的根尖装入广口瓶倒入固定液固定1~24小时固定液固定液::卡诺氏Ⅰ,冰乙酸冰乙酸((1份):):无水乙醇无水乙醇无水乙醇((3份)逐级转入70%乙醇中保存备用3.制片制片::十字压片法制临时片解离水洗软化取分生区(膨大部位以上膨大部位以上))十字压片染色加盖玻片压片、敲片镜检绘图1M 1M盐酸盐酸60ºC 水浴1515~~2020分钟分钟60ºC 温水清洗清洗33~5次4545%%醋酸2~3枚碱性品红3~5分钟2n=4x=28 2n=2x=142n=4x=281.1.绘制正常细胞和加倍细胞中期分裂相各一个绘制正常细胞和加倍细胞中期分裂相各一个2.2.写出实验收获和体会写出实验收获和体会作业。
植物多倍体的诱发和鉴定

可编辑ppt
11
2 讨论: ① 选择合适的材料是实验成功的首要因素, 请问该实验选材时注意什么问题? ② 酶解时酶液的组成及浓度如何确定? ③ 研究原生质体的意义是什么?
可编辑ppt
12
药品:蒸馏水、卡诺氏固定液、45%醋酸、秋 水仙素、改良苯酚品红染液等。
实验步骤:
1 培养根尖:将大蒜瓣放在盛有清水的培养皿
中,让根部接触水,在20~25℃光照下培养,待根 尖长到0.5~1cm时备用。
可编辑ppt
3
2 多倍体诱导:将水换成0.1%的秋水仙素溶液, 在阴暗处培养2天左右。
3 固定:11:30左右将剪取根尖1~2cm冲洗后 转移至卡诺氏固定液中,室温下处理3~8小时。
用高温、低温、射线照射、等物理化学方法人工诱
发多倍体植物。其中,以应用化学试剂更为有效和
方便,如秋水仙素、异生长素、富民农等,使用最
广泛、效果最好的是秋可水编辑仙ppt素。
2
实验材料:
洋葱、大蒜等。本实验选用大蒜。
实验用品:
用具:显微镜、剪刀、镊子、解剖针、载玻片、 盖玻片、酒精灯、铅笔、吸水纸等。
和果胶酶分离原生质体可。编辑ppt
7
实验材料:
菠菜、油菜等。
实验用品:
用具:显微镜、离心机、载玻片、盖玻片、尼 龙过滤网、离心管、剪刀、镊子、吸水纸等。
药品:70%乙醇、甘露醇、CPW缓冲液、纤维素 酶、果胶酶、20%蔗糖溶液等。
实验步骤:
1 选取叶片:选取充分伸展的幼嫩叶片,自来 水清洗后,用吸水纸吸干水分。
请注意比较该实验结果与 有丝分裂实验结果有何不 同?
实验报告:
1 说明秋水仙素诱发多倍体的原理是什么? 2 画出在显微镜下看到的多倍体细胞的图像;
遗传学实验实验十 植物多倍体的诱发

三、实验材料、实验用具及试剂 大蒜根尖; 显微镜、染缸、酒精灯、培养皿、载玻片、盖玻片、
镊子、解剖针、刀片、擦镜纸、吸水纸等; 0.1%秋水仙素溶液、卡诺氏固定液、1mol/L盐酸、
改良苯酚品红染液。
四、操作步骤 1.生根:
将小烧杯或广口瓶装满自来水,把大蒜鳞茎洗干净, 用剪刀将鳞茎上的老根剪除,再把其放在小烧杯或广口瓶 上,使其生根部位恰好接触到水面,在25℃下培养2-3日 至根尖长1.5-2cm。 2.秋水仙素处理:
实验十 植物多倍体的诱发
一. 实验目的 通过实验,进一步了解人工诱导多倍体的原
理,并初步掌握用秋水仙素诱发多倍体的一般 方法。
多倍体是在细胞中具有3个或3个以上的染色体组 的生物体。自然界中有许多植物是多倍体的,是变 异发生的重要途径之一。多倍体植物在形态上较二 倍体的植物个体大,叶片上的气孔也很大,因此很 容易辨认。多倍体的研究在育种工作中非常重要, 因为利用多倍体可以改良作物的某些经济性状,同 时还可利用多倍体克服远缘杂交过程中的障碍。
将生新根大蒜转移到装有0.1%的秋水仙素水溶液大培 养皿,培养36-48小时,当根尖明显膨大时,上午10-11点 将根尖取下,长度大约在1.5cm 左右,放入固定液中固定 24h,再用95%乙醇溶液换洗两次,转入70%乙醇保存。
3.酸解: 从70%乙醇中取出固定好的根尖→用水浸泡3
min→夹出根尖放入盛有适量1 mol/L HCl,60±0.5℃ 水浴保温的小烧杯中→解离10min。 4.染色
解离后材料水洗3min并吸干,截取1/2个根尖的乳 白色分生组织于载玻片上夹碎捣烂,滴加1~2滴改良 石炭酸品红染液,染色10~1Fra bibliotekmin,压片。
5.压片 在经染色的材料上加一滴染液,盖上盖玻片,
湖北师范大学植物多倍体诱发的遗传分析实验报告附实验结果和答案

植物多倍体诱发的遗传分析实验报告【实验目的】1.了解人工诱导多倍体的原理,初步掌握用秋水仙素诱发多倍体的方法。
2.了解植物多倍体细胞染色体加倍的特点。
【实验原理】植物多倍体: 每个细胞中的染色体数具有3整套或更多套数的植物。
染色体组来自同一物种或由原来的染色体组加倍而形成时称为同源多倍体;增加的染色体组如果来自不同的物种称为异源多倍体。
染色体组倍数的增加,可能使一些作物的经济性状发生有利的变化。
植物多倍体的研究和利用是育种工作中值得重视的途径之一。
秋水仙素化学分子式为C22H25O6N。
有剧毒。
纯秋水仙素呈黄色针状结晶,熔点157℃。
易溶于水、乙醇和氯仿。
味苦,有毒。
秋水仙素能抑制有丝分裂,破坏纺锤体,使染色体向两极的移动被阻止,细胞分裂停滞在分裂中期, 但染色体的复制不受影响。
这种由秋水仙素引起的不正常分裂,称为秋水仙素有丝分裂。
在这样的有丝分裂中,染色体虽然纵裂,但细胞不分裂,不能形成两个子细胞,因而使染色体加倍。
若染色体加倍的细胞继续分裂,就形成多倍性的组织.由多倍性组织分化产生的性细胞,可通过有性繁殖方法把多倍体繁殖下去。
如果将种子用秋水仙素浸渍,也可诱导多倍体植株产生。
人工诱导多倍体的方法很多,分为物理的(温度剧变、机械损伤、各种射线处理等)和化学方法的(各种植物碱、麻醉剂、植物生长激素等)诱导方法。
其中,秋水仙素是诱导多倍体的最有效的方法之一。
多倍体的直接鉴定方法是:压片法【实验材料】大蒜(2n=16)【实验药品和器具】0.01%-0.1%秋水仙素溶液,1%醋酸洋红染液,45%冰醋酸溶液, 显微镜等。
【实验步骤】1.多倍体诱发:待大蒜新根长出约1-2 cm左右时,移到盛有秋水仙素溶液的培养皿中,直到根尖膨大为止。
2.取下已膨大的根尖,放入盛有1%醋酸洋红溶液的小试管中,置于酒精灯上加热至沸腾,冷却后,小心取出根尖于载玻片,用切片纵切一部分于另一载玻片上,加一滴45%冰醋酸溶液,盖上盖玻片和吸水纸,压片镜检。
9 实验九 植物多倍体诱发

洋葱(Allium cepa, 2n=16) 蚕豆(Vicia faba, 2n=12) 西瓜(Citrullus vulgaris , 2n=22)等作物的种
子、根尖、花蕾或幼苗
四、实验用具药品
1.用具:水浴锅、显微镜、培养皿、载 玻片、盖玻片、镊子、刀片、解剖针、 纱布、吸水纸等
抑制纺锤丝微管的形成进而抑制抑制纺锤丝微管的形成进而抑制染色体移向两极的运动使细胞停滞在中染色体移向两极的运动使细胞停滞在中期期不能分裂成二个新的子细胞不能分裂成二个新的子细胞秋水仙素对染色体结构并无明显的影响对细胞也不产生严重毒害细胞解除秋水仙素环境后仍可正常生长分裂因而出现细胞含有多个染色体组的情况构成多倍体细胞
遗传育种学实验
实验九 植物多倍体诱发
一、实验目的
了解人工诱导多倍体的原理 了解用秋水仙碱诱发多倍体植物的方法 学习识别多倍体细胞学特点
二、实验原理
秋水仙素: 细胞有丝分裂的抑制剂
作用:抑制纺锤丝微管的形成,进而抑制 染色体移向两极的运动,使细胞停滞在中 期, 不能分裂成二个新的子细胞
秋水仙素对染色体结构并无明显的影响, 对细胞也不产生严重毒害,细胞解除秋水 仙素环境后仍可正常生长分裂,因而出现 细胞含有多个染色体组的情况,构成多倍 体细胞。
细胞学观察
用根尖压片法制成染 色体玻片标本,在显微 镜下认真观察和染色体 计数,与对照进行对比。
洋葱根尖细胞中期分裂相(左,2n;右,4n)
二倍体和四倍体
大蒜
六、作业及思考题
1.所观察种的染色体数目?处理后得到了哪 些染色体数目变异类型的细胞?
2.许多染色体畸变的类型可以通过多倍体传 递下去,且多倍体植物对环境具有更强的适 应性,为什么?
(二)恢复生长24小时左右,诱导后细胞为
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
诱变物质的微核检测技术
摘要人工诱导多倍体植物观察多倍体的特点,利用染色体分析的方法对多倍体细胞做出准确判断。
1.引言
微核:间期细胞的细胞质中一个或多个圆形或杏仁状结构。
微核的折光率及细胞化学反应性质和主核一样,也具有合成DNA的能力。
微核是染色体畸变的一种表现方式。
引起染色体断裂的因素分为物理因素和化学因素。
物理因素包括:具有能量的各种射线,如α射线,β射线,γ射线,X-ray,中子,质子,UV等。
化学因素包括:诱变剂和重金属等。
经典断裂剂:X射线。
诱变剂:环磷酰胺、氧化铬CrO3、叠氮化钠NaN3、甲基璜酸乙酯EMS、硫酸二乙酯。
微核发生率同作用因子的剂量呈正相关。
微核技术获得的结果与通过中期畸变染色体计数所获结果相当。
2.实验材料
2.1实验材料
多倍体诱导的蒜根,1mol/L盐酸,改良苯酚品红,载玻片,盖玻片,解剖针,显微镜,刀片。
2.2实验方法
2.2.1材料的获取及处理
取材:
取大蒜发根至0.5-1cm,然后转入盛有0.15%秋水仙素水溶液的培养皿中继续培养24小时,待观察到根部有膨大时取出固定。
与在水中培养的材料做对照。
图片来源:/webcourse/xibaoyichuan/jdsy/images/5-1.jpg 固定:
在卡诺固定液中固定24小时,移至70%乙醇中保存或备用。
解离:
解离植物的分生组织如根尖、茎尖等需要经过处理以便除去细胞之间的果胶层并使细胞壁软化,经解离的组织才能使压片步骤顺利进行。
解离常用酸解法和酶解法。
①酸解法:固定后的材料用清水洗涤后,用1MHCl在60℃水浴中恒温处理5-10min。
在酸解过程中一定要掌握好温度和时间,若解离不够,则压片不易分散。
若解离太过,在下一步处理材料时由于材料过软而易丢失。
然后水洗3次。
②酶解法:用10-20g/L的果胶酶,或与10-50g/L的纤维素酶混合使用。
本次实验采用酸解法。
染色:
切取根尖分生组织区,用改良苯酚品红染色15 min
2.2.2染液的制备
改良苯酚品红,其制备过程如下:
原液A 3g碱性品红溶于100ml 70%乙醇中。
原液B 取原液A 10 ml加入90 ml 5%的苯酚水溶液。
取原液B 45ml加入6ml 冰乙酸和6ml 37%的甲醛。
(适合于植物原生质培养中的细胞核染色)取2-10ml染色液,加90-98ml 45%的醋酸1.8g山梨醇。
(适合于细胞核的染色,只有细胞核及染色体被染成紫红色,而细胞质不着色)
2.2.3制片及镜检
压片:
将染色后的材料盖上盖玻片,在盖玻片上盖上两层吸水纸,用一个双面刀片,插到盖片与载片之间的一角,用左手食指压紧盖片,防止滑动,用右手持解剖针,用针柄轻敲盖片,使材料均匀分散开。
然后将刀片轻轻撤出,再用针柄重敲盖片,使细胞分散压平。
镜检:
在制成的染色体玻片标本中,染色清晰而且分散良好的中期分裂相总是少数,所以,在压片之后需要认真地进行镜检。
镜检时先用低倍镜进行观察,找到好的视野后再转用高倍镜观察。
3.结果
16条染色体,有姐妹染色单体
16条染色体,无姐妹染色单体
32条染色体,无染色单体
64条染色体,无染色单体
4.讨论
1)微核监测的关键:
(1)材料的选择
应选择染色体条数少,个体大,便于统计,对污染物反应比较敏感的材料,应适宜于在当地生长。
在微核试验(MNT)中经常使用的小鼠品系CD-1、BDF1、ddY、MS/Ae系(小鼠是由瑞典学者Aeschbacher建立的对诱变作用高度敏感的新品系)。
(2)材料的处理
①巨大性:随着染色体加倍,细胞核和细胞变大,组织器官也变大。
根、茎粗壮叶宽厚、色深、花大、色艳、气孔、花粉粒、果实、种子大
②可孕性低:多倍体特别是三倍体是高度不孕的。
例如,无籽、种子皱缩如无籽香蕉,无籽葡萄,无籽西瓜,无籽柑橘,无球悬铃木。
但风信子三倍体品种(2n=3X=24)表现高度可孕性。
③适应性强:植物多倍化不仅使植株基因活性及酶的差异性增强,而且还增强了植株的生态适应性、对逆境的抗耐性,所以分布地区较广。
多倍体杜鹃多分布在我国西南山区,而二倍体只分布在平原。
④有机合成速率增加:多倍体有多套基因,新陈代谢旺盛,酶活性加倍,提高了有机物的合成速率。
例如,多倍体甜菜,产糖量高;三倍体表现出明显的超亲优势;浆果类,贮存期延长;多倍体花卉花大香味浓。
⑤克服远缘杂交的不结实性
2.一张制片好的细胞染色体制片至少符合如下条件:
①在一张制片中应有较多的中期分裂相。
②染色体分散而不重叠。
③染色体不扭曲、断裂、主缢痕、随体清晰。
④制片基本上为一层平展的细胞,视野内的细胞都在一个平面上。
⑤染色体着色较深而细胞质不着色或着色很浅,背景清晰无过多杂质。
选择中期分裂相好的细胞观察,通过观察和计数中期染色体数目,确定细胞类型。
