有机化学 第十一章 醛酮(4)
有机化学第五版第十一章醛和酮课后习题答案

第十一章醛和酮习题答案最新版1. 用系统命名法命名下列醛、酮;解:1 2-甲基-3-戊酮24-甲基-2-乙基己醛3反-4己烯醛4Z-3-甲基-2庚烯-5-炔-4-酮53-甲氧基-4-羟基苯甲醛 6对甲氧基苯乙酮7反-2-甲基环己基甲醛83R-3-溴-2-丁酮93-甲酰基戊二醛10螺癸-8-酮2. 比较下列羰基化合物与HCN加成时的平衡常数K值大小;1Ph2CO 2PhCOCH3 3Cl3CHO 4ClCH2CHO5PhCHO6CH3CHO解:1<2<5<6<4<3原因: HCN对羰基加成是亲核加成,能降低羰基碳原子上电子云密度的结构因素将会使K值增大,故K值顺序是:6<4<3,而羰基碳原子的空间位阻愈小,则K值增大,故K 值的顺序是:1<2<5<6 ,综合考虑:则K值顺序是:1<2<5<6<4<3;6. 完成下列反应式对于有2种产物的请标明主次产物;解:7. 鉴别下列化合物:解:或12. 如何实现下列转变解:13. 以甲苯及必要的试剂合成下列化合物;解:1214. 以苯及不超过2个碳的有机物合成下列化合物;解:2解:18. 化合物F,分子式为C10H16O,能发生银镜反应,F对220 nm紫外线有强烈吸收,核磁共振数据表明F分子中有三个甲基,双键上的氢原子的核磁共振信号互相间无偶合作用,F经臭氧化还原水解后得等物质的量的乙二醛、丙酮和化合物G,G分子式为C5H8O2,G能发生银镜反应和碘仿反应;试推出化合物F和G的合理结构;解:19. 化合物A,分子式为C6H12O3其IR谱在1710 cm-1有强吸收峰,当用I2-NaOH处理时能生成黄色沉淀,但不能与托伦试剂生成银镜,然而,在先经稀硝酸处理后,再与托伦试剂作用下,有银镜生成;A的I HNMR 谱如下: δ s,3H,δ d, 2H , δs,6H , δt,1H;试推测其结构;解:20. 某化合物A,分子式为C5H12O,具有光学活性,当用K2Cr2O7氧化时得到没有旋光的B,分子式为 C5H10O,B与CH3CH2CH2MgBr作用后水解生成化合物C,C能被拆分为对映体;试推测A、B、C结构;解:2013-4-9。
基础有机化学王兴明主编十一章醛酮答案

第11章醛酮
习题答案
习题1
请参照教材中醛酮的命名部分。
习题 2
a.苯甲酸
b.苯甲酸
c.苯甲酸
d.苄醇
e.苄醇
f.二苯甲醇
g. h. i. PhCH=NOH j. PhCH=NNHPh
k.l.
习题3
与g无反应,其它参照习题2
习题4
(a)苯乙酮和(b)丁醛可以和亚硫酸氢钠发生反应,其中丁醛反应速度较快。
习题 5
习题6
请参照教材中缩醛缩酮半缩醛半缩酮定义。
习题7
请参照教材中醛酮的化学性质部分。
习题8
a为动力学控制,取代基少的一端去质子反应速率快;b为热力学控制,共轭的且双键上取代基比较多结构相对比较稳定(见下图)。
习题9
习题10
习题11
习题12
习题13
习题14
习题15
习题16 习题17
习题18
习题19。
大学有机化学重点知识总结第十一章 醛、酮
—制备增加2个C原子的伯醇:
+
H2C CH2
-+
RM gBr
O -
(C2H5)2O
R C H 2 C H 2 O M g B r
H 3O + H O C H 2C H 2R
精选可编辑ppt
42
33.
CH3 ( NBS )
CH2Br
Mg
(
干醚
CH2MgBr )
① O / 干醚
(
② H3O+
CH2CH2CH2OH )
R C O R '+H 2 O H +
R CO +2 R 'O H
(R '')HO R '
(R '')H
精选可编辑ppt
33
H +
O O C H 3
( )+ ( )
O
CH2CH2CH2CH CH3OH
HO
O
O
O
C OCH3 H
O O
C OCH3
H OC H2CH 2OH
精选可编辑ppt
34
(3)活性:醛>酮 酮一般用原甲酸三乙酯形成缩酮
O C
羰基
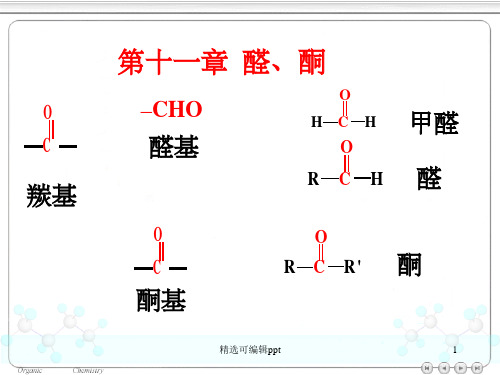
第十一章 醛、酮
–CHO
醛基
O HCH
O
RCH
甲醛 醛
O
C
酮基
O
R C R' 酮
精选可编辑ppt
1
烃基
脂肪族醛和酮 芳香族醛和酮
醛和酮
饱和醛和酮
的分类 烃基是否饱和 不饱和醛和酮
一元醛和酮
羰基个数 二元醛和酮
多元醛和酮
有机化学第十一章 醛酮

NaCl + SO2↑ + H2O
Na2CO3 NaHCO3 + Na2SO3
(C)转化成α-羟基腈 α-羟基磺酸钠与NaCN作用,其磺酸基则被氰基取代生成α-
羟基腈。如:
CHO NaHSO3
OH C
Na C N
SO3Na
OH C
CN
HCl H2O
OH C
COOH
优点:可以避免使用易挥发、有毒的HCN,且产率较高。
O
O
CH3-C-CH2-C-CH3
2,4 戊二酮
H3C O
3 甲基环戊酮
练习
命名下列化合物。
O CH3 CH3CCH2C=CH2
4-甲基-4-戊烯-2-酮
CH3CHCH2CHO OH
3-羟基丁醛
O CH3CHCH2CCH3
Cl
4-氯-2-戊酮
O CCH3
CHO
CHO
苯乙酮
CH2CHO
苯甲醛
CH3
3-甲基苯甲醛
= = R
++ δ
δ
R δ+ δ
CO >
CO
H
R
羰基碳原子连有基团的体积↑,空间位阻↑,不利于亲核试剂
进攻,达到过渡状态所需活化能↑,故反应活性相对↓。
综上所述,下列醛、酮进行亲核加成的相对活性为:
Cl3C C=O
H
> C=O
> CH3 C=O
R
> C=O
Ar
> C=O
>
H
H
H
H
H
= CH3 C O >
α -二醛或酮:两个羰基直接相连。 β -二醛或酮:两个羰基间隔一个碳原子。
有机化学_曾昭琼_第四版_答案_第十一章

HO
CHO
(4)
H3CO
(5) (CH3)2CHCOCH2CH3
(6) O
O CH
(7)
H3C
(8)
25
2、 写出下列有机物的构造式:
(1) 2-methylbutanal
4-羟基-3-乙酰基苯甲醛 2-甲基-3-戊酮 4-乙撑基环己酮 或 4-亚乙基环己酮
1-苯基-1-丙酮 反-2-甲基-4-乙基环己酮
OH
NaOH
CHCH-CH-CH=O
OH NaBH4 H SO
24
CH2=CH-CH=CH2
(2) 由环己酮合成己二醛
解:
O NaBH4
OH H2 S 4
O
O3
CHO
CHO
(3) 由丙醛合成 CH3CH2CH2CH(CH3)2
OH 2CH3CH2CH=O
OH CH3CH2C-CH-CH=O
CH3
H3 + O
CH(OCH2CH2O) CHO
CHO CHO
CHO OH
CHO
CH(OCH2CH2O)
CH(OCH2CH2O)
CHO
(7) CH3COCH2CH2CH2OH
7
C 3COC 3 解: H H
CH3COCH2Br O
CH3C(OC 2CH2O)CH2Br H
CH3C(OCH2CH2O)CH2MgBr
CH CH C(CH )=CH (1)
3
3
解:
+
-
Ph3P -CH3 Cl
PhLi
CH3CH2C(CH3)=O + Ph3P=CH2
CH3CH2C(CH3)=CH 2
6
大学有机化学第11章__醛和酮

O C CH3
苯乙酮
(乙酰苯)
共九十一页
2)系统(xìtǒng)命名 法
O
5
CH3
CH3CH2-C-CH2-CH-CH2CH3
CH3-CH-CH2CH2CHO
HO-CH-CH3
6
4-甲基戊醛
5-乙基-6-羟基 3-庚酮
- (qiǎngjī)
共九十一页
C H 3
C H O
C H 2 C H 2 C H C H O O H C C H 2 C H C H 2 C H O
共九十一页
加成-消除(xiāochú)历程
R’
R—C=O + H2N—G
H+
R’ R-C — N—G
H+ -H2O
R’ R-C=N—G
OH H
(N-取代(qǔdài)亚胺)
这种加成-消除实际上可以看成由分子间脱去一分子水:
R’
R—C=O + H2 N—G
R’ R-C=N—G + H2O
共九十一页
加成-缩合产物(chǎnwù)的结构及名称:
加成-缩合产物的结构(jiégòu)及名称:
R’ R—C=O +
R’
H2N—R H2N—OH
R—C = N-R Schiff base R’
R—C = N-OH 肟(oxime)
H2N—NH2 H2N—NH-
O
R’
R—C=N-NH2 腙(hydrazone) R’
R-C=N-NH-C6H5 苯腙
H2N—NH-C-NH2
R’
R-C=N-NH-CO-NH2 缩氨脲
共九十一页
6) 与格氏试剂加成
有机化学第十一章

羰基化合物的活性次序(电子效应和空间效应): 羰基化合物的活性次序(电子效应和空间效应):
HCHO > CH3CHO > ArCHO > CH3COCH3 > CH3COR> CH3COAr > RCOR' > ArCOAr'
O 2N CHO > CHO
>
H 3C
CHO
1、与HCN的加成 、 的加成
维纶
4、与金属有机试剂的加成 、
(1)格氏试剂 )格氏试剂: H2CO +
MgCl 无水 乙醚
CH2OH 64-96%
H2O CH2OMgCl H SO 2 4
CH3 无水 乙醚 CH3COPh + PhCH2MgCl PhCH2 C OMgCl Ph CH3 H2O PhCH2 C OH NH4Cl Ph 92% Grignard: 1912 Nobel Prize
异 丙 醇 铝 ,丙 酮 丙 苯,回流
80%
CHCH CCH CH2 CH3
CH3 C CH CHCH CCH CH2 CH3 O
Oppenauer氧化: 异丙醇铝是催化剂 反应中双键不受影响。 氧化: 异丙醇铝是催化剂, 反应中双键不受影响。 氧化
脱氢:醇在适当的催化剂条件下脱去一分子氢 生成醛酮。 脱氢:醇在适当的催化剂条件下脱去一分子氢,生成醛酮。
CH3OH 浓H2SO4
COOCH3
CH2 C COOCH3 CH3 90%
过氧化苯甲酰
CH2 C CH3
n
甲基丙烯酸甲酯
聚甲基丙烯酸甲酯 (有机玻璃) 有机玻璃)
2、与NaHSO3的加成 、
加成生成a-羟基磺酸钠 羟基磺酸钠: 醛和甲基酮与饱和的NaHSO3加成生成 羟基磺酸钠: 醛和甲基酮与饱和的
有机化学 第十一章 醛酮

O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ag2+ 或Cu2+
CH 2 =CHCH 2 CH 2 COOH
强氧化剂:HNO3、KMnO4、K2Cr2O7-H2SO4
O RCH2 C CH2R' a b [O] O O O
氧化醛酮
O
RCOH + R'CH2COH + RCH2COH + R'COH
a 处断裂
增长碳链的方法
1. 羟醛缩合反应
2. 利用格氏试剂 -羟基醛(酮) 增一个、二个、多个碳 增两个碳的伯醇 增一个碳的羧酸 增碳的醇
与环氧乙烷反应 与二氧化碳反应 与醛、酮反应 3. 引入 CN- — 增长一个碳 卤代烃与氰化钠反应 羰基化合物与氢氰酸反应 4. 卤代烃与炔钠反应
腈 α- 羟基腈 炔烃
:B-
C
R
X
C
X X
X C
X
卤素与烯醇式C=C的亲电加成; 在α-位引入卤原子后,使α -H更活泼。
6
3. 醛酮的-卤代 (2) 碱催化卤代及卤仿反应(haloform reaction) ● 反应历程-最终产物
O X C C X + OHX
①
O- X C C X X HO
②
O
+ CX C OH 3
o 240 C
H3C C5H5N-CrO3 CH3 CH2OH H3 C
CH3
CH3
24
对甾酮及大分子量的羰基化合物的还原特别有效
2. 还原反应
(2) 还原为烷烃
Question
O 1) O O
用什么试剂完成下列转变?
O CH(CH2)5CH2CH3 O
CH(CH2)5CCH3
O
O
O CH3OCCH2CH2CH2CH2CH3
主要有两种还原形式
[H] CH2
• 氢化金属还原(第III主族元素)
LiAlH4, NaBH4, B2H6
• Clemmensen还原
Zn (Hg) / HCl
• 催化氢化还原:
H2, 加压 / Pt (or Pd, or Ni) / 加热
• Wolff-Kishner还原
NH2NH2 / Na / 200oC 黄鸣龙改良法 NH2NH2 / NaOH/ (HOCH2CH2)2O/
一缩二乙二醇(高沸点溶剂)
优点
常压反应,反应时间大大缩短(50~100h→几小时) 肼的水溶液
23
(2) 还原为烷烃
(b) Wolff-Kishner-黄鸣龙还原法 (适于对碱稳定的羰基化合物)
应用
H3 C LiAlH4 Et2O CH3 COOCH3 H3C NH2NH2 H2O KOH/二缩三乙二醇 CH3 CHO
增长碳链的方法
5. F-C烷基化、酰基化反应
6. 氯甲基化反应 7. Wittig反应 8. Kolbe-Schmitt反应(羧基化) 9. Reimer-Tiemann反应 10. Wurtz反应 11. Perkin反应 12. 酯化反应 烷基苯、芳酮 卤代芳烃 烯烃 酚酸 酚醛 烷烃 α,β- 不饱和酸 酯
下降102-103倍。
4
3. 醛酮的-卤代 (2) 碱催化卤代及卤仿反应(haloform reaction)
O CH3CCH3
Br2,OH- 慢
O CH3CCH2Br
Br2,OH- 快
O CH3CCHBr2
Br2,OH 更 快
-
O CH3CCBr3
Question
O
1.为什么碱催化反应难停留在一元取代阶段? 2. 反应的最终产物是什么 ?
形成一个氧负离子中间体; 氧负离子失去三卤甲基; 一个酸碱反应
③
COO- + HCX3 (Haloform)
7
(2) 碱催化卤代及卤仿反应(haloform reaction)
● 卤仿反应 含有α-甲基的醛酮在碱溶液中与卤素反应,则生成卤仿。
O R C CH3 NaOH X2
O
OH-
(H)
NaOX
R
C
CX3
CHX3
RCOOH
(H)
卤仿
应用一:制少一个碳的羧酸
O (CH3)3CCH2C CH3 Br2 NaOH H
+
O (CH3)3CCH2COH + CHBr3
8
(2) 碱催化卤代及卤仿反应 ● 卤仿反应
O OH CH3 CH
应用二:鉴别 CH3 C
碘仿反应(I2+NaOH或 NaOI)
CH CHCH2OH
HO CH CH3
NO2
NO2
(Oppenauer醇氧化的逆反应)
>NaBH4> Al[OCH(CH3)2]3 催化氢化 (Pt, Ni, Pd) > LiAlH4
20
2. 还原反应
(2) 还原为烷烃 (a) Clemmensen还原法 ( 适用于对酸稳定的体系)
O R C R'(H) Zn(Hg) HCl R CH2 R'(H)
1. RMgX
or NaBH4 2. H2O HCN / NaOH OH R C H(R) CN
16
可逆
(1) 还原为醇 (b) 用金属氢化物还原- 保留C=C LiAlH4 活性 选择性 高 低 醛酮、 COOH、 X、 COOR、CN 遇水剧烈分解, 醚中 NaBH4 中等 中等 醛酮、 Al[OCH(CH3)2]3 低 高 醛酮
还原基团
酰卤中羰基、X
水醇中
试剂要求
异丙醇中
共同特点 氢负离子作亲核试剂对羰基的加成
机理探索中
17
1912 年他出生于英国, 1936 年在芝加哥大学取得学士学 位, 1938 年又在该校取得博士学位。 布朗在毕业后从事金属硼氢化合物的研究,使大量制取二 硼烷的方法取得成功,并由此发明了硼氢化钠及其生产方 法。自此之后,硼氢化钠就成为化工生产上极为重要的选 择性还原剂。 1943 年布朗转到韦尼( wayne )大学并从事 空间张力方面的研究,1947 年他被珀杜( Purdue )大学 聘任,并继续其硼化学方面的研究,发明了著名的硼氢反 应。这个反应被认为是过去卅年中新发展的一个重要反应。 1981 年他仍在珀杜大学研究用有机硼来合成昆虫激素。 布朗发现了硼氢反应,在这方面工作很出色,获得了 1979 年的诺贝尔化学奖, 1981 年获得美国化学会普里斯莱 奖金化学奖。
3. 醛酮的-卤代
O H C C H (R) + X2
+ -
H 或OH
O X C C H(R)
+ H+X-
(1) 酸催化卤代(一卤代产物)
Br O CH3COOH C CH3 + Br2 Br 20oC O C CH2Br + HBr
CH3 + Br2 (1mol) O
CH3COOH H2O
CH3 Br O
(2) 还原为烷烃
(b) Wolff-Kishner-黄鸣龙还原法 (适于对碱稳定的体系)
R (H) R' C O
NH2NH2
R (H) R'
C NNH 2
NaOC2H5
R
CH2 + N2
W
无水
高压釜中 (H)R'
黄鸣龙改良法(Huang-Minlon modification)
O R C R' NH2-NH2, NaOH (HOCH2CH2)2O , R CH2 R' + N2
O
O C X
5
C H
C
C
C
C
OH
X
X
3. 醛酮的-卤代 (2) 碱催化卤代及卤仿反应(haloform reaction) ● 反应历程-三元取代
X
H C H X O C R
:B-
X [H C X [ -C X
O C O R H
X C X
OC OC R R]
X X
O
C O C R R
H C X
X
H.C.布朗 (1912~) 美国化学家
(1) 还原为醇 (b) 用金属氢化物还原- 保留C=C ● LiAlH4 和NaBH4
RC H=C H (R')H C =O
①NaB H4 或LiAlH 4 ②H 3O +
H 1. 2. H2O OH OH
3
特点:可控制在不同阶段
(1) 酸催化卤代(一卤代产物)
反应机理
Step1: 烯醇化
H O C C
+OH
决速步骤
H OH C C
H+
+
H+
slow O C
δ-
C
OH C
X
X
C X
C
C X
Step3: 脱质子
Step2: 卤素进攻
亲电加成
在α-位引入卤原子后,使羰基氧上对应电子云的密度下降; 实验证明,在α-位引入一个卤原子,羰基氧的接受质子能力
CH3O (CH2)3COOH
25
2) CH3OCCH2CH2CH2CCH3
O CH3O C(CH2)2COOH
集科学家、革命家于一身的康尼查罗
1841年进入巴勒摩大学医学系。他迷上生理学,后转向化学。 作为学潮积极分子,被迫离校,到比萨大学深造,成为基础扎 实,实验技术精湛,学术思想活跃的化学家。 1847年回到巴勒摩,投身革命。1849年起义失败。他流亡到法 国,在化学教授谢福瑞的实验室开展有机化学的实验研究。 1851年,皮埃蒙特政府聘请康尼查罗到技术学院任物理、化学 康尼查罗 和数学教授。在这里,他取得了有机化学的一个重要发现:在浓 Cannizaro 碱催化下若两种不同的不含氢的醛交叉歧化,一般是小的醛被氧 (1826~1910) 化,大的醛被还原。即康尼查罗反应。 意大利化学家 1860年,西西里农民再度起义,他回到阔别11年的故乡,成为 西西里国家的非常委员会成员,但他没有忘记科学事业。 1871年,他任罗马大学化学教授。一方面从事教学,培养大批 优秀的化学家,一方面从事有机化学的研究,取得了突出的成就。 他还是意大利王国的副议长,国家教育委员会、国家财政委员会 成员,为建设统一后的意大利作出了杰出贡献。
