共价键 (2)
第九章 共价键-2

1、分子波函数ψ称为分子轨道。
分子中每个电子的空间运动状态都可用 一个分子波函数ψ (即分子轨道)来描述。
有相应的能量和形状
ψ 2 表示电子在空间各处出现的概率密度 原子轨道与分子轨道的区别
原子轨道(AO)
(1)单核系统 (2)名称:s,p,d,f
分子轨道(MO)
多核系统 σ,π,δ
2、分子轨道是由组成分子的原子轨道线 性组合而成。 (Linear combination of atomic orbitals, LCAO )
◎对称性不匹配的判断:
若一个AO对对称操作是对称,而 另一个AO对同一对称操作是反对称, 则二者属对称性不匹配。
不能组合成分子轨道
对旋转和反映这两个对称操作, s轨道具对称性, ∴s, pz原子轨道属 pz轨道具反对称性 对称性不匹配。
图9-14 s原子轨道和pz原子轨道对称性 不匹配示意图
※符合对称性匹配原则的几种常见AO组合: (对x轴) (对xy平面)
s-s, s-px, px- px
σ分子轨道 ◆ 组 合 方 式
同号波函数叠加
(即 +
py-py, pz-pz
π分子轨道
+重叠或-
-重叠)
异号波函数叠加
(即 +
- 重叠)
成键MO σ、π
反键MO
σ*、π*
图9-16 s-s, s-px原子轨道线性组合 (对x轴)成 分子轨道示意图
+
+
异号
-
+
σ*
s-s
- 1312
- 6718 - 3871 - 1797
■从对称性匹配来看,H的1s均可与F的1s、2s、 2p组成分子轨道。 ■从能量近似原则来看,H的1s只可与F的2p组 成分子轨道。 即通过σs-px单键形成HF分子。
1-2-4共价键的基本属性

共价键 (covalent bond): 原子间通过共用电子对相互结合而成键(电子共享)
共 有价机分键子中的的基化学本键 —属—性共价键
碳是四价的
碳与碳之间可以成键,形成复杂化合物
CCC C
廊坊师范学院
C CCC C
继续C 教育学院
第一章 绪 论
C CC CC
1、键长
内
2、键能
容
3、键角
目
4、键的极性
录
(1)非极性共价键
(2)极性共价键
电负性
偶极矩
共价键的基本属性
键参数:表征化学键性质的物理量统称为键参数。
主要指键长、键角、键能等。 通过键参数,可以预测分子的构型,解释分子的稳定性和分子极性等
性质。
1、键长(bond length): 成键原子核之间的距离
不同的共价键具有不同的键长。在不同化合物中,同 一类型的共价键的键长基本相同。
Br
某些元素的电负性
2.9
I
2.6
原子电负性与键的极性
电
△χ
负 性
2.1-2.1=0 H H
差 值
2.5-2.1=0.4 H I
越
大, 2.8-2.1=0.7 HBr
键 的
3.0-2.1=0.9 HCl
极 性
4.0-2.1=1.9 HF
越
强 4.0-0.9=3.1 NaF
Na+ F-
一般规律: 弱极性键:电负性差在0~0.6间 极性键:0 .6~1 .7间,
影响键角的因素 ① 孤对电子的影响 ② 重键的影响
4、键的极性
共价键
极性共共价价键键强弱的极极类性性型键键::如如
2-2共价键

(三)分子间作用力 1.取向力、诱导力和色散力。 2.氢键
谢谢观看!
67
第三节 分子间作用力和氢键
一、分子的极性 根据共价分子中正、负电荷重心是否重合,将分子 分为极性分子和非极性分子。正、负电荷重心不重合的 分子称为极性分子;正、负电荷重心重合的分子称为非 极性分子。
双原子分子
分子极性与键的极性一致
双原子分子
极性键→ 极性分子 HCl,CO,NO 非极性键→ 非极性分子 H2,O2,N2
193
I2
151
N2
946
O2
493
E/kJ·mol-1
HF
565
HCl
431
HBr
366
HI
299
NO
286
CO
1071
E/kJ·mol-1
C-H
413
C-F
460
C-Cl
335
C-Br
289
C-I
230
C-C
346
C=C
610
C≡C
835
E/kJ·mol-1
N-H
391
N-N
159
N=N
418
N≡N
金属晶体 离子晶体 分子晶体 原子晶体
(一)分子晶体
晶格点是分子。非金属单质和某些化合物在降温 凝聚时都能形成分子晶体。
特点:此类晶体的熔点低、硬度小、挥发性较大, 常温常压下呈气态或液态。固态或熔融状态下均不导 电,其溶解遵守“相似相溶”原理。
例如:O2、CO2是气体,乙醇、醋酸是液体。
(二)原子晶体
2.sp2杂化:
以BF3分子的形成为例。( B: 2s22p1 )
人教版高中化学必修二 1.3.2 共价键 教案(2)

第2课时共价键三维目标1.知识与技能(1)知道共价键的概念;(2)了解极性键和非极性键的概念;(3)能用电子式表示共价化合物的形成过程。
2.过程与方法(1)通过对共价键形成过程的学习,培养学生抽象思维和综合概括的能力;(2)通过离子键和共价键的学习,培养学生对微观粒子运动的想象力。
3.情感态度与价值观(1)培养学生用对立统一规律认识问题;(2)通过对共价键形成过程的分析,培养学生怀疑、求实、创新的精神;(3)培养学生由个别到一般的研究问题的方法,使学生领会从宏观到微观,从现象到本质的认识事物的科学方法。
教学重点共价键和共价化合物的概念理解;化学反应的本质理解。
教学难点共用电子对的理解;极性键和非极性键的理解。
课前准备多媒体平台:共价键形成的动画。
教学过程知识回顾回顾氯化钠的形成,离子键的概念、实质、形成条件。
复习原子、离子、分子的电子式以及离子化合物的形成过程的书写。
写出下列物质的电子式:Mg3N2、PH3、K2O导入新课我们知道钠在氯气中燃烧生成氯化钠,由于钠原子容易失去1个电子形成阳离子,氯原子容易得到1个电子形成阴离子,然后钠离子和氯离子间通过静电作用形成了氯化钠这种离子化合物。
那我们在初中学习过的共价化合物HCl的形成和NaCl的形成一样吗?H2和Cl2在点燃或光照的情况下,H2和Cl2分子分别被破坏形成氢原子和氯原子,当氢原子和氯原子相遇时是通过什么样的方式结合在一起的呢?是通过阴阳离子间静电作用结合在一起的吗?推进新课[分析]两种非金属元素的原子化合时,原子间并不是一方失去电子形成阳离子,一方得到电子形成阴离子来形成相互作用力的,而是原子间共用最外层上的电子,形成共用电子对以使原子双方均达到稳定的电子层结构。
共用电子对同时受到两个原子核的吸引,从而将两个原子紧密地联系在一起,如同双面胶把两个小球黏在一起。
[投影]氯原子之间通过共价键形成氯气分子的动画。
[分析]我们以氯原子为例来探讨一下氯分子的形成。
共价键 2
Cl—Cl共价键
б键的种类: 根据形成б键的轨道不同可分为
S—Sб键、S—Pб键、P—Pб键等。
H
H-Cl
Cl
H-Cl的s-pσ键的形成
Cl Cl Cl Cl
Cl-Cl的p-pσ键的形成
(2)Π键
P
P
互相靠拢
Π键的特征:
电子云重叠
Π键的电子云
(1)电子云为镜像,即是每个Π键的电子云由两块组 成,分别位于由两个原子核构成的平面的两侧。 (2)不稳定,容易断裂。 Π键的种类: 根据形成Π键的轨道不同可分为 P—PΠ键、P—dΠ键、d—dΠ键等等。
p-pπ键的形成
p-pπ键的形成
(4)共价键的类型
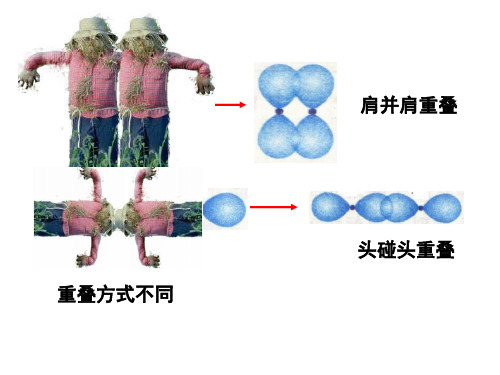
①σ键:以形成化学键的两原子核的连线为轴作旋 转操作,共价键电子云的图形不变,这种特征称为 轴对称。如H-H键。 类型:s—sσ键 、s—pσ键、p—pσ键等。 特点:头碰头、电子云为轴对称,键强度大,不易 断裂。 ②π键:由两个原子的p电子“肩并肩”重叠形成。
π键
平行方向 “肩并肩” 镜像对称 强度较小,易 断裂
键型 成键方向
电子云形状 牢固程度 成键判断 规律
共价单键是σ键,共价双键中一个是 σ键,另一个是π键,共价三键中一个 是σ键,另两个为π键。
因而含有π键的化合物与只有σ键的化合物的化学性质 不同,如我们熟悉的乙烷和乙烯的性质不同。
肩并肩重叠
头碰头重叠 重叠方式不同
(1)s-s σ键的形成
相互靠拢
用电子云来描述共价键的形成过程
1、H2分子的形成过程 (s-sσ键)
H
H H
H
σ键的特征:以形成化学键的两原子核的 连线做为轴旋转操作,共价键电子云的 图形不变,称为轴对称。
共价键(2)高二化学(人教版2019选择性必修2)

某些共价键的键能和键长
键长pm
键
键能(kJ·mol-1)
141
H-F
568
198
H-Cl
431.8
228
H-Br
366
267
H-I
298.7
154
C≡C
812
133
键长pm 92 127 142 161 120
键参数——键长和键角
知识梳理
键 F-F Cl-Cl Br-Br I-I C-C C=C
知识梳理
键 F-F Cl-Cl Br-Br I-I C-C C=C
键能(kJ·mol-1) 157 242.7 193.7 152.7 347.7 615
某些共价键的键能和键长
键长pm
键
141
H-F
198
H-Cl
228
H-Br
267
H-I
154
C≡C
133
键能(kJ·mol-1) 568 431.8 366 298.7 812
H-Br
267
H-I
154
C≡C
133
键能(kJ·mol-1) 568 431.8 366 298.7 812
规律1:同种类型的共价键,成键原子的原子半径越小,键长越小。 规律2:成键原子相同的共价键的键长:单键键长 > 双键键长 > 三键键长
键长pm 92 127 142 161 120
键参数——键长和键角
规律1:同种类型的共价键,成键原子的原子半径越小,键长越小。 规律2:成键原子相同的共价键的键长:单键键长 > 双键键长 > 三键键长 规律3:一般地,键长越短, 键能越大,共价键越牢固,由此形成的分子越稳定。
共价键的类型2
(a)S-S σ键的形成
相互靠拢
s-s
(b). s-p
σ键的形成
未成对电子的 电子云相互靠拢
电子云相互重叠
(c)、p-p σ键的形成
未成对电子的 电子云相互靠拢
电子云相互重叠
σ键的类型
小结: σ键成键方式 “头碰头”
S-S重叠
S-P重叠
P-P重叠
2、π键
原子轨道以“肩并肩”方式相互重叠导 致电子在核间出现的概率增大而形成的共价 键
﹕ ﹕
氮原子有孤对电子,氢离子有空轨道。 共用电子对全部由氮原子提供。
(四)、按提供共用电子对的方式分: 普通共价键和配位键。
由一个原子提供孤对电子,另一个原子提
供空轨道或另一个接受电子对的原子形成的共价键 称配位键。 氨根离子与水合氢离子等是通过配位键形成的。 +
﹕ ﹕ ﹕ ﹕
H H ﹕O﹕ + H+ →
3、有机物中的共价键
(1)、C – H 是σ键。 (2)、C—C 是σ键。 (3)、C=C 一个σ键,一个π键。 (4)、 C ≡C 一个σ键,两个π键。
乙烯、乙炔分子中C-C σ键比较稳 定不容易断裂, π键比较容易断裂。
乙烷、乙烯和乙炔 分子中的共价键分别由 几个σ键和几个π键组成?
乙烷: 乙烯: 乙炔:
7 5 3
个σ键 个σ键 个σ键
1 2
个π键 个π键
乙烯、乙炔分子中轨道重叠方式示意图
请写出乙烯、乙炔与溴发生 加成反应的反应方程式。并思考: 在乙烯、乙炔和溴发生的加成反 应中,乙烯、乙炔分子断裂什么 类型的共价键?
1、根据氢原子和氟原子的核外电子 排布,你知道F2和HF分子中形成的共价键 有什么不同吗?
2、键的极性由强到弱的顺序: F—H O– H N—H C—H
第二章 第一节 共价键
肩并肩 ”重叠形成 由两个原子的p轨道“_______
镜像 ; 面,它们互为_____ 不能 旋转;一般不如σ键牢固,较易_____ 断裂 ②π键_____
首 页 上一页 下一页
末 页
结
束
现有①N2 ②CO2 ③CH2Cl2 ④C2H4四种分子 (1)只存在σ键的分子有哪些? (2)同时存在σ键和π键的分子有哪些? (3)σ键和π键的数目之比为1∶1的是哪种分子?
提示:(1)③
(2)①②④
(3)②
首 页
上一页
下一页
末 页
结
束
分子中σ键和π键的判断方法 (1)根据成键原子的价电子数来判断能形成几个共用电 子对。如果只有一个共用电子对,则该共价键一定是σ键; 如果形成多个共用电子对,则先形成1个σ键,另外的原子轨 道形成π键。 (2)一般规律:共价单键是σ键;共价双键中有一个σ 键,另一个是π键;共价三键中有一个σ键,另两个是π键。
特征
连线 为轴作旋转操作, ①以形成化学键的两原子核的_____ 轴对称 不变 ,这种特征称为__ 共价键电子云的图形_____ __; 较大 ②σ键的强度_____
首 页 上一页 下一页
末 页
结
束
(2)π键 形成 pp型 ①π键的电子云具有_____ 镜像 对称性,即每个π键的 电子云由两块组成,分别位于由原子核 ______构成平面 特征 的两侧,如果以它们之间包含原子核的平面为镜
解析:等电子体要具备两个条件:一是粒子的原子总数 相同,二是粒子的价电子总数相同。分析可知①②两组 属于等电子体,③中F-和Mg的价电子总数不同,④中 H2O和CH4的原子总数不相同。
首 页 上一页
答案:A
下一页
共价键 第2课时 示范教案
共价键第2课时◆教学目标1. 理解键能、键长和键角等键参数的含义。
2. 能应用键参数——键能、键长、键角说明简单分子的结构和性质。
◆教学重难点用键参数解释物质的某些性质。
◆教学过程一、新课导入之前的学习我们讨论分析了乙烷、乙烯和乙炔的分子中两个碳原子之间的成键情况。
它们分别有几个σ键和几个π键?发生化学反应的过程中,旧的化学键被破坏。
从这一角度,讨论为什么乙烯和乙炔的化学反应活性更高,比如它们能与Br2加成,而乙烷不能?乙烯、乙炔在与Br2加成时,只破坏了其中的π键,而σ键未发生改变。
因为π键的轨道重叠程度相较于σ键较小,故更易断裂。
在描述两个原子之间的共价键强度时,我们使用“牢固”或“不牢固”这样的描述不够科学、清晰。
是否有参数可以定量描述共价键的强度?这个参数可能与什么因素相关?这个参数是否有规律性?如何描述这种规律性?二、讲授新课二、键参数——键能、键长与键角1.键能定义:键能是指气态分子中 1 mol化学键解离成气态原子所吸收的能量。
键能可以直接定量直观的反映共价键的强弱。
说明:①键能通常是298.15 K、101kPa条件下的标准值。
②键能可以通过实验测定,更多是推算获得的(如盖斯定律)。
③同样的共价键在不同的分子中键能略有区别,如甲烷中的C-H键和乙烯中C-H键键能不严格相等。
表2-1中列出了若干共价键键能的数据,请你观察表格,自己寻找并归纳期中的规律,并将你的结论与小组同学交流。
【提问】(1)同主族的卤原子与H之间的共价键键能的变化规律如何?同周期的C、N、O、F与H之间的共价键键能的变化规律如何?【讲解】卤化氢中X-H键键能自上而下逐渐减小;同周期的C、N、O、F与H之间的共价键键能F-H > O-H > C-H > N-H,自左向右呈逐渐增大趋势(N-H略小于C-H)【提问】(2)碳碳单键、碳碳双键、碳碳叁键的键能变化趋势如何?它们之间的差值大小是怎样的?从键能的角度谈谈乙烷、乙烯、乙炔的反应活性差别。
2-1共价键(2)
2、键长:形成共价键的两个原子之间的核间距。 键长是衡量共价稳定性的另一个参数。
键 H—H F—F 键长/Pm 74 141 键 C=C C —H 键长/Pm 120 109
Cl—Cl
198
O—H
96
讨论:对比表 2-1和表2-2 10-12m 定性的关系。 ②一般而言原子半径越大,键长越大。
破坏1mol化学键形成气态基态原子所需的最低能量。 键能越大,化学键越稳定。
应用:计算化学反应的反应热。 ∆H=反应物键能总和-生成物键能总和 键长:形成共价键的两个原子之间的核间距。 键长越短,键能越大,化学键越稳定。 键角:两个共价键之间的夹角。
三、等电子原理 等电子体:
课堂小结
原子总数、价电子总数相同的分子。
(第二课时)
二、键参数--键能、键长与键角 1、键能(阅读P30) (1)键能是气态基态原子形成1mol化 学键释放的最低能量。 例如:形成1molH-H键释放的最低能 量为436.0kJ,形成1molN N键释放的最 低能量为946kJ,这些能量就是相应化学 键的键能,通常取正值。
(2)单位:kJ/mol
共价单键 — σ键
共价双键 — 1个σ键,1个π键
共价三键 — 1个σ键,2个π键
键参数
键能:键能越大,共价键越稳定 衡量共价键 键长:键长越短,共价键越稳定 的稳定性 键角:描述分子空间结构的重要参数
科学视野:用质谱仪测定分子结构
现代化学常利用质谱仪测定分子的结构。它的基本 原理是在质谱仪中使分子失去电子变成带正电荷的分子 离子和碎片离子等粒子。由于生成的分子离子、碎片离 子具有不同的相对质量,它们在高压电场加速后,通过 狭缝进入磁场分析器得到分离,在记录仪上呈现一系列 峰,化学家对这些峰进行系统分析,便可得知样品分子 的结构。例如,图2—7的纵坐标是相对丰度(与粒子的 浓度成正比),横坐标是粒子的质量与电荷之比(m/e) ,简称质荷比。化学家通过分析得知,m/e=92的峰是 甲苯分子的正离子(C6H5CH3+),m/e=91的峰是丢失一 个氢原子的的C6H5CH2+ ,m/e=65的峰是分子碎片…… 因此,化学家便可推测被测物是甲苯。
