专题3 第一单元弱电解质的电离平衡第1课时课件
合集下载
高中化学第三章 第一节电离平衡第1课时强电解质和弱电解质弱电解质的电离平衡课件新人教版选择性必修1

探究一 电解质的分类与电离
情境探究
某化学课外活动小组设计实验探究溶液
导电性与离子浓度的关系。实验装置如图所
示,根据所学知识回答下列问题。
(1)两溶液为什么能导电?
提示:溶液中存在自由移动的离子。
(2)接通电源后 a 、 b 两个灯泡哪个更亮?试分析原因。
提示: b 灯泡更亮。 CH3 COOH 是弱电解质, HCl 是强电解质。相同浓度的盐酸和醋酸
为
),分子中虽然含有3个 H ,但只有一个 — OH 能发生电离,故属于一元酸。
易错辨析2(1) 电离平衡右移,弱电解质分子的浓度一定减小,离子浓度不一定增大。
( ×)
(2)电离平衡向右移动,弱电解质的电离程度一定增大。( × )
提示:向稀醋酸中加入少量浓醋酸,醋酸的电离平衡向右移动,但醋酸的电离程度减小。
(2) Al OH
Na+ + H + + SO2−
4 ;熔融状态: NaHSO4
Na+ + HSO−
4 。
3 是中学化学涉及的一种重要的两性氢氧化物,存在酸式电离和碱式电离。
酸式电离: Al OH
3
⇌ H + + AlO−
2 + H2 O ;碱式电离: Al OH
3
⇌ Al3+ + 3OH− 。
(3)含氧酸分子中氢原子数与酸的元数不一定相等,如 H3PO2 (次磷酸,结构式
向氨水中加入少量浓 溶液, − 浓度增大,则 ⋅ 的电离平衡逆向移动,
C错误;向氨水中加入少量 固体,溶液中 + 增大,D错误。
2.[2022江苏无锡期末]一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电
弱电解质电离平衡ppt课件
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
例:250C时,在0.5L0.2mol/L的HA溶液中, 有0.01mol的HA电离成离子。求该温度下HA的 电离常数。
二、电解质的电离方程式书写
强 弱
③多元弱碱分步进行,一步写
等 可 号 逆
多 元 弱 酸 分 步 写
多 元 弱 碱 写 一 步
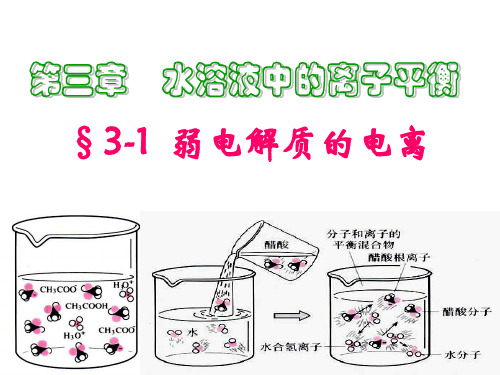
§3-1 弱电解质的电离
(第二课时)
弱电解质的电离
•思考:冰醋酸加水稀释,醋酸在稀释的过程中微粒的变化包含哪些过程?
CH3COOH
离子化 分子化
CH3COO - + H+
醋酸在电离过程中各微粒浓度的变化
c(H+) c(Ac-) c(HAc)
最小 最大
HAc初溶于水 紧接着 最后
最小
不变
不变
不变
1、电离平衡状态建立
讨论完成表格: CH3COOH
CH3COO-- + H+
---) (Ac C C(HAc)
改变条件C 加 通HCl 热
平衡移 动方向
+) (H C
电离常数
正向
逆向 加 NaOH(s) 正向 加NaAc(s) 逆向
加 CH3COOH 正向 加 水 正向
增大 增大 减小
增大 减小 增大 增大 增大 减小
§3-1 弱电解质的电离
回顾
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮 导电 溶液中有自由移动的离子
电离:化合物在溶于水或受热熔化时, 离解成自由移动的离子的过程。
相关知识复习
1.电解质与非电解质
电解质 非电解质 在水溶液中和熔化 状态下不能够导电 的化合物 溶质分子 极性键结合共价化 合物
例:250C时,在0.5L0.2mol/L的HA溶液中, 有0.01mol的HA电离成离子。求该温度下HA的 电离常数。
二、电解质的电离方程式书写
强 弱
③多元弱碱分步进行,一步写
等 可 号 逆
多 元 弱 酸 分 步 写
多 元 弱 碱 写 一 步
§3-1 弱电解质的电离
(第二课时)
弱电解质的电离
•思考:冰醋酸加水稀释,醋酸在稀释的过程中微粒的变化包含哪些过程?
CH3COOH
离子化 分子化
CH3COO - + H+
醋酸在电离过程中各微粒浓度的变化
c(H+) c(Ac-) c(HAc)
最小 最大
HAc初溶于水 紧接着 最后
最小
不变
不变
不变
1、电离平衡状态建立
讨论完成表格: CH3COOH
CH3COO-- + H+
---) (Ac C C(HAc)
改变条件C 加 通HCl 热
平衡移 动方向
+) (H C
电离常数
正向
逆向 加 NaOH(s) 正向 加NaAc(s) 逆向
加 CH3COOH 正向 加 水 正向
增大 增大 减小
增大 减小 增大 增大 增大 减小
§3-1 弱电解质的电离
回顾
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮 导电 溶液中有自由移动的离子
电离:化合物在溶于水或受热熔化时, 离解成自由移动的离子的过程。
相关知识复习
1.电解质与非电解质
电解质 非电解质 在水溶液中和熔化 状态下不能够导电 的化合物 溶质分子 极性键结合共价化 合物
弱电解质的电离平衡ppt课件

合作探究 从微观层面理解强弱电解质的本质区别
一、强电解质和弱电解质
2.强电解质和弱电解质
强酸 H2SO4 HCl HNO3等
电解质 在水溶液中 电离程度
强电解质 强碱 NaOH KOH Ca(OH)2 Ba(OH)2等 (完全电离) 大多数盐 NaCl KNO3 BaSO4 AgCl等
弱酸 CH3COOH H2CO3等
电解质: 酸 碱 盐水
活泼金属氧化物 活泼金属氢化物
非电解质: 非金属氧化物 非金属氢化物 大多数有机物
电解质和非电解质的概念
一、电解质和非电解质
3.写出下列电解质的电离方程式。 NaHSO4(水溶液中) NaHSO4(熔融状态) NaHCO3(水溶液中) NaHCO3(熔融状态)
合作探究 从微观层面理解强弱电解质的本质区别
的量 与过量活泼金属反应产生
H2的量 c(A-)与c(B-)大小 加水稀释相同倍数后酸性
溶液的导电性
相同体积,相同浓度的强 酸HA与弱酸HB cHA(H+) > cHB(H+) HA > HB
HA = HB
HA = HB
c(A-) > c(B-) HA > HB HA > HB
相同体积,相同c(H++)的强 酸HA与弱酸HB c(HA) < c(HB) HA = HB
↓
越热越电离 越稀越电离 同离子效应
注意:平衡移动方向与电离程度、离子浓度大小无必然关系!
精讲点拨 弱电解质的电离平衡
二、弱电解质的电离平衡
2.弱电解质电离平衡的影响因素
(1)内因:弱电解质本身的性质
电离度:表示了弱电解质的电离程度的 相对强弱,弱电解质本身的性质是决定 性因素。
2728学高中化学苏教版选修4专题3第一单元第1课时强弱电解质弱电解质的电离平衡课件34张[可修改版

(3)常见的强电解质和弱电解质(填物质种类) ①强电解质: _强__酸__、 _强__碱__、 _大__多__数__盐___等。 ②弱电解质: _弱__酸__、 _弱__碱__和水。
二、弱电解质的电离平衡
1.电离平衡 在一定温度下,弱电解质分子在溶液中_电__离__成__离__子__的速率和 __离__子__结__合__成__弱__电__解__质__分__子___的速率相等,溶液中各分子和离 子的浓度都不再发生变化,电离过程就达到了平衡状态。
一、强电解质和弱电解质
1.电解质、非电解质 (1)电解质:在__水__溶__液__中__或__熔__融__状__态__下___能导电的化合物。 (2)非电解质:在水__溶__液__中___和__熔__融__状__态__下_都不导电的化合物。
2.强电解质、弱电解质 (1)强电解质:在水溶液中能__完__全__电__离__的电解质。 (2)弱电解质:在水溶液中只能_部__分__电__离___的电解质。
2.弱电解质电离方程式的书写
(1)弱酸、弱碱在_水__溶__液___中电离,在熔融态下__不__电__离__。
(2)弱电解质电离是_可__逆____的,用_______表示。
例如:CH3COOH
_C_H__3_C_O__O__-_+__H__+_,
NH3·H2O
_N__H_+ 4_+__O__H_-__。
解析:选 A。电离出的 HA 的物质的量浓度为
c(HA)=0.10 mol·L-1×1%=1.0×10-3 mol·L-1,
根据:HA
H++A-,则平衡时:
c(H+)=c(A-)=1.0×10-3 mol·L-1,
c(HA)平=0.10 mol·L-1-1.0×10-3 mol·L-1
二、弱电解质的电离平衡
1.电离平衡 在一定温度下,弱电解质分子在溶液中_电__离__成__离__子__的速率和 __离__子__结__合__成__弱__电__解__质__分__子___的速率相等,溶液中各分子和离 子的浓度都不再发生变化,电离过程就达到了平衡状态。
一、强电解质和弱电解质
1.电解质、非电解质 (1)电解质:在__水__溶__液__中__或__熔__融__状__态__下___能导电的化合物。 (2)非电解质:在水__溶__液__中___和__熔__融__状__态__下_都不导电的化合物。
2.强电解质、弱电解质 (1)强电解质:在水溶液中能__完__全__电__离__的电解质。 (2)弱电解质:在水溶液中只能_部__分__电__离___的电解质。
2.弱电解质电离方程式的书写
(1)弱酸、弱碱在_水__溶__液___中电离,在熔融态下__不__电__离__。
(2)弱电解质电离是_可__逆____的,用_______表示。
例如:CH3COOH
_C_H__3_C_O__O__-_+__H__+_,
NH3·H2O
_N__H_+ 4_+__O__H_-__。
解析:选 A。电离出的 HA 的物质的量浓度为
c(HA)=0.10 mol·L-1×1%=1.0×10-3 mol·L-1,
根据:HA
H++A-,则平衡时:
c(H+)=c(A-)=1.0×10-3 mol·L-1,
c(HA)平=0.10 mol·L-1-1.0×10-3 mol·L-1
《弱电解质电离平衡》课件

3 举例
乙酸、甲酸、碳酸等都是弱电解质。
弱电解质电离的平衡
电离平衡常数
描述了弱电解质的电离反应, 是反应物浓度和产物浓度的比 值,通常用Kc表示。
反应式
弱电解质的电离反应式一般为 HA + H2O ⇔ A- + H3O+
影响因素
温度、离子强度、化学品浓度 等都会影响弱电解质电离的平 衡。
离子强度和离子活度
根据平衡常数计算pH值比较麻烦,可以通 过Henderson-Hasselb alch方程直接计算pH 值。
总结
弱电解质电离平衡的重要性
弱电解质电离平衡在生命科学和化学领域非常重要,我们必须加深对其实质的理解。
缓冲作用在生命科学中的应用
缓冲溶液是生命科学研究中不可或缺的重要试剂,被广泛应用于生化、药学、医学等领域。
1
离子活度与离子强度的关系
2
Байду номын сангаас
离子活度是指溶液中反应组分实际浓度
与理论浓度之比,通常用ai表示。离子活
度与离子强度呈指数函数关系。
3
离子强度的定义
离子强度是所有离子的总浓度之和,通 常用I表示。
离子活度的计算方法
离子活度可以由各种离子运动率的反比 例关系计算,运动率低的离子活度高。
pH的概念和计算方法
《弱电解质电离平衡》 PPT课件
本课件介绍弱电解质电离平衡的原理和应用,包括离子强度和离子活度的概 念,pH的计算方法,以及缓冲溶液的作用和制备方法。
什么是弱电解质?
1 定义
弱电解质是指在水溶液中只部分离解的物质,电离度较低。
2 特征
弱电解质的离子度随浓度的变化而变化;化学反应较慢,达到化学平衡需要较长的时间。
3.1.1弱电解质的电离平衡(教学课件)(共28张PPT)—高中化学苏教版(2019)选择性必修一

改变 条件 通HCl气体 加NaOH(s) 加NaAc(s) 加冰醋酸
加Na2CO3
电离平衡 C(H+) 移动方向
逆向 增大
正向 逆向
减小 减小
正向 增大
正向 减小
C(Ac-)
减小 增大 增大 增大 增大
C(HAc)
增大 减小 增大 增大 减小
导电能力
增强 增强 增强 增强 增强
电离程度 (电离度)
谢谢观看
NaHCO3 HCl H2S
非电解质 Cl2 CCl4 Cu
C2H5OH
随堂训练
2.将1 mol冰醋酸加入一定量的蒸馏水中最终得到1 L溶液。下列各项 中,表明已达到电离平衡状态的是( D ) A.CH3COOH的浓度达到1 mol·L-1 B.H+的浓度达到0.5 mol·L-1 C.CH3COOH的浓度、CH3COO-的浓度、H+的浓度均为0.5 mol·L-1 D.CH3COOH分子电离成离子的速率和离子重新结合成CH3COOH分 子的速率相等
CH3COOH
CH3COO-+H+
CH3COO- H3O+
电离
CH3COOH
H2O
结合
电离过程是可逆的,故存在电离平衡。
弱电解质的电离平衡
在一定温度下,当弱电解质在水溶液中的电离达到最大限度时,电离过程并未停止。 此时,弱电解质分子电离成离子的速率与离子结合成弱电解质分子的速率相等,溶液 中弱电解质分子和离子的浓度都不再发生变化,弱电解质的电离达到了电离平衡状态。
弱电解质的电离平衡 【思考】出现轻微碱中毒后,如何缓解中毒症状呢? 分析问题的化学本质
直接吸入大量CO2合理吗? 可用纸袋,罩于鼻、口上再呼吸,增加动脉血CO2浓度
3.1 电离平衡(第1课时 弱电解质的电离平衡)高二化学课件(人教版2019选择性必修1)
)
A.水溶液中NaHSO4的电离:NaHSO4
B.H2CO3的电离:H2CO3
2H+ + CO32-
C.Al(OH)3的碱式电离:Al(OH)3
D.水溶液中NaHSO3的电离:NaHSO
【答案】A
Na+ + H+ + SO42-
Al3++3OH3Na++HSO3-
课堂练习
典例3. 在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH
教学过程
教学过程
1.强、弱电解质的定义、物质类别与比较
定义
强电解质
弱电解质
完全
在水溶液中能_______电离的电解质
部分
在水溶液中只能_______电离的电解质
电离过程
不可逆,无电离平衡
在溶液中的
存在形式
只有离子
物质类别
及示例
①强酸,如HCl、H2SO4
②强碱,如KOH、Ba(OH)2
③大部分盐,如NaCl、BaSO4
教学过程
实
验
视
频
教学过程
【实验现象及结论】
酸
1.0 mol·L-1盐酸
1.0 mol·L-1醋酸
pH
小(pH=1)
________
大(pH≈3)
________
强
________
弱
________
剧烈
反应_______,产生气体
缓慢
反应_______,产生气体
导电能力
与镁
反应
现象
结论
大
盐酸反应快,表明盐酸中 c(H+ )较____,说明盐酸的电离程度
3.1.1 弱电解质的电离平衡 课件 高二上学期化学人教版(2019)选择性必修1
相同点
化合物类型
物质类别
不 溶质微粒
同 点
电离程度
表示方法
实例
电离方程式
【小结】
强电解质
弱电解质
都是电解质,在水溶液中都能电离,与溶解度无关
离子化合物,共价化合物
共价化合物
强酸、强碱、大多数盐
弱酸、弱碱、水
离子
分子(多)、离子
完全电离(不可逆)
部分电离(可逆)
电离方程式用“ = ”
电离方程式用“⇌”
不同温度下0.05 mol/L 醋酸的pH: 温度 20 ℃
pH 3.05
24 ℃ 3.03
CH3COOH
温度升高,pH减小,c(H+)增大
CH3COO- + H+ ΔH >0
(1)电离是一个吸热过程,温度升高, 平衡正向移动,电离程度增大 (2)达到平衡时分子、离子共存
(3)弱电解质的电离都是微弱的过程,一般来说,绝大数以分子 的形式存在。如0.1mol/L的醋酸溶液中,c(H⁺)在0.001mol/L左右
1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速 率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态 ― 电离平衡
逆:弱电解质的电离是可逆过程
等:V电离 = V结合≠0
2.特征
动:动态平衡
定:溶液中各分子、离子的浓度不变 变:条件改变时,电离平衡发生移动
3.弱电解质电离的特点
点拨:对强电解质和弱电解质的正确理解 (1)区分电解质强弱的唯一依据是电解质在水溶液中能否完全电离,即电离 程度。 (2)电解质的强弱与溶液导电性的强弱无必然联系。相同条件下溶液中离 子浓度大的导电能力强,离子电荷越高,导电能力越强。 (3)电解质的强弱与物质的溶解性无必然联系。即使溶解度很小,只要溶于 水的部分完全电离就是强电解质,所以不能根据溶解度大小进行判断。 (4) 强弱电解质与化学键的关系:离子化合物一定是强电解质,共价化合 物不一定(如硫酸是强电解质,醋酸是弱电解质,蔗糖是非电解质)。
《弱电解质电离平衡》课件
《弱电解质电离平衡》ppt课件
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
• 弱电解质电离平衡概述 • 弱电解质的电离过程 • 弱电解质电离平衡的应用 • 弱电解质电离平衡的实验研究 • 弱电解质电离平衡的挑战与展望 • 相关资料与参考文献
01
弱电解质电离平衡概述
定义与特点
定义
弱电解质在水溶液中部分电离, 存在电离平衡。
特点
电离程度较小,离子浓度较低, 但电离平衡常数较大。
03
弱电解质电离平衡的应用
在化学反应中的应用
弱电解质电离平衡在化学反应中起着重要的调控作用,通过改变反应物和产物的浓 度,可以影响化学反应的速率和方向。
在化学反应中,弱电解质电离平衡常用于研究反应机理和反应动力学,帮助人们更 好地理解化学反应的本质和过程。
弱电解质电离平衡还可以用于指导化学反应条件的选择和优化,提高化学反应的效 率和选择性。
在环境保护中的应用
弱电解质电离平衡在环境保护中 也有着广泛的应用,例如水处理 、土壤修复和大气治理等方面。
在水处理中,利用弱电解质电离 平衡可以控制水中的离子浓度和 酸碱度,实现水质的净化和处理
。
在土壤修复中,利用弱电解质电 离平衡可以研究土壤污染物的迁 移转化规律,为土壤污染治理提
供理论依据和技术支持。
弱电解质的电离程度较小,溶液中离子浓度较低 。
影响因素
3
浓度、温度、压力等。
电离平衡的移动
影响因素
浓度、温度、压力、催化剂等。
移动方向
向电离程度增大的方向移动,即向着离子浓度增大的方向移动。
电离过程的速率
影响因素
浓度、温度、压力、催化剂等。
速率变化
随着反应物浓度的增加或温度的升高,电离速率会增大;反之,随着反应物浓度 的减小或温度的降低,电离速率会减小。
(精品)弱电解质的电离平衡ppt课件全面版
弱酸、弱碱、水。 H2CO3、HClO、H2S、HF、CH3COOH NH3·H2O Fe(OH)3等
5
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
6
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征:逆、动、等、定、变。
9
二、电离平衡常数(K)
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
10
3.多元弱酸在水溶液中的电离
30
集腋成裘,聚沙成塔。几秒钟虽然不长, 却能构成永恒长河中的伟大时代。
31
只要我们坚持了,就没有克服不了的困难。或许,为了将来,为了自己的发展,我们会把一件事情想得非常透彻,对自己越来越严,要求越来越高,对任何机会都不曾错过,其 目的也只不过是不让自己随时陷入逆境与失去那种面对困难不曾屈服的精神。但有时,“千里之行,始于足下。”我们更需要用时间持久的用心去做一件事情,让自己其中那小 小的浅浅的进步,来击破打破突破自己那本以为可以高枕无忧十分舒适的区域,强迫逼迫自己一刻不停的马不停蹄的一直向前走,向前看,向前进。所有的未来,都是靠脚步去 丈量。没有走,怎么知道,不可能;没有去努力,又怎么知道不能实现?幸福都是奋斗出来的。那不如,生活中、工作中,就让这“幸福都是奋斗出来的”完完全全彻彻底底的 渗入我们的心灵,着心、心平气和的去体验、去察觉这一种灵魂深处的安详,侧耳聆听这仅属于我们自己生命最原始最动人的节奏。但,这种聆听,它绝不是仅限于、执着于 “我”,而是观察一种生命状态能够扩展和超脱到什么程度,也就是那“幸福都是奋斗出来的”深处又会是如何?生命不止,奋斗不息!又或者,对于很多优秀的人来说,我们 奋斗了一辈子,拼搏了一辈子,也只是人家的起点。可是,这微不足道的进步,对于我们来说,却是幸福的,也是知足的,因为我们清清楚楚的知道自己需要的是什么,隐隐约 约的感觉到自己的人生正把握在自己手中,并且这一切还是通过我们自己勤勤恳恳努力,去积极争取的!“宝剑锋从磨砺出,梅花香自苦寒来。”当我们坦然接受这人生的终局, 或许,这无所皈依的心灵就有了归宿,这生命中觅寻处那真正的幸福、真正的清香也就从此真正的灿烂了我们的人生。一生有多少属于我们的时光?陌上的花,落了又开了,开 了又落了。无数个岁月就这样在悄无声息的时光里静静的流逝。童年的玩伴,曾经的天真,只能在梦里回味,每回梦醒时分,总是多了很多伤感。不知不觉中,走过了青春年少, 走过了人世间风风雨雨。爱过了,恨过了,哭过了,笑过了,才渐渐明白,酸甜苦辣咸才是人生的真味!生老病死是自然规律。所以,面对生活中经历的一切顺境和逆境都学会 了坦然承受,面对突然而至的灾难多了一份从容和冷静。这世上没有什么不能承受的,只要你有足够的坚强!这世上没有什么不能放下的,只要你有足够的胸襟! 一生有多少 属于我们的时光?当你为今天的落日而感伤流泪的时候,你也将错过了明日的旭日东升;当你为过去的遗憾郁郁寡欢,患得患失的时候,你也将忽略了沿途美丽的风景,淡漠了 对未来美好生活的憧憬。没有十全十美的生活,没有一帆风顺的旅途。波平浪静的人生太乏味,抑郁忧伤的人生少欢乐,风雨过后的彩虹最绚丽,历经磨砺的生命才丰盈而深刻。 见过了各样的人生:有的轻浮,有的踏实;有的喧哗,有的落寞;有的激扬,有的低回。肉体凡胎的我们之所以苦恼或喜悦,大都是缘于生活里的际遇沉浮,走不出个人心里的 藩篱。也许我们能挺得过物质生活的匮乏,却不能抵挡住内心的种种纠结。其实幸福和欢乐大多时候是对人对事对生活的一种态度,一花一世界,一树一菩提,就是一粒小小的 沙子,也有自己精彩的乾坤。如果想到我们终有一天会灰飞烟灭,一切象风一样无影亦无踪,还去争个什么?还去抱怨什么?还要烦恼什么?未曾生我谁是我?生我之时我是谁? 长大成人方是我,合眼朦胧又是谁?一生真的没有多少时光,何必要和生活过不去,和自己过不去呢。你在与不在,太阳每天都会照常升起;你愁与不愁,生活都将要继续。时
5
一、弱电解质的电离平衡
电离
CH3COOH 结合 CH3COO- + H+ v
v电离 v结合
v电离= v结合
电离平衡状态
0
t1
t2
t
6
1.定义: 在一定条件(如温度、浓度)下, 当电解质分子电离成离子和离子重新结合成分子的速率相 等时,各种微粒的浓度保持不变,电离过程就达到了平衡 状态——电离平衡。 2.特征:逆、动、等、定、变。
9
二、电离平衡常数(K)
1.表示方法 一元弱酸 HA
[H+][A-] H+ +A-, Ka= [HA]
一元弱碱 MOH 2.注意事项:
[M+][OH-] M++OH-, Kb= [MOH]
(1)只有温度变,才有K变。 (2)意义:K值越大,表示弱电解质电离程度越大。
10
3.多元弱酸在水溶液中的电离
30
集腋成裘,聚沙成塔。几秒钟虽然不长, 却能构成永恒长河中的伟大时代。
31
只要我们坚持了,就没有克服不了的困难。或许,为了将来,为了自己的发展,我们会把一件事情想得非常透彻,对自己越来越严,要求越来越高,对任何机会都不曾错过,其 目的也只不过是不让自己随时陷入逆境与失去那种面对困难不曾屈服的精神。但有时,“千里之行,始于足下。”我们更需要用时间持久的用心去做一件事情,让自己其中那小 小的浅浅的进步,来击破打破突破自己那本以为可以高枕无忧十分舒适的区域,强迫逼迫自己一刻不停的马不停蹄的一直向前走,向前看,向前进。所有的未来,都是靠脚步去 丈量。没有走,怎么知道,不可能;没有去努力,又怎么知道不能实现?幸福都是奋斗出来的。那不如,生活中、工作中,就让这“幸福都是奋斗出来的”完完全全彻彻底底的 渗入我们的心灵,着心、心平气和的去体验、去察觉这一种灵魂深处的安详,侧耳聆听这仅属于我们自己生命最原始最动人的节奏。但,这种聆听,它绝不是仅限于、执着于 “我”,而是观察一种生命状态能够扩展和超脱到什么程度,也就是那“幸福都是奋斗出来的”深处又会是如何?生命不止,奋斗不息!又或者,对于很多优秀的人来说,我们 奋斗了一辈子,拼搏了一辈子,也只是人家的起点。可是,这微不足道的进步,对于我们来说,却是幸福的,也是知足的,因为我们清清楚楚的知道自己需要的是什么,隐隐约 约的感觉到自己的人生正把握在自己手中,并且这一切还是通过我们自己勤勤恳恳努力,去积极争取的!“宝剑锋从磨砺出,梅花香自苦寒来。”当我们坦然接受这人生的终局, 或许,这无所皈依的心灵就有了归宿,这生命中觅寻处那真正的幸福、真正的清香也就从此真正的灿烂了我们的人生。一生有多少属于我们的时光?陌上的花,落了又开了,开 了又落了。无数个岁月就这样在悄无声息的时光里静静的流逝。童年的玩伴,曾经的天真,只能在梦里回味,每回梦醒时分,总是多了很多伤感。不知不觉中,走过了青春年少, 走过了人世间风风雨雨。爱过了,恨过了,哭过了,笑过了,才渐渐明白,酸甜苦辣咸才是人生的真味!生老病死是自然规律。所以,面对生活中经历的一切顺境和逆境都学会 了坦然承受,面对突然而至的灾难多了一份从容和冷静。这世上没有什么不能承受的,只要你有足够的坚强!这世上没有什么不能放下的,只要你有足够的胸襟! 一生有多少 属于我们的时光?当你为今天的落日而感伤流泪的时候,你也将错过了明日的旭日东升;当你为过去的遗憾郁郁寡欢,患得患失的时候,你也将忽略了沿途美丽的风景,淡漠了 对未来美好生活的憧憬。没有十全十美的生活,没有一帆风顺的旅途。波平浪静的人生太乏味,抑郁忧伤的人生少欢乐,风雨过后的彩虹最绚丽,历经磨砺的生命才丰盈而深刻。 见过了各样的人生:有的轻浮,有的踏实;有的喧哗,有的落寞;有的激扬,有的低回。肉体凡胎的我们之所以苦恼或喜悦,大都是缘于生活里的际遇沉浮,走不出个人心里的 藩篱。也许我们能挺得过物质生活的匮乏,却不能抵挡住内心的种种纠结。其实幸福和欢乐大多时候是对人对事对生活的一种态度,一花一世界,一树一菩提,就是一粒小小的 沙子,也有自己精彩的乾坤。如果想到我们终有一天会灰飞烟灭,一切象风一样无影亦无踪,还去争个什么?还去抱怨什么?还要烦恼什么?未曾生我谁是我?生我之时我是谁? 长大成人方是我,合眼朦胧又是谁?一生真的没有多少时光,何必要和生活过不去,和自己过不去呢。你在与不在,太阳每天都会照常升起;你愁与不愁,生活都将要继续。时
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.1 mol/L
HCl(aq) 与镁反应的速率 快 溶液的pH约为 c (H+) mol/L
【附:pH与c (H+) 的关系表】
pH 1 2 3 4
0.1 mol/L
CH3COOH
慢
5
c (H+) mol/L
0.1
Hale Waihona Puke 0.010.001
10-4
10-5
我们的结论是: ____________________________。
根据你的经验,你认为相同浓度的氢 氧化钠溶液与氨水的电离程度有无差异? 请提出你的假设并设计实验加以验证, 完成表 3-2。 实验假设
实验方案
实验现象 结论
下列物质中 ① NaCl ③ NH3· H2O
② NaOH
⑥Cu ⑨ H2O
④ CH3COOH ⑤ BaSO4 ⑦ 稀硫酸 ⑧ 酒精
哪些是强电解质,那些是弱电解质?
大约相同、去氧化膜的镁条;分别同时滴加
2 mL 0.1 mol/L 的盐酸、
0.1 mol/L 的醋酸溶液于试管中;比较反
应速率快慢。 2:取两片干燥的pH试纸放在表面皿中,分 别用洁净、干燥的玻棒蘸取0.1 mol/L 盐
酸和 0.1 mol/L 醋酸溶液点在pH 试纸上
,立即与标准比色卡对照,记录 pH。 温馨提示:试剂瓶中镁条已经除去氧化膜; 玻棒用洗净,并用棉花擦干。
右图,请分析曲线变化的原因。 用等浓度稀醋酸滴定 0.1mol·L-1 氨水溶液,电导率的变化如右图, 请分析曲线变化的原因。
课堂小结
弱电解质的电离特征是什么? 弱电解质溶液中存在哪些微粒?强电解质呢?
弱电解质溶液稀释时,其导电能力变化
与强电解质溶液比较有什么不同?
酸的电离
H3O+水合氢离子,一般简
人体血液的pH要控制在7.35~7.45之间,呈现弱 碱性,当 pH 小于 7.35 时会引起酸中毒,而当大于
7.45 时 会引 起 碱 中 毒 。 因 血 液 中 存 在 如 下 平 衡 :
H2O + CO2 H2CO3 H
+ +HCO3 ;健康人的
血液的pH能够保持在一定范围为变化,医学上称之 为血液酸碱平衡。 (1)我们在输液时会稀释血液,为什么不会使血液 碱性减弱, 引起酸中毒呢? 。 (2)胃液的主要成分是强酸,饭后大量饮水会引起
强电解质: ① ② ⑤ 弱电解质: ③ ④ ⑨
⑩NH3
概念辨析
强电解质溶液的导电能力一定强? CaCO3、 BaSO4是难溶物,其水溶液几 乎不导电,
为什么却属于强电解质? 强弱电解质的区分依据不是看该物质溶解
度的大小,也不是看其水溶液导电能力的强弱 ,而是看溶于水的部分是否完全电离。
第一单元
弱电解质的电离平衡
强电解质和弱电解质
活动与探究
1
根据你的经验,你认为 醋酸 和 盐酸 的
电离程度 有无差异?结合 酸的通性 ,请
你设计实验验证你的猜想?请写出实验 方案并与同学交流? 温馨提示: 电解质溶液的导电能力与溶液中 离子浓度成正比
学生 实验
1:用镊子往小试管中各放入一小段表面积
强电解质
电离程度 电离方程式
弱电
水溶液中主要微粒
活动与探究
2
0.1 mol/L溶液
溶液稀释 相同的倍数
盐酸电导率 醋酸电导率
温馨提示:电解质的稀溶液加水稀释时, 电解质电离生成的离子浓度会因溶液体积
变大而相应减小;而溶液导电能力与离子
学以致用
用等浓度稀硫酸滴定 0.1mol·L-1
氢氧化钡溶液,电导率的变化如
