人体生物等效性试验中生物样本分析技术的评价
仿制药一致性评价生物等效性试验技术审评要点

仿制药一致性评价生物等效性试验技术审评要点仿制药一致性评价是指通过对比原研药和仿制药之间的生物等效性数据,评价仿制药是否具备与原研药相似的药代动力学和药效学特性,进而确定其是否可以替代原研药进行临床应用。
生物等效性试验技术审评是评价仿制药一致性评价的关键环节,下面将详细介绍生物等效性试验技术审评的要点。
一、试验设计:1.试验组织架构:评价机构应具备完备的检测设备和专业的研究人员,确保试验的可靠性和准确性。
2.试验设计:采用随机化、双盲、交叉设计,以最小化个体差异的影响,确保药物之间的比较有效。
二、选择受试者:1.受试者的选择要符合药物适应症,并且在健康状况良好的人群中进行。
2.受试者应具备药物代谢和排泄功能正常的特点,以保证试验结果的可靠性。
三、样本大小和统计分析:1.样本数量的确定需要根据统计学原理,以达到试验结果的有效性和可靠性。
2.统计分析应采用合适的方法,如t检验、方差分析等,以确保结果的准确性和可信度。
四、试验指标:1. 药物代谢动力学指标:包括药物的Cmax、AUC、t1/2等参数,用来评估药物在体内的代谢和排泄情况。
2.药效学指标:常见的指标包括药物的主要活性成分的血浓度、药物的疗效、不良反应等。
五、试验步骤与方法:1.药物给药方案:根据药物的给药途径和剂量,确定合适的给药方案,以确保药物在体内的稳态水平。
2.试验操作步骤:严格按照试验方案进行试验操作,确保试验过程的一致性和可重复性。
3.试验数据的采集和分析:准确地采集试验数据,并进行合理的统计和分析,以得出准确的结论。
六、不确定性和风险评估:1.对于不确定性的讨论需建立在充分的科学基础之上,通过合适的统计方法进行分析和评估。
2.需要对试验过程中出现的潜在风险进行评估,确保试验结果的准确性和可信度。
综上所述,生物等效性试验技术审评要点包括试验设计、受试者选择、样本大小和统计分析、试验指标、试验步骤与方法、以及不确定性和风险评估等方面。
生物等效性试验实施中的注意事项

生物等效性试验生物等效性定义如下:在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。
以药动学参数为终点评价指标的生物等效性研究通常采用Cmax 和AUC进行评价。
生物等效的接受标准:一般情况下,Cmax和AUC 几何均值比值的90%置信区间数值应落在80.00%-125.00%范围内,对于窄治疗窗药物,应根据药物的特性适当缩小90%置信区间范围。
一个完整的生物等效性研究包括研究设计、生物样本分析、统计分析、结果评价四个方面内容。
生物等效性研究方法按照研究方法评价效力,其优先顺序为药代动力学研究、药效动力学研究、临床研究(以临床疗效为终点)和体外研究。
研究设计1、两制剂、单次给药、交叉试验设计;2、两制剂、单次给药、平行试验设计:适用于半衰期较长的药物;3、重复试验设计:适用于部分高变异药物(个体内变异≥30%)。
受试者选择1、年龄在18周岁或以上,同一批受试者年龄相差不宜超过10岁;2、如果研究药物拟用于两种性别的人群,一般情况下,研究入选的受试者应有适当的性别比例;3、为避免其他药物干扰,试验前两周内及试验期间禁服任何其他药物,试验期间禁烟、酒及含咖啡因的饮料;4、如果研究药物主要拟用于老年人群,应尽可能多地入选60岁以上的受试者;5、当入选健康受试者参与试验可能面临安全性方面的风险时,则建议入选试验药物拟适用的患者人群,并且在试验期间应保证患者病情稳定。
参比制剂的选择:1、尽可能选择原研产品;2、国际公认的同种药品,指在欧盟、美国上市并获得参比制剂地位。
给药方案:1、推荐采用单次给药药代动力学研究方法评价生物等效性;2、若出于安全性考虑,需入选正在进行药物治疗,且治疗不可间断的患者时,可选择多次给药;3、给药剂量一般应与临床单次用药剂量一致,不得超过临床推荐的单次最大剂量或已经证明的安全剂量。
食物影响1、通常需进行空腹和餐后生物等效性研究;2、如果参比制剂说明书中明确说明该药物仅可空腹服用(饭前1小时或饭后2小时服用)时,则可不进行餐后生物等效性研究;3、仅能与食物同服的口服常释制剂,除了空腹服用可能有严重安全性方面风险的情况外,均建议进行空腹和餐后两种条件下的生物等效性研究;4、如有资料充分说明空腹服药可能有严重安全性风险,则仅需进行餐后生物等效性研究;5、对于口服调释制剂,建议进行空腹和餐后生物等效性研究。
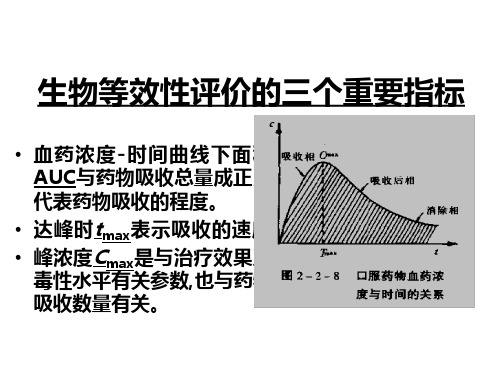
生物等效性评价的三个重要指标.
方差分析
• 方差分析是检验差异的传统方法,也是其它 方法的基础。
• 方差分析的统计假设是: • 样品的随机化; • 方差齐性; • 统计模型的可加性; • 残差的独立性和正态性。
V (ka k)
kV
缓控释制剂的剂量设计
当控释制剂以零级速率释放药物时,控释制剂的维持剂量Xm等
于释放速率
k
0 r
与维持时间T的乘积,而释放速率
k
0 r
应与体内药物消除量相等,即:
X m kr0.T
kr0 kXb
如临床治疗希望该药物达到的稳态血药浓度为 Css
则
X0
CssV F
k
0 r
Cmax的90%可信限在70%~143%范围。 tmax用非参数检验, 无差异性为生物等效。
第三节 缓释与控释制剂的药物动力学
一、缓释与控释制剂的药物动力学设计 二、缓释与控释制剂的生物利用度与生物等效性研究 三、缓释与控释制剂的质量评价
缓释与控释制剂的定义
缓释制剂:系指在规定释放介质中,按要求缓慢地非恒速
释放药物,其与相应的普通制剂比较,给药频率比普通制剂减 少一半或给药频率比普通制剂有所减少,且能显著增加患者顺 应性的制剂。
控释制剂:系指在规定释放介质中,按要求缓慢地恒速或
接近恒速释放药物,且与相应的普通制剂比较,给药频率比普 通制剂减少一半或给药频率比普通制剂有所减少,血药浓度比 缓释制剂更加平稳,且能显著增加患者顺应性的制剂。
生物等效性评价中方差分析的基础
生物等效性评价的试验方法

FDA推荐的生物等效性试验方法包括体内和体外的 方法。按方法的优先考虑程度从高到低排列如下:
(1)(iHale Waihona Puke 药代动力学法:测量生物样本(如全血,血
浆,血清,或其他生物样本) 中药物的活性成份,或
其代谢产物的浓度与时间的关系;(ii)体外法:此种 方法具有已确立好的体内外相关关系,可用于预测人体 生物利用度的相关数据. (2)人体体内法:测量尿样样本中药物的活性成份,或 其代谢产物的浓度与时间的关系;
(3)药效法:测量药物的活性成份,或其代谢产
物的即时药效与时间的关系。
(4)临床试验法:通过设计良好的临床比较试验,
以综合的疗效终点指标来确立生物等效性。
(5)体外方法(通常为体外溶出度测定法):能 够确保体内生物利用度; (6)FDA认可的任何其它用于测量生物利用度和 生物等效性的方法。
生物等效性试验中样本保存及前处理应注意的几个问题

生物等效性试验的样本来源多为血样或尿样,所含的药物浓度较低,内源性干扰成分多,目标药物多与蛋白结合或呈缀合状态,在整个试验过程中,样本测定周期长,测试工作量大,因此其分析方法学的要求与一般的药物分析方法相比具有其自身的特点,我们在建立方法学时,应注重以下几个方面:一、样品采集后的的处理和贮存鉴于生物样本的特点,为了避免样品中被测药物发生分解或产生其他化学变化,取样后最好立即进行分析测定,但实际工作中几乎无法做到,常需将收集到的样品冷藏、冰冻,临用前再融化并放至室温后使用。
在样本冷冻贮藏前,需及时进行处理。
血浆和血清都需要在采血后及时分离(24小时内),若不及时分离,血凝后再冰冻保存,则因冰冻时引起细胞溶解,阻碍血浆或血清的分出,同时因溶血而影响药物浓度变化。
尿液主要是水、尿素及盐类,是很好的细菌生长液,因此应在取样后立即测定。
不能立即测定时,应于4℃冷藏,如在室温保存,则应在采样后的尿液中加入少量防腐剂甲苯(1%)或氯仿(饱和)。
生物样品中的一些不稳定的药物(如普鲁卡因、丙酸、红霉素、阿糖胞苷),易受血浆酯酶水解的影响,当采好样品之后应立即加入酯酶抑制剂氟化钠、三氯醋酸等,防制药物分解。
易氧化的药物(如儿茶酚类、阿扑吗啡等)一般直接在-15℃仅能保存4周;若样品中加入维生素C或其他抗氧剂,则可稳定10周。
生物样品在采样、贮存与分析过程中都应注意可能造成样品的损失或污染,以免将污染物作为药物新的代谢物。
二、生物样本贮存期间的稳定性考察由于生物等效性试验样本从采样到检测的周期通常需要几周至几个月,在其贮存期间目标药物的稳定性需经考察验证。
含药样本稳定性是指样品中的药物从采样至测定时性质和含量的稳定程度,它是贮存条件、药物的化学性质、空白生物样品和容器系统的函数,在特定的容器和生物样品中待测物的稳定性不能外推至其他系统。
生物样本稳定性的评价应考察:1、短期室温稳定性:要求高、低浓度样本在4~24 h内稳定。
人体生物等效性试验数统分析方法介绍与应用

1502021年11月下 第22期 总第370期学术研究China Science & Technology Overview0.引言数统分析是一项药物临床试验过程中非常重要的一个环节,真实、可靠、可溯源的数据是药物最后获批上市的关键。
试验过程中产生的数据必须是真实的、可靠的,从而才能从根本中解决现在临床数据库中的问题。
如今,各国家的卫健委及研究人员对药物质的安全性及有用性的认识不断提高。
世界卫生组织、欧盟、日本、美国及我国都相继颁出有关临床试验数据管理与统计分析的指导原则,对药品试验数统分析也做出了明确的规定。
美国制定出关于临床研究实验中采用网络行业指导规范,另外,美国为规范电子化数据过程制定了临床医学试验数据的规章制度。
我国正在实施的药品临床试验管理的法律法规及其他各类药物临床试验的指导原则,尤其临床试验过程中的数据管理进行了详尽的描述。
本文将详细介绍几种不同的数统分析方法及应用,针对临床研究中如何进行设计、实施、分析和评价提供参考,以保证药物临床试验的科学、真实和规范。
1.常见的数统分析方法适当的临床试验数据管理与统计分析是确保招募到的受试者利益得到保障、提高临床试验质量的前提。
以下为人体生物等效性试验中常用的数统分析方法,本文将从原理出发,对其进行详细的介绍。
1.1描述统计方法描述性统计为通过制作表格、图形以及使用总结性的说明来描述数据的离散和集中趋势、峰度、偏度。
其中缺失值填充常用的方法有:均值法、剔除法、决策树法、比率回归法;正态性检验常用的方法有:非参数检验的K-量检验、P-P 图、Q-Q 图、W 检验等。
临床试验中通常使用的描述统计方法有:平均值、标准差、离散值、中位数、最小值和最大值以及正常值范围等。
1.2推断统计方法统计推断学是现代统计方法学中的最基础的方法,在统计研究中得到了广泛的使用,能研究根据样本量的数据去推断整体的数量值,对研究总体的数量特征做出一个统计的说明。
药物制剂人体生物利用度和生物等效性

药物制剂人体生物利用度和生物等效性试验指导原则人体生物利用度(bioavailability)是反映制剂中主药吸收进入人体体循环的相对量和速度的药代动力学参数。
生物等效性(bioequivalancy)指一种药物的不同制剂,在相同实验条件下以相同剂量用于人体,其吸收程度和速度无显著性差异。
两者概念不尽相同,但试验方法基本一致。
药物制剂人体生物利用度和生物等效性试验属临床试验范畴,故须具备我国药品临床试验管理规范要求的各项必要条件,并按规范要求进行试验。
一、生物样品分析方法的建立和验证应根据所试药物的理化特性建立生物样品的分析方法。
所建方法须经过充分验证,证明符合如下基本要求,方可用于正式试验。
(一)特异性须证明所测定物质是受试药品的原形药物或特定活性代谢物。
生物样品所含内源性物质或代谢物不得干扰对样品所测物质的分析。
根据药物结构特性,首选色谱法,如HPLC、GC、GC-MS或LC-MS等方法,并确定保证分析方法特异性的最佳条件。
色谱法应提供空白生物样品、标准品、空白生物样品加入标准品及用药后生物样品的色谱图,以反映分析方法的特异性。
(二)标准曲线与线性范围所测定物质的浓度与响应的相关性,用回归分析方法(如用加权最小二乘法)所得的回归方程来评价。
标准曲线高低浓度范围为线性范围,在线性范围内浓度测定结果应可达到试验要求的精密度和准确度。
必须用至少5个浓度建立标准曲线,应使用与待测样品相同生物介质,线性范围要能覆盖全部待测浓度,不得用线性范围外推的方法求算未知样品的浓度。
标准曲线不包括零点。
(三)精密度与准确度要求选择三个浓度的质控样品同时进行方法的精密度和准确度考察,低浓度选择在最低量限(LOQ)附近,高浓度在标准曲线的上限附近,中间选一个浓度,每一浓度至少测定5个样品。
精密度用质控样品的日内和日间相对标准差(RSD)表示,一般RSD应小于15%在LOQ附近RSD应小于20%。
准确度是指用特定方法测得的生物样品浓度与真实浓度的接近程度,可用相对回收率表示,一般应85%~115%范围内,在LOQ附近应在80%~120%范围内。
生物等效性实验生物样品处理注意事项严)

生物等效性实验生物样品处理注意事项一、样品采集后的的处理和贮存鉴于生物样本的特点,为了避免样品中被测药物发生分解或产生其他化学变化,取样后最好立即进行分析测定,但实际工作中几乎无法做到,常需将收集到的样品冷藏、冰冻,临用前再融化并放至室温后使用。
在样本冷冻贮藏前,需及时进行处理。
1.1血液样本处理注意事项1.1.1. 在肌肉注射或静脉输含有葡萄糖或电解质(含钾、钠、氯离子)的液体时,建议3小时以后采集静脉血样本进行这些项目的检验,以防止上述检验项目因输液引起的假性升高。
1.1.2保定非麻醉状态的动物时应尽量避免用力挤压动物头颈和胸腹,以免引起血液淤滞,局部组织缺氧,造成血液某些成分的改变,特别是测定乳酸,血液含氧量等指标时。
1.1.3血液中红细胞内外成分有很大差异,溶血可造成红细胞内的物质向细胞外转移,如K+、Mg2+和某些酶类(LD、AST、ALT、ACP);另外,溶血还可干扰某些化学项目(TBil、DBil、TC等)的测定,严重影响结果的准确性,血样本应防止溶血。
引起溶血的原因有:注射器采血时抽吸力太大;血液与抗凝剂比例失调;混匀样本时过度振荡;注射器或采血容器带水或容器污染;全血放置时间长或突然受冷或受热;注射器中的血沫注入采血容器;真空采血时如未采满至相应刻度,残存负压造成红细胞破裂;不拔针头直接注入采血容器;样本离心时离心力过大等。
为避免溶血,取血时应注意:①、抽拉注射器时应尽量避免注射器内产生大量真空;②、添加抗凝剂后的容器在除必要干燥流程后应及时密封;③、混匀样本时避免用力过度,切勿产生泡沫;④、避免重复使用注射器、针头、采血管、毛细玻璃管等一次性用品,手术刀片和剪刀等器材取材时尽量洗去残留血液;⑤、采血时的室温应控制在22℃至25℃,采取的血液容器在需要放入冰盒时,切勿紧贴冰袋,冰水;⑥、当注射器内因吸入空气产生血沫时,注意弃掉血沫,在将血液注入采血容器时勿将血沫一并注入;⑦、使用真空采血管需抽取负压时切勿过量;⑧、将血液注入采血容器时要除去针头,轻柔推入;⑨、离心带有血细胞的血样时,按照规格设定离心参数;1.1.4. 正确选择采集管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人体生物等效性试验中生物样本分析技术的评价
CDE审评五部吴丽花杨焕
摘要: 笔者通过仔细分析和梳理在人体生物等效性试验审评中发现的生物样本分析方面的问题,对《化学制剂人体生物利用度和生物等效性研究技术指导原则》进行再次解读,期望对进一步提高人体生物等效性试验水平有所帮助。
一个完整的生物等效性研究包括试验设计、生物样本分析、统计分析和结果评价四方面的内容。
建立可靠的和可重现的定量分析方法是进行生物等效性试验的关键和基础。
2005年SFDA发布的《化学制剂人体生物利用度和生物等效性研究技术指导原则》中明确地描述了测定方法建立和确证、质量控制的基本要求,此类试验一般都应按照该指导原则来进行。
然而,在审评过程中发现部分申请人提供的生物样本分析资料简单且粗糙,严重影响了对生物等效性试验结果的整体正确评价。
本文仅就生物样本分析技术评价中的常见问题逐一梳理,以供交流。
1.特异性:须提供色谱条件、质谱条件、质谱扫描图。
应该完整提供:(1)空白生物样品色谱图:至少要考察6个不同个体,空白生物样品中干扰物质的响应不超过待测物定量下限时响应的20%(S/N=5);(2)对照物质色谱图(注明浓度):受试药品的原形药物或特定活性代谢物、内标;(3)空白生物样品外加对照物质色谱图(注明浓度);(4)用药后的生物样品色谱图;(5)对于质谱分析,应注意考察分析过程中的基质效应(ME,将另文详述)。
2.标准曲线和定量范围:反映浓度与仪器响应值(峰高、峰面积)之间的关系,应提供线性方程和相关系数。
需注意:(1)采用与分析样本相同的生物介质(血清、血浆、全血、尿等);(2)必须至少用6个浓度点;(3)随行空白生物样品(计算时不包括该点,仅用于评价干扰);(4)定量范围要能覆盖全部待测生物样品浓度,不得外推。
有文献资料认为上限可为最高浓度的115%,下限可为最低浓度的80%。
多数申请人在项目上基本都能提供上述资料,但审评也发现,尽管试验报告均提供了线性方程和相关系数,大多数也提供了相应浓度的响应值,但是往往都忽视了对合格标准曲线的判定。
事实上,指导原则中清楚地阐述只有合格的标准曲线才能对临床待测样品进行定量计算。
合格标准曲线的判定标准应包括:(1)相关系数r > 0.99;(2)实测值与标示值的偏差(相对标准差,RSD,精密度)最低浓度点小于20%,其他小于15%。
需要指出的是,仅相关系数r > 0.99并不能保证实测值与标示值的偏差在可接受的范围之内。
3.定量下限(LLOQ):LLOQ是标准曲线上的最低浓度点,需符合下列要求:(1)应能满足测定3~5个消除半衰期时样品中的药物浓度或能检测出Cmax的1/10~1/20的药物浓度;(2)其响应值应为空白生物基质干扰物响应值的5倍以上(S/N≥5);(3)准确度应在真实浓度的80%~120%范围内;精密度为RSD小于20%;(4)至少应有5个标准样品测试结果证明。
审评发现,多数试验报告对LLOQ的描述是一笔带过,未对其准确度和精密度等指标进行判定,有时把LLOQ和最低检测限混淆。
提醒注意的是,由于定量的需要,LLOQ的响应值测定时至少要保证S/N在5,而最低检测限(灵敏度,S/N=3)只需能检到该物质即可,但不能保证定量的准确性。
尽管在后续的精密度和准确度等考察时,低浓度的质控样品通常也会选定在LLOQ,但建议在制作标准曲线时,随行制作5个定量下限样本,从而获得定量下限的准确度和精密度结果。
4. 精密度和准确度:用低、中、高3个浓度的质控样品来考察,需关注:(1)低浓度的选择应在定量下限3倍以内(大多会选定LLOQ),高浓度应接近标准曲线的上限;(2)准确度:实测
浓度与真实浓度(标示值)的接近程度,用相对回收率来表示,一般中、高浓度应在85%~115%范围内,在LLOQ附近(低浓度)应在80%~120%范围内;(3)精密度:相同浓度样品测量值的分散程度(偏差),用批内和批间相对标准差(RSD)来考察,一般(中、高浓度)RSD应小于15%,在LLOQ附近(低浓度)RSD应小于20%;(4)测定批内精密度,每一浓度至少制备并测定5个样品;测定批间精密度,应在不同天连续制备并测定,至少有连续3个分析批(不少于45个样品)。
质控样品的低浓度选择LLOQ未尝不可,倘若对于LLOQ已经进行了考察,则最好选择其它浓度,但注意应在LLOQ 的3倍以内。
对于高浓度质控样品,可选择上限值或上限值的75~90%,推荐选择接近Cmax的浓度(参照文献报道或预试验的Cmax值)。
在绝大多数提供的注册资料中,质控样品浓度的选择通常是符合要求的,但往往没有充分理解批间精密度的具体要求,或同批内精密度一样提供每一浓度的5个数据,或仅提供每一浓度的3 个数据。
故需注意在测定批间精密度时至少应有连续3个分析批,不少于45个样品的测定值。
还有的资料以待测样品分析时进行方法学质量控制中的批内、批间精密度来代替方法学确证中的批内、批间精密度,这是非常不妥的做法。
应该强调的是,在方法学尚未确证之前是无法进行生物样品的定量分析测定的。
5. 样本稳定性:建议根据具体情况,并参照文献中关于分析物稳定性的报道,在结合各试验环节,考察以下三类样本的稳定性,即(1)含药生物样品处理和储存过程中的稳定性(室温/冷藏/
避光/冰冻/冻融条件下);(2)样品处理后分析物在溶液中(上样液)的稳定性(室温/冷藏);(3)储备液(包括对照品和内标溶液)的稳定性。
审评中发现该部分资料缺项十分常见,尤其是处理后的待测样品(上样液)以及储备液的稳定性试验资料往往缺如。
建议各临床试验研究单位尽可能规范地进行稳定性考察,以保证生物样本分析结果的准确性和重现性。
例如,某药物提供的药动学数据:静脉滴注75mg后Cmax 12.24±2.22 mg/L、AUC 28.98±2.76 mg·h/L,而国外参考文献数据为口服后吸收迅速,生物利用度90~100%,口服75mg后Cmax最高约0.5mg/L,AUC约2.4 mg·h/L,两者进行对比分析,相差甚远,经申报单位深入分析试验过程,发现提供的对照品在运输过程中极不稳定,而在试验中又未进行稳定性考察,在分析方法学确证上存在较大问题,故改进方法重新进行了该品种的药代动力学研究。
6.提取回收率(绝对回收率):指样品提取过程前、后分析物的含量百分比。
需注意(1)扣除基质效应和体积改变;(2)应考察低、中、高3个浓度的提取回收率;(3)其结果应当精密和可重现。
对于提取回收率要求的并不是其绝对值的高低,能达到检测的灵敏度即可,通常在50%以上。
但强调其结果应精密和可重现,这里包含值得商榷的两层意思:(1)低、中、高3个浓度各自的提取回收率的精密度要好,可以认为要求RSD小于15%;(2)低、中、高3个浓度之间的提取回收率也应相差不大,可以认为总体RSD小于15%。
申报资料对于提取回收率方法的描述不尽相同,此方面问题将另文讨论和分析。
7. 测定方法的质量控制:检测生物样本时,应确保(1)每个分析批应随行建立新的标准曲线;(2)每个分析批应随行测定至少各双样本的高、中、低三个浓度的质控样品,并均匀分布在未知样品测试的顺序中;(3)质控样品数应不少于未知样品总数的5%;(4)质控样品测定结果的偏差(RSD)一般在中、高浓度应小于15%,低浓度应小于20%;(5)最多允许1/3 的质控样品结果超限,但不能出现在同一浓度中。
申报资料往往会提到在生物样本测试时遵守随行质量控制的SOP,却没有提供方法学质量控制的具体情况,难以认可生物样本检测数据的准确、可靠和可重现性;有的资料尽管提供了方法学质
量控制的情况,但在描述上过于简单,多以质控样品测定的总体均值和标准差来表示,无法了解每个质控样品结果超限的情况,应建议提供各质控样品的具体测定值和RSD,从而可以判定所采用测定方法的质量控制情况。
还应提醒注意质控样品数应不少于未知样品总数的5%。
此外,不论是生物等效性研究还是人体药代动力学研究,指导原则必须要求申报单位提供20%受试者样品测试(包括随行标准曲线及质控)的色谱图复印件。
仅从单个岗位目前申报的资料分析,至今仍有近一半的资料中(56/118)没有提供色谱图,而有的资料尽管提供了20%受试者样品测试的色谱图,但未提供随行标准曲线及质控的色谱图。
从生物等效性研究的整体评价来看,方法学的确证和质量控制无疑是关键的,而提供的临床试验报告缺条少项,无法保证数据的真实性和可靠性,此时通过所提供的色谱图有助于判断生物样本检测的质量。
为提高对5、6类化药技术审评的质量和效率,提醒注册申请人、临床试验单位规范生物样本分析过程,并提供准确、可靠的数据及相关色谱图资料。
