《硅及其重要化合物转化关系》方程式的书写
高中化学与硅有关的方程式

高中化学与硅有关的方程式篇一:硅和硅的化合物方程式硅和硅的化合物1、硅和氢氧化钠溶液反应的化学方程式:Si + 2NaOH + H2O = Na2SiO3 + 2H2 ↑2、硅和氢氧化钠溶液反应的离子方程式:Si +2OH— + H2O= SiO32—+ 2H2 ↑3、硅和氢氟酸反应的化学方程式:Si + 4HF= SiF4↑ + 2H2↑4、保存氢氧化钠溶液的试剂瓶不用玻璃瓶的原因:SiO2 + 2NaOH = Na2SiO3 + H2O5、用氢氟酸刻蚀玻璃的原理:SiO2 + 4HF= SiF4↑+ 2H2O6、制玻璃的反应原理:SiO2 + Na2CO3 = Na2SiO3 + CO2↑(高温条件自己写) SiO2 +CaCO3 = CaSiO3 + CO2↑(高温条件自己写)7、制粗硅的反应原理:2C + SiO2 = Si + 2 CO↑(高温条件自己写)8、制硅酸的反应方程式:(写三个反应)Na2SiO3 + 2HCl= 2NaCl + H2SiO3(胶体)Na2SiO3 + CO2(少)+H2O = Na2CO3 + H2SiO3(胶体) Na2SiO3 + 2CO2(多)+2H2O = 2NaHCO3 + H2SiO3(胶体)9、二氧化硅和氧化钙反应:SiO2 + CaO = CaSiO3 (高温条件自己写)10、二氧化硅在自然界的存在形态有硅石。
说出二氧化硅的一种用途制光导纤维。
11、陶瓷的原料,制玻璃的原料是制水泥的原料以黏土和石灰石为主要原料,在加入适量的石膏12、说出硅的两点用途:硅酸的主要用途制硅胶干燥剂硅酸钠的主要用途木材防火剂篇二:硅和氯的化学方程式(完整版)非金属及其化合物的方程式集锦一、硅及其化合物的相互转化1、二氧化硅与氢氟酸反应:SiO2+ 4HF =SiF4 ↑+2 H2O二氧化硅与氢氧化钠溶液反应:SiO2+ 2NaOH =Na2SiO3+ H2O离子方程式:SiO2+2 OH- =SiO2-3+H2O二氧化硅与氧化钙高温反应:SiO2+ CaO高温CaSiO3工业制玻璃原理:SiO2 + Na2CO3 2SiO3+ CO2↑SiO2 + CaCO33+ CO2↑ 2、硅酸钠溶液中通入二氧化碳:Na2SiO3+H2O+CO2= Na2CO3+ H2SiO3↓离子方程式:SiO2-2-3 +H2O+CO2= CO3+ H2SiO3 ↓硅酸钠与盐酸反应:Na2SiO3 +2HCl = 2NaCl + H2SiO3 ↓离子方程式:SiO2-3 +2H+ = H2SiO3 ↓ 硅酸受热分解:H2SiOSiO2+ H2O3、粗硅的制取:SiO2 + 2C Si + 2CO↑ 粗硅的提纯:Si+2Cl4SiCl4+2HSi +4HCl4、硅单质与O2 、F2、HF、NaOH溶液:Si + 2F2 = SiF4Si + 4HF = SiF4 + 2H2↑Si + 2NaOH + H2O = Na2SiO3 +2H2↑ Si +O2点燃SiO2二、氯及其化合物的相互转化1、氯气与金属反应:2Na +Cl点燃2点燃2NaCl(黄色火焰,产生白烟)Cu +Cl2(产生棕黄色烟)2Fe +3Cl2点燃CuCl22FeCl3(产生棕黄色烟)2.氯气与非金属单质反应:H2 +Cl2点燃2HCl(安静燃烧,苍白色火焰,瓶口有白雾产生,并且产生有刺激性气味的气体)H2 +Cl2HCl(发生爆炸,瓶口有白雾产生) 3Cl点燃2+2P2PCl3(小液滴)PCl点燃3+Cl2PCl5(固体小颗粒)3.氯气与水反应:Cl2 + H2O = HCl + HClO离子方程式:Cl+-2 + H2O = H+Cl+HClO 4.HClO光照下分解:2HClO2↑ 5.制漂白液(或氯气尾气处理):Cl2 + 2NaOH = NaCl + NaClO + H2O离子方程式:Cl-2 + 2OH- = Cl- + ClO + H2O6. 制漂白粉(或漂粉精):2Cl2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H2O7.漂白粉的使用原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO离子方程式:Ca2++2ClO-+H2O+CO2=CaCO+ 2HClO 漂白粉长期置露在空气中失效:Ca(ClO)2 + CO2 + H2O = CaCO3↓+ 2HClO ,2HClO8.实验室制氯气:4HCl(浓)+MnOMnCl2+Cl2↑+2H2O离子方程式:4H++2Cl-+MnO2+Mn+Cl2↑+2H2O9. 氯气与还原性物质反应a. Cl-2+2NaBr=2NaCl+Br2 离子方程式:Cl2+2Br=2Cl-+Br2b. Cl--2 +2 K I =2 KCl+I2离子方程式:Cl2 +2 I =2 Cl+I2 c. Br--2 +2 K I =2 K Br+I2离子方程式:Br2 +2 I =2Br+I2d. Cl2+H2S =S↓+2HCle. FeCl2+2+Cl2 =2FeCl3 离子方程式:Fe+Cl2 =2Fe3++Cl-f. 2H2O+SO2+Cl2 =2HCl+H2SO4离子方程式:2H+-2-2O+SO2+Cl2 =4H+2Cl+SO4篇三:高一化学方程式——硅4、硅及其化合物的转化关系4 ①Si+O2④△SiO2①②SiO2+2C高温Si+2CO↑(制取粗硅)2 CaSiO 3※③SiO2+4HF = SiF4↑+2H2O(刻蚀玻璃)②④Si+4HF = SiF4↑+2H2↑Na 2SiO3 H2 3 ⑤SiO2+CaOSiO2+2NaOH = Na2SiO3+H2O(SiO2是酸性氧化物)2+CaCO3 SiO2+2OH-= SiO32-+H2O (装NaOH的试剂瓶不可以用玻璃塞)SiO2+Na2CO3高温⑦⑧CaSiO3高温CaSiO3+CO2↑Na2SiO3+CO2↑ (Na2SiO3是粘合剂)※⑦Na2SiO3+2HCl = H2SiO3↓+2NaCl SiO32-+2H+= H2SiO3↓(白色胶状沉淀)(硅胶可以用作干燥剂)※⑦Na2SiO3+H2O+CO2=H2SiO3↓+Na2CO3或Na2SiO3+2H2O+2CO2=H2SiO3↓+2NaHCO3SiO32-+H2O+CO2=H2SiO3↓+CO32-或SiO32-+2H2O+2CO2=H2SiO3↓+2HCO3-(强酸制弱酸,SiO2不能和H2O反应制硅酸)⑧H2SiO3+2NaOH = Na2SiO3+2H2O ⑨H2SiO3△2O+SiO2H2SiO3+2OH-= SiO32-+2H2O ※⑩Si+NaOH +H2O=Na2SiO3+H2↑ 5、氯及其化合物的转化关系①2Fe+3Cl2 2点燃2FeCl3 (棕黄色的烟)②Cu+Cl2 CuCl2 (棕黄色的烟)⑤3+Cu = 2FeCl2+CuCl2③2FeCl+④Cl 2 NaClO 2Fe3+Cu = 2Fe2++点燃④H2+Cl22HCl(苍白色火焰,光照时发生爆炸)或光照CuCl2 ③FeCl3△※⑤MnO2+4HCl(浓) MnCl2+Cl2↑+2H2OMnO2+4H++2Cl-Mn2++Cl2↑+2H2O光照※⑥Cl2+H2O = HCl+HClO(次氯酸是弱酸)※⑦2HCl +O2↑ Cl2+H2O = H++Cl-+HClO 2HClO 光照2H++2Cl-+O2↑※⑧Cl2+2NaOH = NaCl+NaClO+H2O⑨2Cl2+2Ca(OH)2 = CaCl2+Ca(ClO)2+2H2O工业制漂白粉用石灰乳Cl2+2OH-= Cl-+ClO-+H2O※⑩Ca(ClO)2+H2O+CO2 = CaCO3↓+2HClO或Ca(ClO)2+2HCl = CaCl2+2HClOCa2++2ClO-+H2O +CO2= CaCO3↓+2HClO或ClO-+H+= HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO2:Ca(ClO)2+2H2O+2CO2 = Ca(HCO3)2+2HClO ClO-+H2O+CO2 = HCO3-+HClO△点燃相关热词搜索:方程式高中化学高中化学方程式大全有关硅的化学方程式。
硅化学反应方程式

硅化学反应方程式硅化学反应是指涉及硅元素的化学反应过程。
硅是一种非金属元素,化学符号为Si,原子序数为14。
硅在地壳中广泛存在,是地球上第二丰富的元素,仅次于氧气。
硅具有许多重要的化学特性,因此硅化学反应在工业和科学研究中具有广泛的应用。
硅化学反应可以分为两类:硅与非金属元素的反应和硅与金属元素的反应。
一、硅与非金属元素的反应1. 硅与氧气的反应:硅与氧气发生反应生成二氧化硅(化学式为SiO2)。
该反应在自然界中广泛存在,例如,石英和硅砂都是由SiO2组成的。
反应方程式如下:Si + O2 → SiO22. 硅与氮气的反应:硅与氮气反应生成硅氮化物(化学式为Si3N4)。
硅氮化物是一种重要的陶瓷材料,具有良好的耐高温、耐腐蚀性能。
反应方程式如下:3Si + 2N2 → Si3N43. 硅与碳的反应:硅与碳反应生成碳化硅(化学式为SiC)。
碳化硅是一种高硬度、高熔点的陶瓷材料,广泛用于制造耐高温、耐磨损的零部件。
反应方程式如下:Si + C → SiC二、硅与金属元素的反应1. 硅与铝的反应:硅与铝反应生成硅铝化合物(化学式为Al4SiC4)。
硅铝化合物具有良好的导热性和机械性能,广泛用于制造高温结构材料。
反应方程式如下:4Si + Al → Al4SiC42. 硅与铁的反应:硅与铁反应生成硅铁合金(化学式为FeSi)。
硅铁合金是一种重要的铁合金,用于炼钢和合金制备。
反应方程式如下:Si + Fe → FeSi3. 硅与镁的反应:硅与镁反应生成镁硅合金(化学式为Mg2Si)。
镁硅合金具有较高的强度和耐热性,用于制造轻质结构材料。
反应方程式如下:2Si + Mg → Mg2Si总结起来,硅化学反应涉及硅与非金属元素和金属元素的反应。
这些反应产生了一系列具有重要应用价值的化合物,例如二氧化硅、硅氮化物、碳化硅、硅铝化合物、硅铁合金和镁硅合金等。
这些化合物在材料科学、电子工业、冶金工业等领域具有广泛的应用。
碳、硅及其化合物的化学方程式和离子方程式

碳硅及其化合物的化学方程式和离子方程式碳及其化合物的化学方程式和离子方程式一、碳1、碳在少量的氧气中燃烧:2C+O22CO2、碳在足量的氧气中燃烧:C+O2CO23、碳和硫蒸气高温反应:C+2S CS24、碳和氧化铁在高温下反应:2Fe2O3+3C2Fe+3CO2↑5、碳粉与氧化铜共热:2CuO+C2Cu+CO2↑6、碳和水蒸气高温反应:C+H2O CO+H27、碳和二氧化碳在高温下反应:C+CO22CO8、碳与浓硫酸共热:C+2H2SO4CO2↑+2SO2↑+2H2O9、碳与浓硝酸共热:C+4HNO3CO2↑+4NO2↑+2H2O10、碳与稀硝酸共热:3C+4HNO33CO2↑+4NO ↑+2H2O11、工业上制备粗硅:SiO2+2C Si+2CO↑12、工业上制备金刚砂:SiO2+3C SiC+2CO↑13、工业上制备碳化钙:CaO+3C CaC2+CO↑二、一氧化碳1、一氧化碳在氧气中燃烧:2CO+O22CO22、一氧化碳气体和氧化铁在高温下反应:Fe2O3+3CO2Fe+3CO23、一氧化碳通过灼热的氧化铜:CuO+CO Cu+CO24、一氧化碳和水蒸气反应:CO+H2O CO2+H2三、二氧化碳1、镁在二氧化碳中燃烧:2Mg+CO22MgO+C2、碳和二氧化碳在高温下反应:C+CO22CO3、氧化钠与二氧化碳反应:Na2O+CO2Na2CO34、氧化钙与二氧化碳反应:CaO+CO2CaCO35、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑6、二氧化碳和水反应:CO2+H2O H2CO37、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、工业上生产碳铵:NH3+CO2+H2O NH4HCO310、向澄清石灰水中通入二氧化碳:Ca(OH)2+CO2CaCO3↓+H2OCa2++2OH-+CO2CaCO3↓+H2O11、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-12、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓13、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-14、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O Al(OH)3↓+HCO3-15、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓16、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓17、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-18、向苯酚钠溶液中通入二氧化碳气体:C6H5ONa+CO2+H2O C6H5OH+NaHCO3C6H5O-+CO2+H2O C6H5OH+HCO3-19、向次氯酸钠溶液中通入二氧化碳气体:NaClO+CO2+H2O HClO+NaHCO3ClO-+CO2+H2O HClO+HCO3-20、向次氯酸钙溶液中通入二氧化碳:Ca(ClO)2+CO2+H2O CaCO3↓+2HClOCa2++2ClO-+CO2+H2O CaCO3↓+2HClO四、碳酸钙1、碳酸钙溶于稀盐酸:CaCO3+2HCl CaCl2+CO2↑+H2OCaCO3+2H+Ca2++CO2↑+H2O2、碳酸钙溶于醋酸:CaCO3+2CH3COOH(CH3COO)2Ca+CO2↑+2H2OCaCO3+2CH3COOH2CH3COO-+Ca2++CO2↑+H2O3、碳酸钙溶于氯化铁溶液:3CaCO3+2FeCl3+3H2O2Fe(OH)3+3CaCl2+3CO2↑3CaCO3+2Fe3++3H2O2Fe(OH)3+3CO2↑+3Ca2+4、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑5、高温分解碳酸钙:CaCO3CaO+CO2↑6、向碳酸钙的悬浊液通入二氧化碳气体:CaCO3+CO2+H2O Ca(HCO3)2CaCO3+CO2+H2O Ca2++2HCO3-五、碳酸氢钙1、碳酸氢钙与盐酸反应:Ca(HCO3)2+2HCl CaCl2+2CO2↑+2H2OHCO3-+H+CO2↑+H2O2、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O3、向碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O4、向碳酸氢钙溶液中加入石灰水:Ca(HCO3)2+Ca(OH)22CaCO3↓+2H2OCa2++HCO3-CaCO3↓+H2O5、加热碳酸氢钙:Ca(HCO3)2CaCO3↓+CO2↑+H2O6、碳酸氢钙溶液与碳酸钠溶液反应:Ca(HCO3)2+Na2CO3CaCO3↓+2NaHCO3Ca2++CO32-CaCO3↓硅及其化合物的化学方程式和离子方程式一、硅1、硅和氟气反应:Si+2F2SiF42、硅和氯气加热:Si+2Cl2SiCl43、硅与氧气加热:Si+O2SiO24、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑5、硅和氢氟酸反应:Si+4HF SiF4+2H2↑二、二氧化硅1、工业上用二氧化硅制备粗硅:SiO2+2C Si+2CO↑2、工业上二氧化硅制备金刚砂:SiO2+3C SiC+2CO↑3、碳酸钙高温条件下与二氧化硅反应:CaCO3+SiO2CaSiO3+CO2↑4、碳酸钠高温条件下与二氧化硅反应:Na2CO3+SiO2Na2SiO3+CO2↑5、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O6、将二氧化硅溶于氢氟酸:SiO2+4HF SiF4+2H2O7、二氧化硅高温与生石灰反应:CaO+SiO2CaSiO3三、硅酸1、硅酸溶于氢氧化钠溶液:H2SiO3+2NaOH Na2SiO3+2H2OH2SiO3+2OH-SiO32-+2H2O2、加热硅酸:H2SiO3SiO2+H2O四、硅酸钠1、硅酸钠溶液加入氯化钙溶液:Na2SiO3+CaCl2CaSiO3↓+2NaClSiO32-+Ca2+CaSiO3↓2、硅酸钠溶液呈碱性:Na2SiO3+H2O NaHSiO3+NaOHSiO32-+H2O HSiO3-+OH-3、向硅酸钠溶液中加入盐酸:Na2SiO3+2HCl2NaCl+H2SiO3↓SiO32-+2H+H2SiO3↓4、向硅酸钠通入中通入少量的二氧化碳:Na2SiO3+CO2+H2O H2SiO3↓+Na2CO3SiO32-+CO2+H2O CO32-+H2SiO3↓5、向硅酸钠通入中通入过量的二氧化碳:Na2SiO3+2CO2+2H2O H2SiO3↓+2NaHCO3SiO32-+2CO2+2H2O2HCO3-+H2SiO3↓6、硅酸钠溶液与氯化铵溶液混合:Na2SiO3+2NH4Cl2NaCl+H2SiO3↓+2NH3↑SiO32-+2NH4+H2SiO3↓+2NH3↑8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
硅化学方程式

硅及其化合物序反应物及反应条件化学反应方程式离子反应方程式1 硅在氧气中加热Si + O2△ SiO2×2 硅和氟气反应Si + 2F2 = SiF4×3 硅和氢氟酸反应Si + 4HF = SiF4+2H2×4 硅和氢氧化钠溶液反应Si + 2NaOH + H2O = Na2SiO3+2H2↑Si + 2OH-+ H2O = SiO32-+2H2↑5 二氧化硅和氢氧化钠溶液反应SiO2+ 2NaOH = Na2SiO3+ H2O SiO2+ 2OH- = SiO32- + H2O6 二氧化硅和氢氟酸反应SiO2 + 4HF = SiF4↑ + 2H2O SiO2+ 4HF = SiF4↑ + 2H2O7 硅酸钠和稀盐酸反应Na2SiO3+ 2HCl = 2NaCl + H2SiO3↓2H+ + SiO32- =H2SiO3↓8 硅酸钠溶液通入二氧化碳Na2SiO3+ CO2+ H2O = Na2CO3+ H2SiO3↓SiO32- + CO2+ H2O = CO32-+H2SiO3↓9 工业上用二氧化硅制取单质硅SiO2+ 2C 高温电炉Si + 2CO↑×10 碳酸钠和二氧化硅高温下反应SiO2+ Na2CO3高温Na2SiO3+ CO2↑×11 碳酸钙和二氧化硅高温下反应SiO2+ CaCO3高温CaSiO3+ CO2↑×硅酸盐产品生产条件生产设备生产原理化学成分12 水泥高温水泥回转窑3CaO·SiO2、3CaO·Al2O3、2CaO·SiO213 玻璃高温玻璃窑Na2CO3+SiO2=Na2SiO3+CO2↑CaCO3+SiO2=CaSiO3+CO2↑Na2O·CaO·6SiO214 陶瓷高温窑炉氧化硅、氧化铝、、氧化钠、、氧化镁、、氧化钛等15 俗名硅石石英水晶玛瑙刚玉16 主要化学成分SiO2SiO2SiO2SiO2Al2O3合金生铁钢熟铁合金钢青铜黄铜白铜铝合金主要成分Fe、C Fe、C Fe、C Fe、C Cu、Sn Cu、Zn Cu、Ni、Zn Al 合金的特点良好的物理、化学和机械性能;硬度大、熔点低。
硅及其化合物方程式

硅及其化合物方程式硅是一种非金属元素,其化学符号为Si。
硅在自然界中广泛存在,当被氧化时,硅可以形成二氧化硅(SiO2),这是一种非常重要的化合物,用于制造玻璃、水晶、陶瓷等。
硅化合物是指硅与其他元素形成的化合物,其中最常见的包括硅氧烷(SiH4)和硅酸(H4SiO4)。
以下是硅及其化合物的方程式:1.硅的制备方程式:将硅矿石(SiO2)与碳在高温下还原,可以制备出硅。
SiO2(s) + 2C(s) → Si(s) + 2CO(g)2.二氧化硅的制备方程式:二氧化硅是一种广泛应用的化合物,可以通过燃烧或加热硅酸盐制备。
SiO2(s) + 2C(s) → Si(s) + 2CO(g)CaSiO3(s) + 2HCl(aq) → SiO2(s) + CaCl2(aq) +H2O(l)3.硅氧烷的制备方程式:硅氧烷是一种无色、有毒的气体,可以通过硅和氢气的反应制备。
Si(s) + 2H2(g) → SiH4(g)4.硅酸的制备方程式:硅酸是一种无色、无味、易溶于水的化合物,可以通过硅酸盐的水解制备。
Na2SiO3(s) + H2SO4(aq) → H4SiO4(aq) + Na2SO4(aq)5.硅水化物的制备方程式:硅水化物是一种白色粉末,可以通过硅氧烷和水的反应制备。
SiH4(g) + 2H2O(l) → Si(OH)4(s) + 4H2(g)6.硅化氢的制备方程式:硅化氢是一种无色、有毒的气体,可以通过硅和氢气的反应制备。
Si(s) + 4H2(g) → SiH4(g)7.八甲基环四硅氧烷的制备方程式:八甲基环四硅氧烷是一种有机硅化合物,可以通过硅氧烷和甲基氯化物反应制备。
SiH4(g) + 4(CH3)Cl(g) → (CH3)8Si4O4(s) + 4HCl(g)8.硅藻土的制备方程式:硅藻土是一种天然的无机无机材料,可以从淡水或海水中提取。
SiO2 + nH2O → SiO2·nH2O总之,硅及其化合物在生活中起着重要作用,广泛应用于玻璃、水晶、陶瓷、半导体等领域。
硅及其化合物方程式
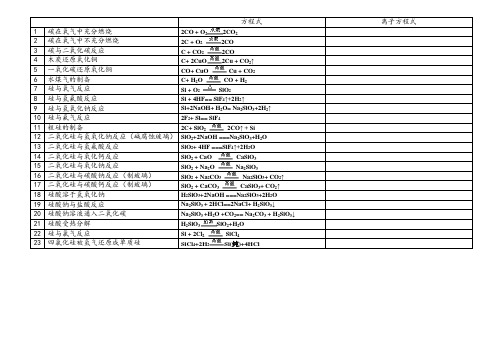
方程式离子方程式1 碳在氧气中充分燃烧2CO + O2CO222 碳在氧气中不充分燃烧2C + O22CO3 碳与二氧化碳反应 C + CO2CO24 木炭还原氧化铜C+ 2CuO2Cu + CO↑25 一氧化碳还原氧化铜CO+ CuO Cu + CO26 水煤气的制备C+ HO CO + H227 硅与氧气反应Si + O2SiO28 硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9 硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10 硅与氟气反应2F2+ Si== SiF411 粗硅的制备2C+ SiO2CO↑ + Si212 二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13 二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14 二氧化硅与氧化钙反应SiO+ CaO CaSiO3215 二氧化硅与氧化钠反应SiO+ Na2O Na2SiO3216 二氧化硅与碳酸钠反应(制玻璃)SiO+ Na2CO3Na2SiO3+ CO2↑217 二氧化硅与碳酸钙反应(制玻璃)SiO+ CaCO3CaSiO3+ CO2↑218 硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19 硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20 硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21 硅酸受热分解H2SiO3SiO2+H2O22 硅与氯气反应Si + 2ClSiCl4223 四氯化硅被氢气还原成单质硅SiCl+2H2Si(纯)+4HCl4。
硅及其化合物方程式

方程式离子方程式1碳在氧气中充分燃烧2CO + O22CO22碳在氧气中不充分燃烧2C + O22CO3碳与二氧化碳反应 C + CO22CO4木炭还原氧化铜C+ 2CuO2Cu + CO2↑5一氧化碳还原氧化铜CO+ CuO Cu + CO26水煤气的制备C+ H2O CO + H27硅与氧气反应Si + O2 SiO28硅与氢氟酸反应Si + 4HF== SiF4↑+2H2↑9硅与氢氧化钠反应Si+2NaOH+ H2O= Na2SiO3+2H2↑10硅与氟气反应2F2+ Si== SiF411粗硅的制备2C+ SiO22CO↑ + Si12二氧化硅与氢氧化钠反应(碱腐蚀玻璃)SiO2+2NaOH ===Na2SiO3+H2O13二氧化硅与氢氟酸反应SiO2+ 4HF ===SiF4↑+2H2O14二氧化硅与氧化钙反应SiO2 + CaO CaSiO315二氧化硅与氧化钠反应SiO2 + Na2O Na2SiO316二氧化硅与碳酸钠反应(制玻璃)SiO2 + Na2CO3 Na2SiO3+ CO2↑17二氧化硅与碳酸钙反应(制玻璃)SiO2 + CaCO3 CaSiO3+ CO2↑18硅酸溶于氢氧化钠H2SiO3+2NaOH ===Na2SiO3+2H2O19硅酸钠与盐酸反应Na2SiO3 + 2HCl==2NaCl+ H2SiO3↓20硅酸钠溶液通入二氧化碳Na2SiO3 +H2O +CO2== Na2CO3 + H2SiO3↓21硅酸受热分解H2SiO3SiO2+H2O22硅与氯气反应Si + 2Cl2 SiCl423四氯化硅被氢气还原成单质硅SiCl4+2H2Si(纯)+4HCl。
物质转化关系图

物质转化关系图1.氯及其化合物2。
硫及其重要化合物3.氮气其重要化合物4.碳及其重要化合物5.硅及其重要化合物6.钠及其化合物7。
镁及其化合物8.铝及其重要化合物9.铁及其重要化合物10.有关O2、H2、H2O、H2O2的转化关系。
11.磷及其重要化合物有关氯元素的转化关系NaClOHClOCl2HClNaClCuCl2FeCl3Ca(ClO)2AgClH2NaOHCuFeAgAgNO3AgNO3AgNO3H20NaOHCa(OH)2HClH2O光照SSO 2Na 2SO 3Na 2SO 4H 2SO 4SO 3H 2SO 3O 2O 2H 20H 20 Cu HClO 3NaOHNaOHNa 2SO 3NH 3 N 2NONO 2HNO 3NH 4HCO 3 NH 3.H 2O4放电O 2H 20H 2O 2Ca(OH)2HCl △H 2O NaOH CuCu O 23.碳及其重要化合物硅及其重要化合物4.钠及其化合物NaNa2O2NaOH Na2CO3NaHCO3NaClNa2OSi SiO2Na2SiO3H2SiO3CaSiO3SiF4CO2CaCO3HFNaOH HClH2SiCl4Cl2镁及其化合物铝及其化合物MgMgCl 2MgOMgCO3Mg(HCO 3)2Mg(OH)2Mg 2N 3Cl 2 HCl CuCl 2 HCl电解熔态O 2 CO 2(点燃)加水水解N 2(点燃)H 2O (反应慢) 加热高温 H 2O+CO 21、 水中煮沸AlAl (OH )3NaAlO 2Al 2O 3AlCl 3O 2△HClNaOHHClNaOHHClNaOH5. 铁及其化合物10。
有关O 2、H 2、H 2O 、H 2O 2的转化关系.11。
磷及其重要化合物HCl HClO 2H 2O FeFe 3O 4FeO Fe 2O 3FeCl 2 FeCl 3 Fe(OH)2Fe(OH)3Cl 2 Fe △HClNaOHH 2O O 2 HCl。
