组蛋白磷酸化涉及的酶
表观遗传:组蛋白甲基化、磷酸化解决方案

表观遗传:组蛋白甲基化、磷酸化解决方案组蛋白修饰(histone modification)是指组蛋白在相关酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化、泛素化、ADP核糖基化等修饰的过程。
今天我们来重点说说组蛋白甲基化、组蛋白磷酸化。
一、组蛋白甲基化组蛋白甲基化是由组蛋白甲基化转移酶(histonemethyl transferase,HMT)完成的。
甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够发生单、双、三甲基化,而精氨酸残基能够单、双甲基化,这些不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性。
甲基化的作用位点在赖氨酸(Lys)、精氨酸(Arg)的侧链N原子上。
组蛋白H3的第4、9、27和36位,H4的第20位Lys,H3的第2、l7、26位及H4的第3位Arg都是甲基化的常见位点。
研究表明·,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关,而H3和H4精氨酸的甲基化丢失与基因沉默相关。
相反,赖氨酸甲基化似乎是基因表达调控中一种较为稳定的标记。
例如,H3第4位的赖氨酸残基甲基化与基因激活相关,而第9位和第27位赖氨酸甲基化与基因沉默相关。
此外,H4—K20的甲基化与基因沉默相关,H3—K36和H3—K79的甲基化与基因激活有关。
但应当注意的是,甲基化个数与基因沉默和激活的程度相关。
【1】组蛋白甲基化定量组蛋白甲基化位点主要发生在H3和H4上面赖氨酸(K)和精氨酸(R)上,且能够发生单、双、三甲基化等。
要按照数学的排列组合,那也是蛮多类型了,举例EpiQuik 组蛋白H3修饰多重检测试剂盒(比色法)(96 次),P-3100-96,EpiQuik组蛋白H3修饰定量试剂盒(比色法)是一组完全的、优化的试剂组合,可以同时定量H3上面21个修饰方式,是一个简单的Elisa检测方法。
【2】组蛋白甲基转移酶(HMTs)分析测定组蛋白甲基化修饰的时候,需要甲基转移酶来进行催化。
景杰生物:磷酸化修饰蛋白质组学

16
磷酸化蛋白质组学分析
降低样品复杂度
规模化分析
特异性富集方法 有效预分级方法 IMAC/MOAC C18/SCX/HILIC
Nat. Protocol, 2013, 8, 461-480.
17
磷酸化蛋白质组学分析策略
常用 定量 方法
绝对定量 MRM
Spectral counts
无标记定量
色谱峰面积
calcium calmodulin kinase IV (CaMKIV)
Annu. Rev. Biochem. 2011, 80:825–858.
钙调蛋白激酶4
12
Cross-talk with Ubiquitination
Mol. Cell, 2007, 28(5), 730-738.
13
Cross-talk with Ubiquitination and Acetylation p53 stabilization
Tauopathy (Tau蛋白病) Alzheimer’s disease
Trends Mol. Med., 2009, 15(3), 112-119.
10
mTOR磷酸化和细胞自噬
mTORC1复合体
Nat. Cell. Biol., 2011, 13(2), 132-141.
11
Cross-talk with O-GlcNAc
20
肝脏组织的磷酸化蛋白质组
J. Proteomics, 2014, 96, 253–262.
21
PTM-Biolabs
谢谢!
18
三、磷酸化蛋白质组学的应用
样品类型
某细胞 某细胞
项目类型
SILAC SILAC
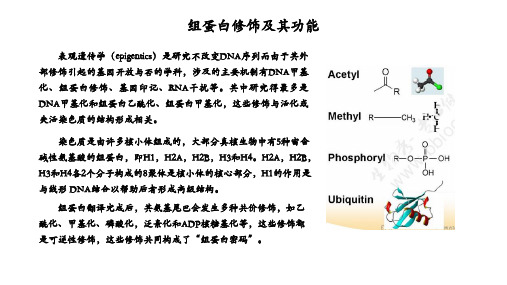
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯讲解学习

表观遗传学(epigentics)是研究不改变DNA序列而由于其外 部修饰引起的基因开放与否的学科,涉及的主要机制有DNA甲基 化、组蛋白修饰、基因印记、RNA干扰等。其中研究得最多是 DNA甲基化和组蛋白乙酰化、组蛋白甲基化,这些修饰与活化或 失活染色质的结构形成相关。
染色质是由许多核小体组成的,大部分真核生物中有5种富含 碱性氨基酸的组蛋白,即H1,H2A,H2B,H3和H4。H2A,H2B, H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是 与线形 DNA结合以帮助后者形成高级结构。
组蛋白翻译完成后,其氨基尾巴会发生多种共价修饰,如乙 酰化、甲基化、磷酸化,泛素化和ADP核糖基化等,这些修饰都 是可逆性修饰,这些修饰共同构成了“组蛋白密码”。
1. 组蛋白乙酰化
核心组蛋白乙酰化反应多发生在核心组蛋白 N端碱性氨基 酸集中区的特定 Lys 残基。组蛋白乙酰化由组蛋白乙酰转移酶 (histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)协调进行。HAT通过将乙酰辅酶 A 的乙酰 基转移到 Lys 的NH+,中和掉一个正电荷。 HDAC使组蛋白去乙 酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因的 转录受到抑制。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色 体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心 组蛋白乙酰化,进而使DNA与组蛋白结合减弱,核小体释放,转录因子和RNA聚合酶可以 与DNA上特异的启动子结合,启动靶基因的转录。
蛋白质磷酸化与非磷酸化

改变靶蛋白质的活性。如:糖原合成酶磷酸化后,停止合成 糖原。
3、DAG与IP3的协调作用 IP3- →细胞质中Ca2 + ↑-→ 糖原合成酶活性↑ 蛋白激酶C- →使IP3 诱导增高糖原磷酸化酶活性的过
程终止。
4、DAG的激活机理 DAG-→ 增加蛋白激酶C对Ca2 + +的亲合性-→ 在Ca2
结构与功能
2个调节亚基(R)+2个催化亚基(C)→PKA全酶复合体 (R2C2)(无cAMP时,无活性)
cAMP与特异R亚基结合→构象变化→成为R亚基二聚体+2个有活 性C亚基,各种哺乳动物细胞可不同水平表达3种C亚基亚型 (CαCβCγ)和4种R亚基亚型(RⅠ α RⅠ β RⅡ α RⅡ β) →结 合成全酶PKA Ⅰ型和 Ⅱ型.
根据是否有调节物来分又可分成两大类: 信使依赖性蛋白质激酶(messenger-dependent protein
kinase),包括胞内第二信使或调节因子依赖性蛋白激酶及激 素(生长因子)依赖性激酶两个亚类;非信使依赖型蛋白激酶。
蛋白激酶的催化作用: 调节酶磷酸化 (1)磷酸化酶激酶P—激活 (2)糖原合成酶P—失活
+生理水平上被活化。蛋白激酶C为 77kd , 催化区抑制调节区, 当DAG结合到蛋白激酶C上,解除酶的调节区的抑制作用,使酶 发挥催化活性。
4)cGMP依赖的蛋白激酶 (cGMP dependent protein kinase,,GPK)
1963年从肾脏首次发现cGMP
5)DNA依赖的蛋白激酶( DNA dependent protein kinase,DNA-PK)
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯
组蛋白密码学说的完善: 1. 更好地开发新药。研究组蛋白密码对药物开发具有战略
意义,多种组蛋白修饰酶已成为相关疾病治疗的靶目标。比如,组蛋白去乙酰酶
(HDACs)抑制剂已应用于临床治疗多种肿瘤; 2. 深入探讨遗传调控和表观遗传调控相互作用的网络与不同生物学表型之间的关系;
3. 在控制真核基因选择性表达的网络体系内进一步深入理解染色质结构、调控序列以
②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核
小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管);
③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表
达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用;
及调控蛋白之间交互作用的内在机制; 4. 建立基因表达的调控网络数据库及其分析系统。总之,随着越来越多组蛋白核心结
构区域和修饰方式的确定,组蛋白密码在基因调控过程中的作用会越来越明确。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色
体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心
组蛋白修饰酶对基因转录的调控_邢欣荣

生理科学进展 2008年第 39 卷第 4期
组蛋白修饰酶对基因转录的调控 *
邢欣荣 刘宇博 程智逵 伍会健 ■
(大连理工大学 环境与生命学院 , 辽宁大连 116024)
摘要 基因在转录过程中 , 需招募多种组蛋白修饰酶来对组蛋白进行化学修饰 , 这些化学修饰包 括 :组蛋白的甲基化 、乙酰化 、磷酸化 、泛素化和 SUMO化等 。 大多数组蛋白修饰酶能与不同的转 录因子形成复合物 , 并引起组蛋白和 DNA之间相互作用的改变 , 从而调控基因的转录 。 本文总结 了各种组蛋白修饰酶复合物的组成 、结构及功能方面的研究进展 。 关键词 组蛋白修饰酶 ;基因转录 ;转录调控 中图分类号 R73
一 、组蛋白乙酰转移酶 、去乙酰化酶对基因转录 的调控
组蛋白是碱性蛋白质 , 通常带正电荷 , 能与带负 电荷的 DNA分子结合 , 从而遮蔽了 DNA分子 , 妨碍 了转录 。近年来 , 发现大量与转录有关的调控因子 能修饰组蛋白 , 其中 p300/CBP、Gcn5、p/CAF、SRC1、TIF2、p/CIP、TAFⅡ 250等都具有组蛋白乙酰转移 酶 (HAT)的活性 [ 1] 。
TAFⅡ 250 是基因转 录过程的 辅激活因 子 , 是 TFⅡ D复合物中最大的构成因子 。 TFⅡ D具有 TATA盒结合蛋白 (TBP)功能域 。 当其与 TATA盒结 合时 , 随即与 TFⅡ A~ TFⅡ H形成前起 始复合物 (preinitiationcomplex)。 TAFⅡ 250 具有激酶活性 , 能磷酸化自身和 TFⅡ F。此外 , 其还有 HAT酶活性 和两个 Bromo结构域 , 能识别和结合到乙酰化的组 蛋白 H4上 [ 2] 。
近年来 , 表观遗传学 (epigenetics)已成为生物 医学领域研究的热点 , 而组蛋白修饰因其形式多样 、 涉及的酶十分丰富被认为是研究的难点 。 组蛋白修 饰酶广泛存在于真核生物的基因转录过程中 , 是由 多种蛋白质组成的 , 在组蛋白和 RNA聚合酶 II之 间发挥修饰 、调控和桥梁的作用 。 在转录调控过程 中 , 组蛋白修饰酶的作用极其重要 , 这些不同形式的 酶复合物 , 其修饰有的能促进基因转录的激活 , 而有 的则起抑制作用 。 因此 , 弄清这些组蛋白修饰酶复 合物的组成成分和功能 , 对了解基因转录调控的机 制具有非常重要的意义 。
蛋白磷酸化与蛋白激酶

蛋白激酶、蛋白磷酸酶与信号转导
一、 蛋白激酶
蛋白磷酸化是多种信号转导途径中 的重要环节,细胞内大部分重要的生命过 程都涉及蛋白磷酸化。
可逆的蛋白质磷酸化:
ATP 蛋白激酶 蛋白质 蛋白磷酸酶 Pi H2O 蛋白质 P ADP
蛋白激酶(protein kinase,PK):
是一类磷酸转移酶,其作用是将 ATP 的 - 磷酸基转移到底物特定的氨基 酸残基上,使蛋白质磷酸化, 发挥其生理 生化功能。
SH2能特异地识别磷酸化的酪氨酸残 基以及磷酸化残基的羧基端氨基酸序列并 与其相互结合。 SH2的主要功能是介导胞质内多种信 号蛋白的相互连接,形成蛋白异聚体复合 物,从而调节信号传递。
Cterminal PLC SH2 domain
c)SH3结构域
可见于多种胞质信号蛋白及肌动蛋白 结合蛋白中。 SH3识别的部位是一些富含脯氨酸的 区域PXXP。 功能:参与PTK介导的蛋白质间的相 互作用,可能在亚细胞定位和细胞骨架蛋 白相互作用中起作用。
(一)蛋白激酶的结构
共同的结构特征:
• 保守的催化结构域/亚基
• 调节结构域/亚基
• 其他功能结构域
PKC
1. 催化结构域/亚基
催化核心含有12个高度保守的亚区。
功能: • 与蛋白质或多肽底物结合; • 与磷酸供体ATP/GTP结合; • 转移磷酸基到底物相应的氨基酸残基上。
2. 调节结构域/亚基
NH HC CH2 O C OH NH HC CH2 O C O O P O O
(1)蛋白激酶A(protein kinase A,PKA)
即cAMP依赖性蛋白激酶。
全酶存在胞浆,被cAMP激活后,催化亚 基可① 调节代谢;②调节离子通道;③调 节其他信号转导途径的蛋白;④ 进入细胞 核调节基因表达。
蛋白质磷酸化修饰在多聚谷氨酰胺疾病中的研究进展

蛋白质磷酸化修饰在多聚谷氨酰胺疾病中的研究进展周亚芳△江泓△汤建光△唐北沙【摘要】多聚谷氨酰胺(polyglutamine,polyQ)疾病是一大组常见的神经退行性疾病,疾病的发生源于致病基因编码区CAG三核苷酸重复扩展突变导致基因的编码蛋白——p01yQ蛋白产生多聚谷氨酰胺扩展突变。
p0№疾病的发病机制目前虽然尚未得到完全阐明,但越来越多的研究表明蛋白质的磷酸化修饰在亨廷顿舞蹈病、齿状核红核苍白球路易氏体萎缩症、延髓脊肌萎缩症、遗传性脊髓小脑型共济失调1型、遗传性脊髓小脑型共济失调3型/马查多.约瑟夫病等疾病的发生发展中发挥了重要的作用。
【关键词】多聚谷氨酰胺疾病;蛋白质磷酸化;核内包涵体Theadvancesinresearchphosphorylationofpolyglutaminedisease。
ZHOUYa-fan91△,Jb“VGllon91△,TANG励卜班矿,TANGBei-shal.1(玖妒删ofNeurology,Xio哪aHospital,GerardSD砒University,Cha增sha,Hunan,410008P.R.Ch/na);2(TheSecondXio愕,yaHospital,CentralSouthUniversity,Changsha,Hunan,410008P.R.China)ZHOUYa-fo阢g,JIANGHongandTANGJian-guangcontributedequallytothisworkCorrespondingauthor:TANGBei-sha。
Ema//:baan97398@yahoo.com.cn【Abstract】Polyglutamine(polyQ)diseasesgroupofhereditaryneurtMegenerativedisorderscausedbypamionofglutⅢninerepeatinresponsiblegenepln(1ucts.Todate,thepathogenesisofpolyQdiseasesisstillnotveryclear,butmanyresearchessuggestthatphosphorylationofmutantproteinsplayscriticalroletheprocessofHu血ng—ton’8disease,dentatorubral-pallidoluysianatrophy,spinalbulbarmuscularatrophy,spinocerebellarataxia1andspinocerebellarataxia3/Machado-Josephdisease.【Keywords】polyglutaminediseases;phosphorylation;nuclearinclusion*SupportedbytheNationalNaturalScienceFoundationofChina(喇.No.30670720,30400262,30710303061)多聚谷氨酰胺(polyglutamine,polyQ)疾病是一大组常见的神经退行性疾病,疾病的发生源于致病基因编码区CAG三核苷酸重复扩展突变导致基因的编码蛋白——凼rQ蛋白产生多聚谷氨酰胺扩展突变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组蛋白磷酸化涉及的酶
组蛋白磷酸化是一种重要的细胞内信号转导过程,涉及多种酶的作用。
这些酶能够在细胞中精确调节组蛋白的磷酸化水平,从而调控基因表达、细胞周期、细胞分化和发育等生物学过程。
本文将介绍一些与组蛋白磷酸化密切相关的酶,旨在为读者提供有关磷酸化酶的综合了解。
1. 磷酸化酶:磷酸化酶是一类具有磷酸化底物特异性的酶,可以从组蛋白上去除磷酸基团。
其中最知名的磷酸化酶是蛋白磷酸酶(protein phosphatase),该类酶能够通过水解反应去除磷酸基团。
常见的蛋白磷酸酶包括蛋白磷酸酶1(PP1)、蛋白磷酸酶2(PP2)以及蛋白磷酸酶2A(PP2A)等。
这些磷酸酶的活性受到细胞内多种调控机制的影响,确保组蛋白磷酸化水平的准确调控。
2. 激酶:激酶是组蛋白磷酸化过程中的关键酶,能够在组蛋白上增加磷酸基团。
一些重要的激酶包括激酶A(PKA)、激酶B
(PKB/Akt)、激酶C(PKC)和激酶D(PKD)等。
这些激酶能够被特定的信号途径或细胞内环境激活,并通过磷酸化作用调节特定的组蛋白底物,参与细胞发育、增殖和转录调控等生物学过程。
3. 激酶激酶:激酶激酶是一类可以磷酸化和激活其他激酶的酶。
其中最著名的是激酶激酶激酶(MAPK激酶激酶,MAPKKK),它可以通过磷酸化和激活MAPK激酶激酶(MAPKK)来启动整个MAPK信号传导级
联反应。
MAPK信号通路在细胞的生长、分化和凋亡等过程中发挥重要
作用,其调控组蛋白磷酸化是其中的关键一环。
4. 组蛋白激酶:组蛋白激酶可以磷酸化组蛋白蛋白质,从而调节
组蛋白的结构和功能。
最为典型的组蛋白激酶是CDK(细胞周期调节蛋白激酶),它可以在细胞周期不同阶段磷酸化不同的组蛋白底物,从
而参与细胞周期的调控。
此外,其他组蛋白激酶如JNK(c-Jun N-端激酶)和ERK(外源性信号调节激酶)等也能够磷酸化组蛋白,并影响细胞的生长、分化和转录调控等生理过程。
综上所述,组蛋白磷酸化是一个复杂而重要的细胞信号转导过程,涉及多种酶的调控作用。
磷酸化酶、激酶、激酶激酶和组蛋白激酶等
酶通过磷酸化和去磷酸化反应的调控作用,精确地调节细胞内组蛋白
的磷酸化水平,进而调控基因表达和细胞功能。
对于深入理解细胞生
物学过程并为疾病治疗提供新的靶点,研究这些酶的功能和调控机制
具有重要的指导意义。
