β内酰胺类化合物-药物化学资料
药物化学(各类别药品资料整理)
作用于拓扑异构酶II 小细胞肺癌
作用于拓扑异构酶II 脑瘤首选
作用于微管蛋白 干扰蛋白质代谢
半合成 有双键
非小细胞肺癌
紫杉烯环二萜,10位酯 抗有丝分裂
10位去乙酰基半合成紫杉烷类,水溶性好
三氮唑,二氰基苯 抑制芳香化酶,阻断雌激素合成。 作用机理:酪氨酸激酶抑制剂
6- 苯基-8- 氯-4-H-三氮唑- 苯并二氮杂桌 1-甲基-6- 苯基-8- 氯-4-H-三氮唑-苯并二氮杂 4-羟基的代谢产物有抗焦虑活性 1H 3H 7硝基
旋光性 左旋
右旋
消旋± 左旋大 右旋大
手性 手性中心 异构体
酸碱 性
酸性
两性
右旋》左旋 用消旋
酸性
镇静 催眠药 焦类及虑别抗药
化学名称
三苯乙烯 抗雌激素药,治疗绝经后乳腺癌一线药物
不能手术的肠胃道肿瘤
含三种类型的N原子 晚期非小细胞肺癌最后一道防线
1-甲基-5-苯基-7-氯-1,3-二氢- -1,4-苯并二氮杂 -2-酮 不稳定 遇酸碱受热水解开环失效 1,2和4,5开环
5-苯基 -3-羟基 -7-氯-1,3-二氢--1,4-苯并二氮杂-2-酮 重氮化
氯硝西泮 唑吡坦 其他 佐匹克隆 丁螺环酮
苯巴比妥 抗癫 痫及抗 苯妥英钠 惊厥 药 异戊巴比妥
硫喷妥钠 卡马西平 丙戊酸钠 其他类 奥卡西平 加巴喷丁 拉莫三嗪
氯丙嗪
抗精神 奋乃静 病药 氟哌啶醇
舒必利
阿米替林
氟西汀 抗抑郁
药 帕罗西汀 文拉法辛 舍曲林 吗氯贝胺 吡拉西坦
多奈哌齐 改善脑 功能的 茴拉西坦
白消安
药物化学考试重点

2019药物化学第二章新药研究的基本原理与方法一、先导化合物的发现(选择)1.天然产物:青蒿素、β内酰胺酶抑制剂克拉维酸、HMG-COA还原酶抑制剂他汀类、猪胰岛素2.现有药物:(1)副作用:氯丙嗪由抗组胺药异丙嗪镇静副作用发展而来;磺胺类降糖和利尿由抗菌药发展而来(2)代谢:羟布宗是保泰松的活性代谢物;奥沙西泮是地西泮的活性代谢物(3)现有突破性药物:me too ,兰索拉唑由奥美拉唑发展而来3.活性内源性物质:避孕药的先导化合物是甾体激素黄体酮;抗炎药吲哚美辛先导化合物是炎性介质5-羟色胺4.组合化学和高通量筛选5.计算机靶向筛选二、先导化合物的优化(简答)在新药研究过程中:发现的先导化合物可能存在某些缺陷如活性不够高,化学结构不稳定,毒性较大,选择性不高,药代动力学性质不合理等,需要对先导化合物进行结构修饰或改造,使之成为理想的药物,这一过程称为先导化合物的优化。
先导化合物的优化方法:传统的药物化学方法和现代的方法。
1.传统的药物化学方法1)利用生物电子等排体原理优化先导化合物生物电子等排体是具有相似的分子形状和体积、相似的电荷分布并由此表现出相似的物理性质(如疏水性),对同一靶标产生相似或拮抗的生物活性的分子或基团。
分为经典和非经典的生物电子等排体。
经典的生物电子等排包括外层价电子相同的原子或基团,元素周期表中同主族的元素,以及环等价体。
非经典的生物电子等排体是具有相似的空间排列、电性或其他性质的分子或基团,相互替换会产生相似或相反生物活性的分子或基团。
利用生物电子等排体对先导化合物中的某一个基团逐个进行替换得到一系列的新化合物,是药物化学家设计研究药物的经典方法,有许多成功例子。
例如将H2受体拮抗剂西味替丁 (aimetidine)结构中的咪唑环用呋喃环和噻唑环替换得到雷尼替丁( rnitidine )和法莫替丁 ( famotidine) ,它们的H2受体拮抗作用均比西咪替丁强。
2)通过前药设计优化先导化合物。
药物化学第八章抗生素1β内酰胺类

半 胱氨 酸 Cys
O HH
结构特点
RN H
S N
O
COOH
❖ 分解1、β-内酰胺环、四氢噻唑环、 缬氨酸 Val
酰胺侧链
❖ 分解2、半胱氨酸、缬氨酸、侧链;
➢ 两个环张力都较大(故体内活性和体外易失 活):β-内酰胺环,四氢噻唑环;
➢ 两个环不在一个平面上,致使β-内酰胺环中 的羰基与氮原子的孤电子对不能共轭,羰基
分类—按化学结构
β-内酰胺类 四环素类 氨基糖苷类 大环内酯类 其它类
OH H N
Cl Cl
O2N
O OH
OH HH
NMe2 OH
OH
O HH
N
S
H
N
O
COOH
OH O
OH O
CONH2
HO
HO HO
O
OH
OH
O NHMe OH
H2N O
O
O HN
O
HO
OH O
HO OO
NMe2
O
O OMe
阻止侧链羰基电子向β-内酰胺环转移,增
加对酸的稳定性。
O
HH
O N
S
H
N
O
COOH
青霉素V
青霉醛
青霉胺
胺,醇
H R'CONH
O
H S
N COOH
RNH2 or ROH
青霉素
HH
RCONH
S
O HN OH
COOR
青霉酸酯 or
HH
RCONH
S
O HN OH
CONHR
青霉酰胺
性质小结
由以上稳定性可见: ❖ 青霉素只能注射给药 ❖ 在肠胃中,青霉素易分解失活
药综备考药物化学知识点 抗生素

1、分类1)β-内酰胺类2)四环素类3)氨基糖苷类4)大环内酯类5)多肽多烯类6)其他类病源微生物:细菌、真菌、寄生虫、支原体、衣原体、病毒细菌:能被革兰氏试剂(结晶紫和碘)染为蓝色的称为革兰氏阳性菌G+;相反不能染色或呈粉红色的称为革兰氏阴性菌(G-)。
按形态:杆菌、螺旋菌、球菌抗生素(Antibiotics)抗生素是某些细菌、放线菌和真菌等微生物的次级代谢产物,或用化学方法合成的相同化合物或结构类似物,在低浓度下对各种病原性微生物或肿瘤细胞有强力杀灭、抑制或有其他药理作用的药物抗菌药物的作用机制(1)干扰细胞壁的合成:青霉素和其他β内酰胺类药物抑制胞浆外黏肽的交联过程;磷霉素和环丝氨酸干扰胞浆内黏肽前体N-乙酰胞壁酸的合成;万古霉素干扰胞浆膜阶段的黏肽合成.(2)损伤细胞膜: 多粘菌素B和两性霉素等作用在细胞膜上,引起细胞膜的损伤,通透性增加,细胞内物质外流.(3)抑制细菌蛋白质的合成: 氯霉素, 林可霉素,四环素和大环内酯,氨基糖苷类,噁唑烷酮类药物能够与细菌核糖体中的亚基作用,阻止细菌蛋白质的合成.(4)抑制和干扰核酸的合成: 磺胺干扰四氢叶酸的合成,进而影响DNA的合成. 利福平和灰黄霉素干扰细菌RNA和DNA的合成和转录;喹诺酮类药物抑制细菌的拓扑异构酶,使DNA的复制受阻.第一节β-内酰胺类抗生素一、基本结构结构特点(1)除单环β-内酰胺类外,均具有一个四元的β-内酰胺,四元环通过N及相邻的叔C与另一个五元(六元)环稠合,青霉素类的稠合环氢化噻唑环,头孢菌素类的稠和环是氢化噻嗪环(2)除单环β-内酰胺类,2位C连有羧基;青霉素类C-6,头孢菌素类C-7,单环β-内酰胺类C-3都有酰胺侧链(3)β-内酰胺环取代基在环平面下称α键,用虚线表示;在环平面上称β键,用实线表示(4)优势构象为两个稠合环非共平面。
青霉素沿N1-C5轴折叠,头孢菌素沿N1-C6轴折叠(5)抗菌活性与母体的构型有关。
药物化学-抗生素

23
青霉素G的化学性质
对 解CβRHRRO2O-OHOHN内OHNHHNOO酰HHNH NHNHS胺CSOSCCCOC酶OOHHHCOCCOC33HHHHHH不3333 稳定β-la,CRcHtCaCR2ORmHO水H2OaHN2OOsOeHNHHNOHHOHNOHHHNHNHSCSSOCCCCOOOHHHCCCCOO33HHHHHH3333
青霉素
显示较强的抑
N
制作用。
分析原因是由于其侧链为亲水性。
32
Design principle of broadspectrum Penicillins
广谱:侧链引入NH2,COOH,SO3H
等亲水性基团
O HH
N
S CH3
H HN NH2 O
CH3
COOH
Ampici
O HH
N HH
NH2 O
S CH3 N CH3
αβ
指分子中含有由四个原子组成β-内酰 胺环
发挥生物活性的必需基团
-和细菌作用时,内酰胺环开环与细菌发 生酰化作用
抑制细菌细胞壁的合成
分子张力比较大
11
β-内酰胺抗生素的分类
经典β-内酰胺抗生
素HH
RCOHN
S CH3
O
N
CH3 COOH
Penicillins 青霉素类
RCOHN H H S
N O
碍化合物与酶活性中心结合
萘夫西林:
O HH
NH
S
N
O
COOH
31
Design principle of broadspectrum Penicillins
广谱:侧链引入NH2,COOH,SO3H 等亲水性基团
β-lactam 药物化学复习资料

青霉素
临床应用
用于G+引起的全身或严重的局部感染 –如链球菌、葡萄球菌、肺炎球菌等
青霉素
过敏反应 过敏原 外源性过敏原--蛋白多肽类杂质 –生物合成时带入(残留量) 内源性过敏原--高分子聚合物 –可能来自于生产,贮存和使用过程 β-内酰胺环开环、聚合 儿童 欣弗 细菌比人聪明
青霉素
交叉过敏 β-内酰胺抗生素在临床使用中常发生交 叉过敏反应 –抗原决定簇青霉噻唑基 –不同侧链的Penicillins都能形成相同结构的 抗原决定簇青霉噻唑基
青霉素
霉素的缺点 对酸不稳定 –只能注射给药,不能口服 抗菌谱比较狭窄 –对G+效果比对G-的效果好 耐药性 有严重的过敏性反应
内容
A 合成 半合成青霉素 B 耐酸 C 耐酶 D 广谱
半合成青霉素
半合成青霉素 自五十年代开始,研究了数以万计的半 合成Penicillins衍生物 取得重大进展 –口服的耐酸青霉素 –广谱青霉素 G+,G–耐酶青霉素
半合成青霉素
半合成青霉素的合成 1,酰氯法 2,酸酐法 3,DCC法药物化学Medcinal Chemistry
主讲教师:董大鹏 主讲教师 董大鹏
抗生素
抗生素概述
1. 定义 2. 应用 3. 来源 4. 分类 5. 作用机制
概论
定义: 微生物的代谢过程中产生的或合成的类似物
能以极小的浓度抑制或杀灭病原微生物, 对宿主不会产生毒性
概论
应用
1, 抑制病原菌的生长 –用于治疗细菌感染性疾病 2, 具有抗肿瘤活性 –用于肿瘤的化学治疗 3, 免疫抑制和刺激植物生长作用 抗生素不仅用于医疗,而且还应用于农业、畜牧和食 品工业方面
药物化学-β-内酰胺类抗生素

目 录
• β-内酰胺类抗生素简介 • β-内酰胺类抗生素的结构与性质 • β-内酰胺类抗生素的合成 • β-内酰胺类抗生素的应用与效果 • β-内酰胺类抗生素的未来发展
01
β-内酰胺类抗生素简介
定义与特性
定义
β-内酰胺类抗生素是一类具有β-内酰 胺环的抗菌药物,通过抑制细菌细胞 壁的合成来发挥抗菌作用。
治疗效果与副作用
抗菌效果
β-内酰胺类抗生素具有强效的抗菌活性,尤 其对革兰氏阳性菌和革兰氏阴性菌具有良好 的抗菌效果。
副作用
长期或不当使用β-内酰胺类抗生素可能导致 肠道菌群失调、过敏反应、肝肾损伤等副作 用。
耐药性问题
耐药机制
细菌对β-内酰胺类抗生素的耐药机制主要包括产生β-内 酰胺酶、外排泵机制、靶位改变等。
抗生素的分类
按结构分类
根据β-内酰胺环的结构,β-内酰胺类抗生 素可以分为青霉素类、头孢菌素类、单环 内酰胺类等。
VS
按抗菌谱分类
根据抗菌谱的广窄,β-内酰胺类抗生素可 以分为广谱抗生素和窄谱抗生素。
02
β-内酰胺类抗生素的结 构与性质
β-内酰胺环的结构
01
β-内酰胺环是β-内酰胺类抗生素的 核心结构,由四个原子组成,其中 三个是碳原子,一个是氮原子。
β-内酰胺酶的稳定性是指其在不同条件 下的稳定性,与抗生素的活性密切相关。
03
β-内酰胺类抗生素的合 成
天然产物的半合成
青霉素的半合成
利用青霉素发酵产物进行化学修饰, 得到多种半合成青霉素,如氨苄西林 、羧苄西林等。
头孢菌素的半合成
以头孢菌素发酵产物为原料,经过一 系列化学反应,合成出多种头孢菌素 ,如头孢克洛、头孢曲松等。
药物化学部分知识点小结

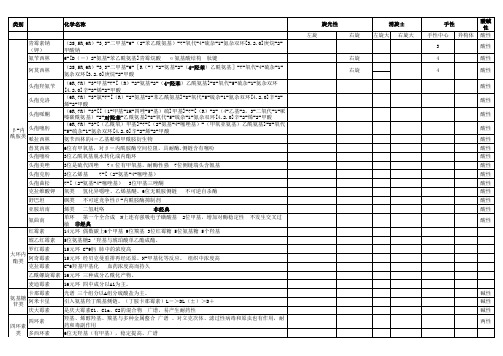
第四章镇静催眠药一,苯二氮䓬类(氯氮䓬,地西泮,奥沙西泮)二,非苯二氮䓬类GABA受体激动剂(唑吡坦,阿吡坦)三,巴比妥类药物(巴比妥,苯巴比妥)苯二氮䓬类构效关系①七元亚胺内酰胺环为活性必需基团②C-7位和C-2’位,引入吸电子基团,可明显增强活性③1,2位或4,5位并入杂环可增强活性④R2以长链烃基取代,可延长作用地西泮性质物理:白色或类白色结晶性粉末,无臭味微苦,易溶于丙酮,三氯甲烷,在乙醇中易溶,水中几乎不溶化学①稳定性:不稳定,有内酰胺及稀胺结构在酸碱及受热条件下会水解开环鉴别可进行生物碱的一般反应 +碘化铋钾试液=橙红色沉淀作用本品与中枢苯二氮草受体结合而发挥安定、镇静、催眠、肌肉松弛和抗惊厥作用。
临床上主要用于治疗神经官能症。
抗癫痫药一,酰脲类①巴比妥类②乙内酰脲类及其类似物(苯妥英钠,苯妥英,乙苯妥英)二,二苯并氮杂䓬类(卡马西平)三,GABA类似物(普洛加胺,加巴喷丁)四,脂肪羧酸类及其他类(舒噻美,唑尼沙胺,托吡酯,非你氨酶)巴比妥类构效关系①为5,5-二取代基的环丙二酰脲类②本身无活性,5位次甲基上的两个氢被烃基取代后呈现活性③R2的甲基取代起效快④可开环代谢(1,6取代酰脲;1,2取代酰胺)性质:①形成烯醇型-弱酸性,溶于NaOH、Na2CO3形成钠盐,NaHCO3中不溶,需制成粉针剂,先配先用,防止吸收空气中CO2析出游离巴比妥不稳定。
②水解性:中性,室温不易水解③与重金属反应+银盐,Na2CO3=白色酮吡啶反应=紫色含O 绿色含S 作用:目前主要用于抗惊厥,抗癫痫和麻醉及麻醉前给药苯妥英钠性质物理白色粉末,无臭,味苦,微有引湿性化学①水溶液显碱性,与空气中CO2或酸性药生成苯妥英②水解性(乙内酰脲)和NaOH加热=酰脲类化合物和氨气鉴别:于二氯化汞生成白色沉淀作用:本品抗惊厥作用强,虽然毒性较大,并有致畸形的副作用,但仍是治疗癫痫大发作和局限性发作的首选药,对小发作无效。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗菌谱:G+及少数G-,窄谱抗菌药
黏肽D-丙酰胺-D
丙氨酸末端结构象
青霉素构象
两者构象相似,使 D -丙酰胺- D -丙氨酸转肽酶识别 错误,干扰细胞壁合成。而且药物对人体细胞不起作用, 具有很大的选择性,因此, β -内酰胺类药物毒性很小。
四元环的 张力很大
酰胺键易 受攻击
青霉素G 的不稳定
双功能前药 头孢母核4-位羧基引入特戊酸甲酯 7-位侧链噻唑环上的氨基用亲水性的L一丙氨酸修饰
合理的油水分配系数
非奈西林
• 口服吸收好,药效高 于青霉素V
三苯甲青霉素
发现其对β-内酰胺酶十分稳定,空间位阻
甲氧西林
• 金葡菌对其很
快产生耐药性
苯唑西林
• 第一个发现的耐 酶、耐酸青霉素
双氯西林
• 耐酶、耐酸性质
进一步提高
青霉素N
氨苄西林
• 第一个广谱青霉素类
药物,生物利用度低,
注射给药
阿莫西林
• 广谱、对酸稳定、口服 吸收好
羧苄西林
• 对G+、G-,铜绿假单 胞、流感杆菌
哌拉西林
• 含氮杂环,迅速穿越G+ 的细胞膜,作用强、快
匹氨西林
• 羧基改为酯
键,口服吸 收更好,改 进生物利用 度
替莫西林
• 增大空间位
阻,使其不 易水解,抗 G-
在此位置引入O、N、X等电 负性原子,降低羰基上的电 子密度,增加对酸的稳定性 ,如阿度西林等。
研究热点: 对头孢烯酸的酰胺基侧链用氨基噻唑肟或氨基噻二唑肟基团修 饰可得到对MRSA敏感的头孢菌素类化合物
对MRSA、耐青霉素的肺炎链球菌(PRSP)和耐亚胺培南的铜绿假单胞菌有效。
由Basilea Pharmaceutica公司开发的全球首个抗 MRSA头孢菌素 ceftobiprole于2008年6月30日宣布,获准在加拿大上市
ANTIBIOTICS
Q1、03年 全球非典造 成多少人死 亡? 2003年全球因非典死亡 919人
Q2、03年全
同年全球因心血管病死 亡1650万人
球心血管病 造成多少人 死亡?
Q3、欧洲著 名瘟疫黑死 病造成多少 人死亡?
黑死病,公元1347-
1350,造成至少2350万
欧洲人死亡
转 折 点 ︓ 弗 莱 明 与 青 霉 素 的 邂 逅
半合成头孢 菌素是发展 最快的一类 抗生素
第三代 第二代 第一代
第一代
头孢噻吩
第二代
头孢呋辛
第三代
耐酶性 抗菌谱 对酶亲和性 透膜性 蛋白亲和性
头孢噻肟 头孢匹罗
第四 三代 四代
稳定 性
抗铜 绿
亲脂性基团,如苯 环、噻吩扩抗菌 谱,增抗菌活性 亲水性基团 如氨基 磺酸基,扩抗菌谱
MRSA
水解酶 的产生
绿脓杆菌
青霉素 结合蛋 白改变
耐药性 的产生
细胞膜通 透性改变
不耐酶 不耐酸
抗菌谱 窄
青霉 素G
结构改造
耐酸青霉素
耐酶青霉素 广谱青霉素
拉电子效应
空间位阻效应
引入α 氨基使易透膜 引入羟基提高利用度
青霉素V
耐酸,但抗菌活性差
青霉素G
• 最早使用的抗生素
阿度西林
• 阻止侧链羰基电子向 四元环转移
中国唐朝:裁缝用长绿毛的浆糊涂抹在被剪刀割破的手上
•桑德斯、 李斯特
•霉菌污染的 培养液,尿 液
1875
• 丁达尔 • 青霉会 杀死细 菌
• 巴斯德 • 霉菌抑制 尿液炭蛆 杆菌
1897
• 杜彻斯尼 • 青霉防治伤 寒
• 格拉提亚、 达斯 • 感染青霉 的培养基
1870
1877
1920
“牛津小组”开创各学科合作奋战的模式,已成为现代研发的基本模式
修饰β内酰胺环?
不稳定 易过敏
有药效
提高稳定性(耐酸、耐酶)
降低四元环活性
对侧链的修饰
扩大抗菌谱(透膜能力、结合能力)
提高抗G+、铜绿假单胞菌等病原菌活性的新一代头孢菌 素(扩大抗菌谱)
对活性高的化合物进行修饰(前药原理)
开发一类与其它药物组合而成的复方制剂,以期得到协 同与增强各自的药理活性且避免某些不良反应的药物
广谱青霉素
噻睉环羧基六位酰胺侧 链-抗菌谱 基本活性基 团
位阻较大基
三手性碳-保
团-耐酶性
持活性构型
Cephalosporin
四元环并六元环体系比 四元环并五元环体系稳定!
亲核试剂
7-ACA母核
共轭效应
7-ADCA母核
第五代
天然头孢 菌素药效 活性很差
第四代
优点:抗 菌谱广、 稳定、毒 副作用低
耐酸青霉素
耐酶青霉素
此位置的H可用甲氧 基取代。如替莫西 林等。
将此位酸酯化,改 善药物口服吸收, 增加生物利用度。 如匹氨西林。
前药原理
在此位置引入空间位阻大的基团 ,阻止化合物与酶活性中心的结 合。 如甲氧西林等。
耐酶青霉素
在苄青霉素侧链上引入α -氨基 得到氨苄西林,再在其苯基4 位引入羟基得到阿莫西林
其他类
氨基糖甙类
大环内酯类
四环素类
β -内酰胺类
头孢菌素类 50% 氟喹诺酮类 15% 青霉素类 13% 大环内酯类 5% 其它 18%
Β -LACTAM
青霉素类 经典
头孢菌素类 β -内酰胺类
碳青霉烯类
非经典
头霉素类
单环β -内酰胺类
发现
耐药 性
改性
结构
性质
哪一部分结构在起作用?
β-内酰胺抗生素:分子中含有由四个原子组 成的β-内酰胺环的抗生素
甲氧基取代, 增大空间位阻
空间位阻 用CH2等排 用O等排
张力增大, 抗菌活性增强
用CH3,Cl取代 减缓药物代谢 用硫代杂环, 增强抗菌活性
酯化,前药 增加药物对细胞膜 的穿透力,增加耐 酶能力 提高稳定性、扩大抗菌谱
Β-内酰胺 环
活性高
天然产物中 青霉素G活性最强 青霉素V次之 天然头孢更次 过敏反应 青霉素G>青霉素V>天然头孢 增大空间位阻
酸性条件下易分解
故不可口服,需肌肉注射 代谢速度快,对皮肤刺激大
青霉素类的主要缺点
过敏原分
类
内源性
外源性
青霉噻唑 蛋白
青霉噻唑 多肽
青霉噻唑 聚合物
蛋白多肽 类杂质
在上世纪60年代,全世界每年死于感染性疾病的人数约为700万, 而这一数字到了本世纪初上升到2000万,大部分人死于超级病菌带来 的用药困难。
膦酰胺类头孢菌素类化合物 母核7一位氨基噻唑肟侧链的氨基上引入膦酰基基团,提高了化 合物的稳定性及水溶性,满足制备注射剂所需的溶解度
曾在对复杂性皮肤及皮肤组织感染(CSSSI)的多中心、随机、双盲研究 (CANVAS I and CANVAS II)中,ceftaroline表现出与万古霉素/氨曲南联 合治疗具有相同的疗效。
