实验3 盐酸、硫酸的物理性质 初中化学实验报告
初中酸性质实验报告(3篇)

第1篇实验名称探究酸的化学性质实验目的1. 了解酸的物理性质和化学性质。
2. 通过实验验证酸的酸性、腐蚀性、与金属反应等性质。
3. 学会书写化学方程式和进行实验操作。
实验原理酸是一种能够释放出氢离子(H+)的化合物。
酸的化学性质主要包括:1. 酸与指示剂反应:酸能使紫色石蕊试液变红,使蓝色石蕊试液变蓝。
2. 酸与金属反应:酸能与某些金属反应,生成氢气和相应的盐。
3. 酸与碱反应:酸与碱发生中和反应,生成盐和水。
4. 酸与碳酸盐反应:酸能与碳酸盐反应,生成二氧化碳气体、水和相应的盐。
实验材料1. 实验器材:试管、滴管、镊子、酒精灯、石蕊试液、酚酞试液、金属片(如锌片、铁片)、氢氧化钠溶液、碳酸钠溶液、硝酸银溶液、浓盐酸、蒸馏水等。
2. 实验试剂:盐酸、硫酸、硝酸、氢氧化钠、碳酸钠、硝酸银等。
实验步骤1. 观察酸的物理性质- 取少量盐酸于试管中,观察其颜色、气味、状态等。
- 将盐酸滴在纸上,观察是否留下痕迹。
2. 酸与指示剂反应- 取少量紫色石蕊试液于试管中,滴加少量盐酸,观察颜色变化。
- 取少量蓝色石蕊试液于试管中,滴加少量盐酸,观察颜色变化。
3. 酸与金属反应- 取少量锌片于试管中,滴加少量盐酸,观察气泡产生情况。
- 取少量铁片于试管中,滴加少量盐酸,观察气泡产生情况。
4. 酸与碱反应- 取少量氢氧化钠溶液于试管中,滴加少量盐酸,观察颜色变化。
- 取少量酚酞试液于试管中,滴加少量氢氧化钠溶液,滴加少量盐酸,观察颜色变化。
5. 酸与碳酸盐反应- 取少量碳酸钠溶液于试管中,滴加少量盐酸,观察气泡产生情况。
- 取少量硝酸银溶液于试管中,滴加少量盐酸,观察沉淀产生情况。
6. 酸与盐的反应- 取少量硝酸银溶液于试管中,滴加少量盐酸,观察沉淀产生情况。
实验现象1. 盐酸为无色液体,有刺激性气味。
2. 盐酸滴在纸上,留下白色痕迹。
3. 紫色石蕊试液遇盐酸变红,蓝色石蕊试液遇盐酸变蓝。
4. 锌片与盐酸反应产生气泡,铁片与盐酸反应产生气泡。
初三化学浓硫酸和浓盐酸性质

变为黑色的碳
气体
浓硫酸与蔗糖的反应
现象:
蔗糖由白变黑,体积膨胀,呈疏松多孔的海绵状,放出大量的热,同时有刺激性及酸味的气体生成 。
探究:
因为蔗糖中含C、H、O元素, 使其脱水炭化,所以 。脱水反应是放热反应,故放出大量的热,体积膨胀为疏松多孔状,说明有 产生,是什么气体呢?
浓盐酸、浓硫酸的性质
单击添加副标题
生活中的酸
浓硫酸
浓盐酸
溶质的化学式
H2SO4
HCl
颜色
无色
无色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
挥发性
浓硫酸和浓盐酸的物理性质
油状粘稠液体
水状液体
无气味
强烈刺激性气味
比水大
比水大
/CONTENTS
要点:将水倒入盛有浓盐酸的烧杯中,并用玻璃棒不断搅拌。
浓盐酸的稀释
要点:将浓硫酸慢慢的沿玻璃棒倒入盛有水的烧杯中,并用玻璃棒不断搅拌,切不可把水倒入浓硫酸里。
浓硫酸的稀释
浓硫酸和浓盐酸的稀释
错误操作:由于浓硫酸密度比水大,浮在上面,而浓硫酸溶于水时, 放出大量的热,会产生局部高温,使水沸腾,造成液滴飞溅出来。
正确操作:把浓硫酸慢慢地倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
浓硫酸的稀释
浓硫酸的稀释
浓硫酸的特性
一、吸水性
实验一
CuSO4﹒5H2O CuSO4+5H2O
实验二
浓硫酸也能够吸收空气中的水分。
浓硫酸如果敞口放置,会发生什么变化?根据这一性质,它在实验室有什么用途?
1
2
3
浓硫酸的脱水性与吸水性相同吗?
实验6_酸碱的化学性质实验报告

实验6_酸碱的化学性质实验报告一、实验目的1.了解酸碱的化学性质;2.掌握酸碱溶液的鉴别方法。
二、实验原理1.酸的化学性质:酸可以与金属反应产生氢气,与碱反应生成盐和水,与金属碱土金属的氢氧化物反应生成盐和水,与碱式盐反应生成普通盐和水。
2.碱的化学性质:碱可以与酸反应生成盐和水,与酸式盐反应生成普通盐和水。
三、实验设备和试剂1.实验设备:试管、试管架、酒精灯、玻璃棒、滴管等。
2.实验试剂:盐酸、稀硫酸、氢氧化钠、氢氧化钾、氯化钠、硝酸银溶液。
四、实验步骤1.盐酸和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数滴盐酸,观察产生的现象和气体。
2.碳酸氢铵和稀硫酸的反应a.取一根盛满碳酸氢铵溶液的试管;b.在试管中加入数滴稀硫酸,产生的气体通过试管口,倾斜试管观察产生的现象。
3.酸式盐和氢氧化钠的反应a.取一根盛满氢氧化钠溶液的试管;b.在试管中加入数粒酸式盐,观察产生的现象。
4.酸和金属的反应a.取一根盛满盐酸的试管;b.将一块锌片放入试管中,观察产生的气体。
五、实验结果与分析1.盐酸和氢氧化钠的反应a.实验现象:盐酸与氢氧化钠混合后,产生大量气泡,并有气泡从试管口直接飘出。
b.化学方程式:HCl+NaOH→NaCl+H2Oc.结果分析:盐酸与氢氧化钠反应生成盐(氯化钠)和水。
2.碳酸氢铵和稀硫酸的反应a.实验现象:碳酸氢铵与稀硫酸混合后,试管内产生了大量白色气体,并发出刺激性气味。
倾斜试管时,气体滴入湿润的白纸上,使白纸颜色发生变化。
b.化学方程式:NH4HCO3+H2SO4→(NH4)2SO4+CO2+H2Oc.结果分析:碳酸氢铵与稀硫酸反应生成盐(硫酸铵)、二氧化碳和水。
3.酸式盐和氢氧化钠的反应a.实验现象:酸式盐与氢氧化钠混合后,溶液变得中性,即颜色变淡。
b.化学方程式:NaOH+HClO_4→NaClO4+H2Oc.结果分析:酸式盐与氢氧化钠反应生成盐(氯酸钠)和水。
化学鉴别物质实验报告

化学鉴别物质实验报告实验目的通过观察和分析一系列化学反应,学习使用化学性质来鉴别不同的物质,并掌握一些常见物质的鉴别方法。
实验原理物质的化学性质是由其化学成分所决定的,不同物质之间的化学反应会产生不同的物化变化。
本实验通过酸碱中和反应、氧化还原反应和沉淀反应等方法,根据观察反应产物的性质来鉴别不同物质。
实验仪器和试剂实验仪器:试管、试管架、移液管实验试剂:盐酸、硫酸、硝酸、氢氧化钠、氢氧化铝、铁(II)硫酸、硫酸亚铁、氯化铅、氯化氢、氯化铜、硫酸铜、氢氧化钠溶液等。
实验步骤1. 鉴别酸性物质- 取一小块试纸,轻轻沾湿于待测物质上,若试纸变红,则物质为酸性。
- 将一滴酸性物质滴在纸上,若纸上出现明显腐蚀或炭化,则为酸性氧化剂。
- 将少量酸性物质与蔗糖混合搅拌,若产生气泡并有发烟现象,则为氧化性酸。
2. 鉴别碱性物质- 取一小块试纸,轻轻沾湿于待测物质上,若试纸变蓝或紫,则物质为碱性。
- 取少量碱性物质与盐酸混合,若产生气泡并有明显刺激性气味释放,则为氢氧化物。
3. 鉴别氯离子- 取少量待测物质溶于水中,加入少量稀硝酸,用银氨溶液与之反应,若形成白色沉淀,则为氯离子。
4. 鉴别铁离子- 取少量待测物质溶于水中,加入少量硫酸亚铁溶液,若反应产物呈绿色,则为铁离子。
- 取少量待测物质溶于水中,加入少量硫酸,放入试管中,轻轻转动试管,如试管内出现橙色沉淀,则为铁离子。
实验结果及分析通过以上实验步骤鉴别了不同物质的性质:- 酸性物质通过试纸变红和与蔗糖反应产生气泡发烟进行鉴别;- 碱性物质通过试纸变蓝或紫以及与盐酸反应产生气泡刺激性气味进行鉴别;- 氯离子通过与银氨溶液反应产生的白色沉淀进行鉴别;- 铁离子通过与硫酸亚铁反应产生的绿色溶液以及与硫酸反应生成的橙色沉淀进行鉴别。
结论通过酸碱中和反应、氧化还原反应和沉淀反应等方法,可根据观察反应产物的性质来鉴别不同物质。
本实验成功鉴别了酸性物质、碱性物质、氯离子和铁离子,并掌握了一些常见物质的鉴别方法。
酸碱盐实验报告_3
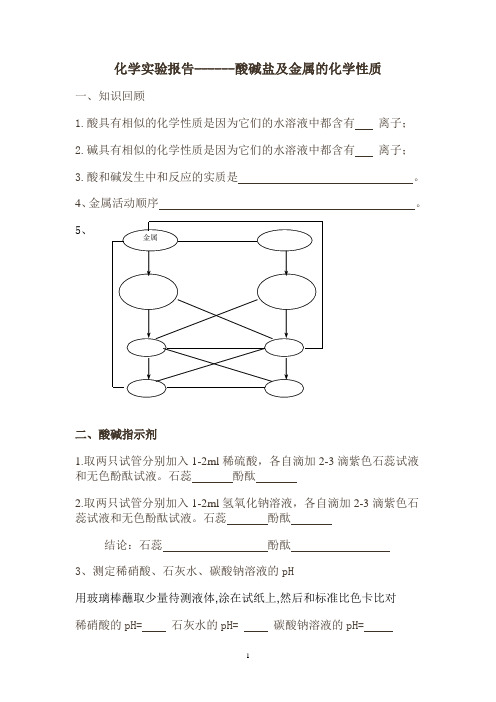
化学实验报告------酸碱盐及金属的化学性质
一、知识回顾
1.酸具有相似的化学性质是因为它们的水溶液中都含有离子;
2.碱具有相似的化学性质是因为它们的水溶液中都含有离子;
3.酸和碱发生中和反应的实质是。
4、金属活动顺序。
二、酸碱指示剂
1.取两只试管分别加入1-2ml稀硫酸,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。
石蕊酚酞
2.取两只试管分别加入1-2ml氢氧化钠溶液,各自滴加2-3滴紫色石蕊试液和无色酚酞试液。
石蕊酚酞
结论:石蕊酚酞
3、测定稀硝酸、石灰水、碳酸钠溶液的pH
用玻璃棒蘸取少量待测液体,涂在试纸上,然后和标准比色卡比对
稀硝酸的pH= 石灰水的pH= 碳酸钠溶液的pH=
三、酸碱盐及金属的化学性质
四、拓展反思
1.滴有酚酞试液的氢氧化钠溶液与盐酸反应,如果溶液变无色,能否说二者恰好完全中和反应?
2.能否用无色酚酞溶液鉴别氢氧化钠溶液和碳酸钠溶液?若不能,则用何种试剂鉴别?
3.能否用氢氧化钠溶液干燥二氧化碳气体?若不能则用什么溶液来干燥?
4、请用三种方法鉴定氢氧化钠已变质。
盐酸浓度有关实验报告

盐酸浓度有关实验报告引言盐酸是一种广泛应用于化学实验和工业生产中的强酸,常用于酸碱中和反应和金属腐蚀实验等。
在实际应用中,盐酸的浓度对其性质和反应速率有着重要影响。
因此,本实验旨在通过实验验证盐酸浓度与其酸性的关系,以及探究浓盐酸对金属反应反应速率的影响。
实验目的1. 了解盐酸浓度对其酸性的影响;2. 探究盐酸浓度对金属反应速率的影响。
实验材料和仪器- 盐酸溶液(不同浓度)- 快速反应金属(如锌片)- 装有盐酸溶液的试管- 酸性指示剂(如酚酞溶液)- 实验平台- 配套实验器材实验步骤和数据记录1. 将10mL盐酸溶液(浓度为0.1mol/L)倒入装有盐酸溶液的试管中;2. 按一定时间间隔记录试管中酸性指示剂的颜色变化,并记录下时间和颜色;3. 将锌片放入试管中,观察和记录金属腐蚀反应的起始时间和过程;4. 按照相同步骤,重复上述实验,但盐酸溶液浓度分别为0.05mol/L和0.01mol/L。
实验结果和分析根据实验记录,我们得到了盐酸浓度与其酸性的关系和盐酸浓度对金属反应速率的影响。
盐酸酸性与浓度的关系随着盐酸浓度的增加,酸性指示剂颜色变化的时间越短,颜色变化也更为明显。
具体数据如下表所示:盐酸浓度(mol/L)颜色变化时间(分钟)0.1 40.05 70.01 10由上表可见,随着盐酸浓度的增加,酸性指示剂颜色变化所需的时间减少。
这表明盐酸的浓度与其酸性呈正相关关系,浓度越高,酸性越强。
盐酸浓度对金属反应速率的影响随着盐酸浓度的增加,金属腐蚀反应的速率也随之增加,反应发生的时间更短。
以锌片反应为例,不同盐酸浓度下的反应时间如下表所示:盐酸浓度(mol/L)反应时间(分钟)-0.1 20.05 50.01 8可以观察到,随着盐酸浓度的增加,锌片与盐酸的反应速率逐渐增加。
这是因为盐酸浓度越高,其中的氢离子浓度也越高,与金属反应的速率也随之增加。
结论通过实验我们得出以下结论:1. 盐酸浓度与其酸性呈正相关关系,浓度越高,酸性越强;2. 盐酸浓度对金属反应速率有明显影响,浓盐酸反应速率更快。
浓盐酸和浓硫酸在物理性质方面有哪

我探究:浓盐酸和浓硫酸的物理性质
浓盐酸
浓硫酸
溶质的化学式及质量分数 HCl 37%~38% H2SO4 98%
颜色
无色
无色
状态
液体Leabharlann 粘稠、油状液体气味 密度 打开瓶口的现象 其他
刺激性气味
无气味
1.18g/mL 有白雾 挥发性
1.84g/mL 无现象 吸水性 腐蚀性
氢气和水蒸气 的混合气体
代表水分子 代表氢分子
氢气
浓硫酸
浓硫酸可做某些气体的干燥剂
如果不慎将浓硫酸沾到皮肤上,
应立即用大量的水冲洗,然后涂3%∼5%的碳 酸氢钠溶液,以防灼伤皮肤。
浓硫酸溶于水,放出大量的热, 并且密度比水大。
猜想:如何用水稀释浓硫酸,为什么?
稀释浓硫酸
稀释浓硫酸的视频
物质的分类
纯净物
物质
混合物
单质 化合物
产生无色气体、放热
铁锈逐渐消失、溶液变为黄色
铁钉表面有气泡生成
产生无色气体
氯化铜溶液
无可见现象
如果把上述实验中的稀盐 酸换成稀硫酸,是否出现类似 的现象?原因呢?
会. 不同的酸溶液都含有H+
迁移应用
右图所示已平衡的天平
两端放着两个分别盛有
浓盐酸和浓硫酸的敞口
烧杯,过一段时间后,
天平会 ( B )。
实验探究
浓盐酸和浓硫酸在物理性 质方面有哪些异同?
酸的性质
认识浓盐酸和浓硫酸
浓盐酸 (37~38%) Hydrochloric acid
500ml (1.18g/mL) 化学式HCl 相对分子质量36.5 有腐蚀性!
符合 GB622-89
初中化学实验报告范本

初中化学实验报告范本实验名称:酸碱中和反应实验实验目的:通过观察酸碱溶液的中和反应,了解酸碱中和的概念,并学习合理操作实验仪器和记录实验数据。
所需实验器材:1. 试管2. 进水蒸馏水3. 酸碱指示剂4. 碱溶液(氢氧化钠NaOH)5. 酸溶液(盐酸HCl)6. 凡士林球7. 称量器具实验步骤:1. 将一定量的酸碱指示剂加入试管中,用洗净的试管配备好准备好的酸溶液。
2. 在另一根洗净的试管中,同样加入酸碱指示剂,并用进水蒸馏水稀释成淡粉红色。
3. 逐滴加入碱溶液到酸溶液中,同时进行搅拌,直到实验溶液的颜色发生变化。
4. 记录滴加的碱溶液体积V1,记录下两种溶液混合后的颜色。
5. 重复步骤3和4,将酸溶液换为另一种酸溶液。
6. 对于每次实验,都需要记录数据,并清洗试管以备下次使用。
实验数据记录:实验一:酸溶液:盐酸(HCl)碱溶液:氢氧化钠(NaOH)实验前颜色:红色滴加的碱溶液体积V1:5.0 mL实验后颜色:橙色实验二:酸溶液:硫酸(H2SO4)碱溶液:氢氧化钠(NaOH)实验前颜色:红色滴加的碱溶液体积V1:8.0 mL实验后颜色:黄色实验结果:通过实验观察,发现在滴加酸溶液的过程中,酸碱指示剂的颜色逐渐发生变化。
酸碱中和反应后,溶液的颜色由红色变为橙色、黄色。
根据实验数据,可以计算出每种酸溶液中的酸性物质与碱性物质的量的比例。
实验分析与讨论:中和反应是一种重要的化学反应类型,当酸与碱按适当比例混合时,会发生中和反应,生成盐类和水。
实验中使用的酸碱指示剂能够通过颜色的变化来指示溶液是否发生了中和反应。
不同的酸碱指示剂在酸碱中和过程中会有不同的颜色变化情况,这使我们可以根据颜色变化来判断反应的进行。
实验中使用的酸溶液包括盐酸和硫酸,碱溶液为氢氧化钠。
其中,盐酸和硫酸均为常见的强酸,氢氧化钠为常见的强碱。
通过实验结果可以看出,不同酸碱组合下的酸性物质与碱性物质的量比例不同,这也导致了中和反应后溶液颜色的变化程度不同。
