盐酸、硫酸的性质比较
初三化学浓硫酸和浓盐酸性质

变为黑色的碳
气体
浓硫酸与蔗糖的反应
现象:
蔗糖由白变黑,体积膨胀,呈疏松多孔的海绵状,放出大量的热,同时有刺激性及酸味的气体生成 。
探究:
因为蔗糖中含C、H、O元素, 使其脱水炭化,所以 。脱水反应是放热反应,故放出大量的热,体积膨胀为疏松多孔状,说明有 产生,是什么气体呢?
浓盐酸、浓硫酸的性质
单击添加副标题
生活中的酸
浓硫酸
浓盐酸
溶质的化学式
H2SO4
HCl
颜色
无色
无色
状态
气味
密度(与水比较)
敞开试剂瓶口发生的现象
挥发性
浓硫酸和浓盐酸的物理性质
油状粘稠液体
水状液体
无气味
强烈刺激性气味
比水大
比水大
/CONTENTS
要点:将水倒入盛有浓盐酸的烧杯中,并用玻璃棒不断搅拌。
浓盐酸的稀释
要点:将浓硫酸慢慢的沿玻璃棒倒入盛有水的烧杯中,并用玻璃棒不断搅拌,切不可把水倒入浓硫酸里。
浓硫酸的稀释
浓硫酸和浓盐酸的稀释
错误操作:由于浓硫酸密度比水大,浮在上面,而浓硫酸溶于水时, 放出大量的热,会产生局部高温,使水沸腾,造成液滴飞溅出来。
正确操作:把浓硫酸慢慢地倒入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
浓硫酸的稀释
浓硫酸的稀释
浓硫酸的特性
一、吸水性
实验一
CuSO4﹒5H2O CuSO4+5H2O
实验二
浓硫酸也能够吸收空气中的水分。
浓硫酸如果敞口放置,会发生什么变化?根据这一性质,它在实验室有什么用途?
1
2
3
浓硫酸的脱水性与吸水性相同吗?
常见的酸碱盐

Cu+2AgNO3= 2Ag+ Cu(NO3)2 Fe+CuSO4= FeSO4 +Cu 2Al+3 CuSO4=Al2(SO4)3+3Cu AgNO3 +HCl=AgCl↓+HNO3 H2SO4+BaCl2=BaSO4↓+2HCl Na2CO3 +2HCl=2NaCl + H2O +CO2↑ FeCl3 + 3NaOH= Fe (OH) 3↓+ 3NaCl Na2CO3+Ca(OH)2=CaCO3 +2NaOH AgNO3 +NaCl= AgCl↓+NaNO3 CuSO4+BaCl2= BaSO4↓+ CuCl2 Na2CO3+CaCl2= CaCO3 +2NaCl
常见的酸碱盐
酸碱盐的通性
思考问题:
1、什么叫酸? 由氢离子和酸根离子构成的化合物叫酸.
如: 硫酸 H2SO4 碳酸 H2CO3 盐酸 HCl 硝酸 HNO3 醋酸 CH3COOH . .
2、什么叫碱? 由金属离子和氢氧根离子构成的化合物叫碱。
如: 氢氧化钠 NaOH 氢氧化钙 Ca(OH)2 氢氧化钾 KOH 氨水 NH3 ·H2O . .
C、氧化镁
D、碳酸钙
用锌粒和盐酸反应制取的氢气中,常 混有水蒸气和氯化氢气体,为了除去气体 杂质,可使混合气体通过右图A、B两装置, 气体通过两瓶的导管顺序正确的是( )
CA、abcd B、dcba C、cdab D、bacd
a b c d
浓硫酸
A
B
NaOH 溶液
下列四种物质中,能和其他三种物 质反应的是(
常见酸的性质

解。
几乎所有的硫化物也都可被硝酸溶解,但应先加入盐酸,使硫以H2S的形式挥发出去,以免单质硫将试样裹包,影响分解。
③硫酸(H2SO4)除钙、锶、钡、铅外,其它金属的硫酸盐都溶于水。
热的浓硫酸具有很强的氧化性和脱水性,常用于分解铁、钴、镍等金属和铝、铍、锑、锰、钍、铀、钛等金属合金以及分解土壤等样品中的有机物等。
硫酸的沸点较高(338℃),当硝酸、盐酸、氢氟酸等低沸点酸的阴离子对测定有干扰时,常加硫酸并蒸发至冒白烟(SO3)来驱除。
硫酸能将物质里的H、O元素以2:1脱去。
④磷酸(H3PO4)磷酸根具有很强的配位能力,因此,几乎90%的矿石都能溶于磷酸。
包括许多其它酸不溶的铬铁矿、钛铁矿、铌铁矿、金红石等,对于含有高碳、高铬、高钨的合金也能很好的溶解。
单独使用磷酸溶解时,一般应控制在500~600℃、5min以内。
若温度过高、时间过长,会析出焦磷酸盐难溶物、生成聚硅磷酸粘结于器皿底部,同时也腐蚀了玻璃。
⑤高氯酸(HClO4)热的、浓高氯酸具有很强的氧化性,能迅速溶解钢铁和各种铝合金。
能将Cr、V、S等元素氧化成最高价态。
高氯酸的沸点为203℃,蒸发至冒烟时,可驱除低沸点的酸,残渣易性质:仅知存在于某些溶剂中。
很不稳定,45℃分解,很易快速分解为硫酸、硫、硫化氢、多硫化氢和二氧化硫(混合物)。
硫代硫酸可看成是硫酸分子中的一个氧原子被硫原子所代替的产物。
两个硫原子的平均氧化数为+2。
其中一个硫原子氧化数为+6,另一个硫原子氧化数为-2,因此硫代硫酸及其盐类具有一定的还原性。
硫代硫酸根酸离子在碱性条件下很稳定,有很强的络合能力。
硫代硫酸可在低温(-78℃)下,在乙醚等有机溶剂(-78℃)或无溶剂(10℃以下)中用干燥的氯化氢处理(酸化)无水硫代硫酸钠而得(不能在水溶液中!);或者在0℃和无水条件下,在乙醚中使三氯化硫与硫化氢反应而制得。
由于它很不稳定,故仅用其盐。
主要用作还原剂、定影剂和络合剂等。
对于初中生,只要求掌握盐酸、硝酸、硫酸的一些简单的化学性质,比如酸的通性:使紫色石蕊试液变红、能和碱生成盐和水、能和碱性氧化物生成盐和水。
几种常见的酸碱盐
几种常见的酸
总结、扩展
盐酸、稀硫酸、硝酸的性质对比
常见的碱、碱的通性氢氧化钠和氢氧化钙的比较
常见的盐小结:
酸、碱、盐化学性质汇总(列举出相关化学方程式)
一、酸的化学性质
1、酸与指示剂的反应
2、酸与活泼金属的反应
3、酸与碱性氧化物的反应
4、酸与碱的反应
5、酸与盐的反应
二、碱的化学性质
1、碱与指示剂的反应
2、碱与酸性氧化物的反应
3、碱与酸的反应
4、碱与盐反应
三、盐的化学性质
1、盐与金属的反应
2、盐与酸的反应
3、盐与碱的反应
4、盐与盐的反应。
盐酸和硫酸的性质比较

盐酸和硫酸的性质比较盐酸(HCl)和硫酸(H2SO4)是两种常见的无机酸,它们在化学实验室和工业生产中广泛应用。
尽管它们都是酸,但它们在性质上有一些明显的区别。
本文将比较盐酸和硫酸的性质,从而更好地了解它们的应用和特点。
一、化学结构盐酸的分子式为HCl,是一种单质化合物。
它由氢原子和氯原子组成,其中氯原子与氢原子形成共价键。
硫酸的分子式为H2SO4,是一种复合化合物。
它由氢原子、硫原子和氧原子组成,其中硫原子与氢原子形成离子键,氧原子与硫原子形成共价键。
二、物理性质1. 盐酸是一种无色无味的液体,有强烈刺激性气味。
它可以溶于水并迅速与水反应,放出大量热量。
2. 硫酸是一种无色至浅黄色的液体,有浓烈的刺激性气味。
它也可以溶于水,并且与水反应,释放出大量热量。
三、酸性1. 盐酸是一种强酸,可以完全解离成H+离子和Cl-离子。
溶液的pH值通常小于1,是一种较为浓烈的酸性溶液。
2. 硫酸也是一种强酸,可以完全解离成2H+离子和SO4^2-离子。
溶液的pH值通常小于1,也是一种较为浓烈的酸性溶液。
四、化学反应1. 盐酸与碱反应会产生盐和水,例如与氢氧化钠反应生成氯化钠和水。
反应示意为:HCl + NaOH -> NaCl + H2O。
2. 硫酸与碱反应也会产生盐和水,例如与氢氧化钠反应生成硫酸钠和水。
反应示意为:H2SO4 + 2NaOH -> Na2SO4 + 2H2O。
五、腐蚀性1. 盐酸具有较强的腐蚀性,能够腐蚀金属并与许多物质反应。
因此在使用和储存时需要格外小心。
2. 硫酸的腐蚀性更强,可以腐蚀许多有机物和无机物,包括金属。
与盐酸相比,硫酸在储存和使用时需要更加谨慎。
综上所述,盐酸和硫酸在化学结构、物理性质、酸性、化学反应以及腐蚀性等方面存在一些差异。
了解这些差异有助于我们更好地理解它们的特点和应用。
在实验室和工业上使用这两种酸时,必须谨慎操作,遵守安全操作规程,以免对身体和环境造成危害。
浓盐酸和浓硫酸在物理性质方面有哪

我探究:浓盐酸和浓硫酸的物理性质
浓盐酸
浓硫酸
溶质的化学式及质量分数 HCl 37%~38% H2SO4 98%
颜色
无色
无色
状态
液体Leabharlann 粘稠、油状液体气味 密度 打开瓶口的现象 其他
刺激性气味
无气味
1.18g/mL 有白雾 挥发性
1.84g/mL 无现象 吸水性 腐蚀性
氢气和水蒸气 的混合气体
代表水分子 代表氢分子
氢气
浓硫酸
浓硫酸可做某些气体的干燥剂
如果不慎将浓硫酸沾到皮肤上,
应立即用大量的水冲洗,然后涂3%∼5%的碳 酸氢钠溶液,以防灼伤皮肤。
浓硫酸溶于水,放出大量的热, 并且密度比水大。
猜想:如何用水稀释浓硫酸,为什么?
稀释浓硫酸
稀释浓硫酸的视频
物质的分类
纯净物
物质
混合物
单质 化合物
产生无色气体、放热
铁锈逐渐消失、溶液变为黄色
铁钉表面有气泡生成
产生无色气体
氯化铜溶液
无可见现象
如果把上述实验中的稀盐 酸换成稀硫酸,是否出现类似 的现象?原因呢?
会. 不同的酸溶液都含有H+
迁移应用
右图所示已平衡的天平
两端放着两个分别盛有
浓盐酸和浓硫酸的敞口
烧杯,过一段时间后,
天平会 ( B )。
实验探究
浓盐酸和浓硫酸在物理性 质方面有哪些异同?
酸的性质
认识浓盐酸和浓硫酸
浓盐酸 (37~38%) Hydrochloric acid
500ml (1.18g/mL) 化学式HCl 相对分子质量36.5 有腐蚀性!
符合 GB622-89
硫酸与盐酸的性质对比
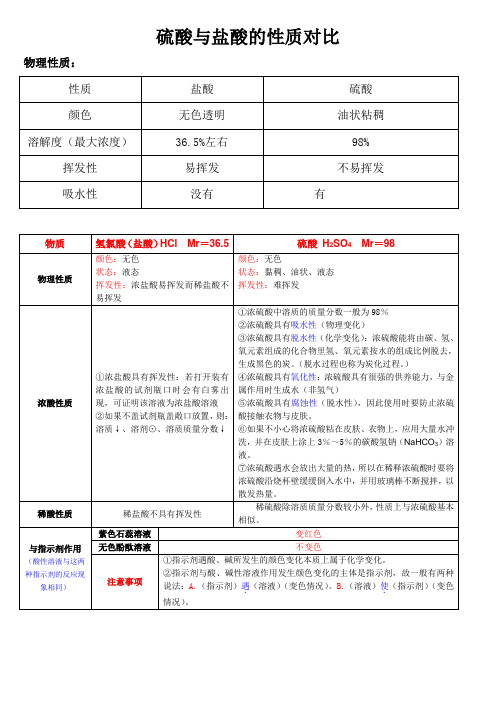
硫酸与盐酸的性质对比物理性质:42HCl化学性质:1.稀盐酸,稀硫酸具有酸的通性:①能和指示剂反应。
(使紫色石蕊试液变红,使酚酞不变色)②能和活泼金属反应(排在H前的金属,如铁,锌,镁,铝)对应训练1:实验室制取氢气,为什么一般选用锌和稀盐酸(或稀硫酸),而不用铁,也不用铝?③能和碱反应,生成盐和水。
(即中和反应)注意:生成盐和水的反应不一定都是中和反应。
例如:2NaOH+CO2 = Na2CO3+H2O④能和碱性氧化反应。
例如:CaO+2HCl = CaCl2+H2O⑤能和某些盐反应。
如:H2SO4+BaCl2 =BaSO4↓+2HCl(注意:该反应是复分解反应,反应物要可溶,生成物要有沉淀,气体或水,这三种物质中的其中一种)2.浓硫酸的浓度最高可达98%,所以此时浓硫酸具有它独特的性质。
①强氧化性。
②脱水性。
如何稀释浓硫酸?为什么不能将水倒入浓硫酸中?为什么要用玻璃棒不断搅拌呢?1.下列说法不正确的是()A.稀硫酸能和铁反应B.稀硫酸具有挥发性C.稀盐酸不能使酚酞试剂变红色D.浓盐酸放在空气中浓度会变低2.下列化学方程式书写正确的是()A. 2Fe +3 H2SO4 = Fe2(SO4)3 +3H2↑B. 2HCl + BaO =BaCl2 +H2OC. HCl + AgNO3 =AgCl +HNO3D.NaOH + CaCl2 =Ca(OH)2+ NaCl3.我们已经学过,实验室制取二氧化碳用石灰石和稀硫酸反应。
实验的反应方程式为:CaCO3+ 2HCl = CaCl2+ H20+ CO2↑请问:(1)能否用浓盐酸代替稀盐酸?————————————————————————————(2)请问稀硫酸能和石灰石反应吗?若能,写出化学方程式,若不能,请说明理由。
———————————————————(3)请问能用稀硫酸和石灰石制取二氧化碳吗?。
盐酸和硫酸的比较

盐酸和硫酸的比较盐酸(Hydrochloric acid)和硫酸(Sulfuric acid)作为常见的无机酸,在实际应用中具有广泛的用途。
本文将对盐酸和硫酸的性质、用途及其比较进行论述。
一、性质比较盐酸和硫酸都是无色透明液体,在常温下呈强酸性。
它们的酸性是由于溶解在水中后释放出H+(氢离子)所致。
1. 盐酸:盐酸的化学式为HCl,在水中充分离解,并释放出氯离子(Cl-)。
盐酸具有刺激性气味,可溶于水和一些有机溶剂。
它具有较强的酸性和腐蚀性,可以与金属反应生成相应的盐和释放出氢气。
2. 硫酸:硫酸的化学式为H2SO4,它是一种具有很强酸性的无机酸。
在水中可以完全解离,产生两个H+(氢离子)和一个SO4^-2(硫酸根离子)。
硫酸是一种无色的油状液体,具有高黏度和吸湿性。
二、用途比较1. 盐酸的用途:盐酸作为一种重要的化学原料和试剂,在许多领域具有广泛的用途。
它可用于金属表面的清洗、废水的中和处理、皮革加工、食品工业、医药行业以及矿物冶金方面的应用。
盐酸还可以被用作实验室中的试剂和酸碱滴定的指示剂。
2. 硫酸的用途:硫酸是一种常用的化工原料,在工业生产和实验室中被广泛使用。
它可以用于制造肥料、染料、炸药、合成橡胶、玻璃纤维等化学产品。
此外,硫酸还可用作蓄电池的电解液和金属表面的腐蚀防护。
三、盐酸与硫酸的比较1. 酸性强度:硫酸比盐酸酸性更强,这是因为硫酸的离子解离程度更高。
在酸解离常数的比较中,硫酸的酸解离常数高于盐酸。
2. 腐蚀性:硫酸的腐蚀性较盐酸更强。
硫酸具有强烈的腐蚀性,可以与许多金属发生反应,甚至可以溶解一些金属。
而盐酸的腐蚀性相对较弱,对大部分金属并不具有明显的腐蚀作用。
3. 用量和价格:由于硫酸的酸性更强,相对来说使用硫酸所需的用量会少于盐酸。
然而,硫酸的制备成本较高,所以在市场价格上通常会比盐酸更昂贵。
总结:综合来看,盐酸和硫酸都是重要的无机酸,具有广泛的应用。
盐酸在实际应用中主要用于清洗、中和、皮革加工等领域,而硫酸则更常用于肥料、染料、炸药等化工生产中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)碳酸钠溶液显碱性,能使无色酚酞溶液变红 (2)碳酸钠能与稀盐酸反应,生成CO2气体。 (3)碳酸钠溶液能与氢氧化钙溶液(石灰水)反应,生成CaCO3沉淀。
10、粗盐提纯 (1)需要的仪器有:______________________ (2)操作步骤有______、________、________。 (3)玻璃棒在每步操作中的用途_____________。 (4)经两次过滤后滤液仍浑浊的可能原因_________。
练习:设计实验证明鸡蛋壳里含有碳酸根离子。
6、用石灰石、水、纯碱为原料制取少量烧碱。
(写化学方程式并判断反应类型)(三个)
7、食盐作调味剂、消雪剂、碳酸钠生产洗涤剂、
碳酸氢钠焙制糕点、治疗胃酸过多、
碳酸钙用作补钙剂、大理石或石灰石用作建筑材料。
8、复分解反应发生的条件。
(背诵P109溶解性表并记住常见的沉淀)
CuO+H2SO4=CuSO4+H2O
现象:黑色固体逐渐 消失,溶液变为蓝色.
1.在稀释浓硫酸时,一定要把 浓硫酸沿器壁慢慢注入 水 里,并不断搅拌。若将水倒入浓硫酸里,硫酸液滴 会向四周飞溅,因为水的密度较小,浮在浓硫酸上 面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向 四周飞溅。
2.胃液中含有 盐酸 ,帮助消化。 盐酸和硫酸都可以用于 除锈 。 浓硫酸具有 吸水性 ,所以可用作某些气体的 干燥剂 。
取氢氧化钠溶液少量于试管中,滴加无色酚 酞试液,振荡,溶液变红;然后向试管中滴 加稀盐酸,边滴边振荡,至溶液恰好变成无 色,证明氢氧化钠溶液与稀盐酸能发生反应。
中和反应:酸和碱作用生成盐和水的反应
2NaOH + H2SO4 == Na2SO4 + 2H2O Ca(OH)2 + 2HCl == CaCl2 +2 H2O
(即工业制烧碱)
④盐与盐反应,生成 两种新盐。
如:Na2CO3 + CaCl2 ==== CaCO3 + 2NaCl
4、氢氧化钠变质的相关问题。
(1)变质原因
(2)设计实验证明氢氧化钠是否变质(三种方法)。
(3)若氢氧化钠部分变质,如何除杂。
5、CO32-的检验:
组成里含有 或
的盐都能与盐酸反应,生成CO2。
2Al+6HCl=2AlCl3+3H2↑
Mg+H2SO4=MgSO4+H2↑ Zn+H2SO4=ZnSO4+H2↑ Fe+H2SO4=FeSO4+H2↑
2Al+3H2SO4=Al2(SO4)3+3H2↑
与金属
氧化物 反应
Fe2O3+6HCl=2FeCl3+3H2O
现象:铁锈逐渐消失,
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 溶液变为黄色
盐酸、硫酸的性质比较
物理 性质
无色 刺激性 气味的液体,
有 挥发性 ,在空气中形 成 白雾 .
无色 无 味的液体, 有 吸水性,溶于水时放热。
与指示 1.都能使紫色石蕊试液变 红 色,使酚酞试液不变色.
剂反应
与活 Mg+2HCl=MgCl2+H2↑
泼金 Zn+2HCl=ZnCl2+H2↑
属反 应ห้องสมุดไป่ตู้
Fe+2HCl=FeCl2+H2↑
苛性钠 火碱 烧碱
熟石灰 消石灰
白色固体,易吸收水分而潮解, 易溶于水,溶于水时放热。
白色粉末状固体,不易 吸收水分,微溶于水
1.溶液都能使紫色石蕊试液变蓝色,使无色酚酞变红色。
2.都能与某些非金属氧化物反应。(4个化学方程式)
密封(在空气中不仅吸收水分,还 密封(在空气中能与CO2
会与CO2反应)
3、盐的化学性质:(写出相关的化学方程式)
①盐与金属反应,生成 新金属 和 新盐。
铁+硫酸铜; 铝+硫酸铜; 铜+硝酸银; 铁+硝酸银
②盐与酸反应,生成 新 盐和 新 酸。
碳酸钠+ 稀盐酸; 碳酸氢钠+ 稀盐酸; 碳酸钙 + 稀盐酸;
③盐与碱反应,生成 新 盐和 新 碱 。
碳酸钠 + 氢氧化钙===
举例说明中和反应在实际中的应用
1、在酸性土壤中加入熟石灰 2、硫酸厂的污水中含有硫酸等杂质,可以用熟石灰 进行中和处理。
Ca(OH)2 +H2SO4 == CaSO4 +2H2O 3、服用某些含有碱性物质的药物中和过多的胃酸。
AI(OH )3 +3HCl ==AlCl3 + 3H2O Mg(OH )2 +2HCl ==MgCl2 + 2H2O 4、被蚊虫叮咬后,涂一些含有 碱性物质的药水如氨 水 、牙膏、肥皂水等。
Ca(OH)2+CO2== CaCO3 ↓+ H2O 2、氢氧化钠溶液变质的原因?
2NaOH+CO2== Na2CO3 + H2O 3、如何除去有毒气体二氧化硫?
2NaOH+SO2== Na2SO3+ H2O
另:2NaOH+SO3== Na2SO4 + H2O
设计实验证明氢氧化钠溶液和稀盐酸能发生反应?
反应)
生活中除油污;实验室做干燥剂 (不能干燥CO2、SO2、HCl等气体)
做建筑材料
各取少量于试管中,分别通入CO2,变浑浊的是石灰水,无明
显现象的是NaOH溶液。
CaO + H2O = Ca(OH)2
1、检验二氧化碳的方法?
用石灰浆
砌砖抹墙很牢固?
盛石灰水的试剂瓶
用久后瓶内壁上有一层白色的膜?
11、化肥: (1)知道一些常见化肥的名称和作用: (2)铵态氮肥不能与碱性物质混合使用: (3)P81表格:利用物理、化学性质的不同初步区分常见化肥的方法。
书写下列化学方程式:
1、铁与稀盐酸反应: 2、用稀硫酸除铁锈: 3、氢氧化钠变质的原因: 4、检验氢氧化钠变质: 5、用氢氧化钠溶液吸收有害气体二氧化硫: 6、检验二氧化碳的反应: 7、除去氢氧化钠溶液中的碳酸钠: 8、实验室制取二氧化碳: 9、过氧化氢制氧气: 10、氢氧化铝治疗胃酸过多: 11、碳酸氢钠治疗胃酸过多: 12、铜与硝酸银反应:
盐酸、硫酸等酸有相似的化学性质,是因为:
不同的酸溶液都含有相同的H+
氢氧化钠、氢氧化钙等碱有相似的化学性质是因为:
不同的碱溶液都含有相同的OH-
复习提纲:
1、盐是自然界广泛存在的一类化合物,它们的组成里含有
。
2、食盐的主要成分是 ,碳酸钠俗称 ,碳酸氢钠俗称 ____,大理石、石灰石的主要成分是 。(并会写化学式)
1、溶液的酸碱度可用pH 表示, 测定溶液的pH最简便的方法是使用pH试纸。
酸性溶液的pH < 7,pH越小酸性越强。 碱性溶液的pH > 7,pH越大碱性越强。 中性溶液的pH = 7 2、在农业生产中,农作物一般适宜在pH为7
或接近7的土壤中生长;
3、正常雨水的pH约为5.6,因为溶解有二氧化碳。 酸雨的pH小于5.6。
