第 7 章 芳烃及非苯芳烃
有机化学第七章(多)
4 3 2 1
1
α-甲基萘 β-甲基萘 1-甲基萘 2-甲基萘
SO3H
5 4 NO2
SO3H 2 3
4 3 2 1 OH
CH3 5
4-甲基-1-萘磺酸 5-硝基-2-萘磺酸
5-甲基-1质: (1)性状:无色片状晶体,mp:80.2℃,bp:218 ℃,有特殊气味。 性状: 有特殊气味。 性状 无色片状晶体, ℃ 有特殊气味 (2)易升华,蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 易升华, 易升华 蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 萘的化学性质与苯相似,但由于离域的不太好, 萘的化学性质与苯相似,但由于离域的不太好,π电子云不是均匀 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 而且也较易进行加成和氧化反应。 而且也较易进行加成和氧化反应。 1.亲电取代反应 亲电取代反应 萘环上的π电子云不是均匀分布,据测定,它的α 萘环上的π电子云不是均匀分布,据测定,它的α位上电子云密度 最高, 位次之, 位最低, 最高,β位次之,γ位最低,所以萘的亲电取代反应一般发生在 特殊情况下也能在β位反应。 α位。特殊情况下也能在β位反应。
CH3
(2)原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时 位取代。 -位取代。如: NO
2
NO2
萘亲电取代的定位规律
但是,萘的亲电取代反应有的不遵循定位规律, 但是,萘的亲电取代反应有的不遵循定位规律,如:
H2 SO4 H2O
9,10-蒽醌和它的衍生物是蒽醌类染料的主要原料。 -蒽醌和它的衍生物是蒽醌类染料的主要原料。
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
有机化学第七章 芳烃

1
一、教学目的和要求 通过对本章的学习,掌握芳烃的定义、分类、苯的结构、 闭合共轭体系、芳香性及苯的同系物的命名,掌握苯环上 的亲电取代反应及定位规则,侧链卤代和氧化反应,掌握 萘的结构及命名,萘的亲电取代反应、氧化反应;熟悉休 克尔规则及非苯芳烃的芳香性判断;了解联苯、蒽、菲的 结构及命名以及苯及其同系物的主要物理性质(易燃性)。 二、教学重点内容 芳烃的结构、闭合共轭体系、命名、亲电取代反应及其定 位规律、侧链氧化、萘的结构、命名及亲电取代反应、非 苯芳烃芳香性的判断是本章的重点。
CH3 CH3 CH3
(1)单环芳烃
苯 甲苯 间二甲苯
(2)多环芳烃
连 苯 三
C H 苯 甲
烷
(3)稠环芳烃
萘 蒽 菲
4
5.1
芳烃的构造异构和命名
5.1.1 构造异构
苯及其同系物的通式为:CnH2n-6。 例如苯有六个碳和六个氢,其六个碳和六个氢是等同的; 结构异构: 一元取代:只有一种
CH3 CH CH2 H3C CH CH3
(a)
(b) (c) (d) (e)
卤化
硝化 磺化 Friedel-Crafts反应 氯甲基化
17
(1)亲电取代反应
(a) 卤化
苯环上和卤代反应较困难,常用FeX3(Lewis酸)作催化剂。
+ Cl2
FeCl3,25oC 90%
Cl + HCl
控制苯过量,不要太激烈,避免二卤代。 因是亲电反应,所以苯的同系物(甲苯)比苯更易反应。 Cl 卤代活性: F2>Cl2>Br2>ICH CH3 CH3 CH3 2。 3
14
5.3
单环芳烃的物理性质
有机化学章节习题参考答案(7-10)
(4)
习题 10-3.出分子式为 C5H10O 的醛和酮的同分异构体,并加以命名。 答案:
CHO
CHO
CHO
C2H5 H CH3
CHO
H C2H5 CH3
CHO
戊醛 二甲基丙醛
3-甲基丁醛
R-2-甲基丁醛 S-2-甲基丁醛 2,2-
习题 10-6.用化学方法区别下列各组化合物: 答案: (1)加 Tollens 试剂并加热,能产生银镜的为苯甲醛。 (2)加 Tollens 试剂并加热,能产生银镜的为己醛。 (3)加 I2/NaOH 溶液,能产生亮黄色固体的为 2-己酮。 (4)加饱和 NaHSO3 溶液,能产生固体的为丙酮。 (5)加 Na, 有气体产生的是 2-己醇。 (6)加 I2/NaOH 溶液,能产生亮黄色固体的为 1-苯基乙醇。 (7)加饱和 NaHSO3,能产生固体的为环己酮;剩下的各加入 Na,有气体产生的 为环己醇。 (8)加饱和 NaHSO3,能产生固体的为环己酮;剩下的各加入 I2/NaOH 溶液,能 产生亮黄色固体的为 2-己醇。
COOH
NO2 NHCOCH3
NO2 CH2CH3
CH2CH3
NO2
NO2
COOH
HNO3 H2SO4
COOH OH HNO3 H2SO4 O2N
COOH
HNO3 H2SO4
CH3
OCH3
H3CO
HNO3 H2SO4
NO2
COOH OH
COOH OH
COOH
NO2
NO2
CH3 OCH3
NO2
OCH3
(3) CH3CH2CH3 + MgBr(OC2H5) (4) CH3CH2CH3 + MgBr2 (5) CH3CH2CH3 + Br Mg (C C CH2 CH2 CH3)
chem-7多环芳烃和非苯芳烃

β
β
Br
β
β
αα
β-溴萘
Br
α-溴萘
-NH2 ,-OH ,-CHO, -SO3H, -COOH OH
SO3H
βቤተ መጻሕፍቲ ባይዱ萘磺酸
α-萘酚
2.二取代物
8 7
6 5
1 2
3 4
C2H5
C2H5 1,6-二乙基萘
CH3
SO3H
4-甲基-1-萘磺酸
OH SO3H
C2H5 5-乙基-2-萘磺酸
NO2 4-硝基-1-萘酚
(三)萘的化学性质
1.亲电取代反应
α
α β
E+
β
EH
EH
+
+ 其它不稳定共振结构
+
+E H + 其它不稳定共振结构
⑴卤化
Cl
+ Cl2
I2 苯
Br
+ Br2 CCl4
⑵硝化
HNO3/H2SO4
N O2
⑶磺化(可逆反应)
< 80℃
浓 H2SO4
165℃
SO3H
96%
SO3H
165℃ / H2SO4
斥力较大
H SO3H
85%
H
SO3H
H
斥力较小
⑷付氏酰基化反应
AlCl3 + CH3COCl
CS2 或 C2H2Cl4 -15℃
硝基苯 200℃
COCH3 93%
COCH3 90%
⑸一取代萘的定位效应
由于邻对位定位基的致活作用,取代发生在同环,并且第 二个基团进入这个定位基的邻对位中的α位。
CH3
有机化学第七章 芳烃

2-甲基-3-苯基戊烷 2-methyl-3-phenylpentane
烃链上含有多个苯环时,一般 把苯作取代基,烃作母体。
C H
三苯甲烷
2. 二烃基取代苯:有三种异构体,取代基的位置可以用 阿拉伯数字标出,或用邻、间、对(o-, m-, p-)表示。
CH3 CH3
CH 3 CH3
CH3
CH3
1, 2-二甲苯 1, 3-二甲苯 1, 4-二甲苯
O + N + O
H
E
⑤原子不具有完整的价电子层且带电荷的极限结构稳定性 差,对真实分子贡献小。 CH2=O-CH3 · ·
稳定 +
CH2-O-CH3
不稳定 碳不具有完整的价电子层
+
在共振式中,稳定的经典结构式越多,其杂化体越稳定。 4. 关于共振论应用的几点说明: ①共振论在有机化学上有重要的作用,能解释并预测一些 有机化合物的基本的化学性质; ②共振论是一种理论,共振式是理论上存在的,无法测得; ③共振论引入了一些人为规定,对某些化学现象尚不能给
苄基(Benzyl):甲苯的甲基上去掉一个H后的基团,用Bz 表示。
CH2
苯 Benzen 苯基 phenyl 苄基 benzyl ( phenyl methyl)
CH2Cl
苄氯(氯化苄) Benzyl chloride
三、芳香族化合物
1. 取代基若为硝基或卤素,应以苯环为母体来命名。
NO2
Br
共振能152kJ/mol 共振能12kJ/mol
(3)不同的极限式对共振杂化体的贡献大小不一样,能量 越低、越稳定的极限式的贡献越大。
+
贡献大 贡献小
(4)这些极限结构式均不是这一分子、离子或自由基的真 实结构,其真实结构为所有经典结构式的共振杂化体。
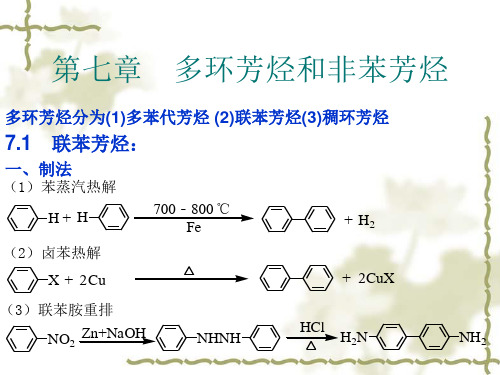
第7章、多环芳烃和非苯芳烃
Br2 FeBr3
高温
SO3H
H2SO4
有机化学 芳烃 19
蒽的化学性质
② 加氢 氢化时多在 9 、 10 位,这样氢化后形 成两个苯环,稳定性高。若在其它位置,则产物中 留下一个萘环,相比之下,萘环不如苯环稳定,所 以氢化亦多在9、10位加成。
Zn HCl
9,10-二氢蒽
③ 氧化 蒽比苯易氧化,发生在 位,生成 9,10-蒽醌,是重要的化工原料,其衍生物是许多 醌式染料的中间体。 O
有机化学
芳烃
常见的非苯芳香体系
碳原子数 电子数 离域键 (4n+2)n值
0
3 2
2 3
1
5 6
6 5
1
6 6
6 6
1
7 6
6 7
8 10 2
10 8
以上这些结构不具有苯的六员环结构,但却有与 苯相似的芳香性。
芳烃 26
有机化学
例:
该化合物由一个五员环和一个七员环 稠合而成。其外围有 10 个电子,经测 定,该化合物有偶极距(烃类,应无 偶极距或偶极距很小),但其=1.0D, 这说明分子中发生了电子偏移。 原因是,七员环中的一个电子转移到 五员环中,则两个环都有6个电子,符 合4n+2规则,则两部分都有芳香性, 使体系能量降低,分子稳定。该化合 物是一个芳香化合物,具有芳香性。
如:6,6’-二硝基-2,2’-联苯二甲酸的异构体
镜面
有机化学 芳烃 6
(6) 重要联苯衍生物——联苯胺(4,4’-二氨基联苯):
无色晶体; 熔点127℃ ; 是合成多种染料的中间体; 该化合物毒性大,且有致癌可能,近来很少用。
高教第二版(徐寿昌)有机化学课后习题答案第7章
第七章 多环芳烃和非苯芳烃一、 写出下列化合物的构造式。
1、α-萘磺酸 2、 β-萘胺 3、β-蒽醌磺酸SO 3HNH 2C C OO SO 3H4、9-溴菲5、三苯甲烷6、联苯胺BrCHNH 2二、 命名下列化合物。
1.2.C COO 3.SO 3HNO 24.CH 25.6.CH 3CH 3OHNO 2二苯甲烷 对联三苯 1,7-二甲基萘三、 推测下列各化合物发生一元硝化的主要产物。
SO 3HSO 3H1.HNO H 2SO 4O 2NSO 3HNO 2+2.CH 3H 2SO 4HNO CH 3NO 23.OCH 3H 2SO 4NO 2OCH 4.CNCNNO 23H 2SO 4NO 2CN四、 回答下列问题:1,环丁烯只在较低温度下才能生成,高于350K 即(如分子间发生双烯合成)转变为二聚体什么?写出二苯环丁烯三种异构体的构造式。
解:环丁二烯π-电子为四个,具有反芳香性,很不稳定,电子云不离域。
三种二苯基环丁二烯结构如下:PhPhPh PhPhPh2,1,3,5,7-环辛四烯能使高锰酸钾水溶液迅速褪色,和溴的四氯化碳溶液作用得到C 8H 8Br 8。
(a ),它具有什么样结构?3 3这两个共振结构式表示?解:不可以,因为1,3,5,7-辛环四烯不具有离域键,不能用共振结构式表示。
(c ),用金属钾和环辛四烯作用即得到一个稳定的化合物2K +C 8H 8(环辛四烯二负离子),这种盐的形成说明了什么?预期环辛四烯二负离子将具有怎样的结构?解:环辛四烯二负离子具有芳香性,热力学稳定,其结构为:五、 写出萘与下列化合物反应所生成的主要产物的构造式和名称。
1,CrO 3, CH 3COOH 2,O 2,V 2O 5 3, Na,C 2H 5OHOOC O COO1,4-萘醌 邻苯二甲酸酐 1,2-二氢萘 4,浓硫酸,800C 5,HNO 3,H 2SO 4 6,Br 2NO 2BrSO 3Hα-萘磺酸 α-硝基萘 1-溴萘 7,H 2,Pd-C 加热,加压8,浓硫酸,1650CSO 3H四氢萘 β-萘磺酸六、 用苯、甲苯、萘以及其它必要试剂合成下列化合物:1.CH 2CH 3Cl ,hvCH 2ClAlCl3CH 2ClCl 2FeCH 2Cl2.(C 6H 5)3CH CH 3Cl ,hvCHCl2AlCl 3(C 6H 5)3CH3.NO 2Br23H 2SO 424.NO 2SO 3HSO 3H NO 2SO 3HH 2SO 4165C3H 2SO 45.CC OCO O COAlCl 3O 2,V 2O 5450CC COOHO 97%H 2SO 4CC OO七、 写出下列化合物中那些具有芳香性? 解:1.2.3..4.+5.6.7.8.9.10.11.CH2=CHCH=CHCH=CH2。
第7章芳烃及非苯芳烃详解
— 3H2
7.3.2 石油的芳构化 2.烷烃脱氢环化和再脱氢
C H3 C H2 C H2 C H2 C H3 C H2
—H2
—3H2
3.环烷烃异构化和脱氢
C H3
异构化
—3H2
4.石油裂解生成的副产品也有一定量的芳烃。
7.4 单环芳烃的物理性质 单环芳烃不溶于水,而溶于汽油,乙醚和四氯化 碳等有机溶剂。 一般单环芳烃都比水轻。 沸点随相对分子量增高而升高。 对位异构体的熔点一般比邻位和间位异构体的高 (可能是由于对位异构体分子对称,晶格能较大之故)。 芳环骨架的伸缩振动表现在: 1625~1576 cm-1和 1525~1475 cm-1 处有两个吸收峰。 芳环的C-H伸缩振动在3100~3010 cm-1。 苯的取代物及其异构体在 900~650 cm-1处具有特 殊的C-H面外弯曲振动。
OH
OH
C O 2H
S O 3H
C H 2C H 3
S O 3H
对乙基苯酚
间羟基苯磺酸
邻磺基苯甲酸
芳基、苯基、苄基 芳基:芳烃分子的芳环上减去一个H后的基团, 用“Ar”表示。 苯基:苯分子上减去一个H后的基团,用“Ph” 表示。
苄基:甲苯的甲基上减去一个H。 7.3 单环芳烃的来源和制备 1845年-1940年期间 7.3.1 煤的干馏
C H3
C H3
邻二甲苯 (1,2-二甲苯)
间二甲苯 (1,3-二甲苯)
对二甲苯 (1,4-二甲苯)
三元取代物:用数字代表取代基的位置或用“连, 偏,均”字表示它们的位置。
C H3 C H3
C H3 C H3
C H3
C H3
H3C
C H3
1,2,3-三甲苯 (连三甲苯)
有机化学第7章,ppt
苯分子环状结构及π电子云分布图
共振论认为苯的结构是两个或多个经典结构 的共振杂化体:
共振能=极限结构的能量-杂化体的能量
苯的氢化热比假想的 1,3,5-环己三烯的低 150 kJ· -1,称作共振能或离域能,体现了苯的稳定性。 mol
7.2.3 分子轨道理论对苯结构的处理
苯的分子轨道模型
反键轨道
sp 2 杂 化
H E +E
+
sp 3 杂 化
E
π络合物
+
+
+ -H
E
+H
取代苯
+
亲电试剂
σ络合物
讨论:1.当过渡态
+H
E
+
比
H E+
+
稳定时,中间体 σ
H E+
络合物较难形成,一旦形成后很快转化成产物。
+H
2.当过渡态 + 比 + 能量相近时, σ 络合物能逆转回反应物,即反应可逆。
K
2K, T HF
K
=
=
2K+
0.1462nm
成环 C 不在同一平面 π 电子 = 8 不能形成环状共轭体系
无 芳 性
成环 C 在同一平面 π 电子 = 10 n = 2 环状闭合共轭体系
有芳 性
薁
7 6 5 4 3 8 1 2
天蓝色片状固体,熔点90° 含10个π 电子,成环C都在同一平面 是闭环共轭体系,有芳性
的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
沸点
b.p:与偶极矩有关: o- > m- , p蒸馏法分离出邻位异构体
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
§7.3 单环芳烃的来源和制法
§7.4 单环芳烃的物理性质
单 环 芳 烃 不 溶 于 水 , 比 重 小 于 1 , b.p 随 分 子 ↑ 而 ↑,… 对位异构体的熔点比邻、间位的高。对称性好,晶格 能大。 单环芳烃的IR谱图特征: ① νC-H :伸缩振动3100~3010cm-1; ② 1625~1576; 1525~1475cm -1处苯环骨架伸 缩振动; ③ 900~650cm-1处(指纹区)一系列γC-H面外弯曲 振动可提供苯环上的取代信息。 单环芳烃的1H NMR谱图特征:δ苯氢≈7.25
Br2 CCl4 CH3CH2CH CH2 KMnO4 H+
Br2 CCl4 苯 KMnO4 H+
Br CH3CH2CH CH Br CH3CH2COOH
FeX3 Br2
苯
取代产物
苯的不饱和度为4,这应该是一种高度不饱和的 结构。似乎应具有不饱和烃的相关反应特性 。 苯在结构上的不饱和性与其性质上的饱和 性发生了矛盾,苯究竟是一什么样的结构?
Cl2
+ FeCl3 H+ +
Cl + + [FeCl4]亲电试剂 FeCl4FeCl3 + HCl 再生
Cat :对应卤素的 FeX3 规律: 苯环上有 –X, -R 时,取代在邻,对位. 注 : CH3
+ Cl2 加热,or hυ 侧链α -H 卤代 or 过氧化物 (见后部分性质反应)
2 : 硝化反应 : 硝酰正离子 (硝基正离子) NO2+取代 苯环上氢 硝化剂 : 浓 HNO3: 浓 H2SO4 = 1 : 2 (混酸)
b.p. 152℃ K THF
+ +
K
K
环辛四烯双负离子
π电子数 = 10
符合4n+2
芳性
(二)环状共轭烯离子
1)环丙烯正离子
H
H
-HH
H
H
H
H 空轨道 H
H
H
环丙烯
该正离子中,碳碳键和苯环中碳碳键的键长十分接近。两个π电子呈 离域状态均匀分布在三个碳原子上的。从图可以看出,基态下两个π电子 正好填满一个成键轨道。可见,环丙烯正离子应该具有芳香性。
+ -
+ SO3
H SO3
(-H ) HSO4-
+
SO3
H3O+
SO3H + H2O
特点 : 去 H 再加 H ,每步反应可逆。 用途:①增加水中溶解度,用于有机物分离及复原 ②有机合成中利用-SO3H 在苯环上阻挡保护作用。 例 CH3 合成 CH3 Cl
4 : 付瑞迪尔-克拉佛兹反应 :Frieldel-Crafts ------付氏反映 : 烷基化, 酰基化 ⑴ 付氏烷基化 :苯环上引入烷基 烷基化试剂 : RX ,醇, 烯 Cat : AlCl3 (无水) > FeCl3 > ZnCl2 > H2SO4 = H3PO4 = HF = BF3
1 6 5 4
2 3
1 6 5 4 2 3
Kekulé 式中有单双键之分,但事实上键长一样.
四. 苯分子结构的近代概念
1. 价键理论(杂化)
苯是平面正六边形构 型 C:SP2杂化
苯分子中的键:C-H,C-C
H H
0.1 39 7n
H
m
120。 H H H
苯分子中12个原子共面,每个碳原子上有一个与σ平 面⊥的p轨道,相互之间以肩并肩重叠形成π66大π键。
+ H2SO4
磺化,80℃ 水解,180℃
SO3H + H2O
可逆反应
苯磺酸 (强酸,易溶于水、硫酸)
特点:可逆反应
SO3+ H2SO4 H + H2O H+
SO3H + H2O
σ络合物脱去H+和脱去SO3两步的活化能(E1和E2)相差不大,而且
它们的反应速度比较接近,因此无论是正反应还是逆反应都有可能
§7-5 苯的化学性质 一.亲电取代反应
① 第一步先生成中间体σ-络合物。决速步。
加成
亲电试剂首先进 攻 sp2
+ E+
快
E+ 络合物
慢
+
E H
sp3
-H+
E
sp2
络合物
芳正离子
H
②
E
E -H+ 快
恢复稳定苯环 SP --SP
3
2
两步能量变化曲线 (第一步活化能高)
1: 卤化反应 : F2 太猛烈,副产物多, I2 不易反应
能量曲线:正逆活化能相近,可逆, 指中间体:σ -络合物脱H+及脱 SO3两步
SO3H
+ H SO (发烟) 200~245℃ 2 4
SO3H 间苯二磺酸 SO3H
难 SO3H + HCl
+ ClSO3H
若 Cl SO3H 过量
SO2Cl + H2SO4 + HCl 苯磺酰氯 ----氯磺化反应
由以上讨论知:苯的结构很稳定,其π电子高度 离域,键长完全平均化。
或 强调离域 ! 离域 或 更符合习惯
苯分子结构的表示方法
(简) 3: 共振论解释 苯环结构除 Kehule 式 外,还有 杜瓦式: 均为根据价键理论画出的路易斯结构式. 1931~1933 年, Pauling 认为这些结构式的整体反映了 苯的结构式,称为共振式:
b
π电子数 = 10
符合4n+2
芳性
•芳性:具有稳定闭壳层电子构型的结构,能量远低于相 应的直链烯烃,独特的热力学稳定性,独特的反应性能
2):符合4n
a
环丁二烯
π电子数 = 4 符合4n
极不稳定的双自由基
——反芳性
半 填 满
b
环辛四烯
π电子数 = 8 符合4n
却是一个稳定的环状共轭化合物—非芳性
贡献:各占39% (能量低)
各占7.3%
小
IBM的科学家首次借助原子力显微镜拍摄了
单个并五苯分子的照片
分子结构模型示意图
归纳芳烃的共性:
结构: 环状闭合共轭体系, 较大的离域能
化学性质:环稳定,不易加成、氧化,易取代。
闭合环状体系、 有较大离域的化合物 一定有芳性?
当年芳香性引起了人们的极大的兴趣。 人们偿试着合成类似苯一样的闭环体系
三. 苯的三元取代物,位置异构
CH3 CH3 CH3 CH3 CH3 CH3 连三甲苯 1,2,3-三甲苯 偏三甲苯 1,2,4-三甲苯 均三甲苯 1,3,5-三甲苯 CH3 CH3
CH3
四. 苯环上连有大支链或官能团:苯环作取代基
CH CH3CH2CH-C-CH3 CH3
CH=CH2
CH2-CH-CH=CH-CH3 CH3 Ar 芳基 Ph 苯基 CH2 苄基
H 质子化硝酸
HONO2 H
H2O + NO2
H2O + H2SO4
H3O + HSO4-
总反应 HNO3 + 2H2SO4 1 :2 历程 + NO2 慢
NO2 + H3O + 2HSO4-
H NO2 -H+ σ -络合物
NO2
3: 磺化反应 : -SO3H 取代 H ,亲电试剂 : SO3 (非 –SO3H), SO3 为中性,因电负性差, S 带δ +,具亲电性. 磺化剂 : 浓 H2SO4 , 发烟 H2SO4, SO3/ CCl4, Cl SO3H
处于π66大π键中的π电子高度离域,电子云完全平均化, 在结构中并无单双键之分,是一个闭合的共轭体系。
H H H
H H H
π66是离域的大π键,体系稳定,能量低, 不易开环(即不易发生加成、氧化反应) 。
2.分子轨道理论(了解)
苯分子中电子云分布。像两个救生圈分布在苯分子 平面的上下侧 ,
苯的离域π分子轨道 :
π电子数 = 2
符合4n+2
芳性
人们已经合成出一些稳定的含有取代基的环丙烯正离子的盐
2)环戊二烯负离子
H H
SP3杂化 SP2杂化
+ (CH3)3COK
k+
(CH3)3COH
H H C
环戊二烯
环戊二烯负离子
π电子数 = 6
符合4n+2
芳性
3)环庚三烯正离子HFra bibliotekH + (C6H5)3C X
+
环庚三烯正离子 (卓正离子) π电子数 = 6
Cl + Cl2 Fe 或 FeCl3 55~60℃ + HCl
真正Cat :FeCl3, 常加 Fe + Cl2 CH3 Fe + Cl2 30℃ CH3 Cl + CH3 + HCl Cl 42%
58%
Cl + Cl2 Fe
Cl Cl +
Cl + HCl Cl
+ Br2
Fe,FeBr3
Br
催化历程:
环丁二烯
不稳定,没有芳香性!
环辛四烯
和烯烃一样活泼,无芳性
五:芳香性的判断 休克尔规则 (Hcickel) 1931年总结出芳香性两条件 (同时符合) ①成环碳在同一平面(或接近同平面),且成封 闭连续共轭体系。 ②环上π 电子数符合 4n+2 个 (n=0、1、2、3----) 注 :只适合单环共轭多烯烃,对多环不适合: 必 C=16,π =16 (不合 4n+2) 但有芳香性
+ 2ClSO3H
