GMP认证全套文件资料05-标签、小盒 、中盒、说明书质量标准
GMP认证全套文件资料053-00
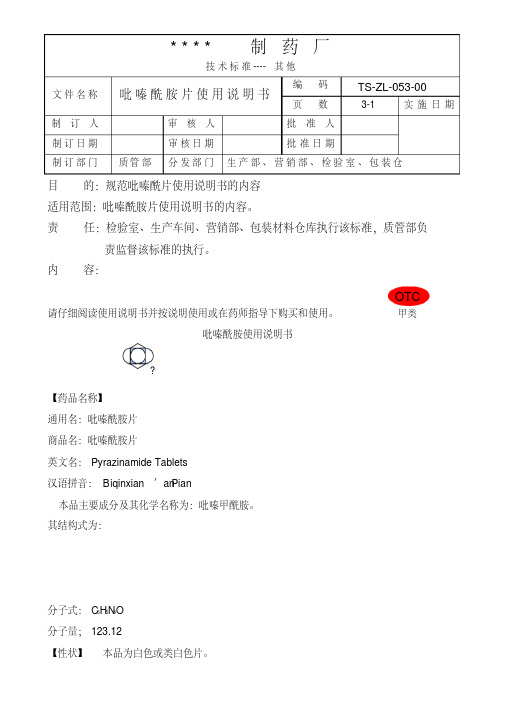
文件名称吡嗪酰胺片使用说明书编码TS-ZL-053-00页数3-1 实施日期制订人审核人批准人制订日期审核日期批准日期制订部门质管部分发部门生产部、营销部、检验室、包装仓目的:规范吡嗪酰片使用说明书的内容适用范围:吡嗪酰胺片使用说明书的内容。
责任:检验室、生产车间、营销部、包装材料仓库执行该标准,质管部负责监督该标准的执行。
内容:请仔细阅读使用说明书并按说明使用或在药师指导下购买和使用。
吡嗪酰胺使用说明书【药品名称】通用名:吡嗪酰胺片商品名:吡嗪酰胺片英文名:Pyrazinamide Tablets汉语拼音:Biqinxian’an Pian本品主要成分及其化学名称为:吡嗪甲酰胺。
其结构式为:分子式:C5H5N3O分子量;123.12【性状】本品为白色或类白色片。
OTC 甲类?文件名称吡嗪酰胺片使用说明书编码TS-ZL-053-00 页数3-2【药理】 1.药效学本品为烟酰胺的衍生物,具有抑菌或杀菌作用,取决于药物浓度和细菌敏感度。
本品仅在PH偏酸时(PH≤5.6)有抗菌活性。
2.药动学口服后在胃肠道内吸收迅速而完全。
广泛分布于全身组织和体液中,包括肝、肺、脑脊液,肾及胆汁;脑脊液内药浓度可达同期血浓度的87%~105%。
蛋白结合率约10%~20%。
口服2小时后血药浓度可达峰值,T1/2为9~10小时,肝、肾功能减退时可能延长。
主要在肝中代谢,水解成吡嗪酸,为具有抗菌活性的代谢物,继而羟化成为无活性的代谢物,经肾小球滤过排泄。
24小时内以代谢物排出70%,(其中吡嗪酸约33%)3%以原形排出。
血液透析4小时可减低吡嗪酰胺血浓度的55%,血中吡嗪酸减低50%~60%。
【适应症】与其他抗结核药(如链霉素、异烟肼、利福平及乙胺丁醇)联合用于治疗结核病。
本品仅对分枝杆菌有效。
【用法与用量】口服,成人常用量,与其他抗结核药联合,每日15~30mg/kg顿服,或50~70mg/kg,每周2~3次;每日服用者最高每日2g,每周3次者最高每次3g,每周服2次者最高每次4g。
GMP认证全套文件资料11-药品包装检查标准

藥品包裝檢查標準目的: 規範藥品包裝的質量監控。
適用範圍: 片劑、膠囊劑的藥品外觀及包裝檢查。
責任:質檢員、車間質量管理人員及包裝操作工人有責任正確實施本藥品包裝驗收標準。
規程:1.药品外观检查:1.1片剂的检验1.1.1外观检查:主要检查色泽、斑点、异物、麻面、吸潮、粘连、发霉、粘冲、边缘不整、缺角、松片、黑点等。
1.1.2检查方法:取100片平铺于白纸上,距25cm处检视,只看一面。
要求片形厚薄一致,片面光洁细腻,色均匀,无粘冲、无异物、无吸潮,不得有明显的暗斑。
边缘不整、缺角、松片不超过1%,80~100目杂点不超过3%。
1.2包衣片的验收:1.2.1包衣片包括糖衣片、肠溶片和薄膜衣片三种,外观检查主要有:色泽、黑点、斑点、异物、花斑、瘪片、异形片、龟裂、脱壳、珠头等。
1.2.2检查方法:取100片平铺于白纸上,距25cm处检视,只看一面。
包衣应完整、光亮、色均、无明显花斑、珠头、龟裂等不良品不超过1%,大于80目杂点不得有,80~100目杂点不超过2%。
1.3硬胶囊剂的验收:1.3.1外观检查:主要检查色泽、漏药、破裂、变形、粘连、异臭、霉变等。
1.3.2检查方法:取100粒胶囊,距25cm处检视,只看一面。
外观整洁,大小长短一致,带色的胶囊颜色应均匀一致,有光泽度,不得有褪色、变色现象,无斑点,无砂眼、破裂、漏药、附粉、变形、异臭、发霉等现象。
梅花、皱皮、缺角、瘪头、气泡等不超过1%。
2.包装检查:2.1装量检查:2.1.1瓶装:2.1.1.1小于100片(粒)装:抽检10个包装单位;判定标准:不得有误差。
如有1个包装单位误差±1片(粒),可进行加倍抽样复查,以复查结果为准,判定标准:同上。
2.1.1.2 100片(粒)装,抽检10个包装单位;如有2个包装单位出现误差±1片(粒),或有1个包装单位出现误差±2片(粒),可进行加倍抽样复查,以复查结果为准,判定标准:同上。
GMP认证检查现场必备的文件、记录、档案、图纸等资料

一、文件管理档案⑴现行文件目录;⑵一套完整的存档受控文件并按文件编码分类排列;⑶文件发放记录、关键文件会审记录(如:文件管理程序、变更管理、偏差管理、物料管理、供应商管理、产品召回、退货等涉及部门多和规定范围广的文件);⑷文件变更台帐和变更记录;⑸过时、作废文件回收、销毁记录(过时、作废文件原件加盖过时或作废印章并与现行文件原件分开存放,以便专家追溯)。
二、质量档案:按《质量档案管理程序》执行,包括各品种生产批件三、印刷包材档案⑴印刷包材药监部门批件;⑵供应商印刷前彩稿(或墨稿)的QA签字审核件;⑶ 标准样张:① 包材实样经QA签字的盖章件和分发记录(旧版本留档一份并有回收和销毁记录);② 现行包材实样的分发:QA、QC、采购、库房、车间各一份,作为采购、验收、检验、使用的标准;四、机构职责⑴公司组织机构图、质量管理机构图、各部门/车间的组织机构图;⑵GMP认证领导小组、自检小组、供应商审计评估小组、药品质量风险管理小组、药品召回领导小组、变更控制小组、偏差处理领导小组、验证委员会组成人员名单及公司批准证明文件;⑶各级机构职能、岗位职责;员工花名册,可再细分管理人员列表、质量管理人员列表、⑷技术人员列表;内容包括编号、岗位、姓名、性别、出生年月、学历、毕业院校、专业、从药年限、职称、入司时间、备注;五、人事健康档案⑴ 人事档案:① 个人简历(包括毕业院校、专业和工作经验、从药年限)、毕业证、职称证;② 中层以上干部的任免文件,总经理授权副总主管产品放行人员的授权委托书,取样等指定人员的专项培训记录和授权书;③ 关键岗位外部资格证:化验员、锅炉工、电工、计量员、中药购销(验收)员;④ 主管质量的企业负责人、质量部门负责人、生产部门负责人的备案表等;⑵ 健康档案:①员工健康卡、历年县级以上单位健康体检证明(体检表、健康证等);②体检结果异常处理情况证明、复岗体检合格证明③注意:包括整个生产质量系统(生产、质量、库房、采购、动力、机修、行政后勤),容易漏掉清洁工、临时工、机修、厨师等;生产质量系统每年至少体检一次,其他建议两年一次;六、培训档案⑴公司培训档案:①公司培训规划、每年度培训计划、培训实施情况(培训记录)及培训效果评估表;②每次培训签到表和培训教材(若为书本或文件可不收集) ;③培训空白考卷(考试可为培训一次考一次,也可为培训一阶段考核一次,但文件培训必须在其生效日期前完成)⑵ 个人培训档案① 员工培训卡、考核试卷或其他方式的培训效果评价记录;② 外出培训总结、证明;③ 培训合格上岗证明、不合格调整工作岗位记录;④ 每人一档,企业分层次对全员培训。
包装小、中盒质量标准

目的:制定小盒、中盒的质量标准。
适用范围:药品包装用的小盒、中盒。
责任:质检员、车间质量管理人员及包装操作工人有责任正确实施本标准。
标准:
1.纸盒表面平整、光滑、干净、无破损,无斑点,无雾化离层和受潮现象。
2.纸盒文字印刷清晰无误,商标及图案清晰美观。
3.文字、商标、图案的具体要求以质管部签定的样板为标准。
4.每批小盒、中盒颜色深浅几乎无区别,且与样板的色差无较大的差别。
5.尺寸规格与纸材要求见附表,长、宽、高尺寸偏差为±0.5mm。
6.包装规格以每扎100个(小盒)或50个(中盒)为标准,每扎数量与示数量相符。
7.根据批量多少,抽检每批小盒不少于300个,中盒不少于200个,合格率不得低于99.0%。
附表:
小盒、中盒的纸材和尺寸规格标准。
gmp质量管理体系文件

gmp质量管理体系文件
GMP质量管理体系文件是指符合GMP(Good Manufacturing Practice,良好生产规范)要求的质量管理体系文件。
以下为
可能包含在GMP质量管理体系文件中的内容:
1. 质量手册(Quality Manual):描述企业的质量管理体系的
范围、目标和政策,以及各个部门的职责和任务。
2. 程序文件(Procedures):详细描述实施质量管理活动的步
骤和方法,包括原料采购、生产过程控制、产品检验和审批等。
3. 工作指南(Work Instructions):指导员工在具体工作环节
中如何进行操作和记录,以保证产品质量和符合GMP要求。
4. 表格和记录(Forms and Records):用于记录各种操作和检
验的结果,以便后续的追溯和复查。
5. 核查表(Checklist):用于核查和审核质量管理体系的执行
情况,以确保各项要求得以满足。
6. 标准操作规程(Standard Operating Procedures,SOP):对
于特定的工作操作,制定详细的操作规程,包括步骤、要求、注意事项等。
7. 变更控制文件(Change Control):规定对于质量管理体系
文件的任何修订或变更都必须经过控制程序,并且需要记录和审核变更的原因和影响。
以上仅为一些常见的GMP质量管理体系文件,不同企业和行业可能根据实际情况有所不同。
企业根据自身的情况和GMP 要求制定适合自己的质量管理体系文件是十分重要的。
GMP认证全套文件资料5-×××片检验标准操作规程

目的: 规范吡嗪酰胺片检验的操作。
适用范围: 吡嗪酰胺片成品的检验。
责任:检验室检验人员对本规程的实施负责,检验室主任对本规程的有效执行承担监督检查责任。
程序:本品含吡嗪酰胺(C5H5N3O)应为标示量95.0-105.0% 。
1.性状:本品为白色片。
2.鉴别2.1仪器及用具:紫外分光光度计、水浴锅、电炉、蒸发皿、试管、量瓶、移液管、滤纸等。
2.2试剂及试液:乙醇、氢氧化钠试液、红色石蕊试纸、硫酸亚铁试液。
2.3测定法取本品的细粉适量(约相当于吡嗪酰胺0.2g)加乙醇20ml,微温,并振摇使吡嗪酰胺溶解,滤过,滤液蒸干,提取物进行以下的试验。
2.3.1 鉴别(1)取本品适量,置试管中,加氢氧化钠试液5ml,缓缓煮沸,即发生氨臭,能使湿润的红色石蕊试纸变蓝色。
2.3.2 鉴别(2)取本品0.1g,加水10ml溶解,加硫酸亚铁试液1ml,溶液显橙红色,加氢氧化钠试液使成碱性后,转变为蓝色。
2.3.3 鉴别(3)取本品加水制成每1ml中含10μg的溶液,照《紫外分光光度法标准操作规程》(SOP-QC-079-00)测定,在268nm的波长处有最大吸收。
3.检查3.1仪器及用具:紫外分光光度计、天平、溶出仪、取样注射器、取样针头、过滤器、滤膜、量瓶、移液管、试管、量筒、镊子等。
3.2试剂及试液 :蒸馏水 3.3测定法3.3.1溶出度:取本品,照《溶出度测定法标准操作规程》(SOP-QC-096-00),以水900ml 为溶剂,转速为每分钟50转,依法操作,经45分钟时,取溶液5ml ,滤过,精密量取滤液适量,用水稀释成每1ml 中约含10μg 的溶液,另取吡嗪酰胺对照品适量,用水稀释成每1ml 中约含10μg 的溶液,照《紫外分光光度法标准操作规程》(SOP-QC-079-00)试验,在268nm 波长处分别测定吸收度,按二者吸收度的比值计算出每片的溶出量,限度为标示量的75%,应符合规定。
结果计算:3.3.2其他:应符合片剂项下有关的各项规定(附录I A)。
[实用参考]药品GMP认证用的全套文件.doc
![[实用参考]药品GMP认证用的全套文件.doc](https://img.taocdn.com/s3/m/4631c355ba1aa8114531d93b.png)
1目的本厂对自行编制和有关“药品生产质量管理规范”文件实施编号管理规范,以明确文件的识别系统,以便正确编号和使用有明了。
2范围本文件适用于本厂自行编制的“药品生产质量管理规范”文件。
3责任所有承担“药品生产质量管理规范”文件编写的人员都必须按照本文的要求严格执行。
4定义4.1管理标准(制度):是在生产、经营管理过程中,为了行使管理职能,使管理过程标准化、规范化而制订管理制度的书面要求。
4.2操作标准:是以人的工作为对象,对工作范围、职责、权限、工作方法等内容和操作所制订的规定、标准的书面要求。
4.3技术标准:是指生产技术活动中,国家、地方、行业、企业颁布和制订的书面要求。
质量标准:是对产品的技术要求、试验方法、检验规则和标志、包装、运输和贮存的说明。
工艺规程:是对组织某种类产品生产基本条件及要求的描述。
4.4记录:是反映实际生产经营活动中执行标准情况结果的书面说明。
5内容5.1文件编号一般由文件种类代码、部门代码、分类代码、文件顺序号、文件版本顺序号组成。
5.2文件代码的设定5.2.1部门名文字代码英文字母代码办公室技术科质监科生产科设备科销售科固体制剂车间注射剂车间5.2.2文件种类代码管理标准操作标准技术标准记录记录表格标签、卡、凭证类账册5.2.3文件分类代码5.2.3.1管理标准分类、操作标准分类用两个阿拉伯数字组合而成人员01文件02设备03厂房生产物料质量卫生验证销售其它5.2.3.2技术标准分类用两个阿拉伯数字组合而成生产工艺规程质量标准其它标准5.2.3.3质量标准的细分类用一个阿拉伯数字表示成品原辅料包装材料中间产品5.2.3.4工艺规程、其它标准不设细分类,用一个阿拉伯数字0表示5.2.3.5记录表格种类记录表格分为生产记录、质量记录、其它记录。
其类别用两个阿拉伯数字组合而成生产记录细分为生产科仓库注射剂车间固体制剂车间其它质量记录细分为质量检验质量监控台综合质量管理其它记录不细分5.2.4文件顺序号的编排文件的顺序号以文件细分类(无细分类的按分类)类别编排顺序:一般文件顺序号用两位阿拉伯数字组成;记录文件顺序号用三位阿拉伯数字组成。
GMP认证全套文件资料056-×××胶囊使用说明书

目的:规范盐酸雷尼替丁标签文字内容及质量规格。
适用范围:盐酸雷尼替丁标签文字内容及质量规格
责任:检验室、生产车间、营销部、包装材料仓库执行该标准,质管部负责监督该标准的执行。
内容:
1.文字内容:
1.1药品名称:盐酸雷尼替丁胶囊
Ranitidine Hydrochloride Capsules
1.2规格:每料含盐酸雷尼替丁150mg×20粒(或30粒)
1.3贮藏:遮光、密封在干燥处保存。
1.
2.5标志:OTC
1.6批准文号:&卫药准字(1996)第7030号
1.7批号:
1.8生产日期:
1.9生产厂:&&&&制药厂
1.10注意:请仔细阅读使用说明书并按说明使用或药师指导下购买和使
用。
2.标签规格:
2.1尺寸:长64mm,宽42mm(20粒庄);长64mm宽31mm(30粒庄)
3.2颜色:白底、上下底边深绿色,注册商标印红色、药品名白色、规格
印绿色、其余印黑字。
2.3质量要求:符合标签验收细则的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
标签、小盒、中盒、说明书质量标准
目的:制定标签、小盒、中盒、说明书的质量标准。
适用范围:药品包装用的小盒、中盒、标签、使用说明书。
责任:质检员、车间质量管理人员及包装操作工人有责任正确实施本标准。
标准:
1.标签的质量标准。
1.1标签应干净、整洁、无污迹、无破损、变形。
1.2标签的文字、商标、图案印刷清晰无误。
(文字、商标、图案的具体要求以质量部鉴定的样板为标准。
)
1.3标签与小盒等包装物文字说明应一致。
1.4每批标签的颜色应几乎无区别,且与样板色差无较大的差别。
1.5标签的尺寸规格及纸材见附表,标签的长、宽尺寸偏差±0.5mm。
1.6包装规格以每扎1000张为标准,每扎数量只允许±7‰偏差。
1.7每批抽样,按包装材料取样规程,抽取包装材料,在充足光线下检查,应符合以
下要求。
标签缺陷分类及可接受的限度
2.小盒、中盒的质量标准。
2.1纸盒表面平整、光滑、干净、无破损,无斑点,无雾化离层和受潮现象。
2.2纸盒文字印刷清晰无误,商标及图案清晰美观。
2.3文字、商标、图案的具体要求以质管部签定的样板为标准。
2.4每批小盒、中盒颜色深浅几乎无区别,且与样板的色差无较大的差别。
2.5尺寸规格与纸材要求见附表,长、宽、高尺寸偏差为±0.5mm。
2.6包装规格以每扎100个(小盒)或50个(中盒)为标准,每扎数量与标示数量相符,合格率不得低于99.0%。
2.7按包装材料取样规程,抽取包装材料在充足的光线下检查以上抽出样品的外观及印刷质量应符合以下要求。
小盒缺陷分类及可接受的限度
中盒缺陷分类及可接受的限度
3.说明书的质量标准。
3.1说明书应干净、整洁、无污染、无破损。
3.2说明书的文字、商标、图案、结构式、分子式印刷清晰无误。
(文字、商标、图案的具体要求以质管部鉴定的样板为标准)
3.3说明书的文字与标签、小盒等包装材料的文字说明应一致。
3.4每批说明书颜色深浅一致,且与样板色差无较大的差别。
3.5尺寸的规格及纸材要求见附表。
3.6包装规格以每扎100张为标准,每扎数量只允许±7‰偏差。
3.7每批按包装材料抽样规定抽样检查,在充足的光线下目测,外观及印刷质量应符合以下要求。
使用说明书缺陷分类及可接受的限度
附表:
小盒、中盒的纸材和尺寸规格标准。
