吲哚乙酸氧化酶活性的测定
吲哚乙酸IAA检测方法及氧化酶活性的测定

吲哚乙酸IAA检测方法及氧化酶活性的测定吲哚乙酸IAA检测方法及氧化酶活性的测定一、原理1、吲哚乙酸产品概述:吲哚乙酸可占植物体内吲哚乙酸的50-90%,可能是生长素在植物组织中的一种储藏形式,它们经水解可以产生游离吲哚乙酸。
吲哚乙酸可刺激形成层细胞分裂;吲哚乙酸刺激枝的细胞伸长、抑制根细胞生长;促进木质部、韧皮部细胞分化,促进插条发根、调节愈伤组织的形态建成。
吲哚乙酸在器官和整株水平上,吲哚乙酸从幼苗到果实成熟都起作用。
吲哚乙酸控制幼苗中胚轴伸长的可逆性红光抑制;当吲哚乙酸转移至枝条下侧即产生枝条的向地性;当吲哚乙酸转移至枝条的背光侧即产生枝条的向光性;吲哚乙酸造成顶端优势;延缓叶片衰老;施于叶片的生长素抑制脱落,而施于离层近轴端的生长素促进脱落;吲哚乙酸促进开花,诱导单性果实的发育,延迟果实成熟。
2、试验原理:吲哚乙酸在吲哚乙酸氧化酶的作用下,被氧化破坏失去活性。
植物体内吲哚乙酸氧化酶活力的大小,对调节体内吲哚乙酸的水平,起着重要的作用,而影响植物的生长。
酶活力的大小可以其破坏吲哚乙酸的速度表示之。
吲哚乙酸的含量可用比色法测定。
二、准备仪器及药品T6新悦型分光光度计离心机恒温水浴锅天平研钵试管移液管烧杯20mmol/L磷酸缓冲液,pH6.0(见附表2)。
1mmol/L2,4—二氯酚:称取二氯酚16.3mg用蒸馏水配制成100ml。
1mmol/L氯化锰:称取MnCl?4HO 19.8mg用蒸馏水配制成100ml。
221mmol/L吲哚乙酸:称取IAA 17.5mg用少量乙醇溶解,然后将其倒于盛有约90ml蒸馏水的容量瓶中(100ml),稀释至刻度。
吲哚乙酸试剂A或B(任备其中之一):试剂A:15ml 0.5mol/L FeCl3,300ml浓硫酸(比重为1.84),500ml蒸馏水,使用前混合之即成,避光保存。
用时1ml样品中加入试剂4ml。
试剂B:10ml 0.5mol/L FeCl3,500ml 35%过氯酸,使用前混合之即成,避光保存。
吲哚乙酸氧化酶活性检测试剂盒说明书 微量法

吲哚乙酸氧化酶活性检测试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4105规格:100T/48S产品内容:提取液:液体60mL×1瓶,4℃保存。
试剂一:粉剂×1瓶,4℃保存。
临用前加入5mL蒸馏水备用。
试剂二:粉剂×1瓶,4℃保存。
临用前加入3mL蒸馏水备用。
试剂三:粉剂×1瓶,-20℃保存。
临用前加入5.71mL50%乙醇(乙醇(V):HO(V)=1:1)溶解备用。
2可以分装后-20℃保存,避免反复冻融。
试剂四:液体30mL×1瓶,4℃保存。
试剂五:粉剂×1瓶,4℃保存。
临用前加入15mL试剂四溶解。
O(V)标准品:粉剂×1支,-20℃保存,10mg吲哚乙酸。
临用前加入1.14mL50%乙醇(乙醇(V):H2=1:1)溶解制成50μmol/mL的标准溶液。
可分装后-20℃保存。
产品说明:吲哚乙酸(IAA)在吲哚乙酸氧化酶的作用下,被氧化破坏失去活性。
IAA氧化酶能调节植物体内吲哚乙酸的的水平,从而影响植物的生长。
作用生成红色产物,在530nm下有最大吸收峰。
酶活力的大小可用破坏IAA IAA在无机酸条件下与FeCl3的速率表示。
自备实验用品及仪器:可见分光光度计/酶标仪、低温离心机、水浴锅、可调式移液器、微量玻璃比色皿/96孔板、研钵/匀浆器、乙醇、冰和蒸馏水。
测定操作:1、样本处理:第1页,共3页(1)组织:称取约0.1g组织,加入1mL提取液进行冰浴匀浆。
12000g4℃离心15分钟,取上清,置冰上待测。
(2)细胞或微生物样品的制备:先收集细胞或微生物样品到离心管内,弃上清,按照每500万细胞或微生物加入1mL提取液,超声波破碎细菌或细胞(功率20%,超声3s,间隔10s,重复30次)。
12000g,4℃离心15min,取上清,置冰上待测。
2、操作步骤:(1)可见分光光度计/酶标仪预热30min,波长调至530nm。
套袋对梨幼果生长发育的影响

・
8 2・
山西师范大学学报 ( 自然科学版 ) 表 1 不 同时期果实过氧化物酶( O 的活性 ( O)0 mn・ g P D) A I7 i m ) 4/
T b T e a t i fP D n t e f i o e r a h i ee t i a .1 h ci t o O i h r t fp a t e d f rn me vy u t f t
参 照 黄群声 等 的改进 方法 .
2 结 果 与 分 析
2 1 套袋 对 果实 过氧化 物 酶 ( O 活性 的 影响 . P D)
以愈 创木 酚作 为过 氧化 物酶 的底 物 , 在有过 氧 化氢存 在 的条 件下 , 氧化 物 酶 能使 愈 创 木 酚 氧化 , 过 生 成茶褐色物质. 本实验采用比色法用分光光度计测量生成物 的含量. 测得过氧化物酶 的活性大小 , 以每分 钟 O D变 化值表 示 , A D mn・ 即 O / i g鲜重 . 结果 见表 1 . 三 次连 续跟 踪 测 定 的 结 果 表 明 ,0天 后 过 氧 化 物 酶 ( O 活 性 较 2 3 P D) 0天 后 增 强 , 袋 果 增 加 了 套 6 . % , 照 果增加 了 6 .% .0天后 过 氧化物 酶 ( O 的活性 较 3 04 对 36 4 P D) 0天后 减弱 , 套袋 果 减弱 了 1 .% , 74 对
指 标 的研 究 , 了解 套袋对 酥 梨果 实初 期生 长发 育 的影 响.
1 材料与方法
幼嫩 酥梨 果实 , 采于 临汾 市襄 汾县 的鄢 里村 , 实袋 为 单 层 塑 膜袋 , 果 于幼 果 出现期 ( 5月 6日) 在供 试
树上随机给单果套袋. 间隔一定天数 , 分别采样.
植物生理学实验讲义最新

实验一植物组织渗透势的测定(质壁分离法)一、实验目的植物细胞的渗透势主要取决于溶液的溶质浓度,因此又称溶质势。
渗透势与植物水分代谢、生长及抗性密切相关。
在干旱、盐渍等条件下,一些植物常在细胞内主动积累溶质,以降低其渗透势,增加吸水能力,在一定程度上保持膨压,保持细胞的生长和气孔的开放,这种现象称为渗透调节作用。
渗透调节能力的大小可以用逆境条件下细胞的渗透势的降低值来表示,在水分生理与抗性生理研究中经常需要测定。
掌握质壁分离法测定植物细胞渗透势的原理和方法。
二、实验原理当植物组织细胞内的汁液与其周围的某种溶液处于渗透平衡状态,植物细胞内的压力势为零时,细胞汁液的渗透势就等于该溶液的渗透势,该溶液的浓度称为等渗浓度。
当用一系列梯度浓度溶液观察细胞质壁分离时,细胞的等渗浓度将介于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离的浓度之间的溶液浓度。
带入公式即可计算出其渗透势。
三、实验材料、仪器设备和试剂1. 实验材料洋葱鳞茎(最好是紫色洋葱)2. 仪器设备光学显微镜、载玻片、盖玻片、镊子、刀片、干净的小培养皿、滴瓶、吸水纸。
3. 试剂(1)1 mol/L蔗糖溶液,(2)蔗糖系列标准液以1 mol/L蔗糖溶液作为母液,配置梯度溶液: 0.20、0.30、0.35、0.40、0.45、0.5、0.55、0.60、0.65、0.70 mol/L的蔗糖溶液。
四、实验步骤1. 取10套干燥洁净的小培养皿,编号,将配制好的不同浓度的蔗糖溶液按顺序倒入各个培养皿中使成一薄层,盖好皿盖。
2. 用刀片在洋葱鳞片外表皮或其它带有色素的组织表皮上纵横划成0.5cm2左右的小块,用镊子将表皮小块轻轻撕下,依次迅速投入各浓度蔗糖溶液中,每个培养皿中放材料3个左右,使其完全浸没,并立即盖好皿盖。
浸泡10~15分钟。
3. 从0.70 mol/L 蔗糖溶液开始依次取出表皮薄片放在滴有同样溶液的载玻片上,盖上载玻片,于显微镜下观察,如果所有细胞都产生质壁分离的现象,则取低浓度溶液中的表皮做制片,进行同样观察,并记录质壁分离的相对程度。
酶的测定

一、过氧化物酶(POD)活性测定(愈创木酚比色法测定)酶液的制取称取0.5g鲜重叶片,加入1ml磷酸缓冲液(PH=7.8,0.05mol/L),冰浴研磨,研磨后再加入4ml磷酸缓冲液。
将研磨液倒入离心管中,平衡。
12000r/min、0-4℃下离心20min,上清液即为酶提取液。
离心后冷藏保存。
POD: 取上清液20微升加入比色杯中(对照加20微升磷酸),加3ml反应液,马上读470nm 下的OD值并计时,每隔1min读一次(读0,1,2min的OD值)。
反应液:PH=6.0的磷酸缓冲液50ml,加入愈创木酚28微升,于磁力搅拌器上加热溶解,加入30%H2O219微升混合保存于冰箱中。
POD活性=ΔA470*V/(a*W)V-酶液总体积(ml);a-测定时酶液体积(ml);W-样品重(g)可溶性蛋白含量的测定取上清夜20微升(对照加20微升水),加3ml考马斯亮蓝,放置2min后,马上于595mn 下比色。
样品蛋白质含量(mg/g鲜重)=(C*V/a)/(W*1000)C-查标准曲线所得每管蛋白质含量(mg);V-提取液总体积(ml);a-测定所取提取液体积(ml);W-取样量(g)。
可溶性蛋白含量(ug):y=0.0061x-0.0359(R2=0.9563)二、多酚氧化酶(PPO)活性测定(比色法测定)PPO活性的测定参照李焕秀(1994)的方法进行改进。
一、原理:多酚氧化酶是一种含铜的氧化酶,能使一元酚和二元酚氧化生成醌。
多酚氧化酶活性可以用氧电极测量反应耗氧的速度,或用比色法测量产物的形成,常用的底物如邻苯二酚(儿茶酚)和多巴。
二、材料:树皮韧皮部(分别在压条育苗前期、愈伤组织形成期、根原基形成期和不定根生长期进行取样)三、仪器与用具:高速低温台式离心机;分光光度计;1mL 、5mL的移液管;5mL离心管;研钵;试管数支;10mL容量瓶;秒表;水浴锅;四、试剂:1、0.1mol·L-1,pH 6.0的磷酸柠檬酸缓冲液;2、1%(10g/L)的邻苯二酚(1g用蒸馏水定容至100 mL);3、0.1%(1/L)的脯氨酸(0.1g(0.05)用蒸馏水定容至100 mL(50));4、石英砂;五、方法步骤1、酶液提取取鲜样0. 5-1.0g, 加1 mL 磷酸柠檬酸缓冲液(0.1mol·L-1,pH 6.0),加少量石英砂,在冰浴中研磨成匀浆,加缓冲液9mL稀释(按100mg鲜重材料加1mL提取液的比例),使终体积为10mL(研完冰盘放回冰箱)。
酶活性测定方法

一、过氧化物酶(POD)活性的测定POD测定参照李合生等(2003)的愈创木酚法方法进行测定,略加改动。
测定:称取样品0.5g,加入5mL 1/15mol/L PH=7.0的磷酸缓冲溶液,冰浴研磨成匀浆,4℃条件下12000r/min离心15min,上清液为粗酶液。
然后在试管中加pH 7.0的磷酸缓冲液2 ml,愈创木酚(0.2%)0.5ml,浓度为0.15%的H2O2 0.5ml,取0.3ml的酶提取液加入到试管中,空白以缓冲液代替。
在470nm下测定其吸光度,加入酶液时开始计时,每隔30s读数一次,连续记录5分钟。
以每分钟每克鲜重增加0.1的酶量作为一个酶活性单位。
△470 ×V TPOD活性=0.01×t×Vs×W式中:△470----反应时间内吸光度值的变化;V T ----提取酶液的总体积(ml)t----反应的时间(min)Vs ----测定时取用酶液体积(ml)W----样品鲜重(g)二、多酚氧化酶(PPO)活性的测定多酚氧化酶活性测定参照朱广廉等(1990)的方法,略加改动。
酶液制备:称取样品0.5g,加入5mL 0.1mol/L PH=6.0的磷酸缓冲溶液,冰浴研磨成浆,4℃条件下12000r/min离心15min后上清液即为粗酶液。
PPO活性测定:反应试管中分别加入0.1 mL酶液+3.9 mL磷酸缓冲液+ 1 mL 1m mol/L的邻苯二酚。
混匀后于30℃保温10 min,迅速加入2 mL质量分数为20%的三氯乙酸终止反应,立即于525nm下测定其吸光度值,计算酶活。
PPO活性= O D×V T0.01×t×0.5g×V s= O D×V T0.005OD——反应时间内吸光值的变化;V T ----提取酶液的总体积(ml)Vs ----测定时取用酶液体积(ml)T———反应时间(min);三、吲哚乙酸氧化酶(IAAO)活性的测定参照张志良等(1990)人的方法并稍作改动。
吲哚乙酸氧化酶活性测定
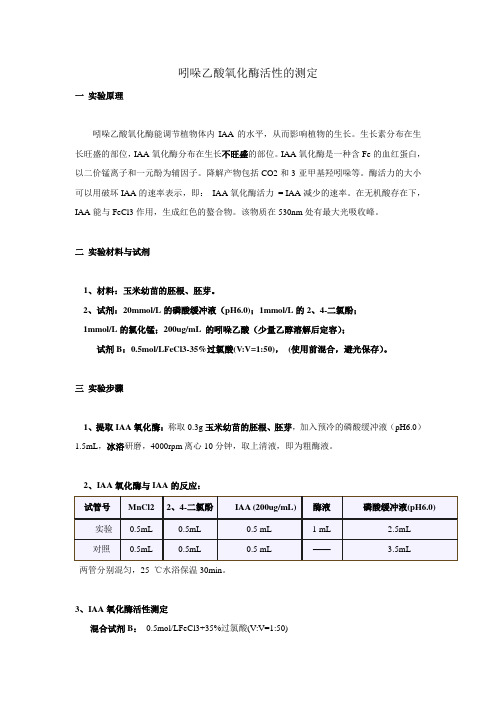
吲哚乙酸氧化酶活性的测定一实验原理吲哚乙酸氧化酶能调节植物体内IAA的水平,从而影响植物的生长。
生长素分布在生长旺盛的部位,IAA氧化酶分布在生长不旺盛的部位。
IAA氧化酶是一种含Fe的血红蛋白,以二价锰离子和一元酚为辅因子。
降解产物包括CO2和3-亚甲基羟吲哚等。
酶活力的大小可以用破坏IAA的速率表示,即:IAA氧化酶活力= IAA减少的速率。
在无机酸存在下,IAA能与FeCl3作用,生成红色的螯合物。
该物质在530nm处有最大光吸收峰。
二实验材料与试剂1、材料:玉米幼苗的胚根、胚芽。
2、试剂:20mmol/L的磷酸缓冲液(pH6.0);1mmol/L的2、4-二氯酚;1mmol/L的氯化锰;200ug/mL 的吲哚乙酸(少量乙醇溶解后定容);试剂B:0.5mol/LFeCl3-35%过氯酸(V:V=1:50),(使用前混合,避光保存)。
三实验步骤1、提取IAA氧化酶:称取0.3g玉米幼苗的胚根、胚芽,加入预冷的磷酸缓冲液(pH6.0)1.5mL,冰浴研磨,4000rpm离心10分钟,取上清液,即为粗酶液。
2、IAA氧化酶与IAA的反应:两管分别混匀,25 ℃水浴保温30min。
3、IAA氧化酶活性测定混合试剂B:0.5mol/LFeCl3+35%过氯酸(V:V=1:50)30min后另取2支试管,每支加入试剂B 4mL,再按表加入反应液或对照溶液各2mL 。
2支试管于40 ℃下保温30min,使反应液呈红色。
530nm处测OD值,分别记为OD实验、OD对照。
4、制作标准曲线:同时,配制IAA梯度浓度溶液各10mL另取7支试管,每支加入试剂B 2mL,再按表加入IAA的梯度浓度溶液各1mL 。
以0管溶液调零,分别测定530nm处吸光值。
5、结果计算:以0~6管的IAA浓度为横坐标,以相应的OD值为纵坐标,绘制标准曲线。
根据实验、对照管的OD值,在标准曲线上查出相应的IAA浓度。
IAA氧化酶活性(ugIAA/g FW.h) =(C对照-C实验)*V T*V/W.t.V1VT:酶液总体积(即上清液体积);V:步骤2所得反应液体积(即5ml);V1:反应所用酶液体积(即1ml)。
植物生理学实验指导

实验1 植物组织渗透势的测定(质壁分离法)原理当植物组织细胞内的汁液与其周围的某种溶液处于渗透平衡状态,植物细胞内的压力势为零时,细胞汁液的渗透势就等于该溶液的渗透势。
该溶液的浓度称为等渗浓度。
当用一系列梯度浓度溶液观察细胞质壁分离现象时,细胞的等渗浓度将介于刚刚引起初始质壁分离的浓度和尚不能引起质壁分离的浓度之间的深液浓度。
代入公式即可计算出春渗透势。
仪器药品显微镜载玻片及盖玻片镊子刀片配成0.5—0.1mol/L梯度浓度的蔗糖溶液各50ml。
称34.23g蔗糖用蒸馏水配成100ml,其浓度为1m0le/L(母液)。
再配制成下列各种浓度:0.50mol/L:吸母液25ml+水25ml0.45mol/L:吸母液22.5ml+水27.5ml0.40mol/L:吸母液20.0ml+水30.0ml0.35mol/L:吸母液17.5ml+水32.5ml0.30mol/L:吸母液15.0ml+水35.0ml0.25mol/L:吸母液12.5ml+水37.5ml0.20mol/L:吸母液10.0ml+水40.0ml0.15mol/L:吸母液7.5ml+水42.5ml0.10mol/L:吸母液5.0ml+水45.0ml操作步骤将带有色素的植物组织(叶片),一般选用有色素的洋葱鳞片的外表皮、紫鸭跖草、苔藓、红甘蓝或黑藻、丝状藻等水生植物,也可用蚕豆、玉米、小麦等作物叶的表皮。
撕取下表皮,迅速分别投入各种浓度的蔗糖溶液中,使其完全浸入,5—10分钟后,从0.5mol/L开始依次取出表皮薄片放在滴有同样溶液的载玻片上,盖上盖玻片,于低倍显微镜下观察,如果所有细胞都产生质壁分离的现象,则取低浓度溶液中的制片作同样观察,并记录质壁分离的相对程度。
实验中必须确定一个引起半数以上细胞原生质刚刚从细胞壁的角隅上分离的浓度,和不引起质壁分离的最高浓度。
在找到上述浓度极限时,用新的溶液和新鲜的叶片重复进行几次,直至有把握确定为止。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
结果总结
不同培养基对怀地黄愈伤组织生长情况的影响
培养基 接种数 (瓶*片) 瓶片
13*3
最早出愈 时间 (d) )
18
出愈率 (%) )
97.43
污染率 (%) )
7.69
愈伤生长 情况
切口处较多出 愈,黄色颗粒 状,偶见灰白 色愈伤 切口及与培养 基接触处生长 愈伤,黄色透 愈伤, 明,较湿润 切口及与培养 基接触处生长 愈伤,黄白色, 愈伤,黄白色, 湿润
简述IAA 氧化酶活力测定的原理。 简述IAA 氧化酶活力测定的原理。 制备酶液时,为何加入pH 制备酶液时,为何加入pH 6.1 的磷酸缓冲液。 的磷酸缓冲液。 酶促反应时,为何要加入MnCl 酶促反应时,为何要加入MnCl2和2,4-二氯酚。 二氯酚。 比色时,为何要选在530nm波长处 比色时,为何要选在530nm波长处? 波长处? 现有黄豆芽、绿豆芽两种材料, 现有黄豆芽、绿豆芽两种材料,测定黄豆芽的吸 光度值为A 绿豆芽的吸光度值为A 光度值为 A1, 绿豆芽的吸光度值为 A2, 且 A1>A2, 试比较这两种材料下胚轴中哪个IAA 氧化酶活力 试比较这两种材料下胚轴中哪个 IAA氧化酶活力 为什么? 大,为什么?
P144
实验目的
熟悉运用比色法测定吲哚乙酸 氧化酶活力的方法,并掌握测定酶 氧化酶活力的方法, 活力的基本要求。 活力的基本要求。
实验原理
吲哚乙酸在吲哚乙酸氧化酶的作用下, 吲哚乙酸在吲哚乙酸氧化酶的作用下,被氧 化破坏失去活力。 化破坏失去活力。植物体内吲哚乙酸氧化酶活力 的大小, 的大小,对调节体内吲哚乙酸的水平起着重要的 作用,从而影响植物的生长。 作用,从而影响植物的生长。 酶活力的大小可以其破坏吲哚乙酸的速度表 示。吲哚乙酸的含量可用比色法测定。 吲哚乙酸的含量可用比色法测定。 IAA +FeCl3
保温: ℃温箱中30min; 保温:30℃温箱中 ; 显色:三支试管中分别加入处理液、对照液、 显色:三支试管中分别加入处理液、对照液、 蒸馏水各2ml后,再分别加入试剂 蒸馏水各 后 再分别加入试剂A8ml,摇匀, ,摇匀, 40℃黑暗处 ℃黑暗处30min(15-20min); ; 用分光光度计在530nm波长处测 值; 波长处测A值 用分光光度计在 波长处测 查标准曲线; 查标准曲线; 计算 对照—处理 对照 处理(µg/ml) 处理 IAA氧化酶活力 = 氧化酶活力 时间(h) 时间 (µg·IAA/h·ml) × 10
→
红色螯合物
实验材料 绿豆芽的下胚轴 。
取 材 部 位
下 胚 轴
上胚轴:子叶到第 片真叶之间的部分 上胚轴 子叶到第1片真叶之间的部分 子叶到第 下胚轴:子叶与根之间的一部分 下胚轴 子叶与根之间的一部分
方法步骤
IAA氧化酶需要两个辅助因子: 氧化酶需要两个辅助因子: 氧化酶需要两个辅助因子 一元酚和二价离子 Mn
标准曲线的绘制。 标准曲线的绘制。 IAA含量的测定 含量的测定 称取1g下胚轴 置于研钵中, 下胚轴, ① 称取 下胚轴 , 置于研钵中 , 加入预冷的磷 酸缓冲液(pH=6.1)1ml, 研磨成匀浆 , 再用 酸缓冲液 , 研磨成匀浆, 再用9ml 分 2 次 冲 洗 , 总 体 积 为 10ml 。 离 心 4000rpm 10min,所得的上清夜即为粗酶液。 ,所得的上清夜即为粗酶液。 ②处理:在试管中加入:MnCl2 1ml +2,4-二 处理:在试管中加入: , 二 氯酚1ml + IAA 2 ml+酶液 ml+磷酸缓冲液 酶液1 磷酸缓冲液5ml 氯酚 酶液 磷酸缓冲液 对照:在试管中加入: 对照:在试管中加入:MnCl2 1 ml +2,4-二氯 二氯 磷酸缓冲液6ml 酚1ml + IAA 2 ml+ 磷酸缓冲液
13*3
出芽时间 (d)
20
平均叶 片数 (个/株) 株
2
增值系数
2
MS+NAA 0.02 +6-BA0.2 MS+NAA0.02 +6-BA0.5
12*3
15
4
4
14*3
10
5
5
MS+2,4-D1.0
MS+2,4-D1.0 +6-BA0.4 MS+2,4-D1.0 +6-BA1.0
12*3
17
100
0
12*3
16
100
0
结果总结
I型愈伤组织 型愈伤组织
Ⅱ型愈伤组织
Ⅲ型愈伤组织
不同培养基对怀地黄试管苗生长情况的影响
培养基 (mg/L)
MS+NAA 0.02
接种数 (瓶*株) 株
