第二节化学电源(新授)
4-2化学电源

单位质量或单位体积所能输出电能的多少, 即比能量的大小;输出功率的大小即比功率 的大小以及电池的存储时间的长短
3、目前化学电池主要分哪几大类?
普通干电池
一次电池 碱性锌锰电池 锌银纽扣电池
铅蓄电池
化学电池 二次电池
锌银蓄电池
锂离子电池
燃料电池 氢氧燃料电池
➢一碱性、锌一锰次电电池池
3、优缺点简析
缺点: 多数只能一次使用,不能充电;价格较贵 优点: 比能量和储存时间有所提高,适用于大电流 和连续放电
➢其它一次电池
锌银电池、锂电池……
锌银电池(纽扣电池)
电解质溶液为KOH浓溶液
负极:Zn +2OH- —2e- =ZnO+H2O 正极:Ag2O + H2O+ 2e- =2Ag+2OH- 总反应:
Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s 下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2s+H2Ol+2e=Mn2O3s+2OHaq C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过02 mol电子,锌的质量理论上减
小65 g
答案:C
三、燃料电池
伴随着向多媒体时代的迈进,笔记本电脑、移动无绳电话、摄 像机等便携电子产品的普及,使对锂离子电池的需求日益增加, 1999年锂离子电池全球需求量为4 02亿只,预计到2004年将达到 7.6亿只,平均每年将增长15%。锂离子电池的显著特点使其在其他 领域如电动汽车、空间技术、国防工业等方面展示了广阔的应用前 景和潜在的巨大经济效益
发表日期:2003年1月9日 出处:百科知识2002.02 已经有283位读者读过此 文 【编辑录入
课时6.2.2 化学电源-高一化学必修第二册(新教材人教版)
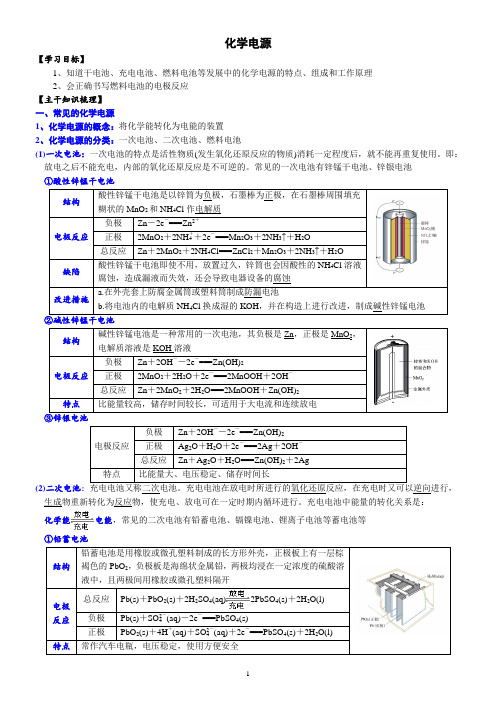
化学电源【学习目标】1、知道干电池、充电电池、燃料电池等发展中的化学电源的特点、组成和工作原理2、会正确书写燃料电池的电极反应【主干知识梳理】一、常见的化学电源1、化学电源的概念:将化学能转化为电能的装置2、化学电源的分类:一次电池、二次电池、燃料电池(1)一次电池:一次电池的特点是活性物质(发生氧化还原反应的物质)消耗一定程度后,就不能再重复使用。
即:放电之后不能充电,内部的氧化还原反应是不可逆的。
常见的一次电池有锌锰干电池、锌银电池①酸性锌锰干电池结构酸性锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质电极反应负极Zn-2e-===Zn2+正极2MnO2+2NH+4+2e-===Mn2O3+2NH3↑+H2O总反应Zn+2MnO2+2NH4Cl===ZnCl2+Mn2O3+2NH3↑+H2O缺陷酸性锌锰干电池即使不用,放置过久,锌筒也会因酸性的NH4Cl溶液腐蚀,造成漏液而失效,还会导致电器设备的腐蚀改进措施a.在外壳套上防腐金属筒或塑料筒制成防漏电池b.将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池②碱性锌锰干电池结构碱性锌锰电池是一种常用的一次电池,其负极是Zn,正极是MnO2,电解质溶液是KOH溶液电极反应负极Zn+2OH--2e-===Zn(OH)2正极2MnO2+2H2O+2e-===2MnOOH+2OH-总反应Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2特点比能量较高,储存时间较长,可适用于大电流和连续放电③锌银电池电极反应负极Zn+2OH--2e-===Zn(OH)2正极Ag2O+H2O+2e-===2Ag+2OH-总反应Zn+Ag2O+H2O===Zn(OH)2+2Ag特点比能量大、电压稳定、储存时间长(2)二次电池:充电电池又称二次电池。
充电电池在放电时所进行的氧化还原反应,在充电时又可以逆向进行,生成物重新转化为反应物,使充电、放电可在一定时期内循环进行。
人教版化学选修四二节《化学电源》PPT课件

工作原理
铅与二氧化铅在硫酸溶 液中发生氧化还原反应
优点
电压稳定、容量大、使 用寿命长
应用
汽车、摩托车启动电源 ,不间断电源等
锂离子电池
构造
碳材料(负极)、金属氧化物(正极)、锂 盐有机溶液(电解质)
优点
能量密度高、自放电小、无记忆效应
工作原理
锂离子在正极和负极之间嵌入和脱出产生电 流
应用
手机、笔记本电脑、数码相机等
环保与节能
相比传统能源,化学电源具有更高 的能量密度和更少的污染排放,有 助于实现环保和节能目标。
化学电源技术的发展趋势与挑战
发展趋势
化学电源技术正朝着高能量密度 、长循环寿命、快速充电和低成
本的方向发展。
技术挑战
当前化学电源技术仍面临安全性 、稳定性、寿命和成本等方面的 挑战,需要不断进行技术创新和
内阻与极化
内阻
电源内部的电阻,包括电解质、电极 和隔膜等部分的电阻。内阻大小直接 影响电源的输出电压和电流。
极化
电极在电流通过时发生偏离平衡电位 的现象。极化会导致电源输出电压降 低,效率下降。
容量与比能量
容量
表示电源在一定条件下可以输出的电量,通常用安时(Ah)或毫安时(mAh)作为 单位。
比能量
THANKS
感谢观看
燃料电池
构造
阳极、阴极、电解质
工作原理
燃料在阳极氧化,氧化剂在阴极还原,电 子从阳极通过负载流向阴极构成电路
优点
能量转换效04 化学电源的性能 参数与评价指标
电压与电动势
电压
表示电源正负极之间的电势差, 通常用伏特(V)作为单位。
电动势
表示电源内部非静电力将正电荷 从负极移到正极所做的功,也反 映了电源将其他形式的能转化为 电能的本领。
第二节 化学电源

2、目前化学电池主要分哪几大类?
一次电池: 电池中的反应物质 普通干电池
进行一次氧化还原反应并放电 碱性锌锰电池
之后,就不能再次利用。
锌银纽扣电池
化 学
二次电池: 又称充电电池或蓄
铅蓄电池
电 电池。放电后经充电可使电 锌银蓄电池
池 池中的活性物质获得再生, 镍镉电池
• 电池总反应: Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2
普通锌锰电池
锌筒
石墨棒 NH4Cl、ZnCl2 和 H2O等 MnO2和C
普通锌锰干电池的结构
2、碱性锌锰电池:(-) Zn│KOH│MnO2 (+) 负极(Zn):Zn + 2OH- - 2e- = Zn(OH)2 正极(MnO2):2MnO2+2H2O+2e- = 2MnOOH+2OH电池总反应:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2
2、燃料电池的特点
①燃料从负极通入,助燃剂氧气从正极通入。 ②电极材料一般不参加化学反应,只起传导电子的作用。
3、燃料电池与前几种电池的差别:
①氧化剂与还原剂在工作时不断补充; ②反应产物不断排出; ③能量转化率高(超过80%),普通的只有30%,有利
于节约能源。 缺点:附属设备较多、体积较大、 优点:能量转换率高、运行噪音低,清洁。
第二节 化学电源
[学与问]在日常生活和学习中,你用过哪 些电池,你知道电池的其它应用吗?
化学电池 将化学能转换成电能的装置
电池
太阳能电池 将太阳能转换成电能的装置
2019高中化学第四章第二节化学电源课件新人教版选修

铅蓄电池 (1)构造
[新知探究]
(2)组成 正极: PbO2 ;负极: Pb ;电解质: H2SO4 。
(3)工作原理 铅蓄电池是最常见的二次电池,其电极反应分为放电和 充电两个过程。 ①放电过程: 负极:Pb+SO24--2e-===PbSO4(氧化反应); 正极:PbO2+4H++SO24-+2e-===PbSO4+2H2O(还原 反应); 总反应:Pb+PbO2+2H2SO4===2PbSO4+2H2O。
[解析] 由所给的电池总反应式可知,电池工作 时,每有 1 mol Zn 参加反应,则会有 2 mol 电子从负 极 Zn 经外电路流向正极,并在正极发生反应:2MnO2(s) +H2O(l)+2e-===Mn2O3(s)+2OH-(aq)。外电路每通 过 0.2 mol 电子,Zn 的质量就减少 6.5 g。
[对点演练] 3.将两个铂电极放置在 KOH 溶液中,然后分别向两极通入 CH4 和 O2,即可产生电流。下列叙述正确的是( ) ①通入 CH4 的电极为正极 ②正极的电极反应式为 O2+2H2O+4e-===4OH- ③通入 CH4 的电极反应式为 CH4+2O2+4e-===CO2+2H2O ④负极的电极反应式为 CH4+10OH--8e-===CO23-+7H2O ⑤放电时溶液中的阳离子向负极移动 ⑥放电时溶液中的阴离子向负极移动 A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
O2+4e-+4H+===2H2O O2+4e-+2H2O===4OH-
2H2+O2===2H2O
2.燃料电池的优点 (1)能量转换率高:燃料电池的能量转换率超过 80%,普通 燃烧过程能量转换率仅 30%多。 (2)污染小,被誉为“绿色”发电站。
[名师点拨] 燃料电池电极反应的书写 (1)明确燃料电池的正负极均为惰性电极,一般具有很强的 催化活性,但不参与反应。 (2)正极反应的书写 正极发生还原反应,通入的气体一般是氧气,氧气得到电 子首先变为氧离子,即 O2+4e-===2O2-,根据电解质的不同, 其正极反应的书写分以下几种情况: ①在酸性溶液中,生成的 O2-与 H+结合生成水,其电极反 应为 O2+4e-+4H+===2H2O;
高中化学第四章第二节化学电源课件新人教版选修

电化学反应中的电子转移和离 子迁移
探索电化学反应中电子转移和离子迁移的原理 和机制。
原理和构造
燃料电池的原理和构造
详细介绍燃料电池的基本原理和复杂的结构,并 解释其工作原理。
可充电电池的原理和构造
解释可充电电池的运作原理,讨论其构造和设计 上的特点。
化学电源的分类
按照电反应类型分类
探索化学电源如何根据不同的电反应类型进行 分类和组织。
按照构造特点分类
介绍化学电源的另一种分类方式,以其构造特 点来进行分类。
化学电源的应用
1
汽车起动电源
分析化学电源在汽车起动系统中的应用,以及其在提供可靠电力方面的优势。
2
通讯电源
讨论化学电源在通讯设备和系统中的广泛应用,以及其长期供电的特点。
3
非晶材料的制备
阐述化学电源在非晶材料的制备过程中的重要作用和贡献。
结束语
1 总结
概述化学电源的重要性和应用范围,对本课程的内容进行总结。
2 展望未来的研究方向
提出未来研究的方向和可能的创新点,鼓励学生投身于件新人教版选修
化学电源是高中化学第四章第二节的核心内容,本课件将深入探讨化学电源 的基本概念、原理和应用,展望未来的研究方向。
引言
电源的定义
介绍什么是电源,它在化学中的角色和重要性。
化学电源的作用
探讨化学电源在不同领域和应用中的作用和价值。
电化学基础
电化学反应基本概念
第4章 第2节化学电源
如果题目给定的是总反应式,可分析此反应中的氧化反应或还 原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情 况去写电极反应式,另一极的电极反应式可用总反应式减去已写出 的电极反应式得出。 以 2H2+O2 2H2O 为例,当电解质溶液为 KOH
溶液时的电极反应式的书写步骤如下: (1)根据总反应方程式分析有关元素化合价的变化情况,确定 2 mol H2 失去 4 mol 电子,初步确定负极反应式为 2H2-4e4H+。
5.用 NO 生产硝酸,可以有效消除污染,其 工作原理如图所示。下列说法正确的是 ( D )。 A.a 极是该电池的正极 B.电流经导线由 a 极流向 b 极 C.b 极发生氧化反应 D.a 极的电极反应式为 NO+2H2O-3eNO3 +4H+
6.某种燃料电池的负极反应式为 S + 4H2O - 8e 通过,下列有关该电池的说法中正确的是( B.质子由正极移向负极 C.该电池的总反应式为 S +2O2
电源是能够实际应用的原电池,作为化学电源的电池有一次电池、 可充电电池和燃料电池等。一次电池只能放电不能充电,使用后即 弃去,因此可能造成环境污染。可充电电池也称为二次电池,可以反 复充电和放电,是电池发展的一个重要方向。
1.了解几种常见化学电源(一次电池、二次电池、燃料电池)的工 作原理。 2.正确书写有关电池的电极反应式和电池总反应。 3.了解化学电源的广泛应用及废旧电池的危害。
c.工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物
,酸性电解质。 2H ; ; 。
+
①一次
②二次
③燃料
④较高
⑤多
⑥大
⑦长
山西省运城市康杰中学高二化学新人教版选修4第四章第二节 化学电源 教案
其次节化学电源一、教材分析通过以前章节的学习,同学已经把握了能量守恒定律、化学反应的限度、化学反应进行的方向和化学反应的自发性、以及原电池的原理等理论学问,为本节的学习做好了充分的理论学问预备。
化学电池是依据原电池原理开发的具有很强的有用性,和宽敞的应用范围的技术产品。
本节的教学是理论学问在实践中的延长和拓展,将抽象的理论和同学在日常生活中积累的感性体验联系起来,挂念同学进一步的深化生疏化学电池。
现代科技的飞速进展也带动了电池工业的进步,各种新型的电池层出不穷。
教材选取具有代表性的三大类电池,如生活中最常用的一次电池(碱性锌锰电池)、二次电池(铅蓄电池)、和在将来有着奇特应用前景燃料电池。
简介了电池的基本构造,工作原理,性能和适用范围。
同时向同学渗透绿色环保的意识。
二、教学目标1.学问目标:(1)知道日常生活中常用的化学电源和新型化学电池;(2)生疏一次电池、二次电池、燃料电池等几类化学电池;(3) 会书写常用化学电池的电极反应式及总反应式。
2.力量目标:培育同学观看、分析、整理、归纳总结、探究等力量。
3.情感、态度和价值观目标:感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,初步形成较为客观、正确的能源观,增加同学的环保意识。
三、教学重点难点重点:化学电源的结构及电极反应的书写难点:化学电源的结构及电极反应的书写四、学情分析在化学2中同学已学习了氧化还原反应的初步学问,前一节又已经学过原电池的基本内容,知道原电池的定义,形成条件,简洁得电极反应等,所以在此基础上,进一步学习化学电源的学问。
同学能通过对试验现象的观看、有关数据的分析和得出相关结论,具有肯定的观看力量、试验力量和思维力量。
五、教学方法1.试验探究与启发争辩法。
2.学案导学:见后面的学案。
3.新授课教学基本环节:预习检查、总结怀疑→情境导入、呈现目标→合作探究、精讲点拨→反思总结、当堂检测→发导学案、布置预习六、课前预备1.同学的学习预备:初步把握试验的原理和方法步骤。
第四章第二节化学电源PPT30张
在总反应式中锌元素化合价升高,失
学习·探究区
第二节
还原反应
Ag2O+H2O+2e-===2Ag+2OH-
本课时栏目开关
学习·探究区 硫酸溶液
第二节
Pb
Pห้องสมุดไป่ตู้O2
本课时栏目开关
Pb(s)+SO (aq)-2e-===PbSO4(s)
PbO2(s)+4H+(aq)+SO (aq)+2e-===PbSO4(s) +2H2O(l)
3O2+6H2O+12e-===12OH-
2CH3OH+3O2+4OH-===2CO +6H2O
本课时栏目开关
学习·探究区
第二节
本课时栏目开关
学习·探究区
第二节
本课时栏目开关
学习·探究区
第二节
本课时栏目开关
学习·探究区 答案 C
第二节
本课时栏目开关
学习·探究区
第二节 D
本课时栏目开关
学习·探究区
锌与稀硫酸反应时,加入少量CuSO4,Cu2+ 被锌置换出来,生成的单质Cu附着在锌的表面,此时会发生 原电池反应,锌为负极,使反应速率加快
本课时栏目开关
c>a>b
学习·探究区
化学能变成电能
第二节
本课时栏目开关
锂电池 干电池
叠层电池
学习·探究区
第二节
本课时栏目开关
放完电以后不能再使用
普通锌锰电池、 碱性锌锰电池
第二节
本课时栏目开关
学习·探究区 答案 C
第二节
本课时栏目开关
学习·探究区
第二节
本课时栏目开关
自我·检测区
第二节
本课时栏目开关
自我·检测区 答案 C
2022版高中化学第四章第二节化学电源课件新人教版选修
C.充电时,电解质溶液中Li+向多孔碳材料区迁移
√D.充电时,电池总反应为Li2O2-x
===2Li++(1-
x 2
)O2
4.(2019·全国卷Ⅰ)利用生物燃料电池原理研究室温下氨的合 成,电池工作时 MV2+/MV+在电极与酶之间传递电子,示意图如下 所示。下列说法错误的是( )
√A.相比现有工业合成氨,该方法条件温和,同时还可提供电能 B.阴极区,在氢化酶作用下发生反应 H2+2MV2+ 2H++2MV+ C.正极区,固氮酶为催化剂,N2 发生还原反应生成 NH3 D.电池工作时质子通过交换膜由负极区向正极区移动
一次电池
锌银电池
化 学
锂电池
电 二次电池 铅蓄电池
源
燃料电池 氢氧燃料电池
构造 工作原理
特点
1.下列有关锌锰干电池的说法中正确的是
√A.锌外壳是负极,石墨碳棒是正极材料
B. 在外电路中电子从碳棒流向锌外壳
C.电流从锌流到碳棒上
D. 在电池内部阳离子从碳棒向锌片移动
2.燃料电池的基本组成为电极、电解质、燃料和氧 化剂。此种电池的能量利用率可高达80%,产物污染 也少。下列有关燃料电池的说法错误的是 A.氢氧燃料电池的电解质用KOH溶液时,其负极电 极反应为:2H2-4e-+4OH-===4H2O B.碱性甲烷燃料电池的正极反应为: O2+2H2O+4e-=4OH-
燃料电池的规律
燃料电池
(1)燃料作负极,助燃剂氧气为正极。 (2)电极材料一般不参加化学反应,只起传导电子
的作用。
燃料电池与前几种电池的差别: (1)氧化剂与还原剂在工作时不断补充; (2)反应产物不断排出; (3)能量转化率高(超过80%),普通燃烧过程能 量转换率只有30%,有利于节约能源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
总反 应
2H2+O2===2H2O
栏目 导引
第四章 电化学基础
2.燃料电池的特点 (1)连续地将燃料和氧化剂的化学能直接转换成电能。 (2)电极材料本身不参与氧化还原反应。 (3)工作时,燃料和氧化剂连续地由外部供给,在电极上不断 地进行反应,生成物不断地被排除。 3.燃料电池的优点 (1)能量转换率高(超过 80%)。 (2)排放废弃物少,运行时噪音低。
进行:
Cd+2NiO(OH)+2H2O
放电 充电
Cd(OH)2+2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2-e-+OH-===NiO(OH)+H2O B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的 OH-向正极移动
栏目 导引
栏目 导引
第四章 电化学基础
解析:选 B。在原电池中负极失去电子,被氧化,因此锂作 负极;锂位于ⅠA 族,只能生成 Li+。
栏目 导引
第四章 电化学基础
题组二 二次电池
3 . (2018·张 家 界 高 二 检 测 ) 关 于 铅 蓄 电 池 的 说 法 正 确 的 是
()
A.放电时,正极发生的反应是
栏目 导引
第四章 电化学基础
充 阴 ____P__b_S_O__4(_s_)+___2_e_-_=_=_=_P_b_(_s_)_+__S_O__24-__(_a_q_)________ 电极
反 阳 __P__b_S_O__4(_s_)_+__2_H__2_O_(_l_)_-__2_e__-_=_=_=__P_b_O__2(_s_)_+_______ 应 极 __4_H__+_(_a_q_)_+__S_O_24_-__(_a_q_)___________
栏目 导引
第四章 电化学基础
分析二次电池问题的方法思路 (1)根据所给电池反应的方程式,分析化合价的变化,确定正 负极及其反应。化合价升高的物质,作负极发生氧化反应, 化合价降低的物质,作正极发生还原反应。 (2)结合电解质溶液的环境,先写出负极反应的电极反应式, 再用总反应方程式减去负极反应式即得正极反应式。书写时 要注意质量守恒、电荷守恒的灵活应用。
第四章 电化学基础
解析:选 A。由总反应可知,放电时,负极 Cd 发生氧化反 应:Cd-2e-+2OH-===Cd(OH)2,负极碱性减弱,C 项错 误;正极反应为 2NiO(OH)+2e-+2H2O===2Ni(OH)2+ 2OH-,放电时,OH-由正极向负极移动(内电路),D 项错误; 充电时,电能转化为化学能,B 项错误;充电时阳极发生氧 化反应,即为 Ni(OH)2+OH--e-===NiO(OH)+H2O,A 项 正确。
第四章 电化学基础
第二节 化学电源
第四章 电化学基础
1.了解常见化学电源的种类及其工作原理。 2.熟练书写常 见化学电源的电极反应式和总方程式。 3.知道废弃电池对环境的危害,设想处理废旧电池的办法。
第四章 电化学基础
化学电池 1.化学电池的概念:化学电池是将__化__学__能__变成__电__能__的装 置。 2.化学电池的分类
总反应
Pb(s)+PbO2(s)+2H2SO4(aq)
放电 充电
2PbSO4(s)+
2H2O(l)
栏目 导引
第四章 电化学基础
正误判断:正确的打“√”,错误的打“×”,并阐释错因或
列举反例。
语句描述
阐释错因或列举 正误
反例
(1)Zn 具有还原性和导电性,可用作
锌锰干电池的负极材料
(2)铅蓄电池在放电过程中,负极质量
栏目 导引
第四章 电化学基础
2.电池在生产、生活中应用越来越广泛。下列说法错误的是 () A.化学电池有一次电池、二次电池和燃料电池等,一次电 池只能放电,不能充电 B.铅蓄电池应用广泛,主要优点是单位重量的电极材料释 放的电能大 C.燃料电池具有能量利用率高、可连续使用和污染轻等优 点 D.锂电池是一种高能电池,体积小、重量轻,单位质量比 能量大
栏目 导引
第四章 电化学基础
(2)工作原理
负极 反应
酸性电解质(H2SO4)
碱性电解质(KOH)
______2_H__2-___4_e_-_=_=_=_4_H__+____ 2_H_2_-__4_e_-_+___4_O_H__-_=_=_=__4_H_2_O
正极 反应
_O__2+__4__e_-_+__4_H_+__=_=_=_2_H__2_O_ O_2_+__4_e_-_+__2__H_2_O__=_=_=_4_O__H_-_
栏目 导引
第四章 电化学基础
解析:选 B。A 项,化学电池有一次电池、二次电池和燃料 电池等,一次电池只能放电,它不能充电反复使用,正确; B 项,铅蓄电池应用广泛,主要优点是制作方便,但质量重, 单位重量的电极材料释放的电能小,错误;C 项,任何可燃 性燃料,只要把燃料失去电子的氧化反应和助燃剂的还原反 应分开进行,都可以设计成燃料电池,燃料电池具有能量利 用率高、可连续使用和污染轻等优点,正确;D 项,锂的相 对原子质量为 7,每产生 1 mol 电子,消耗金属的质量只有 7 g,所以相同质量时提供的能量要比其他电池大得多。因此锂 电池是一种高能电池,具有体积小、重量轻,单位质量比能 量大的优点,正确。
栏目 导引
第四章 电化学基础
题组 燃料电池 1.某种氢氧燃料电池的电解液为 KOH 溶液。下列有关该电 池的叙述不正确的是( ) A.正极反应式为 O2+2H2O+4e-===4OH- B.工作一段时间后,电解液中 KOH 的物质的量不变 C.该燃料电池的总反应方程式为 2H2+O2===2H2O D.消耗 2.24 L H2(标准状况)时,有 0.1 mol 电子转移
阐释错因或列举 反例
栏目 导引
第四章 电化学基础
答案:(1)√ (2)× 铅蓄电池在放电过程中,正、负极质量都增加 (3)× 放电反应和充电反应的反应条件不相同 (4)× 锂元素的化合价升高,失电子,锂电极作该电池的负 极 (5)√
栏目 导引
第四章 电化学基础
题组一 一次电池 1.锌锰干电池在放电时,总反应方程式可以表示为 Zn(s)+ 2MnO2+2NH+ 4 ===Zn2++Mn2O3(s)+2NH3↑+H2O,在此电 池放电时正极(碳棒)上发生反应的物质是( )
各种形状和大小,使用方便,易于维
护
(4)废旧电池可以随意丢弃
栏目 导引
第四章 电化学基础
答案:(1)× 化学电池是将化学能转变成电能的装置 (2)√ (3)√ (4)× 废旧电池含有重金属等污染环境的物质,不可随意丢 弃
栏目 导引
第四章 电化学基础
题组 化学电池 1.废电池必须进行集中处理的首要原因是( ) A.为了利用电池外壳的金属材料 B.防止汞、镉和铅等重金属离子对土壤和水源的污染 C.不使电池中渗泄的电解液腐蚀其他物品 D.回收其中的石墨电极 解析:选 B。废电池中汞、镉和铅等重金பைடு நூலகம்离子能对土壤和 水源造成污染,必须进行集中处理。
____P_b_(_s_)_+__S_O__24-_(_a_q_)_-__2_e_-_=_=_=_P__b_S_O__4(_s_)________
反 正 _P_b_O__2_(s_)_+__S__O__24-___(a_q__) _+__4_H__+_(_a_q_)_+___2_e_-________ 应 极 _=_=_=_P__b_S_O_4_(_s_)+__2_H__2_O_(_l_)
栏目 导引
第四章 电化学基础
一次电池和二次电池
1.一次电池
碱性锌锰电池
锌银电池
基本 构造
负极:__Z_n___
负极:__Z__n__
正极:__M__n__O_2___
正极:__A__g_2O_____
电解质:KOH
栏目 导引
第四章 电化学基础
碱性锌锰电池
锌银电池
负极 Z_n_+__2__O_H__-_-__2_e_-_=_=_=_Z_n__(O__H_)_2 __Z_n__+__2_O_H__-_-__2_e_-_____
反应
__=_=_=_Z_n_(_O__H_)_2________
正极 反应
_2_M__n_O_2_+__2_H__2O__+__2_e_-_=_=_=_ ___2_M__n_O_(_O__H_)_+__2_O_H__-___
___A__g_2_O_+__H__2_O_+__2_e_-____ __=__=_=_2_A_g_+__2_O__H__-____
减小,正极质量增加
栏目 导引
第四章 电化学基础
语句描述
正误
(3)可充电电池中的放电反应和充电 反应互为可逆反应 (4)锂碘电池的电池反应为 2Li(s)+ I2(s)===2LiI(s),则碘电极作该电池的 负极 (5)碱性锌锰电池比普通锌锰电池比 能量和可储存时间均有提高,适用于 大电流和连续放电
栏目 导引
第四章 电化学基础
3.电池优劣的判断标准 (1)比能量:_单__位__质__量___或__单__位__体__积__所能输出电能的多少; (2)比功率:_单__位__质__量___或__单__位__体__积__所能输出功率的大小; (3)电池的可储存时间的长短。 4.化学电池的回收利用 废旧电池中含__重__金__属__和酸碱等有害物质,应回收利用,既 减少污染又节约资源。
Pb(s)
+
SO
2- 4
(aq)
-
2e
-
===PbSO4(s) B.放电时,该电池的负极材料是铅板
C.充电时,电池中硫酸的浓度不断减小
D.充电时,阳极发生的反应是 PbSO4(s)+2e-===Pb(s)+SO24-
