大学化学试卷1
有机化学(1)试卷(化学)
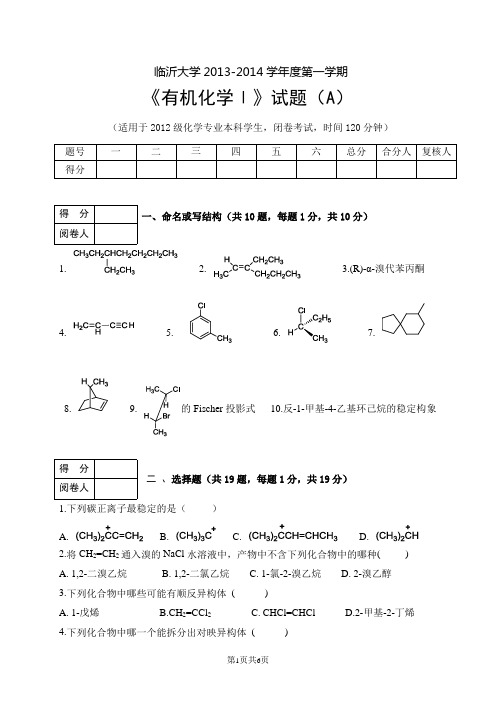
临沂大学2013-2014学年度第一学期《有机化学Ⅰ》试题(A )(适用于2012级化学专业本科学生,闭卷考试,时间120分钟)1. 2.3.(R)-α-溴代苯丙酮4. 5. 6.7.8. 9. 的Fischer 投影式 10.反-1-甲基-4-乙基环己烷的稳定构象1.下列碳正离子最稳定的是( ) A.B. C.D. 2.将CH 2=CH 2通入溴的NaCl 水溶液中,产物中不含下列化合物中的哪种( ) A. 1,2-二溴乙烷 B. 1,2-二氯乙烷 C. 1-氯-2-溴乙烷 D. 2-溴乙醇 3.下列化合物中哪些可能有顺反异构体 ( )A. 1-戊烯B.CH 2=CCl 2C. CHCl=CHClD.2-甲基-2-丁烯 4.下列化合物中哪一个能拆分出对映异构体 ( )A. B.COOHC. D.5.下列一组化合物中,具有休克尔芳香性的是( ) A.B.C.D.6.按次序规则,将下列基团由大到小排列成序( )Ⅰ.-OH Ⅱ. (CH 3)2CH- Ⅲ. -C(CH 3)3 Ⅳ.ClCH 2CH 2- A. Ⅰ>Ⅳ>Ⅲ>Ⅱ B. Ⅳ>Ⅱ>Ⅲ >Ⅰ C.Ⅲ>Ⅳ>Ⅱ >Ⅰ D. Ⅰ>Ⅲ>Ⅱ>Ⅳ 7.化合物与的关系为( )A .相同化合物B .对映异构体C .非对映异构体D .不同化合物 8.下列化合物不能作为Diels-Alder 反应的双烯体的是( ) A .B .C .D .9.化合物HH 3CCH 3H 有几组化学等价质子( )A. 3B.4C. 5D.610.在碘化钾/丙酮溶液中反应速度最快的是( )11.下列各异构体中,与硝酸银醇溶液反应最快的是( )12.能区别五个碳以下的伯、仲、叔醇的试剂为( ) A.高锰酸钾 B.卢卡斯试剂 C.斐林试剂 D.溴水 13.下列化合物酸性最强的是( )A .苯酚B .2,4-二硝基苯酚C .对硝基苯酚D .间硝基苯酚 14.由醇制备卤代烃时常用的卤化剂是( )A. Br 2/CCl 4B.AlCl 3C.SOCl 2D.NBS15. 在碱性条件下, 可发生分子内S N 反应而生成环醚的是下列哪个卤代醇( )A.2Br222Br22Br2OHB.C.D.16. 合成化合物CH 3OC(CH 3)3的最佳方法是()A 甲醇和叔丁醇分子间脱水B 甲基氯和叔丁醇钠反应C 甲醇钠和叔丁基氯反应A. 对映体B. 非对映体C. 相同化合物D. 构造异构体 18.下列四个取代苯都被强烈氧化,不能得到对苯二甲酸的是( )CH 2COOH3CH 3COCH 3C(CH 3)3CH3CHCH(CH3)2CHCOOH19.卤烷与NaOH 在水与乙醇混合物中进行反应,下列现象中,属于S N 2历程的是( ) A. 产物的构型完全转化 B. 有重排产物 C. 生成外消旋产物 D 叔卤烷速度大于仲卤烷1.2.3.4.5.6.CH 3CO 3H7.24160o C8.9.10.+AlCl311. H 2O 2+CH 3B 2H 6OH12.13.14.15. 稀H 2SO 4CH 3CH 2CHCHgSO 418.H H CH 3(CH )COK3OH HCH 3Br H 19.H 催化剂CH3CH C C 20.21.322322.CH2ClCH 33+CO 浓HClO CH 323.1.CH MgBr224.KMnO 425.CH 3CH=CH -CH=CH 2 + HBr1,4-加成26.CH 3OHCH 3HBr1.完成反应机理2.完成反应机理3.完成反应机理(CH3)3CCH2OH(CH3)2CBrCH2CH31.以乙炔及不多于2个碳原子的化合物合成2.以苯及不多于3个碳原子的化合物合成3.以丙烯为原料合成2-甲基-2-戊醇910三重峰;δ3.0 ( 2H ) 四重峰;δ7.7 ( 5H ) 多重峰,试推测A的结构。
大学本科有机化学试题答案(1)

有机化学复习题一、选择题: 下列各题只有一个正确答案,请选出。
1. CH 3-CH-CH 2-C-CH 2CH 3CH 3CH 3CH 3分子中伯、仲、叔、季碳原子的比例是A. 5:2:1;1B. 2:4:2:1C. 5:1:2:1D. 4:3:1:12.烷烃系统命名中的2-甲基丁烷在普通命名法中又称为: A. 异戊烷 B. 异丁烷 C. 新戊烷 D. 叔丁烷3.下列化合物不属于脂环烃的是A. 甲苯B. 2-甲基环己烯C. 环己炔D. 1.2-二甲基环己烷 4 烯烃中碳原子的杂化状态是A. SP 3B. SP 2C. SPD. SP 3和SP 2 5. 炔烃中碳原子的杂化状态是A. SP 3和SPB. SPC. SP 2 D SP 3 6.在下列脂环烃中,最不稳定的是A. 环戊烷B. 环丁烷C. 环己烷D. 环丙烷 7.马尔科夫尼科夫规律适用于A. 烯烃与溴的加成反应B. 烷烃的卤代反应C. 不对称烯烃与不对称试剂的加成D. 烯烃的氧化反应 8.下列化合物用KMnO 4/H +氧化只得到一种产物的是 A. (CH 3)2C=CHCH 3 B. CH 3CH=CHCH 2CH 2CH 3 C. CH 3CH=CH 2 D. (CH 3)2C=C(CH 3)2 9.经催化加氢可得2-甲基丁烷的化合物是A. B.CH 3CH 3-C=CH 2CH 3-CH=CH-CH 3C.CH 3CH 3-CH-C CHD.CH 3CH 3-CH C=CH 2CH 310. 化合物C=CH 3C CH 3H 5C 2COOH属于 A. E 型或顺式 B. E 型或反式 C. Z 型或顺式 D. Z 型或反式11. 1-戊炔和2-戊炔属于A. 碳链异构B. 顺反异构C. 位置异构D. 构象异构 12. 可鉴别2-丁炔与1-丁炔的试剂为A. 溴水B. Cu(OH)2C. HIO 4D. Ag(NH 3)2NO 3 13. 下列基团中,属于间位定位基的是A. –OHB. –CH 2CH 3C. –NO 2D. –Cl 14. 下列基团中,属于邻、对位定位基的是A. –COOHB. –NH 2C. –CND. –CHO15. 下列化合物氧化后可生成苯甲酸的是 A.C(CH 3)3B.CH(CH 3)2C.CH 3CH 3D.CH 316. 下列化合物中,属于叔卤代烷结构的是 A.Cl B.Cl CH 3C.ClD.CH 2Cl17. 下列化合物不能发生消除反应的是A.氯化苄B. 氯乙烷C.2-氯丁烷D. 叔丁基溴 18. 下列化合物与无水氯化锌+浓盐酸反应速度最快的是A.CH 3H 3C C CH 3OHB. CH 3CH 2OHC.CH 3OHD. CH 3CH CH 3OH19. 扎依采夫规律适用于A. 烯烃加HBr 的反应B. 卤代烃的取代反应C. 醇或卤代烃的消除反应D. 芳香烃的取代反应 20. 下列化合物能与Cu(OH)2反应生成兰色溶液的是A.OHB. CH 2CH 2CH 2OH OHC. CH 3CH 2OHD. HOOC-CH CH-COOH OH OH21. 下列化合物能与FeCl 3显色的是A.OHB.OHC.OHOH D.CHO22.下列化合物与溴水反应生成白色沉淀的是 A.-CHO B.-O HC.-OHD.-CH 2 OH23. 下列化合物属于芳香醇的是 A.-O HB.-OHC.-CH 2 OHD.-CHO24. 能区别OH和OCH 3的试剂是A. NaOHB. NaHCO 3C. HBrD. 稀HCl 25. 下列醇中可氧化成酮的是A.CH 3OH CH 3-C-CH 3 B.OHCH 3-CH-CH 2-CH 3 C. CH 3CH 2OH D.CH 3CH 2CH 2OH 26. 可用来鉴别CH 3CHO 和 CH 3COCH 3的试剂是A. 羰基试剂B. 托伦试剂C. NaHSO 3D. I 2+NaOH 27. 下列化合物中,能发生碘仿反应的是A.-C-CH 2-CH 3OB. CH 3-CH 2-C-CH 2-CH 3OC. CH 3CH 2OHD. CH 3CH 2CHO 28. 下列化合物中不能与NaHSO 3反应的是A CH 3-C-CH 3OB.CH 3CH 2CHOC.-C-OD. O29. 下列化合物中能被斐林试剂氧化的是CH 3-C-CH 3OCH 3-CH 2-CHOCH 3CH 2OH -CHO A.B. C. D.30. 下列化合物能进行醇醛缩合反应的是A.-CHOB.CHOC. HCHOD. CH 3CH 3CH 3-C-CHO31.下列化合物属于半缩醛的结构的是 A.O-CH 3O-CH 3B.O-CH 3C.O-CH-CH 3 OHD. CH 3-C-O-C 2H 5O32.下列反应不能产生二氧化碳的是 A. CH 3COOH + NaHCO 3B.CH 2=CHC.CH 3-C-CH 2O△D. CH 2=CH 2KMnO 433.己二酸加热后所得到的产物是A.二元酸B. 环酮C. 酸酐D. 酮酸34.下列化合物中,其酸性最强的是 A.OHB. H 2OC. CH 3CH 2COOHD. CH 3CH 2OH35.下列化合物中,不属于酮体的是A. CH 3-C-CH 3OB. CH 3-C-CH 2-COOH OC. CH 3-CH-CH 2-COOH OHD. CH 3-CH 2-CH-COOHOH36. 区别OH和COOHOH所用的试剂为 A. NaHCO 3 B. FeCl 3 C. HBr D. Na 37. 下列试剂中不能与OHCH 3-CH 2-CH-CH 3反应的是A. I 2 + NaOHB. NaC. KMnO 4D. NaOH 38.下列各糖中不能与托伦试剂反应的是A. α-D-吡喃葡萄糖B. α-D-呋喃果糖C. 蔗糖D.麦芽糖 39.下列化合物中碱性最弱的是CH 3-CH 2-NH 2-NH 2-C-NH 2O-NH-A. B.C.D.40.下列化合物属于五元含氮杂环的是A. 噻吩 B 咪唑 . C. 呋喃 D. 吡啶二、判断题(错×、对○)1. 炔烃都可以和Ag(NH 3)NO 3在加热的条件下产生炔化银沉淀。
大学有机化学试题1..
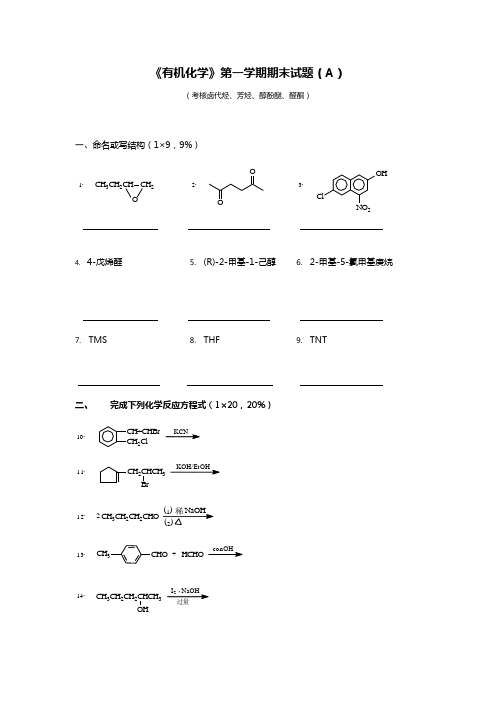
《有机化学》第一学期期末试题(A )(考核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构(1×9,9%)CH 3CH 2CH CH 2O1.OO2.ClNO 2OH3.4. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2-甲基-5-氯甲基庚烷7. TMS8. THF9. TNT二、完成下列化学反应方程式(1×20,20%)CH=CHBr CH 2ClKCN10.CH 2CHCH 3BrKOH/EtOH11.CH 3CH 2CH 2CHO212.CHOCH 3HCHOconOH-+13.CH 3CH 2CH 2CHCH 3OHI 2 NaOH 过量14.(CH 3)2CHOHPBr 315.CH 3(CH 2)3Cl+16.AlCl 3OH OHH+17.CH 3MgBr18.HCHO 乙醚,H 3O+OPh 3P=CH 2+20.CH 3CH 2CH 2CHO21.+NaHSO 3(饱和O CO22.(CH 3)2CHMgBr23.O(1)醚(2)2+OCH 2CH=CHREt Me200C。
24.OHH 2SO 4HNO 325.HCHOHCl26.++ZnCl 2无水CH 3CH=CHCH 2CH 2CHOAg(NH 3)2+OH-27.C CH 3H 3C OHCHON H++H+28.2C 2H 5OH Odry HCl29.+三、有机理论部分(5×5,25%)30按沸点从大到小排列成序,并简要说明理由。
CH 2CH CH 2OH OH OHCH 3CH 2CH 2OH CH 3CH 2CH 2OCH 3CH 2CH CH 2OH OH OCH 3(a)(b)(c)(d)31.按羰基的活性从大到小排列成序,并简要说明理由。
CH 3CH O CH 3CCHOO CH 3CCH 2CH 3O (CH 3)3CCC(CH 3)3O(a)(b)(c)(d)32.解释:为什么化合物无论是进行S N 1还是进行S N 2反应都十分困难?33.写出反应机理CH 2CH 2ClClCH CH 3+(过量)AlCl 3无水34.写出反应机理OO四、有机结构分析部分(4×4,16%)35.用化学方法鉴别化合物C2H5Br CH3O CH2Br C2H5OHA B C36.用化学方法鉴别化合物O OH OHOHA B C D37.根据所给化学式、IR、NMR主要数据,推测化合物的结构C4H8O IR/cm-1: 2970, 2878, 2825, 2718, 1724; NMR: δH: 9.5(三重峰,1H)38.化合物A的分子式为C8H14O。
武汉大学化学工程基础期末考试试卷1

武汉大学化学与分子科学学院2001—2002学年度第二学期期末考试《化学工程基础》试卷系 专业 年级 学号 姓名 成绩一、填空(每空1分,共20分)1、用测量氢气的转子流量计测量空气时,若转子高度在10L/min 处,则其实际流量 10L/min 。
(=,>,<)2、用饱和蒸气加热某有机化合物时,逆流的平均温差应 并流时的平均温差。
(=,>,<)3、流体在由Ø25×2.5mm 及Ø57×3.5mm 钢管组成的套管换热器环隙中流动,其当量直径为 。
4、当理想流体在水平变径管路中作连续定态流动时,在管路直径缩小处,其静压强将 ,而流速将 (增大或减小)。
5、对于平行反应A ,若主反应级数小于副反应级数,为提高R 的选择性,以选择 反应器为宜。
R S (主反应) (副反应)6、对于在一定条件下进行的简单反应,达到某一转化率所需的活塞流反应器容积与全混流反应器容积之比随转化率增加而 ,随反应级数的增加而 。
7、若以σ2表示有量纲方差,则具有σ2=τ2的反应器模型是 ,σ2=0的反应器模型是 。
8、反应器热稳定的条件是 和 。
9、超滤、反渗透、电渗析和气体膜分离等膜分离过程中,推动力类型不同的膜分离过程是 。
10、对可逆放热反应,平衡温度和最佳温度的大小关系为:平衡温度 最佳温度。
11、描述酶催化反应的米氏方程为m s s max p K C C r r +=,酶催化反应表现为一级反应的条件是 ;表现为0级反应的条件是 。
12、减小竞争性抑制作用的措施是 。
13、稀释率的定义式为D = ,类似于化学反应工程中的 ,D 的值应 D crt (=,<,>)。
二、判断题(下列命题中,你认为正确的,请在题后括号内打“√”,错误的打“×”,每小题2分,共14分)1、粘度的国际单位是厘泊。
( ) 2、返混对于自催化反应总是有益的。
大学分析化学试卷第一套

分析化学试卷一、填空题(每空1分,共10分)1.从误差的基本性质来分,可以将它分为 随机误差 、 系统误差、 过失误差 。
2.在含有Ca 2+、Ag +混合溶液中,在pH=12条件下,用EDTA 标准溶液滴定其中的Ca 2+。
加入三乙醇胺的作用是 掩蔽Fe 3+、Al 3+,加入NaOH 的作用是掩蔽Mg 2+,使之形成Mg(OH)2 3.滴定管的读数常有±0.01mL 的误差,则在一次滴定中的绝对误差可能为 ±2 mL 。
常量滴定分析的相对误差一般要求应≤0.1%,因此,滴定时消耗标准溶液的体积必须控制在 20 mL 以上4.用KMnO 4滴定 242O C 时,红色的消失由慢到快是属于 自动催化 反应。
5.强碱滴定弱酸的滴定曲线中,滴定突跃的大小与酸的浓度 和Ka 有关。
二、选择题(在本题的每一小题的备选答案中,只有一个答案是正确的,请把你认为正确答案的题号,填入题干的括号内。
多选不给分。
每题2分,共40分)1.某人根据置信度为95%对某项分析结果计算后,写出如下几种报告,合理的是( B )A .(25.48±0.1)%B .(25.48±0.13)%C .(25.48±0.135)%D .(25.48±0.1328)% 2.下列各组酸碱,属于共轭酸碱对的是( B )A .H +—H 2OB .H 2CO 3—HCO 3—C .H 2S —S 2-D .H 3PO4—HPO 42-3.H 3PO 4的p K a1=2.12,pK a2=7.2,p K a3=12.36。
当pH=10时,磷酸溶液中的主要存在形式是( C )A .H 3PO 4B .H 2PO 4—C .HPO 42-D .PO 434.下列有关随机误差的论述中不正确的是( D )A .随机误差是由一些不确定的偶然因素造成的;B .随机误差出现正误差和负误差的机会均等;C .随机误差在分析测定中是不可避免的;D .随机误差具有单向性5.用EDTA 滴定法测定水中硬度,若水中存在少量Fe 3+和Al 3+,将对测定有干扰,消除干扰的方法是( B )A .控制溶液的pHB .加入配位掩蔽剂掩蔽Fe 3+和Al 3+C .加入沉淀沉淀Fe 3+和Al 3+D .加入氧化还原掩蔽剂进行掩蔽6.指出下列条件适于测定佛尔哈德法的是( C )A .pH=6.5~10.5B .以K 2CrO 4为指示剂C .滴定酸度为0.1~1mol/L HNO 3D .以荧光黄为指示剂 7.某酸碱滴定pH 突跃为7.7~9.7,适宜用的指示剂是( D )A .苯胺黄(pH 变色范围为1.3~3.2)B .甲基橙C .甲基红D .酚酞8.金属离子M ,能够用EDTA 直接滴定的条件是( B )A .cK a ≥10-8B .610'≥MY cK C .610≥MY cK D .610g 1≥MY cK 9. 标定氢氧化钠滴定液,可作为基准物质的是( D )。
大学化学历年考试试题及答案

大学化学历年考试试题及答案1. 选择题1. 下列物质中,哪个不是无机化合物?A. 水B. 醋酸C. 氯化钠D. 硝酸答案:B. 醋酸2. 下列反应,哪个是酸和碱的中和反应?A. NaOH + HCl → NaCl + H2OB. CaO + H2O → Ca(OH)2C. NH3 + HCl → NH4ClD. H2SO4 + H2O → H2SO4·H2O答案:A. NaOH + HCl → NaCl + H2O3. 一根铁丝长度为2m,质量为10g,当该铁丝完全被硫酸铜溶液(质量为50g)浸泡后,铁丝质量增加为多少?A. 30gB. 40gC. 50gD. 60g答案:C. 50g4. 下列元素中,哪个元素能够与氧气发生剧烈反应?A. 镁B. 铝C. 铁D. 铜答案:A. 镁5. 在下列化合物中,哪个是无机酸?A. HClB. CH3COOHC. H2SO4D. C6H12O6答案:A. HCl2. 填空题1. 乙醇的分子式为_________。
答案:C2H5OH2. 水的化学式为_________。
答案:H2O3. 酸的指示剂中常用的是_________。
答案:酚酞4. 化学反应速度可以通过反应物质的_________来表示。
答案:浓度5. 自然界中最常见的元素是_________。
答案:氧3. 综合题化学是一门研究物质组成、性质和变化的科学。
通过历年的大学化学考试试题,我们可以更好地了解化学知识的学习和掌握情况。
以下是几个典型的大学化学考试试题及答案。
1. 选择题考查学生对无机化合物和化学反应的理解,通过选项的选择来测试学生的辨析能力和知识掌握程度。
2. 填空题考查学生对化学式、指示剂、化学反应速度等基础概念的掌握,同时也测试学生的记忆能力和运算能力。
3. 综合题考查学生运用所学的化学知识解答问题的能力,要求学生综合运用多个知识点进行分析和推理,提高学生的综合应用能力。
通过解答历年大学化学考试试题,学生可以对自己的学习情况有更好的了解。
大学化学试题+答案
大学化学试题大学化学试题大学化学试题 一、一、 填空题填空题1、含有杂质铜的铁,在3KNO 溶液中将发生(溶液中将发生( )腐蚀。
此腐蚀)腐蚀。
此腐蚀电池的阴极反应是(电池的阴极反应是( )),可用(,可用( )检查;腐蚀电池的阳极反)检查;腐蚀电池的阳极反应是(应是( )),可用(,可用( )检查。
)检查。
)检查。
2、在单晶硅、KI 、4SiH 、SrO 、3NH 、3FeCl 、石墨中,属于原子晶体的有( )),属于离子晶体的有( ));属于分子晶体的有( ));属于过渡晶体多的有(属于过渡晶体多的有( ))。
3、周期表中5、6周期副族金属的原子半径相近,这是由(周期副族金属的原子半径相近,这是由( ))引起的,使得他们的(引起的,使得他们的( )相似,矿物共生,难以分离。
)相似,矿物共生,难以分离。
)相似,矿物共生,难以分离。
4、作为光电材料的元素分布在周期表的(、作为光电材料的元素分布在周期表的( )区,因为该区元)区,因为该区元素(素( ));作为半导体材料的元素分布在周期表的(;作为半导体材料的元素分布在周期表的( )区,作)区,作为高熔点、高硬度的金属元素分布于周期表的(为高熔点、高硬度的金属元素分布于周期表的( )) ,因为该区的元素(区的元素( ));作为低熔合金的元素分布在周期表的(;作为低熔合金的元素分布在周期表的( )区)区和(和( )区。
)区。
)区。
二、二、 选择题选择题 1、 已知2(/)1.07E B r B r V Q -=,32(/)0.77E Fe Fe VQ ++=。
则反应:32212Br Fe Br Fe -+++¾¾®+的电动势E Q 值为(值为()) ((A )0.3V 0.3V ((B )-0.3V -0.3V ((C )1.84V 1.84V ((D )-1.84V 2、 某反应在某反应在400400℃下平衡常数是℃下平衡常数是1414,此反应的,此反应的r m G Q D 为(为( )) (A )5.21kJ mol -×(B )14.81kJ mol -×(C )-11.41kJ mol -×(D )-14.81kJ mol -×3、 某催化酶反应的活化能是某催化酶反应的活化能是1501kJ mol -×,正常人的体温是3737℃,℃,如果病人发烧到4040℃。
大学化学试卷及答案
大学化学试题答案※ 题中所需数据见附录一.判断题(认为对的在括号内填√,认为不对的填×)(10分,每空0.5分)1. 有机高分子化合物具有玻璃态、高弹态和粘流态等三种状态(×)。
2.导体都有未满能带(√)。
3.反应 2CO (g )+ O 2(g ) = 2CO 2(g )是吸热反应(×),反应的标准熵变小于0(√),是低温自发,高温不自发反应(√)。
提示:O 2按双键处理,CO 是三重键。
4.金属表面水膜酸性较强时,只能发生吸氢腐蚀(×);而当水膜酸性较弱时,吸氢腐蚀和吸氧腐蚀可以同时发生(×)。
5.对于纯固、液、气态物质而言,100kPa 、500K 是其标准态(√)。
6.加催化剂可以加快反应速率(√),还可影响平衡(×),也可使热力学认为不能进行的反应自发进行(×)。
7. 全体整数集合,对于数的乘法构成群(×),而对于数的除法不构成群(√)。
8. 原子在失去电子时,总是先失去最外层电子(√)。
9.Θ代数值越小,该电对还原态还原能力越强(√),其对应的氧化态的氧化能力越弱(√)。
10.原子轨道组成分子轨道时,同号原子轨道重叠是对称性匹配(√),而异号原子轨道重叠为对称性不匹配(×)。
11. 化学反应进度可以度量化学反应进行的限度(×),所谓1mol 反应是指各物质按化学反应方程式进行的完全反应(√)。
二.填充题(将正确的结果填在横线上)(30分)1. 人体中某种酶反应的活化能为50kJ ·mol -1,正常人体温是37℃,则当人发烧达40℃时,该反应速率增加百分之 20 。
2. AgF 可溶于水,而AgCl 、AgBr 、AgI 的溶解度依次显著下降,其原因是 从AgF 到AgI ,其负离子半径↑,变形性↑,共价键成分↑ 。
元素 外层电子构型未成对电子数 周期 族 区 金属或非金属原子半径电离能 甲 3s 23p 5 1 三 VIIA p 非金属 小 大 乙3s 23p 33三V Ap非金属大小注:原子半径和电离能比较甲、乙的大小。
大学有机化学试题1
《有机化学》第一学期期末试题( A )(查核卤代烃、芳烃、醇酚醚、醛酮)一、命名或写结构( 1×9,9%)O OH1. CH3CH2CH CH22.3.OO ClNO24. 4-戊烯醛5. (R)-2-甲基-1-己醇6. 2- 甲基 -5- 氯甲基庚烷7. TMS8. THF9. TNT二、达成以下化学反响方程式(1×20, 20%)10.CH=CHBr KCNCH2Cl11.CH2CHCH3KOH/EtOHBr12.(1) 稀 NaOH2CH 3CH 2CH 2CHO ( )213.CH 3conOH -CHO +HCHO14.CH 3CH 2CH 2CHCH 3I 2 , NaOH过度OH15.(CH 3)2CHOHPBr 316.AlCl 3+CH 3(CH 2)3Cl17.H +OH OHHCHO 乙醚H 3O +18.CH 3,MgBr20.O+Ph 3P=CH 221.CH CH CH CHO+NaHSO (饱和)3223O混酸22.OC(1) O23.醚(CH 3)2CHMgBr+(2) H 2O/HOCH 2CH=CHR。
24.EtMe200 COH25.H 2SO 4HNO 326.无水 ZnCl 2+HCHO +HClAg(NH 3)2+OH -27.CH 3CH=CHCH 2CH 2CHOO+28.H 3C C CH 3H+HCHO+N Hdry HCl29.2CHOH +O2 5三、 有机理论部分( 5×5,25%)30 按沸点从大到小摆列成序,并简要说明原因。
CH2CH CH2CH CH CHCH CH CH OHCH 3CH 2CH 2OCH 322322OH OH OH OH OH OCH 3(a)(b)(c) (d)31.按羰基的活性从大到小摆列成序,并简要说明原因。
O O OOCH 3CH CH 3CCHOCH 3CCH 2CH 3(CH 3)3CCC(CH 3)3(a)(b)(c)(d)Cl32.解说:为何化合物不论是进行S N1仍是进行S N2反响都十分困难33.写出反响机理+CH2CH2无水 AlCl 3CH(过度)Cl ClCH3 34.写出反响机理OKOH, H 2OO O四、有机结构剖析部分( 4×4,16%)35.用化学方法鉴识化合物C H5Br CH O CH Br C2H5OH232A B C36.用化学方法鉴识化合物O OH OHOHA B C D37.依据所给化学式、 IR、NMR主要数据,推断化合物的结构C4H8 O IR/cm -1 : 2970, 2878, 2825, 2718, 1724; NMR:δH: (三重峰, 1H)38.化合物 A的分子式为 C8H14O。
大学基础生物化学考试(习题卷1)
大学基础生物化学考试(习题卷1)第1部分:单项选择题,共100题,每题只有一个正确答案,多选或少选均不得分。
1.[单选题]近年来关于氧化磷酸化的机制是通过下列哪个学说被阐明的?( )A)巴士德效应B)化学渗透学说C)华伯氏学说D)共价催化理论答案:B解析:2.[单选题]由己糖激酶催化的反应的逆反应所需要的酶是( )A)果糖二磷酸酶B)葡萄糖-6-磷酸脂酶C)磷酸果糖激酶D)磷酸化酶答案:B解析:糖异生作用主要沿着糖酵解逆途径进行,但不是糖酵解的直接逆反应( P189 )3.[单选题]下列对环核苷酸的叙述,哪一项是错误的( )A)重要的有cAMP和cGMPB)cAMP与cGMP的生物学作用相反C)cAMP是一种第二信使D)cAMP是由ATP在腺苷酸环化酶的作用下生成答案:B解析:二者都是拮抗物,起相同作用,前者促进基因表达,后者促进DNA复制4.[单选题]DNA 连接酶的功能是( )A)连接双股 DNA 中所断裂的单股B)修复双股 DNA 中失去的一个或多个核苷酸C)是催化 DNA 合成的酶D)连接两个游离的单股 DNA答案:A解析:DNA连接酶能催化双链DNA切口处无间隔的5'-磷酸基团和3'-羟基生成的磷酸酯键;不能催化具有平头末端的两条双链DNA之间的连接,也不能催化两条游离单链DNA间的连接5.[单选题]下列有关糖的功能叙述错误的是( )A)作为生物体内的主要能源物质B)作为其它生物分子如氨基酸、核苷酸、脂等合成的前体C)糖是构成酶分子的主要组成成分D)作为细胞识别的信息分子答案:C解析:存在模棱两可的答案时,选自肯定错的那个,显然酶的原料是氨基酸或者RNA6.[单选题]破坏α-螺旋结构的氨基酸残基之一是 ( )C)脯氨酸D)谷氨酸答案:C解析:脯氨酸与羟脯氨酸都会破坏α-螺旋7.[单选题]磺胺类药物的类似物是( )。
A)四氢叶酸B)二氢叶酸C)对氨基苯甲酸D)叶酸答案:C解析:8.[单选题]DNA 上某段碱基顺序为 5′-ACTAGTCAG-3′转录后的上相应的碱基顺序为( )A)5′-TGATCAGTC-3′B)5′-UGAUCAGUC-3′C)5′-CUGACUAGU-3′D)5′-CTGACTAGT-3′答案:C解析:模板:5′-ACTAGTCAG-3′转录:3′-UGAUCAGUC-5′把转录的从5′→3′书写就是答案9.[单选题]下列有关三羧酸循的生物学意义说法有误的是( )A)三羧酸循环是有机体获得生命活动所需能量的主要途径B)三羧酸循环是糖、脂、蛋白质等物质代谢和转化的中心枢纽C)三羧酸循环是生物体内重要的储能途径D)三羧酸循环是发酵产物重新氧化的途径答案:C解析:10.[单选题]30 参与尿素合成的是:A)柠檬酸循环B)γ 谷氨酰基循环C)鸟氨酸循环D)嘌呤核苷酸循环答案:C解析:11.[单选题]磷酸戊糖途径中需要的酶有( )A)异柠檬酸脱氢酶B)6-磷酸果糖激酶C)6-磷酸葡萄糖脱氢酶D)转氨酶答案:C解析:PPP途径第一步,6-磷酸葡萄糖在6-磷酸葡萄糖脱氢酶作用下生成“6-磷酸葡萄糖脱氢酶-δ-内酯”12.[单选题]下列关于超二级结构的叙述正确的是 ( )A)超二级结构只存在于球状蛋白质中D)超二级结构是二级结构的一种结构单元答案:C解析:超二级结构是指若干相邻二级结构单位组合在一起的蛋白质结构,球状蛋白和纤维状蛋白中都可能存在超二级结构13.[单选题]下列描述体内物质代谢的特点,哪项是错误的( )A)各种物质在代谢过程中是相互联系的B)进入人体的能源物质超过需要,即被氧化分解C)体内各种物质的分解、合成和转变维持着动态平衡D)物质的代谢速度和方向决定于生理状态的需要答案:B解析:进入人体的能源物质超过需要,则会被储存起来14.[单选题]前胰岛素原中信号肽的主要特征是富含下述哪些氨基酸残基 ( )A)碱性氨基酸B)酸性氨基酸C)疏水性氨基酸D)亲水性氨基酸答案:C解析:疏水性物质容易通过细胞膜,信号肽主要是含有疏水性氨基酸,从而可以引导分泌性蛋白质至特定细胞器,并穿过膜15.[单选题]如果质子不经过 F1/F0-ATP 合成酶回到线粒体基质,则会发生( )A)氧化B)还原C)解偶联D)紧密偶联答案:C解析:解偶联剂的作用机制在于他们能够快速消耗跨膜的质子梯度,使得质子不能通过F1/F0-ATP 合成酶,从而抑制电子传递16.[单选题]乳酸脱氢酶(LDH)是一个由两种不同的亚基组成的四聚体,请问其共有几种同工酶( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1页 (共8页)《 大学化学》考试试卷考试形式: 闭卷 考试时间: 120 分钟 满分: 100 分。
题 号 一 二 三 四 五 总 分 得 分 评阅人注意:1、所有答题都须写在此试卷纸密封线右边,写在其它纸上一律无效。
2、密封线左边请勿答题,密封线外不得有姓名及相关标记。
得分 一、填空题(共10小题,每空1分,共20分)1. CH 3CH 2OH 的沸点比CH 3OCH 3的沸点高得多,是因为前者分子间具有________的缘故。
2. 在描述核外电子运动状态的四个量子数中,如果n =3,m =0,m s =+12,那么角量子数l 的可能取值是___________________。
3. 就原子轨道的能级而言,在氢原子中E 3s _ _E 3p ,在铁原子中E 3s _ E 3p 。
(填>、= 或 <)4. 某元素原子的电子分布式为:1s 22s 22p 63s 23p 63d 104s 24p 5,则该元素的原子序数是 ;属于第 周期,第 族;其单质的晶体类型是 。
5. BF 3分子中B 原子采用 杂化,BF 3分子空间构型为 ,它是 (填“极性”或“非极性”)分子。
6. 共价键的特点是具有 性和 性。
7. 已知HAc 的电离常数Ka=1.8×10-5mol·dm -3,在浓度为0.1 mol·dm -3的HAc 溶液中,利用近似公式计算可得H +浓度为 mol·dm -3,溶液的pH 值 是 。
学号: 姓名: 学院: 年级: 专业:------------------------------------------------- 密 - 封 - 线 ------------------------------------------------------第 2页 (共8页)8. 对于某一适用阿累尼乌斯公式的反应,升高温度,反应速率常数k 将 ________ ;使用正催化剂时,反应速率常数k 将________;改变反应物浓度时,反应速率常数k 将________。
9.在标准状态和25℃时, H 2 (g) + (1/2) O 2 (g) = H 2O(l) 的 ∆r H =-285.85 kJ ⋅mol -1,则 ∆f H (H 2O ,l) = ______________________。
10. 某电池反应达到平衡时,电池的电动势E 必然是 。
(填>0、=0或<0) 得分二、选择题(共15小题,每小题2分,共30分)1.下列成套量子数(n,l,m,m s )中不能描述电子运动状态的是( )。
(A) (2,2,0,+1/2) (B) (3,2,-2,+1/2)(C) (6,4,4,-1/2)(D) (6,4,4,+1/2) 2. 比较下列轨道中的电子,哪一个能量较高? 。
(A) 2p x 1 (B) 2p x 2 (C)2p y 1 (D)3s 1 3. 某元素原子的外层电子构型为3d 54s 2,它的原子中未成对电子数为 ( )。
(A) 0 (B)1 (C)3 (D)5 4. 下述各原子外层轨道的电子分布中,违背洪特规则的是________。
(A)2p(B)3d(C)4d(D)5p5. N 2分子之间的作用力有 ( ) (A) 氢键 (B) 取向力 (C) 诱导力 (D) 色散力6. sp 3杂化轨道的形成是由________。
(A) 一条n s 轨道与3 条n p 轨道杂化而成 (B) 1s 轨道与3p 轨道杂化而成 (C) 1条s 轨道与3 条2p 轨道杂化而成 (D) 1个s 电子与3 个p 电子杂化而成第 3页 (共8页)学号: 姓名: 学院: 年级: 专业:------------------------------------------------- 密 - 封 - 线 ------------------------------------------------------7. 原子轨道沿两核连线以“头碰头”方式进行重叠形成的键是 。
(A) σ键 (B)氢键 (C)π键 (D)离子键8. A ,B ,C 和 D 四个状态间的关系如下图所示,则它们之间的∆rH 关系不正确的是________。
A B CDII I IIIIV V(A) III = I + II (B) I = II + III(C) III = V + IV (D) II = I - IV - V 9. 下列说法中正确的是________。
(A) 非自发反应是不能实现的反应 (B) 放热反应都是自发反应 (C) ∆r S m < 0 的反应都是自发反应(D) 一个反应达到平衡的标志是各物质的浓度不随时间的改变而变化 10. 公式 Q p = ∆H 的适用条件是________。
(A) 恒压过程 (B) 恒容过程 (C) 恒压只作体积功的过程 (D) 恒压只作非体积功的过程 11. 反应 CaO(s) + H 2O(l) = Ca(OH)2(s) 在298.15K 和标准态下是自发的,其逆反应在高温下变为自发进行的反应。
那么正反应是 。
(A) Δr H m θ >0,Δr S m θ >0 (B) Δr H m θ >0,Δr S m θ <0 (C) Δr H m θ <0,Δr S m θ <0 (D) Δr H m θ <0,Δr S m θ >012. 如果反应容器的体积增大为原来的2倍,则反应2NO(g) + O 2(g) → 2NO 2(g)(已知为基元反应)的速率将________。
(A) 减小为原来的 1/4(B) 减小为原来的 1/8(C) 增大为原来的 4 倍 (D) 增大为原来的 8 倍 13. 已知下列反应的平衡常数:H 2 (g) + S (s) = H 2S (g) , K 1θ S (s) + O 2 (g) = SO 2 (g) ,K 2θ则反应H 2 (g) + SO 2 (g) = O 2 (g) + H 2S (g)的平衡常数是 。
(A)K 1θ- K 2θ (B)K 1θ·K 2θ (C)K 1θ/ K 2θ (D) K 2θ/ K 1θ14.已知下列各电对的标准电极电势:φӨ (Fe 3+/Fe2+)=+0.77V φӨ (Cu2+/Cu)=+0.34VφӨ (Mg 2+/Mg)= -2.83V φӨ (Cl2/Cl-)=+1.36V则在标准状态下,最强的还原剂是________。
(A) Fe 2+(B) Cu (C) Mg (D) Cl-15. 已知ϕθ(Cl2/ Cl-)= +1.36V,在下列电极反应中标准电极电势为+1.36V 的电极反应是。
(A) Cl2 + 2e—=2Cl-(B) 2Cl--2e—=Cl2(C) 1/2Cl2 + e—=Cl-(D) 都是得分三、判断题(共10小题,每小题1分,共10分)1.(对)电子云的黑点表示可能出现的位置,疏密程度表示电子出现在该范围的机会大小。
2.(对)s轨道和p轨道成键时,只能形成σ键。
3.(错)在离子晶体中,一个阳离子总是属于一个确定的阴离子。
4. (错)因为Q、W不是系统所具有的性质,而与过程有关,所以热力学过程中(Q-W)的值也应由具体的过程决定。
5.(错)稳定单质的SmΘ=0。
6.(对)一级反应的半衰期只与反应的速率常数有关。
7.(错) 298K.15K时,标准状态下,由元素的最稳定单质生成1mol某纯物质时的热效应,称为该物质的标准摩尔生成焓。
8.(错)在原电池的组装中,φӨ值大的电对应设置在正极,而φӨ值小的电对应设置在负极。
第4页(共8页)第 5页 (共8页)学号: 姓名: 学院: 年级: 专业:------------------------------------------------- 密 - 封 - 线 ------------------------------------------------------9.( 对 )已知某电池应为A + 1/2B 2+ → A + + 1/2B ,而当反应式改写为2A + B 2+→ 2A + + B 时,则此反应的E θ不变,而Δr G m Θ改变。
10.( 错 )由于ΘΘΘ+++ϕ<ϕ<ϕCoCo Al Al KK ///23,因此在标准状态下,Co 2+的氧化性最强,而K +的还原性最强。
得分 四、计算题(共2小题,每小题10分,共20分)(可能用到的常量:R=8.314 J·mol -1·K -1 ;F=96485 J·V -1·mol -1 。
) 1. 根据实验,NO 和Cl 2的反应:2NO(g) + Cl 2(g) = 2NOCl(g) 满足质量作用定律。
(1) 写出该反应的反应速率方程? (2) 该反应的总级数是多少?(3) 其它条件不变,若将容器的体积增加到原来的2倍,反应速率如何变化?2. 已知下列电池反应:Mn(s) + Zn2+(aq) → Zn(s) + Mn2+(aq)(1)写出半电池反应式,计算电池在标准状态下的电动势和吉布斯自由能变∆r Gθm。
(2)计算标准平衡常数KӨ(298.15K)。
已知:298.15K时,ϕӨ (Zn2+/Zn) = -0.7621 V ,ϕӨ (Mn2+/Mn) = -1.182 V得分五、问答题(任选其中2小题,每小题10分,共20分)1. 论述液体推进剂的组成、分类、反应及能量转换过程。
第6页(共8页)第7页(共8页)学号: 姓名: 学院: 年级: 专业: ------------------------------------------------- 密 - 封 - 线 ------------------------------------------------------2. 论述化学键类型与材料性能的关系。
3. 阐述光纤的组成、分类、性能及其应用。
第8页(共8页)。
