2020年新课标1化学试卷(高清版)
2020学年普通高等学校招生全国统一考试(新课标I卷)化学及答案解析

2020年普通高等学校招生全国统一考试(新课标I卷)化学一、选择题(共7小题,每小题6分,满分42分)1.(6分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一,采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:下列叙述错误的是()A.合理处理废旧电池有利于保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠解析:A.合理处理废旧电池,可减少污染性废水的排放,且回收含有Al、Fe等金属,可再利用,故A正确;B.由以上分析可知从“正极片”中可回收的金属元素有Al、Fe、Li等,故B正确;C.硝酸具有强氧化性,可氧化亚铁离子生成铁离子,则“沉淀”反应的金属离子为Fe3+,故C正确;D.加入硫酸钠,不能生成含Li沉淀,故D错误。
答案:D2.(6分)下列说法错误的是()A.蔗糖、果糖和麦芽糖均为双糖B.酶是一类具有高选择催化性能的蛋白质C.植物油含不饱和脂肪酸酯,能使Br2/CCl4褪色D.淀粉和纤维素水解的最终产物均为葡萄糖解析:A.蔗糖和麦芽糖均为双糖,果糖为单糖,故A错误;B.绝大多数酶是蛋白质,少数具有生物催化功能的分子不是蛋白质,如复合酶,故B错误;C.植物油为液态油脂,分子的烃基中含不饱和碳碳双键,这种脂肪酸酯,能使Br2/CCl4褪色,发生加成反应,故C正确;D.淀粉和纤维素为多糖,一定条件下水解的最终产物均为葡萄糖,故D正确。
答案:AB3.(6分)在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是()A.B.C.D.解析:A.乙酸乙酯的制备是乙醇浓硫酸和乙酸混合溶液加热生成的,选择试管中加热,故A 不选;B.生成的乙酸乙酯混有乙酸、乙醇,通过饱和碳酸钠溶液吸收乙醇、中和乙酸、降低乙酸乙酯溶解度,防止倒吸导气管不能深入溶液,故B不选;C.饱和碳酸钠溶液吸收静置后,利用分液的方法分离,故C不选;D.图中是利用蒸发皿加热蒸发溶液得到溶质晶体的方法,在生成和纯化乙酸乙酯的实验过程中,操作未涉及,故D选。
2020年新高考全国卷Ⅰ化学高考试题(山东)(含答案)

山东省2020年普通高中学业水平等级考试化 学注意事项:1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Fe 56一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是 A .用冷水贮存白磷B .用浓硫酸干燥二氧化硫C .用酒精灯直接加热蒸发皿D .用二氧化碳灭火器扑灭金属钾的燃烧2.下列叙述不涉及氧化还原反应的是 A .谷物发酵酿造食醋 B .小苏打用作食品膨松剂 C .含氯消毒剂用于环境消毒D .大气中NO 2参与酸雨形成3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物Z 2X 2,Y 、W 最外层电子数相同。
下列说法正确的是 A .第一电离能:W>X>Y>Z B .简单离子的还原性:Y>X>W C .简单离子的半径:W>X>Y>ZD .氢化物水溶液的酸性:Y>W4.下列关于C 、Si 及其化合物结构与性质的论述错误的是A .键能C C>Si Si ——、C H>Si H ——,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p-p π键 5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是A.用甲装置制备并收集CO2B.用乙装置制备溴苯并验证有HBr产生C.用丙装置制备无水MgCl2D.用丁装置在铁上镀铜6.从中草药中提取的calebin A(结构简式如下)可用于治疗阿尔茨海默症。
最新2020年高考全国卷1理综(化学部分)试题及解析

最新2020年⾼考全国卷1理综(化学部分)试题及解析2020年⾼考全国卷1理综(化学部分)试题及答案可能⽤到的相对原⼦质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ar 40 Fe 56 I 127 ⼀、选择题:每⼩题6分。
在每⼩题给出的四个选项中,只有⼀项是符合题⽬要求的。
7.陶瓷是⽕与⼟的结晶,是中华⽂明的象征之⼀,其形成、性质与化学有着密切的关系。
下列说法错误的是A.“⾬过天晴云破处”所描述的瓷器青⾊,来⾃氧化铁B.闻名世界的秦兵马俑是陶制品,由黏⼟经⾼温烧结⽽成C.陶瓷是应⽤较早的⼈造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点9.实验室制备溴苯的反应装置如下图所⽰,关于实验操作或叙述错误的是A.向圆底烧瓶中滴加苯和溴的混合液前需先打开KB.实验中装置b中的液体逐渐变为浅红⾊C.装置c中的碳酸钠溶液的作⽤是吸收溴化氢D.反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯10.固体界⾯上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。
下图为少量HCl⽓体分⼦在253 K冰表⾯吸附和溶解过程的⽰意图。
下列叙述错误的是11.NaOH溶液滴定邻苯⼆甲酸氢钾(邻苯⼆甲酸氢钾H2A的Ka1=1.1×10?3,Ka2=3.9×10?6)溶液,混合溶液的相对导电能⼒变化曲线如图所⽰,其中b点为反应终点。
下列叙述错误的是A.混合溶液的导电能⼒与离⼦浓度和种类有关B.Na+与A2?的导电能⼒之和⼤于HA?的C.b点的混合溶液pH=7D.c点的混合溶液中,c(Na+)>c(K+)>c(OH?)12.利⽤⽣物燃料电池原理研究室温下氨的合成,电池⼯作时MV2+/MV+在电极与酶之间传递电⼦,⽰意图如下所⽰。
下列说法错误的是A.相⽐现有⼯业合成氨,该⽅法条件温和,同时还可提供电能B.阴极区,在氢化酶作⽤下发⽣反应H 2+2MV2+2H++2MV+C.正极区,固氮酶为催化剂,N2发⽣还原反应⽣成NH3D.电池⼯作时质⼦通过交换膜由负极区向正极区移动13.科学家合成出了⼀种新化合物(如图所⽰),其中W、X、Y、Z为同⼀短周期元素,Z核外最外层电⼦数是X核外电⼦数的⼀半。
2020年全国卷Ⅰ化学试题(含答案)

2020年高考全国I卷化学试卷可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27P 31 S 32 Cl 35.5 V 51 Fe 56一、选择题:本题共13个小题,每小题6分。
共78分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳8.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是A.分子式为C14H14O4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键9.下列气体去除杂质的方法中,不能实现目的的是气体(杂质)方法A.SO2(H2S)通过酸性高锰酸钾溶液B.Cl2(HCl)通过饱和的食盐水C.N2(O2)通过灼热的铜丝网D.NO(NO2)通过氢氧化钠溶液10.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是A.CH3COI是反应中间体B.甲醇羰基化反应为CH3OH+CO=CH3CO2HC.反应过程中Rh的成键数目保持不变D.存在反应CH3OH+HI=CH3I+H2O11.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核42He)轰击金属原子W Z X,得到核素30Z+2Y,开创了人造放射性核素的先河:WX+42He→30Z+2Y+10nZ其中元素X、Y的最外层电子数之和为8。
下列叙述正确的是A.W Z X的相对原子质量为26 B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸12.科学家近年发明了一种新型Zn−CO2水介质电池。
电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
2020年高考(新课标Ⅰ卷)化学试卷及答案

2020年普通高等学校招生全国统一考试(新课标Ⅰ卷)化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 P 31 S 32 Cl 35.5 V 51 Fe 56 一、选择题:本题共13个小题,每小题6分。
共78分。
7.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。
对于上述化学药品,下列说法错误的是A.CH3CH2OH能与水互溶B.NaClO通过氧化灭活病毒C.过氧乙酸相对分子质量为76D.氯仿的化学名称是四氯化碳8.紫花前胡醇可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是A.分子式为C14H14O4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键9.下列气体去除杂质的方法中,不能实现目的的是气体(杂质)方法A.SO2(H2S)通过酸性高锰酸钾溶液B.Cl2(HCl)通过饱和的食盐水C.N2(O2)通过灼热的铜丝网D.NO(NO2)通过氢氧化钠溶液10.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是A.CH3COI是反应中间体B.甲醇羰基化反应为CH3OH+CO=CH3CO2HC.反应过程中Rh的成键数目保持不变D.存在反应CH3OH+HI=CH3I+H2O11.1934年约里奥–居里夫妇在核反应中用α粒子(即氦核42He)轰击金属原子W Z X,得到核素30Z+2Y,开创了人造放射性核素的先河:WX+42He→30Z+2Y+10nZ其中元素X、Y的最外层电子数之和为8。
下列叙述正确的是A.W Z X的相对原子质量为26 B.X、Y均可形成三氯化物C.X的原子半径小于Y的D.Y仅有一种含氧酸12.科学家近年发明了一种新型Zn−CO2水介质电池。
电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
2020年全国I卷理综化学试题及参考答案
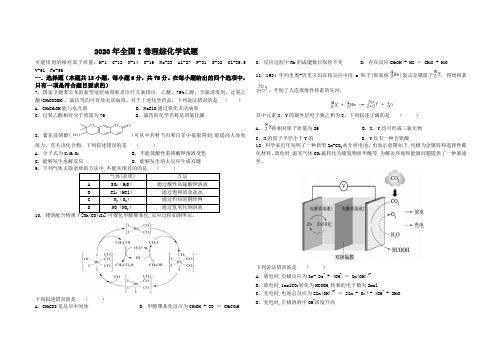
35.[化学——选修3:物质结构与性质](15分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
A.CH3COI是反应中间体B.甲醇羰基化反应为CH3OH+CO=CH3CO2H
C.反应过程中Rh的成键数目保持不变D.存在反应CH3OH+HI=CH3I+H2O
11. 1934年约里奥-居里夫妇在核反应中用a粒子(即氦核 )轰击金属原子 ,得到核素 ,开创了人造放射性核素的先河:
其中元素X、Y的最外层电子数之和为8。下列叙述正确的是( )
28.(14分)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g) + O2(g) SO3(g)ΔH=-98kJ·mol-1。回答下列问题:
(1)钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为______________。
(一)必考题(共129分)
26.(14分)
(1)加快酸浸和氧化反应速率(促进氧化完全)(2分)
(2)Fe2+(1分) VO++ MnO2+ 2H+= VO2++ Mn2++ H2O(2分)
(3)Mn2+(1分) Al3+和Fe3+(2分)
(4)Fe(OH)3(2分)
(5)NaAl(OH)4+ HCl = Al(OH)3↓ + NaCl + H2O(2分)
2020年全国统一高考化学试卷(新课标Ⅰ)附答案
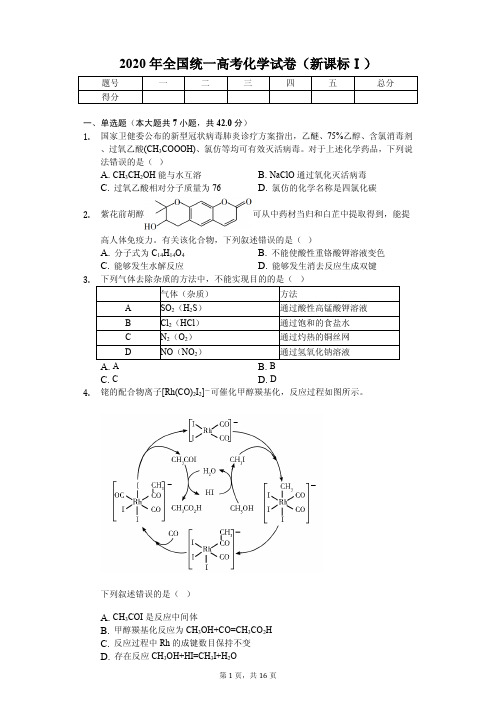
气体(杂质)
方法
A
SO2(H2S)
通过酸性高锰酸钾溶液
B
Cl2(HCl)
通过饱和的食盐水
C
N2(O2)
通过灼热的铜丝网
D
NO(NO2)
通过氢氧化钠溶液
A. A
B. B
C. C
D. D
4. 铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是( )
A. CH3COI 是反应中间体 B. 甲醇羰基化反应为 CH3OH+CO=CH3CO2H C. 反应过程中 Rh 的成键数目保持不变 D. 存在反应 CH3OH+HI=CH3I+H2O
三、简答题(本大题共 2 小题,共 29.0 分)
9. 硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是 SO2 的催化
氧
化:SO2(g)+ O2(g)
SO3(g) ΔH=−98 kJ·mol−1。回答下列问题:
(1)钒催化剂参与反应的能量变化如图(a)所示,V2O5(s)与 SO2(g)反应生成 VOSO4(s)和 V2O4(s)的热化学方程式为:_________________。
D. 充电时,正极溶液中 OH−浓度升高 7. 以酚酞为指示剂,用 0.1000 mol·L−1 的 NaOH 溶液滴定 20.00 mL 未知浓度的二元酸
H2A 溶液。溶液中,pH、分布系数 随滴加 NaOH 溶液体积
的变化关系如下
图所示。
[比如 A2−的分布系数:
]
第 2 页,共 16 页
下列叙述正确的是( )
(2)当 SO2(g)、O2(g)和 N2(g)起始的物质的量分数分别为 7.5%、10.5%和 82%时, 在 0.5MPa、2.5MPa 和 5.0MPa 压强下,SO2 平衡转化率 α 随温度的变化如图(b)所 示。反应在 5.0MPa、550℃时的 α=__________,判断的依据是__________。影响 α 的因素有__________。
2020年高考化学试题及答案(新高考一卷)

2020年高考化学试题及答案(新高考一卷)注意事项:1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1C12O16Na23Cl35.5Fe56一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.实验室中下列做法错误的是 A .用冷水贮存白磷B .用浓硫酸干燥二氧化硫C .用酒精灯直接加热蒸发皿D .用二氧化碳灭火器扑灭金属钾的燃烧2.下列叙述不涉及氧化还原反应的是 A .谷物发酵酿造食醋B .小苏打用作食品膨松剂C .含氯消毒剂用于环境消毒D .大气中NO 2参与酸雨形成3.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,基态X 原子的电子总数是其最高能级电子数的2倍,Z 可与X 形成淡黄色化合物Z 2X 2,Y 、W 最外层电子数相同。
下列说法正确的是 A .第一电离能:W>X>Y>ZB .简单离子的还原性:Y>X>WC .简单离子的半径:W>X>Y>ZD .氢化物水溶液的酸性:Y>W4.下列关于C 、Si 及其化合物结构与性质的论述错误的是A .键能C C>Si Si ——、C H>Si H ——,因此C 2H 6稳定性大于Si 2H 6B .立方型SiC 是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度 C .SiH 4中Si 的化合价为+4,CH 4中C 的化合价为-4,因此SiH 4还原性小于CH 4D .Si 原子间难形成双键而C 原子间可以,是因为Si 的原子半径大于C ,难形成p-p π键 5.利用下列装置(夹持装置略)进行实验,能达到实验目的的是A.用甲装置制备并收集CO2B.用乙装置制备溴苯并验证有HBr产生C.用丙装置制备无水MgCl2D.用丁装置在铁上镀铜6.从中草药中提取的 calebin A(结构简式如下)可用于治疗阿尔茨海默症。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
绝密★启用前2020 年普通高等学校招生全国统一考试理科综合能力测试 (化学)注意事项:1、答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
有一项是符合题目要求的。
2、回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
3、考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Al 27 P 31 S 32Cl 35.5 V 15 Fe 56一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸()3CH COOOH 、氯仿等均可有效灭活病毒。
对于上述化学药品, 下列说法错误的是32CH CH OH NaClO A .能与水互溶B .通过氧化灭活病毒 76C .过氧乙酸相对分子质量为D .氯仿的化学名称是四氯化碳8.紫花前胡醇()可从中药材当归和白芷中提取得到,能提高人体免疫力,有关该化合物,下列叙述错误的是 A .分子式为34244C H O B .不能使酸性重铬酸钾溶液变色 C .能够发生水解反应D .能够发生消去反应生成双键9.下列气体去除杂质的方法中,不能实现目的的是( )10.铑的配合物离子)22[Rh (CO I ]−可催化甲醇羰基化,反应过程如图所示:下列叙述错误的是A .3CH COI 是反应中间体B .甲醇羰基化反应为332CH OH+CO=CH CO H RhC .反应过程中的成键数目保持不变D .存在反应332CH OH+HI=CH I+H Oα11.1934年约里奥—居里夫妇在核反应中用粒子(即氦核42击金属原He )轰子WZ X ,得到核素30+Z 2Y ,开创了人造放射性核素的先河:W430 1Z2Z +20X He Y+n+⎯⎯→X Y 8其中元素、的最外层电子数之和为.下列叙述正确的是 W Z X A .的相对原子质量为26X Y B .、均可形成三氯化物 X Y C .的原子半径小于的Y D .仅有一种含氧酸12.科学家近年发明了一种新型2Zn-CO 水介质电池。
电池示意图如下,电极为金属锌和选择性催化材料。
放电时,温室气体2CO 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是A .放电时,负极反应为()24Zn 2e 4OH Zn OH −−−−+=B .放电时,21 mol CO 转化为HCOOH ,转移的电子数为2 mol C .充电时,电池总反应为()22242Zn OH =2Zn+O +4OH 2H O−−↑+D .充电时,正极溶液中OH −浓度升高13.以酚酞为指示剂,用10.1000 mol L −⋅的NaOH 溶液滴定20.00 mL 未知浓度的二元酸2H A 溶液。
溶液中,pH 、分布系数δ随滴加NaOH 溶液体积NaOH V的变化关系如下图所示。
[比如A 2−的分布系数:(A)2−(A )()+c (22=H A HAc cδ−−2)c (A +)−]下列叙述正确的是A .曲线①代表()2H A δ,曲线②代表()HA δ−B .2H A 溶液的浓度为10.2000mol L −⋅C .HA −的电离常数26=1.010K −⨯D .滴定终点时,溶液中()()()2Na 2A HA c c c +−−<+26.(14分)钒具有广泛用途。
黏土钒矿中,钒以3+、4+、5+价的化合物存在,还包括钾、镁的铝硅酸盐,以及2SiO 、34Fe O 。
采用以下工艺流程可由黏土钒矿制备43NH VO 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH 如下表所示:回答以下问题:(1)“酸浸氧化”需要加热,其原因是。
(2)“酸漫氧化”中,VO +和2+VO 被氧化成2VO +,同时还有离子被氧化,写出VO +转化为2VO +反应的离子方程式。
(3)“中和沉淀”中,钒水解并沉淀为232V O H O x ⋅,随滤液②可除去金属离子K+、2+Mg 、Na +、,以及部分的。
(4)“沉淀转溶”中,232V O H O x ⋅转化为钒酸盐溶解、滤渣③的主要成分是 。
(5)“调pH ”中有沉淀生成,生成沉淀反应的化学方程式是。
(6)“沉钒”中析出43NH VO 晶体时,需要加入过量4NH Cl ,其原因是。
27.(15分)为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验,回答下列问题:(1)由42FeSO 7H O ⋅固体配制140.10mol L FeSO −⋅溶液,需要的仪器有药匙、玻璃 棒、(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。
盐桥中阴、阳离子不与溶液中的物质 发生化学反应,并且电迁移率(u ∞)应尽可能地相近。
根据下表数据,盐桥中应选择(3)电流表显示电子由铁电极流向石墨电极。
可知,盐桥中的阳离子进入电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中()2+Fe c 增加了-10.02mol L ⋅。
石墨电极上未见Fe 析出。
可知,石墨电极溶液中()2+Fe =c 。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为 ,铁电极的电极反应式为。
因此,验证了2+Fe 氧化性小于,还原性小于。
(6)实验前需要对铁电极表面活化。
在4FeSO 溶液中加入几滴()243Fe SO 溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。
检验活化反应完成的方法是 。
28.(14分)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是2SO 的催化氧化:()()()2231SO g O g SO g 2+⎯⎯⎯⎯→钒催化剂1H 98 kJ mol −=−•。
回答下列问题:(1)钒催化剂参与反应的能最变化如图()a 所示,()22V O s 与()2SO g 反应生成()4VOSO s 和()24V O s 的热化学方程式为:___________。
(2)当()2SO g 、()2O g 和()2N g 起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa 、2.5MPa 和5.0MPa 压强下,2SO 平衡转化率α随温度的变化如图()b 所示。
反应在5.0MPa 、550C ︒时的α=__________,判断的依据是________。
影响α的因素有___________。
(3)将组成(物质的量分数)为()22% SO g m 、()2% O g m 和()2% N g q 的气体通入反应器,在温度t 、压强p 条件下进行反应。
平衡时,若2SO 转化率为α,则3SO 压强为_________,平衡常数p K =__________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,2SO 催化氧化的反应速率方程为:()0.811v k n ααα⎛⎫'=−− ⎪'⎝⎭式中:k 为反应速率常数,随温度t 升高而增大;α为2SO 平衡转化率,'α为某时刻2SO 转化率,n 为常数。
在'0.90α=时,将一系列温度下的k 、α值代入上述速率方程,得到~v t 曲线,如图()c 所示。
曲线上v 最大值所对应温度称为该α'下反应的最适宜温度m t 。
m t t <时,v 逐渐提高:m t t >后,v 逐渐下降。
原因是___________。
35.[化学——选修3:物质结构与性质](15分)等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡Goodenough 献而获得2019年诺贝尔化学奖。
回答下列问题:(1)基态2+Fe 与3+Fe 离子中未成对的电子数之比为。
(2)Li 及周期表中相邻元素的第一电离能(1I )如表所示。
()()11Li Na I I >,原因是。
()()()111Be B Li I I I >>,原因是。
(3)磷酸根离子的空间构型为 ,其中P 的价层电子对数为、杂化轨道类型为 。
(4)4LiFePO 的晶胞结构示意图图(a )所示。
其中O 围绕Fe 和P 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
每个晶胞中含有4LiFePO 的单元数有个。
电池充电时,4LiFePO 脱出部分+Li ,形成1-4Li FePO x ,结构示意图如(b )所示,则x =,()()2+3+Fe :Fe =n n 。
36.[化学——选修5:有机化学基础](15分)有机械,例如二甲基胺()、苯胺()、吡啶()等,在有机合成中应用很普遍,目前“有机超强碱”的研究越来越受到关注,以下为有机超强碱F 的合成路线:已知如下信息:③苯胺与甲基吡啶互为芳香同分异构体回答下列问题:(1)A的化学名称为。
(2)由B生成C的化学方程式为。
(3)C中所含官能团的名称为。
(4)由C生成D的反应类型为。
(5)D的结构简式为。
(6)E的六元环芳香同分异构体中,能与金属钠反应,且核磁共振氢谱有四组峰,峰面积之比为6:2:2:1的有种,其中,芳香环上为二取代的结构简式为。
