实验7-稀溶液的依数性
稀溶液依数性

仪器:温度计、烧杯、搅拌 器、滴定管等
实验步骤与操作
准备实验器材:烧杯、温度计、搅拌器、 滴定管等
配置稀溶液:按照一定比例配制不同浓 度的稀溶液
测量溶液温度:将溶液搅拌均匀后测量 其温度
滴定操作:将标准溶液滴加入稀溶液中 记录滴定数据
数据处理与分析:根据实验数据分析稀 溶液依数性的规律
实验结果与分析
在制药行业中稀溶 液依数性对于药物 的提取、分离和纯 化等过程具有重要 影响利用稀溶液依 数性可以提高药物 的纯度和收率。
稀溶液依数性在生物学中的应用
渗透压调节:稀 溶液中的溶质分 子可以影响细胞 的渗透压进而影 响细胞的吸水和 膨胀。
物质运输:稀溶 液中的溶质分子 可以影响物质的 跨膜运输例如葡 萄糖和氨基酸在 血液中的运输。
实验数据:测量 了不同浓度溶液 的蒸气压、凝固 点、沸点等数据
结果分析:通过 数据分析验证了 稀溶液依数性与 浓度之间的关系 得出了依数性的 规律
实验结论:实验 结果与理论预测 基本一致进一步 证实了稀溶液依 数性的存在
实验意义:实验 验证了稀溶液依 数性的理论为进 一步研究溶液性 质提供了实验依 据
添加标题
实例分析:以氯化钠为例 氯化钠溶于水后水分子的 偶极受到氯离子和钠离子 的静电吸引作用导致水分 子的偶极方向发生变化从 而影响了溶液的蒸气压、
沸点、凝固点等性质。
稀溶液依数性与溶剂性质的关系
溶剂的种类对稀溶液依数性有影响不同溶剂的稀溶液依数性不同。 溶剂的浓度对稀溶液依数性有影响溶剂浓度越高稀溶液依数性越明显。 溶剂的分子极性对稀溶液依数性有影响分子极性越强稀溶液依数性越明显。 溶剂的粘度对稀溶液依数性有影响粘度越大稀溶液依数性越不明显。
添加副标题
《基础化学》稀溶液的依数性

Kf称为质量摩尔凝固点降低常数,它只与 溶剂的本性有关。单位为: K ·kg ·mol-1.
注意:溶液的凝固点并不固定。
析出的是什么?上图
返回
沸点升高与凝固点降低的应用
T b K b bB
T f K f bB
T
K
bB
K
nB mA
K
mB MB mA
M
一、溶液的蒸气压下降 二、溶液的沸点升高与凝固点降低 三、溶液的渗透压力 (医学紧密相关)
第一节 蒸汽压下降
一、蒸气压
我们将与液相处与平衡时气相所具有的压强称为 该温度下的饱和蒸气压, 简称蒸气压 (vapor pressure), 常用符号 p 表示, 单位 Pa (帕)或 kPa (千帕)。
若半透膜两侧分别为稀溶液和浓溶液?
把这种溶剂分子自发地透过半透膜由纯溶剂 进入溶液或由稀溶液进入浓溶液的现象称为 渗透现象。
渗透现象产生的条件
图
(1)有半透膜的存在
(2)半透膜两侧单位体积内溶剂分子数不等
渗透的方向
由单位体积内溶剂分子数目多的一侧向单位 体积内溶剂分子数目少的一侧渗透。
由溶剂分子高浓度一侧向溶剂分子低浓度一 侧渗透。
返回
渗透平衡
单位时间内从膜两侧透过的溶剂分子数 相等,渗透作用达到平衡,称为渗透平衡。
平衡时溶剂分子的无规则热运动,扩散 仍在进行,只不过两个方向的速度相等。
动态平衡。
返回
渗透压力
在纯溶剂与溶液之间,为了使渗透现象不发生,必 须在溶液上施加一额外的压力,由此产生的压强正 好可以维持渗透平衡状态,这一额外压强在数值上 等于该溶液的渗透压力。
在一定温度下,难挥发性非电解质稀溶液 的蒸气压等于纯溶剂的蒸气压乘以溶液中溶 剂的摩尔分数。
稀溶液的依数性
液体
蒸 发
凝 聚
气体
3 解释实验现象 过程开始时,水和糖水均以蒸发为主。当蒸气压等于 p 时,
糖水与上方蒸气达到平衡。而 p0 > p ,即水并未与蒸汽达到平衡,
继续蒸发,以致于蒸气压大于 p , 水蒸气分子开始凝聚到糖 水中。
这又使得蒸气压不能达到 p0 于是, H2O 分子从水中蒸
固体
熔 凝
解 固
液体
若 p 固 > p 液, p 固 < p 液,
则平衡右移,固体熔解 , 则平衡左移,液体凝固 。 二 饱和蒸气压图
物质的饱和蒸气压 p,对温度 T 做图,即得到物质饱和蒸气
压图。下面是水,水溶液,冰体系的饱和蒸气压图。
p/Pa
1.013 10 5
A
l1
l2 A′
l1 水 l2 水溶液 l3 冰
度差造成的静压,称为溶液的渗透压,用 表示,单位为 Pa 。 三 渗透压公式 具有渗透压,是溶液的依数性质。它产生的根本原因也是相 界面上可发生转移的分子个数不同引起的。 经过长期研究,人们发现 , 1)温度相同时, 和溶液的体积摩尔浓度成正比; 2)浓度相同时, 和温度 T 成正比。 即
第三章
稀溶液的依数性
各种不同的物质的稀溶液,其化学性质各不相同,这是显然 的。但稀溶液的某些共性,与溶质的种类无关,只与溶液的浓度
相关。我们把这类性质称为稀溶液的依数性。
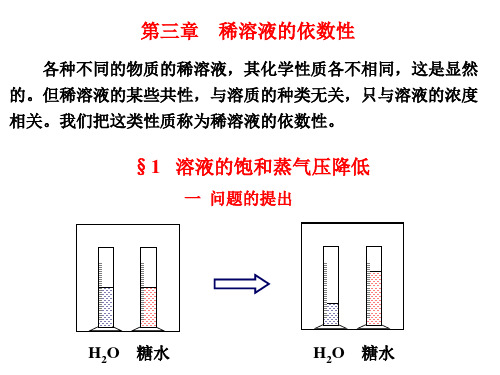
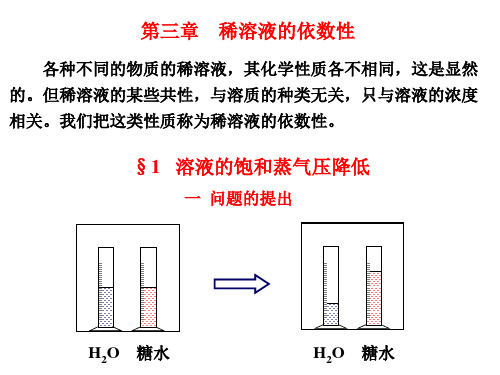
§1 溶液的饱和蒸气压降低
一 问题的提出
H2O 糖水
H2O 糖水
水自动转移到糖水中去,为什么? 这种转移,只能通过蒸气来进行。因此,要研究蒸气的行为, 才能弄清楚问题的实质。 二 饱和蒸气压 1 纯溶剂的饱和蒸气压 ( p0 ) 在密闭容器中,在纯溶剂的单位表面上,单位时间里,有 N0 个分子蒸发到上方空间中。
稀溶液的依数性详解
三 拉乌尔定律
1 溶液的浓度
每 dm3 溶液中含溶质的物质的量为摩尔浓度,也经常称为体
积摩尔浓度。( 单位 mol · dm-3 )
这种浓度使用方便,唯一不足就是其数值要随温度变化。
若用每 kg 溶剂中含溶质的物质的量来表示溶液的浓度,则称
为质量摩尔浓度。( 单位 mol ·kg -1 ) 质量摩尔浓度经常用 m 表示。 摩尔分数
随着上方空间里溶剂分子个数的增加,密度的增加, 分子凝
聚回到液相的机会增加。当密度达到一定数值时,凝聚的分子的
个数也达到 N0 个。这时起,上方空间里溶剂分子的个数不再改变,
蒸气的密度也不再改变,保持恒定。
此时,蒸气的压强也不再改变。这个压强称为该温度下溶剂 的饱和蒸汽压,用 p0 表示。这时液相和气相之间实现相平衡。 蒸 凝 发 聚
故有
p = p0 · X质 。 对于稀的水溶液,有
m p p 0 55.5
一定温度下,p0 为常数。故上式可以写成
p = k ·m
( k 为常数,但对于不同溶剂 k 值不同 )
稀溶液饱和蒸气压下降值,与稀溶液的质量摩尔浓度成正比。 这是 Raoult 定律的又一种表述形式。
§2 溶液沸点升高和凝固点降低
液体
蒸 发
凝 聚
气体
3 解释实验现象 过程开始时,水和糖水均以蒸发为主。当蒸气压等于 p 时,
糖水与上方蒸气达到平衡。而 p0 > p ,即水并未与蒸汽达到平衡,
继续蒸发,以致于蒸气压大于 p , 水蒸气分子开始凝聚到糖 水中。
这又使得蒸气压不能达到 p0 于是, H2O 分子从水中蒸
611
溶液的依数性

溶液的依数性溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关系,与溶质本性无关。
依数性分别用拉乌尔定律、沸点升高、凝固点降低和渗透压公式定量描述。
溶液的依数性所谓“依数性”顾名思义是依赖于数量的性质。
稀溶液中溶剂的蒸气压下降、凝固点降低、沸点升高及渗透压等的数值均与稀溶液中所含溶质的数量有关,这些性质都称为稀溶液的依数性。
1.蒸气压下降对二组分稀溶液,溶剂的蒸气压下降已如式(2-67)所述Δp=p*A-pA=p*AxB即Δp的数值正比溶质的数量—溶质的摩尔分数xB,比例系数即为纯A的饱和蒸气压p*A。
2.凝固点(析出固态纯溶剂时)降低稀溶液当冷却到凝固点时析出的可能是纯溶剂,也可能是溶剂和溶质一起析出。
当只析出纯溶剂时,即与固态纯溶剂成平衡的稀溶液的凝固点Tf比相同压力下纯溶剂的凝固点T*f 低,实验结果表明,凝固点降低的数值与稀溶液中所含溶质的数量成正比,比例系数kf叫凝固点下降系数它与溶剂性质有关而与溶质性质无关。
详细推导3.沸点升高沸点是液体或溶液的蒸气压p等于外压pex时的温度。
若溶质不挥发,则溶液的蒸气压等于溶剂的蒸气压p=pA,对稀溶液pA=p*AxA,pA<p*A,所以在p—T图上稀溶液的蒸气压曲线在纯溶剂蒸气压曲线之下,由图可知,在外压pex时,溶液的沸点Tb必大于纯溶剂羝液的沸点Tb必大于纯溶剂的沸点T*b,即沸点升高。
实验结果表明,含不挥发性溶质的稀溶液的沸点升高亦可用热力学方法推出,kb叫沸点升高系数。
它与溶剂的性质有关,而与溶质性质无关。
4.渗透压若在U形管中用一种半透膜把某一稀溶液和溶剂隔开,这种膜允许溶剂但不允许溶质透过。
实验结果表明,大量溶剂将透过膜进入溶液,使溶液的液面不断上升,直到两液面达到相当大的高度差时才能达到平衡。
要使两液面不发生高度差,可在溶液液面上施加额外的压力,假定在一定温度下,当溶液的液面上施加压力为∏时,两液面可持久保持同样水平,即达到渗透平衡,这个∏值叫溶液的渗透压。
稀溶液的依数性

稀溶液的依数性:当溶质溶解在溶剂中形成溶液后,溶液的蒸气压下降,沸点升高,凝固点降低及产生渗透压等性质,只与溶质中粒子的数目有关,而与溶质的本性无关。
由于这类性质的变化,只适用于稀溶液,故称之为稀溶液的依数性。
人工降雨:①根据开尔文公式RTlnPr/P0=2rVm/R’,最初生成的雨滴半径很小,所以其蒸气压很高,此时对平面液体过饱和度达4的水蒸气,对极小的水滴仍未达饱和,所以这个新的液构很难凝聚出来。
②而空气中的灰尘常会作为凝聚中心促使雨滴形成,若在这种水蒸气过饱和度已超过4的云层中,用火箭或撒入干冰提供凝聚中心,使凝聚水滴的曲率半径增大。
由laplace方程,Ps=2Y/R’,其相应的饱和蒸气压变小,蒸汽会还原凝结成冰。
暴沸:①通常在液态有机物中,溶解的空气很少,在蒸馏过程中,液体中形成的蒸汽泡内壁是一个凹液面。
②根据开尔文公式RTlnPr/P0=2rVm/R’可知,凹面上的R’越小,小蒸汽泡内的蒸气压就越低,所以在相同温度下,小蒸汽泡的蒸气压比平面液体的P0低很多;此时液体内部产生气泡所承受的压力P’1=P大气+P平面+Ps,所以当T超过正常沸点时,液体内部的小蒸汽泡无法形成,溶液无法沸腾。
③继续加热,直至小气泡开始形成,气泡一旦形成后便不断变大。
由laplace公式,Ps=2Y/R’,随着R’增大,Ps下降,而P静在气泡上升阶段中不断下降,此时Ti>T正常,故此很容易产生暴沸现象。
盐碱地农作物枯死:①农作物的生长需要水分,然而盐碱地中盐碱浓度大,此时化学势UA 较低,农作物的中心浓度较盐碱地低,其化学式势UB>UA。
②由UB>UA,土地中的渗透压>农作物中的渗透压,农作物中的水分通过细胞壁渗透到土壤中,导致细胞枯萎。
分解电压:电解质在电极上分解生成电解产物所需施加的最小电压。
析出电压:当外加电压等于分解电压时两极的电极电位,是开始析出物质时所必须的最小析出电位。
电极极化的意义:电极上有电流通过时,就会有净反应发生,表明电极失去了原有的平衡状态,电极电位将偏离平衡电位。
大学化学稀溶液的依数性
什么是稀溶液的依数性?
溶液的性质有别于溶质和溶剂,可分为 两类:一类是由溶质的本性决定的;另一类 性质则只与溶质、溶剂微粒(分子、离子) 数的比值有关,而与溶质的本性无关,这类 性质称为稀溶液的依数性。
溶液的性质
非依数性 依数性
颜色 酸碱性 导电性 粘度 相对密度
蒸气压下降 沸点升高 凝固点降低 渗透压
2.1 溶液的蒸气压下降(Vapor Pressure Lowering)
2.1.2 溶液的蒸气压下降
定义 纯溶剂在一定温度下,其蒸气压是一定值,当在 此溶剂中加入少量的难挥发的非电解质溶质时,此 溶液的蒸气压会小于纯溶剂的蒸气压,这种现象称 为溶液的蒸气压下降。
原因 溶液表面的某些部位被溶质分子所占据,而溶
一、溶液的沸点升高
溶液的沸点升高与溶质的质量摩尔浓度的关系 由于 ΔTb ∝ Δp,Δp ∝ bB 故 ΔTb ∝ bB 即 ΔTb = Tb - Tb0 = Kb bB 式中Kb为溶剂的质量摩尔沸点升高常数,它只与
溶剂的本性有关,单位为K·kg·mol-1
溶液的沸点升高是稀溶液的依数性 上式表明 ,难挥发性非电解质稀溶液的沸点升高
利用溶液的沸点升高和凝固点降低都可以测定溶质的相 对分子质量
医学和生物科学实验中凝固点降低法的应用更为广泛。 这是因为:
① 对同一溶剂来说,Kf总是大于Kb,所以凝固点降低法 测定时的灵敏度高;
② 用沸点升高法测定相对分子质量时,往往会因实验温 度较高引起溶剂挥发,使溶液变浓而引起误差;
0.150 (mol kg )
0.100
实验测得溶液中各种溶质的总质量摩尔浓度为
T f b总 K f
1.1 0.591(mol kg 1 ) 1.86
稀溶液的依数性
稀溶液的依数性凝固点是物质的液相和固相建立平衡的温度。
达到凝固点时,液、固两相的蒸气压必定相等,否则两相不能共存。
(纯水的凝固点为273.16 K(0.009 9℃),这时水和冰的蒸气压均为610.6 Pa(4.58 mm Hg))。
溶液凝固点是指从溶液中开始析出溶剂晶体时的温度。
这时体系是由溶液(液相)溶剂(固相)和溶剂(气相)所组成。
(对于水溶液,溶剂固相即纯冰。
由于溶液蒸气压下降,当273.16 K时,冰的蒸气压仍为610.6 Pa,而溶液蒸气压必然低于610.6 Pa,这样,溶液和冰就不能共存,只有在273.15 K以下的某个温度时,溶液蒸气压才能和冰的蒸气压相等,这时的温度才是溶液的凝固点。
这段话可以用图2-5-2表示)溶液的凝固点总是比纯溶剂的低的现象称为凝固点下降。
(溶液浓度越大,蒸气压下降越多,凝固点下降也越多。
在同一溶液中,随着溶剂不断结晶析出,溶液浓度将不断增大,凝固点也将不断下降。
)溶液凝固点下降是由于溶液蒸气压下降引起的。
对于稀溶液,既然蒸气压下降Dp和溶液的质量摩尔浓度mB成正比,这类溶液的凝固点下降也应和质量摩尔浓度有联系。
Raoult根据依数性指出:对于难挥发非电解质的稀溶液,凝固点下降ΔTf和溶液质量摩尔浓度成正比,即:ΔTf=Tf°-Tf=KfmB式中:Tf为溶液的凝固点;Tf°为纯溶剂的凝固点;Kf为溶剂的凝固点下降常数,Kf由溶剂的本性决定而与溶质的种类无关。
凝固点降低的应用1.生活方面:将食盐和冰混合,可以使温度降低到251 K。
氯化钙与冰混合,可以使温度降低到218 K。
(体系温度降低的原因是:当食盐或氯化钙与冰接触时,在食盐或氯化钙的表面形成极浓的盐溶液,而这些浓盐溶液的蒸气压比冰的蒸气压低得多,冰则以升华或熔化的形式进入盐溶液。
进行上述过程都要吸收大量的热,从而使体系的温度降低。
)冬天在室外施工,建筑工人在砂浆中加入食盐或氯化钙;汽车驾驶员在散热水箱中加入乙二醇等等,也是利用这一原理,防止砂浆和散热水箱结冰。
稀溶液的依数性
四、溶液的渗透压
放置一段 时间后!
纯水
糖水
糖水的蒸气压低于纯水的蒸气压 空气中只有水分子能通过
糖水
胡罗卜
液柱产生的静压力阻止了水继续向管中渗透
阻止渗透所需要的外界静压力,叫渗透压,记作。
渗透压大小的计算——范特荷甫方程(van’t Hoff equation) 1886年,荷兰物理化学家J.H.van’t Hoff发现非电解质稀溶 液的渗透压的大小,可以用与理想气体状态方程(pV = nRT)形 式相似的方程式计算: V = nRT 式中: ——渗透压 V——m3 ( 体积) R——8.314 (Pa m3 mol-1 K-1) 溶液的渗透压与溶质的本性无关,只与溶质的浓度有关——依数性。
除液体外,固体也有饱和蒸气压。如干冰、萘、碘等固体,蒸气 压很大,可直接由固体变成气体(升华)。
饱和蒸气压与物质的种类有关。有些物质的蒸气压很大,如乙醚、 汽油等,有些物质的蒸气压很小,如甘油、硫酸等。蒸气压的大小, 与液体分子间的吸引力有关,吸引力越大,蒸气压越小。
极性分子的吸引力强,蒸气压小。非极性分子的吸引力小,蒸气压大。 分子量越大,分子间的作用力越强,蒸气压越小。
溶液的蒸气压下降,等于纯溶剂的蒸气压,乘溶质的 摩尔分数,而与溶质的本性无关。
对于稀溶液:nA>> nB, 所以 nA+nB nB
nA p nB
p0
三、溶液的沸点上升、凝固点下降
1、什么是沸点和凝固点? 沸点:液体沸腾时的温度。此时液体的饱和蒸气压等于 外界大气的压力。 凝固点:物质由液态变为固态时的温度,或固态变为掖 态时的温度。
*渗透压的应用、计算举例 (p60 例 2-1)
电解质对生命体的重要性 反渗透法制备纯净水
稀溶液的依数性
稀溶液的依数性难挥发的非电解质稀溶液的性质(稀溶液的蒸气压下降、沸点上升、凝固点下降和溶液的渗透压)跟溶入一定量溶剂中溶质的物质的量成正比,而跟溶质的本性无关。
这种性质叫做稀溶液的依数性。
稀溶液的这些性质仅仅依赖于溶质的粒子数目的多少,而跟溶质的本性无关。
在一定温度下,稀难挥发的非电解质稀溶液的性质(稀溶液的蒸气压下降、沸点上升、凝固点下降和溶液的渗透压)跟溶入一定量溶剂中溶质的物质的量成正比,而跟溶质的本性无关。
这种性质叫做稀溶液的依数性。
稀溶液的这些性质仅仅依赖于溶质的粒子数目的多少,而跟溶质的本性无关。
在一定温度下,稀溶液的蒸气压下降是跟溶入这溶剂中溶质的物质的量分数成正比,而跟溶入溶质的性质无关。
它的数学表达式是p0(剂)-p=△p=p0(剂)·X(质)。
其中p0(剂)是纯溶剂的蒸气压,p是溶液的蒸气压,△p是溶液蒸气压下降,X(质)是溶质的物质的量占溶液物质的量的分数。
溶有难挥发非电解质的稀溶液的沸点升高度数跟溶液的质量摩尔浓度成正比。
它的数学表达式是沸点上升常数(只跟溶剂有关),m b是溶液的质量摩尔浓度。
溶有难挥发非电解质的稀溶液的凝固点下降度数跟溶液的质量摩尔浓度成正比。
其数学表达式是△t f=K f·m B。
式中△t f 是凝固点下降度数(纯溶剂凝固点和溶液凝固点的差),K f是溶剂的凝固点下降常数(只跟溶剂有关),m B是溶液的质量摩尔浓度。
稀溶液的渗透压跟溶液的浓度、绝对温度成正比,而跟溶质的本性无关。
它的数学表示式是πV=nRT。
式中π是溶液的渗透压,V是溶液的体积,R是通用气体常数,T是热力学温度,n是溶液中溶入溶质的物质的量。
稀溶液的依数性有广泛的应用,例如,由测定物质的冰点下降和沸点上升来推断物质的分子量,由测定渗透压推断蛋白质、血红素等大分子物质的分子量,利用凝固点下降制作防冻剂和致冷剂,在生物和医学上制作等渗溶液(0.9%的生理盐水)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
——凝固点降低法测定葡萄糖的摩尔质量
授课教师:王楚涵
一、实验目的
1
通过实验加深对稀溶液依数性的理解。
2
了解凝固点降低法测定溶质摩尔质量的原理及方法。习刻 度分值为0.1℃的温度计的使用。
二、实验原理
1、稀溶液的依数性
蒸汽压下降、沸点升高、凝固点降低及渗 透压的改变——难挥发、非电解质、稀溶液。 稀溶液的依数性与在一定量的溶剂中所溶 解的溶质粒子数成正比,而与溶质的本性无关 ΔTf=kf· bB (7-1) 其中,ΔTf为凝固点降低值; bB为溶质B的质量摩尔浓度;
三、实验用品
仪器
分析天平,温度计(精密,最小刻度:0.1 ℃), 移液管(25mL),洗耳球,烧杯(500mL) 大试管,铁 架台,钥匙。 试剂 葡萄糖(s),NaCl(s),粗食盐(s),冰。 材料 玻璃棒、金属丝搅拌棒、胶塞。
四、实验内容
1、安装仪器
用分析天平称取1.3~1.4g 葡萄糖,加到干燥的大 试管中。用移液管量取25.00mL蒸馏水,注入大试管 中。将葡萄糖完全溶解后(注意使大试管内壁上残余 葡萄糖完全溶解),用带有温度计和金属搅拌棒的胶 塞将大试管口塞好,调节温度计高度,使水银球完全 浸入葡萄糖溶液中。向大试管中装入1/2 体积的冰块 和1/4体积的水,在加入3~4勺粗食盐,作为冰盐浴, 图7-3为仪器装置图 。
五、数据处理
凝固点测定记录 测定次数 纯水/℃ 葡萄糖溶液/℃ 1 2 3 平均值/℃
计算3次试验测量值的平均值,求出ΔTf,利用 公式7-3计算出葡萄糖的摩尔质量。
六、思考题
1、凝固点降低法可测量哪些物质的摩尔质量? 2、血清、尿液等生物样品,是否可通过测量器 溶液的凝固点降低值来计算其渗透压力? 3、医学上常需配制等渗溶液,能否通过测量该 溶液的凝固点降低值以确定该溶液是否为等渗溶液? 以水为溶剂时,等渗溶液的凝固点降低值应是多少?
二、实验原理
2、纯溶剂的冷却曲线
图中,ΔTf0为纯溶剂的凝固点。在本实验中,冰盐 浴使水的温度逐渐下降至过冷(T降低),而结冰是个放 热过程(T升高),结冰时二者达到平衡,所以结冰时温 度保持相对恒定,直到完全结冰后温度才继续下降。
二、实验原理
3、溶液的冷却曲线 图中,ΔTf为溶液的凝固点。 本实验冰盐浴使溶液的温度逐渐下 降至过冷(T降低),结冰是个放 热过程(T升高);与纯溶剂不同 的是溶液过冷后,水骤然结冰,与 此同时溶液的浓度增大,导致溶液 的凝固点会进一步降低。 所以在溶剂析出的过程中体系 的温度没有一个相对恒定的阶段, 通常把温度回升的最高点作为该溶 液的凝固点(ΔTf)。
kf为溶液的凝固点降低常数。
二、实验原理
根据溶质B的质量摩尔浓度定义,公式(7-1)可 改写为 ΔTf=(kf· mB)/(mA· MB) MB=(kf· mB)/ (mA·ΔTf) 其中,mB为溶质B的质量; mA为溶剂A的质量; (7-2) (7-3)
MB为溶质B的摩尔质量。 通常,采用过冷法测量纯溶剂或溶液的凝固点。
装置图(暂缺)
四、实验内容
2、溶液凝固点的测量 按图 7-3 的装置,将大试管放入冰盐浴中,使溶 液液面低于冰盐浴的液面。上下移动金属丝搅拌棒, 使溶液慢慢冷却,注意观察温度计读数,待有固体开 始析出时,停止搅拌。记录温度回升时所达到的最高 温度,取出大试管,使冰融化,再重复测量 2次。要 求:3次测量值的极差小于0.05℃。 3、溶剂凝固点的测量
洗净大试管、温度计和金属丝搅拌棒,放入约 20mL蒸馏水,用上述方法测量溶剂的凝固点。重复测 量2次。要求:3次测量值的极差小于0.03℃。
四、实验内容
注意
先测量溶液的凝固点,后测量纯溶剂的凝固 点——只有一个干燥的大试管。
想一想 (1)为什么水的体积不必准确量取? (2)为什么要求测量水比测量溶液的偏差小? (3)大家都知道水的凝固点是0℃ ,实验中为 什么还要测定纯水的凝固点?
