类风湿因子液体试剂盒(免疫透射比浊法)使用指南
类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)产品技术要求shangjing

类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中类风湿因子的含量1.1 包装规格试剂1:1×80mL,试剂2:1×20mL;试剂1:50×240μL,试剂2:1×3mL;试剂1:30×240μL,试剂2:1×1.8mL。
1.2 主要组成成分2.1 外观和性状试剂1为清澈透明的液体,无沉淀、悬浮物和絮状物。
试剂2为乳白色悬浮液,无沉淀。
2.2 净含量每瓶试剂的净含量应不少于标示值。
2.3 试剂空白吸光度用纯化水加入试剂作为样品测试时,试剂空白吸光度A应≤1.60。
2.4 分析灵敏度测含已知浓度的类风湿因子(RF)样本时,吸光度差值(ΔA)应≥0.10。
2.5 线性试剂盒在[3,160]IU/mL的线性范围内分析性能应符合如下要求:2.5.1 线性相关系数(r)≥0.990;2.5.2 相对偏差:浓度在(10,160]IU/mL范围内,相对偏差不超过8%;2.5.3 绝对偏差:浓度在[3,10]IU/mL范围内,绝对偏差不超过0.8IU/mL。
2.6 测量精密度2.6.1 重复性用高低两个浓度样本重复测试,所得结果的变异系数(CV)应≤8.0%。
2.6.2 批间差试剂盒的批间相对极差(R)应≤10.0%。
2.7 准确度与已上市产品比对,线性回归方程的相关系数(r)≥0.975,各个浓度点中≤10IU/mL的绝对偏差不超过±0.8IU/mL,各个浓度点中>10IU/mL的相对偏差不超过±10%。
2.8 稳定性2℃~8℃避光贮存,有效期为12个月,取过有效期后一个月内的试剂盒进行检测,试剂盒应仍能符合2.1、2.3、2.4、2.5、2.6.1、2.7要求。
艾威德 类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)说明书

类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)说明书【产品名称】类风湿因子(RF)测定试剂盒(胶乳免疫比浊法)【包装规格】a)试剂1:1×20mL试剂2:1×5mLb)试剂1:2×40mL试剂2:1×20mLc)试剂1:4×60mL试剂2:2×30mLd)试剂1:2×80mL试剂2:2×20mL【预期用途】用于体外定量测定人血清中类风湿因子的含量。
类风湿因子的检测可以作为类风湿性关节炎的诊断依据,也可作为病情进展的指标。
另外有助于诊断系统性红斑狼疮、慢性肝炎等。
测定类风湿因子常用于类风湿性关节炎的辅助诊断依据[1]。
【检验原理】类风湿因子是和人IgG的Fc片段起免疫反应。
用人IgG包被胶乳微粒和样本中RF发生免疫反应,引起微粒凝聚,致使浊度增加,其增加的程度与RF的含量成正相关。
【主要组成成分】试剂1主要组分三羟甲基氨基甲烷缓冲液18.5mmol/L 聚乙二醇(PEG)4% ProClin300适量试剂2主要组分三羟甲基氨基甲烷缓冲液18.5mmol/L 抗原致敏胶乳类风湿因子(RF)抗体适量ProClin300适量注:不同批号试剂盒中各组分未经试验不可互换。
【储存条件及有效期】1.试剂原包装在2~8℃储存,有效期为12个月,生产日期、有效期见标签。
2.开口后的试剂在仪器仓中(2~8℃)可稳定30天。
【适用仪器】艾威德AS-420/AS-660/AS-1200;日立HITACHI7020型/7060型/7180型/7600型/LABOSPECT008AS型;贝克曼AU400/AU480/AU640/AU680/ AU2700/AU5400/AU5800/AU5811/AU5821;佳能TBA-FX8/TBA-120FR/ TBA-2000FR;罗氏cobas8000c702/cobas8000c701/cobas8000c502;西门子SIEMENS ADVIA1800/ADVIA2400;雅培ABBOTT ARCHITECT c8000/ARCHITECT c16000/ARCHITECT ci8200;西森美康SYSMEX BM6010/C;科华KHB卓越310/卓越330/卓越400/卓越450/ZY-1200/ ZY-1280;迪瑞CS-240/CS-T300/CS-300B/CS-380/CS-400A/CS-400B/ CS-600A/CS-600B/CS-800A/CS-800B/CS-1200/CS-1200ISE/CS-1300B/ CS-1400;迈瑞MINDRAY BS-220/BS-330/BS-350E/BS-380/BS-390/ BS-400/BS-430/BS-600/BS-800/BS-2000M;颐兰贝ES-200/ES-380/ES-480;赛诺迈德SUNMATIK-9050型;雷杜Chemray420;英诺华D280;特康TC6010L;锦瑞GS400;普康6066。
类风湿因子测定试剂盒(胶乳免疫比浊法)产品技术要求jiuqiang

类风湿因子测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人血清中类风湿因子的含量。
1.1 包装规格表1 包装规格试剂1:3×20mL、试剂2:1×20mL试剂1:1×60mL、试剂2:1×20mL试剂1:8×3.8mL、试剂2:4×2.6mL试剂1:2×15mL、试剂2:1×10mL试剂1:6×50mL、试剂2:2×50mL试剂1:12×4.2mL、试剂2:6×2.9mL试剂1:1×45mL、试剂2:1×15mL试剂1:1×15mL、试剂2:1×5mL320测试/盒(试剂1:3×20mL、试剂2:1×20mL)400测试/盒(试剂1:3×20mL、试剂2:1×20mL)480测试/盒(试剂1:3×20mL、试剂2:1×20mL)校准品(液体,4水平或5水平):4×1mL;5×1mL;5×2mL质控品(液体,水平1):1×3mL;1×1mL质控品(液体,水平2):1×3mL;1×1mL1.2 主要组成成分表2 主要组成成分试剂成分浓度试剂1:氨基乙酸缓冲液0.17mol/L试剂2:乳胶颗粒超敏化的变性IgG悬浮液0.17%(w/v)校准品(液体):人血清基质类风湿因子≥10%4水平:水平1:0~20 IU/mL水平2:20~60 IU/mL 水平3:50~100 IU/mL 水平4:100~140 IU/mL5水平:水平1:0~15 IU/mL 水平2:15~30 IU/mL 水平3:30~60 IU/mL 水平4:60~100 IU/mL 水平5:100~140 IU/mL质控品(液体):人血清基质类风湿因子≥10%水平1: 10~30 IU/mL 水平2: 25~50 IU/mL试剂中含有防腐剂。
类风湿因子(RF)校准品产品技术要求mairui

1 性能指标
2.1外观和性状
2.1.1颜色性状
无色或浅黄色液体。
2.1.2包装
分装瓶为白色半透明硬质塑料瓶,盖有塑料旋盖;盒贴、瓶贴、标签标识应完整、清晰。
2.2装量
液体校准品的装量应不少于标示值。
2.3溯源性
2.3.1参考值表
校准品应可提供所包含检测项目的参考值表。
2.3.2赋值准确性
经校准品校准的迈瑞BS 系列检测由高一级测量程序定值的参考血清,结果的偏倚应满足表2 要求。
表 1 校准品赋值准确性的允许偏倚范围
2.3.3参考方法及测量不确定度
应提供对校准品进行赋值时采用的参考方法及对应的测量不确定度计算方法。
2.4均一性
2.4.1瓶内均一性
校准品瓶内均一性应不大于表3 的要求(SD 和CV 值满足其一即可)。
表 3 校准品瓶内均一性的指标要求
2.4.2瓶间均一性
校准品瓶间均一性应不大于表4 的要求(SD 和CV 值满足其一即可)。
1
表 4 校准品瓶间均一性的指标要求
2.5生物安全性
使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂对校准品中HBsAg、HIV 抗体、HCV 抗体、梅毒螺旋体TP 抗体检测应为阴性。
2。
类风湿因子测定试剂盒(胶乳免疫透射比浊法)产品技术要求新产业
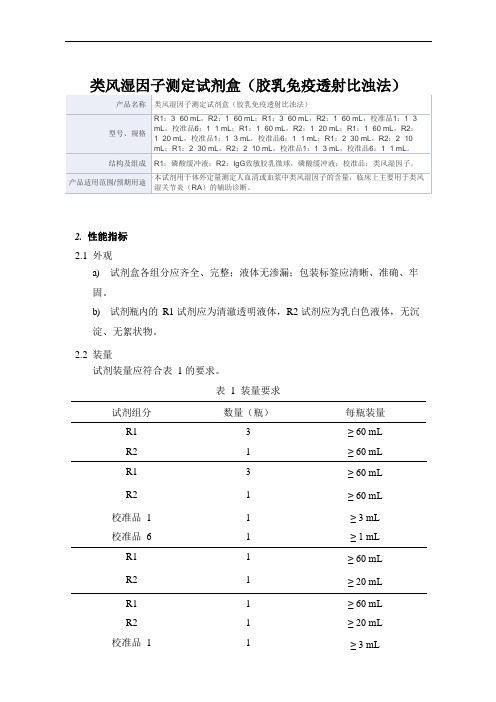
类风湿因子测定试剂盒(胶乳免疫透射比浊法)2.性能指标2.1外观a)试剂盒各组分应齐全、完整;液体无渗漏;包装标签应清晰、准确、牢固。
b)试剂瓶内的R1 试剂应为清澈透明液体,R2 试剂应为乳白色液体,无沉淀、无絮状物。
2.2装量试剂装量应符合表 1 的要求。
表 1 装量要求试剂组分数量(瓶)每瓶装量R1 3 ≥ 60 mLR2 1 ≥ 60 mLR1 3 ≥ 60 mLR2 1 ≥ 60 mL 校准品 1 1 ≥ 3 mL校准品 6 1 ≥ 1 mLR1 1 ≥ 60 mLR2 1 ≥ 20 mLR1 1 ≥ 60 mLR2 1 ≥ 20 mL 校准品 1 1 ≥ 3 mL校准品 6 1 ≥ 1 mL R1 2 ≥ 30 mL R2 2 ≥ 10 mL试剂组分数量(瓶)每瓶装量R1 2 ≥ 30 mLR2 2 ≥ 10 mL 校准品 1 1 ≥ 3 mL校准品 6 1 ≥ 1 mL2.3空白限应≤4.00 IU/mL。
2.4检出限试剂盒检出限不高于 6.00 IU/mL。
2.5线性区间试剂盒线性在[10.00,140.00] IU/mL 区间内,应符合如下要求:a)线性相关系数(r)≥0.990;b)[10.00,14.00] IU/mL 区间内,线性绝对偏差在±1.40 IU/mL 范围内;(14.00,140.00] IU/mL 区间内,线性相对偏差在±10%范围内。
2.6精密度2.6.1重复性试剂盒测试浓度在(15.00±3.00)IU/mL 和(50.00±10.00)IU/mL 范围内的样本时,变异系数(CV)≤10.0%。
2.6.2批间差试剂盒测试浓度在(15.00±3.00)IU/mL 和(50.00±10.00)IU/mL 范围内的样本时,相对极差(R)≤10.0%。
2.7准确度可选用以下方法之一进行验证:a)测试公认参考物质,相对偏差在±10%范围内。
类风湿因子测定试剂盒(胶乳免疫比浊法)产品技术要求zhongshengbeikong

类风湿因子测定试剂盒(胶乳免疫比浊法)适用范围:本试剂用于体外定量测定人血清中类风湿因子的浓度。
1.1包装规格液体双剂型试剂1(R1):60mL×2,试剂2(R2):20mL×2;试剂1(R1):60mL×1,试剂2(R2):20mL×1;试剂1(R1):45mL×1,试剂2(R2):15mL×1;试剂1(R1):75mL×1,试剂2(R2):25mL×1。
1.2主要组成成分1.2.1 试剂1(R1)(液体)甘氨酸100mmol/L 1.2.2 试剂2(R2)(液体)包被变性IgG抗体的胶乳颗粒2mg/mL2.1 外观试剂盒中各组件的外观应满足:2.1.1 试剂1(R1)应为无色或淡黄色透明溶液,无杂质、无絮状物,外包装完整无破损;2.1.2 试剂2(R2)应为乳白色乳浊溶液,无杂质、无絮状物,外包装完整无破损。
2.2 净含量液体试剂净含量应不少于标示值。
2.3 试剂空白吸光度在波长570nm(540nm~600nm)处(光径1cm),试剂空白吸光度(A)应≤1.000。
2.4 准确度测定WHO W1066,相对偏差应不超过±15%。
2.5 分析灵敏度对应于浓度为20 IU/mL 的RF所引起的吸光度差值(△A)的绝对值应在0.010~0.030的范围内。
2.6 重复性重复测定高、低浓度样本,变异系数(CV)应≤ 10%。
2.7 批间差重复测定同一样本,批间差(R)应≤ 10%。
2.8 线性范围在[5,120]IU/mL范围内,线性相关系数(r)应≥0.990,在(20 ,120] IU/mL范围内,线性相对偏差应不超过±10%,在[5,20] IU/mL范围内,线性绝对偏差应不超过±2IU/mL。
2.9 稳定性原包装的试剂盒在2℃~8℃避光贮存,有效期为12个月。
试剂有效期满后3个月以内,试剂性能应符合2.1、2.3、2.4、2.5、2.6、2.8的要求。
类风湿因子(RF)测定试剂盒(免疫比浊法)产品技术要求lideman

类风湿因子(RF)测定试剂盒(免疫比浊法)适用范围:本产品用于体外定量测定人血清中类风湿因子的含量。
1.1包装规格试剂1(R1):2×60mL、试剂2(R2):2×12mL;试剂1(R1):1×20mL、试剂2(R2):1×6mL;试剂1(R1):1×60mL、试剂2(R2):1×12mL;试剂1(R1):2×80mL、试剂2(R2):2×16mL;试剂1(R1):1×80mL、试剂2(R2):1×16mL;试剂1(R1):2×400mL、试剂2(R2):2×80mL;试剂1(R1):1×1000mL、试剂2(R2):1×200mL;试剂1(R1):1×5000mL、试剂2(R2):1×1000mL;试剂1(R1):2×61mL、试剂2(R2):2×13mL;640测试/盒:【试剂1(R1):2×61mL、试剂2(R2):2×12mL】;960测试/盒:【试剂1(R1):3×60mL、试剂2(R2):3×12mL】。
1.2 主要组成成分1.2.1试剂组成试剂1(R1)(以下简称R1),试剂2(R2)(以下简称R2)。
R1:磷酸盐缓冲液(pH7.4)含高分子强化剂(聚乙二醇6000),含0.095%的叠氮化钠。
R2:Rf抗体试剂抗人Rf抗体,含0.095%的叠氮化钠。
2.1 外观液体双试剂: R1:无色澄清液体, R2:浅黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 空白吸光度在37℃、340 nm波长、1cm光径条件下,试剂空白吸光度应<0.08 ABS。
2.4 分析灵敏度浓度为33IU/mL时,吸光度变化范围在(0.008~0.08)之间。
2.5 线性在[2,300]IU/mL线性范围内,线性相关系数r2≥0.995。
类风湿因子测定试剂盒(胶乳免疫比浊法)产品技术要求shouyi

类风湿因子测定试剂盒(胶乳免疫比浊法)
适用范围:本试剂盒用于体外定量测定人血清中的类风湿因子的含量。
1.1产品型号/规格
1.2产品组成
试剂1:PBS 100mmol/L,PEG 4%。
试剂2:变性IgG 10mg/mL,NaN
0.1%,吐温-20 0.2%。
3
2.1 外观
试剂1为无色透明溶液;试剂2为稍有混浊的透明液体;试剂盒各组分齐全、完整,液体无渗漏,包装标签文字符号清晰牢固不易脱落,外包装完整无破损。
2.2 装量
液体试剂的净含量应不少于标示值。
2.3 试剂空白吸光度
在600nm波长、1cm光径条件下,试剂空白吸光度应不大于0.70。
2.4 分析灵敏度
测定30IU/mL类风湿因子时,吸光度变化在0.0198~0.0786范围内。
2.5准确度
采用比对试验,相关系数r2≥0.95,相对偏差应不超过±10%。
2.6 精密度
2.6.1 重复性
用血清样品或质控样品重复测试所得的变异系数(CV)应不大于8.0%。
2.6.2 批间差
试剂(盒)批间相对极差应不大于10.0%。
2.7线性区间
试剂线性在[15,80]IU/mL区间内:
a) 线性相关系数|r|应不小于0.990;
b) [15,80]IU/mL区间内,线性相对偏差应不超过±10%。
2.8稳定性
原包装试剂2~8℃避光保存有效期12个月,到效期末进行检验,检验结果应符合2.3、2.5、2.7的要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本试剂盒用于体外定量测定人血清或血浆类风湿因子。
【产品信息】
货号试剂盒规格
170229910021 试剂1 5×25ml+试剂2 1×25ml 170229910730 试剂1 4×20ml+试剂2 2×8ml 170209910059 5×1ml TruCal RF (类风湿因子校准品)
5个不同浓度水平的校准品
【摘要】
类风湿因子(RF)是一类自身抗体,包括所有类型的免疫球蛋白。
它们是抗变性或聚合IgG分子Fc片段的抗体[1]。
诊断所检测的RF主要是IgM类RF,用来检出各种类风湿疾病,是炎症的起源[2]。
大约70%~80%的类风湿性关节炎(RA)患者RF为阳性,但是并不特异,因为RF浓度的升高还出现在非类风湿疾病中。
在无RA临床症状的高龄人群中,阳性率达到大约10%[3]。
检测RF为鉴别诊断风湿疾病提供了重要的信息[4]。
另外,RA中的高浓度RF值常和疾病的进行性临床发展有关。
但是RF的阳性结果必须结合临床或其他检验结果予以证实。
【方法】
免疫透射比浊终点测定法。
【原理】
使用热聚合IgG和样品中的类风湿因子进行抗原-抗体反应,形成抗原-抗体复合物,进行透射比浊终点测定。
【试剂】
在测定时的各组分和浓度
试剂1(R1):
磷酸缓冲液pH 7.4 40 mmol/L
试剂2(R2):
热聚合人IgG 适量
试剂稳定性与贮存
试剂避光保存于2~8℃,若无污染,可稳定至失效期。
试剂不可冰冻!
注意事项
1. 试剂中含叠氮钠(0.95g/L),不可入口,避免接触皮肤及粘膜。
2. 应采取必要的预防措施使用试剂。
废液处理
参照各地方法规要求。
试剂准备
试剂为即用式。
未提供的实验所需物品
9 g/L氯化钠溶液
一般的实验室仪器设备
【标本】
血清,肝素或EDTA血浆。
不要使用含氟化钠的血样收集瓶。
稳定性:20-25℃保存可稳定1天
2-8℃保存可稳定3天
-20℃保存可稳定4周
不可使用已被污染的标本。
【测定程序】
若需要自动生化分析仪应用参数,请随时和公司联系。
测定条件
波长340 nm,Hg 334nm
比色杯光径 1.0 cm
温度37℃
分析类型终点法
检测扣除试剂空白
操作步骤
R1(试剂1)
R2(试剂2)
A1,然后加R2: 50 μl
: 15 μl
〃R1: 250 μl
ΔA=[(A2-A1) 校准品管或样品管] – [(A2-A1)空白管]
【计算】
按照公司配套校准品使用要求,用5个不同水平的校准液,连同9g/L氯化钠溶液为空白。
经测定后,由仪器自动对校准品响应量通过合适的数学模型如Logit/Log,拟合成校准曲线,校准仪器后,在病人结果可报告范围内,仪器直接报告可靠的检测结果。
校准稳定期:4周
【校准品和控制品】
建议使用DiaSys公司提供的TruCal RF 校准品系列对自动分析仪进行校准。
每批样品检测时,建议使用DiaSys公司提供的TruLab 【性能特性】
病人结果可报告范围
本公司对内含RF浓度水平低于某商品化试剂检测限的10份血清进行了检测,这10份血清的检测均值为5 IU/ml,均值加3倍标准差为12 IU/ml,因此认为只有当样品中RF浓度≥ 12 IU/ml时,本试剂才可以将其和不含RF的样品加以区分。
本法对RF的检测上限为700 IU/ml。
当样品测定值超过上限时,应将样品用9 g/L氯化钠溶液作1+ 1稀释,重新测定,结果乘以2。
前带限制
血清RF值≤ 3000 IU/ml时,没有观察到前带效应。
特异性/干扰
当样品中抗坏血酸浓度≤1704 μmol/L,胆红素浓度≤684 μmol/L,血红蛋白浓度≤ 5 g/L,甘油三酯浓度≤22.6 mmol/L时没有观察到干扰。
灵敏度/检测限
记录吸光度A2
1
对9 g/L氯化钠溶液用本试剂进行重复测定,以均值加3倍
标准差的方式计算RF检测限为1 IU/ml。
方法学比较
本公司的试剂盒(y)与某商品化采用免疫透射比浊法原理的
试剂盒(x),同时对75个样品进行RF检测,将检测结果作
方法学比较,其统计结果如下:y=1.23x -0.31 IU/ml;r = 0.949。
本公司的试剂盒(y)与某商品化采用免疫散射浊度法原理的
试剂盒(x),同时对22个样品进行RF检测,将检测结果作
方法学比较,其统计结果如下:y=0.83x+6.82 IU/ml;r = 0.888。
【参考范围】[5]
健康人群RF浓度预期值为< 10 IU/ml
(注:各实验室应有自己的参考范围。
)
【参考文献】
1. Winchester RJ. Characterization of IgG complexes in
patients with rheumatoid arthritis. Ann N Y Acad Sci 1975;256:73-81.
2. Moore TL, Dorner RW. Rheumatoid factors. Clin
Biochem 1993;26:75-84.
3. Shmerling RH, Delbanco TL. The rheumatoid factor: an
analysis of clinical utility. Am J Med 1991;91:528-34.
4. Mannik M. Rheumatoid factors in the pathogenesis of
rheumatoid arthritis. J Rheumatol Suppl 1992;32:46-9. 5. Mierau R, Genth E.. Autoantibodies in rheumatoid
arthritis. In: Thomas L. Clinical Laboratory Diagnostics.
1st ed. Frankfurt: TH-Books Verlagsgesellschaft;
1998.p.810-3.
2。
