钠的转化关系图
钠元素及其化合物(共10张PPT)

体验热身
下列关于金属钠的叙述,错误的是( ) A.钠的还原性很强,只能以化合态存在于自然界 B.钠质地柔软,可用小刀切割,保存在煤油中 C.钠失火后可用大量水或泡沫灭火器扑灭 D.钠的焰色反应为黄色,可用在雾天做指示灯
答案:C
解析:钠失火后生成Na2O2,它与水或CO2反应会生成O2使得火势增大,应 用沙子 扑灭。
2ห้องสมุดไป่ตู้
2↑
由于钠极易与水反应,所以不能用钠把居于金属活动性顺序钠之后的金属从其盐溶液中置换出来。
溶液和稀盐酸反应的化学方程式为: NaHCO ③2Na2O2+2H2O===4NaOH+O2↑;
钠失火后可用大量水或3泡沫灭火器扑灭
钠的还原性很强,只能以化合态存在于自然界
金属钠还N用a来H制C取钛O,3及+生H产C氢氧l=化=钠=、N氨基a钠C、l+氰C化钠O等2。↑+H2O
钠的用途:
金属钠用途非常广泛,工业价值非常大。 其主要用于:氨钠法制 氰化钠;利用钠的强还原性,置换氧化钾制金属钾;还原四氯化 用钠金具属 有钠很与强氨的钛反还应原制生性成,海氨可基以绵钠从作一钛为些染熔,料融还工的业金可制属选卤制靛化兰物稀粉中的把有中金间属金体置;换属出来钽。 和铌;利用钠易形成合金的性质, 高纯度钠可以配作为制原子铅反应钠堆的合热载金体生。 产四乙基铅,提高汽油的辛烷值,增加抗爆能力; ⑤Na22NCaOO3H++HCC配Ol=2===制=N=aNH钾aC2COO钠3+3N+合HaC2Ol 金; 作冷却剂;利用钠易被氧化的性质,生产过氧化钠 还原四氯化钛作制海为绵钛漂,还白可制工稀有业金的属钽漂和铌白; 剂,不可制成超氧化钠作为人工氧源;生产 钠Na具H有CO很3强+H的C氢还l==原=化性Na,C钠可l+H以作2从O+一为C些O2熔治↑融金的金工属卤业化物锌中把铁金属板置换的出来去。 锈剂;用金属钠与氨反应生成氨 2金可C属利O钠 用3、与沉Na汞淀H反法C基 三O应,加3生和入钠 甲成盐Ba汞酸作 醋C齐反l2,溶应为 、这液种,染 甲产合生金料 酸白是色工 三一沉种淀业 乙活的泼是制 酯的N还a2选等原CO剂靛医3,;也在兰药可许利多粉中用时气候的间体比法纯中体,滴钠加更间;稀适盐体高用酸。,;纯立即生度产生产钠气泡硼可的是氢以Na化作HCO钠为3,开,原始无原子气泡甲反产生酸应的是 Na2CO3。 堆的热载体。
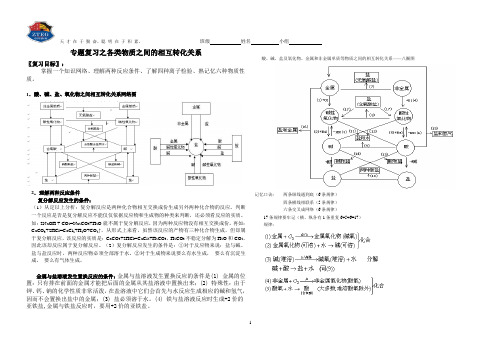
各类物质之间的相互转化关系
天才在于勤奋,聪明在于积累。
班级姓名小组专题复习之各类物质之间的相互转化关系〖复习目标〗:掌握一个知识网络、理解两种反应条件、了解四种离子检验、熟记忆六种物质性质。
1.酸、碱、盐、氧化物之间相互转化关系网络图2.理解两种反应条件复分解反应发生的条件:(1)从定以上分析:复分解反应是两种化合物相互交换成份生成另外两种化合物的反应。
判断一个反应是否是复分解反应不能仅仅依据反应物和生成物的种类来判断,还必须看反应的实质。
如:2NaOH + CO2=Na2CO3+H2O就不属于复分解反应,因为两种反应物没有相互交换成份。
再如:CaCO3+2HCl=CaCl2+H2O+CO2↑,从形式上来看,虽然该反应的产物有三种化合物生成,但却属于复分解反应,该反应的实质是:CaCO3+2HCl=CaCl2+H2CO3,H2CO3不稳定分解为H 2O和CO2,因此该却反应属于复分解反应。
(2)复分解反应发生的条件是:①对于反应物来说:盐与碱、盐与盐反应时,两种反应物必须全部溶于水。
②对于生成物来说要么有水生成,要么有沉淀生成,要么有气体生成。
金属与盐溶液发生置换反应的条件:金属与盐溶液发生置换反应的条件是(1) 金属的位置:只有排在前面的金属才能把后面的金属从其盐溶液中置换出来;(2) 特殊性:由于钾、钙、钠的化学性质非常活泼,在盐溶液中它们会首先与水反应生成相应的碱和氢气,因而不会置换出盐中的金属;(3) 盐必须溶于水。
(4) 铁与盐溶液反应时生成+2价的亚铁盐,金属与铁盐反应时,要用+2价的亚铁盐。
酸、碱、盐及氧化物、金属和非金属单质等物质之间的相互转化关系——八圈图记忆口诀:两条纵线通到底(6条规律)四条横线相联系(5条规律)六条交叉成网络(6条规律)17条规律要牢记(横、纵各有1条重复6+5+6=17)规律:天才在于勤奋,聪明在于积累。
班级姓名小组分解反应以上规律的应用:①可知某物质性质②某物质制法(箭尾)(箭头指向)③各类物质间相互关系从上述规律中可以总结出制盐的十种方法,包括:(2)~(16)【典型例题】[例1] 现有石灰石、水、碳酸钠,怎样制取烧碱(不能引入其他物质),写出化学方程式。
九年级化学物质转化关系图·优选.

一、初中化学物质的转化关系1、氧气、氧化物、酸、氢气、水H2OKMnO4↘↓↑↗CO、CO2↗SO2H2SO4H2O2→→P2O5+ Mg Al Zn Fe→ H2→H2O ↘MgO HClKClO3↗↓↘Al2O3 Fe3O42、碳与碳的化合物3、氢氧化钠、碳酸钠、氯化钠+ CO2↗ Na2SO4 → BaSO4↓(白)NaOH → Na2CO3 → CaCO3↓(白)(变质)↘ NaCl → AgCl↓(白)4、含钙化合物的关系:↙↗―――――――↘↖CaCO3→CaO→Ca(OH)2→CaCl2↖CO2↙5、氧化钡、氢氧化钡与硫酸钡word.word. ↗BaCl 2 → BaSO 4↓(白)BaO → Ba(OH)2 ↗↘ + CuS O 4↘Cu(OH)2↓(蓝)6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵CuO ↗ CO 2↙ ↘ Ca(HCO 3)2 → CaCO 3→CaOCuSO 4.5H 2O →CuSO 4→ Cu ↘ H 2O↗Na 2CO 3 ↗ NH 3 → NH 3.H 2ONaHCO 3 →CO 2 NH 4HCO 3 → H 2O↘H 2O → H 2CO 3 ↘ CO 2 → H 2CO 37、铝、镁、锌、铁、铜及其化合物↗ZnSO 4↖ ↗ AlCl 3↖Zn → ZnO Al → Al 2O 3 ↘ZnCl 2↙ ↘Al 2(SO 4)3↙Fe Al↗MgCl 2↖ ↙﹉﹉﹉﹉↗ CuCl 2↘↖Mg → MgO Cu ←→CuO Cu(OH)2 ↘MgSO 4↙ ↖____↘ CuSO 4↗↙Fe Al↙ FeCl 3 ↖ C CO H 2 Mg Al ↗FeSO 4Fe(OH)3 Fe 2O 3 ←――――→ Fe↖Fe 2(SO 4)3↙ O 2 H 2O ↘ FeCl 28、常见物质的相互转化关系(即注明必要的反应物、反应条件)CO 2 CO C 或O 2 O 2 H 2O H 2O 2Al 2O 3 AlCl 3 Al CuO CuSO 4 Cu ⑴ ⑵ ⑶ ⑷ MgO MgSO 4 Mg Cu H 2 Fe CaO Ca(OH)2 CaCO 3 CaCl 2 Ca(OH)2CaCO 3 ⑸ ⑹ ⑺ ⑻word.最新文件---------------- 仅供参考--------------------已改成word 文本 --------------------- 方便更改 CaCO 3 Na 2CO 3 CO 2 CO 2 NaOH Na 2CO 3 CO 2 O 2 H 2O NaOH NH 4ClNH 3 ⑼ ⑽ ⑾ ⑿。
初中化学常见物质转化关系
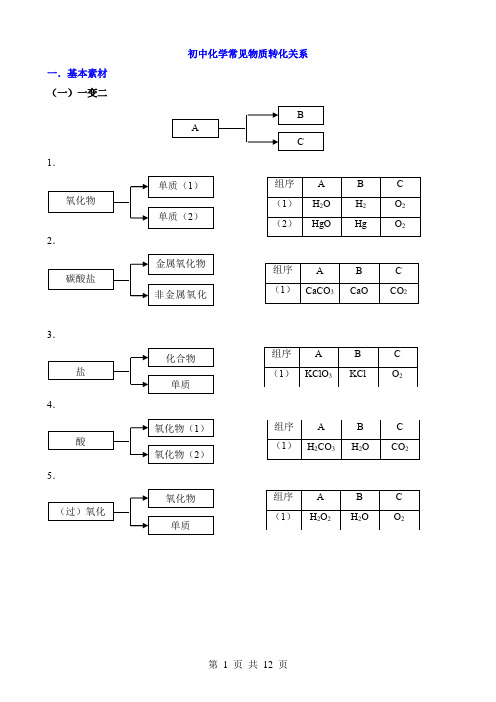
初中化学常见物质转化关系
一.基本素材 (一)一变二
1.
2.
3.
4.
5.
1.
2.
3.
4.
1.置换类
2.还原类
3.氧化类
4.氧化物、酸碱盐类
二.特定素材 (一)直线型互变
1.直线型“两点”互变(含同元素)
(1) (2
) (3)
(4)
(5) (6)
(7)
(8)
2.直线型“三点”互变
(1 (2
(3
(4
三.试题常用框图素材 (一)同元素变化 1.循环类三角形变化
2.指向类三角形变化
3.指向返回类三角型变化
4.循环返回类三角型变化
(二)异元素变化 指向型三角形变化
(三)四边形类变化 1.殊途同归
2. 循环
(四)杂类 1.一变三
2.“二”变“三”
3.二变三
四.六个“核心”变化
O 2、H 2 、H 2O 、CO 2、CO 和Na 2CO 3等六种物质,在中考推断题中是不可缺少的命题“元素”,相关变化列举如下。
(一).二氧化碳的变化
(二).水的变化
(三).氧气的变化
(四).一氧化碳的变化
(五).氢气的变化
(六).碳酸钠的变化。
高中化学常见的元素及其化合物性质与转化思维导图

常见元素及其化合物性质与转化一、典型元素及其化合物的转化关系
1.氯气及其化合物间的转化关系
2.硫及其化合物间的转化关系
3.氮气及其化合物间的转化关系
4.钠及其化合物间的转化关系5.铝及其化合物间的转化关系6.铁及其化合物间的转化关系
、典型非金属单质的化学性质
、典型非金属氧化物性质
四、典型金属氧化物性质
五、典型金属氢氧化物性质
六、物质的特殊转化关系1.交叉型转化
2.三角型转化
七、特征反应
通电
2NaCl +2H2O 2NaOH+Cl2↑+H2↑
通电
2CuSO4 +2H2O 2Cu+O2↑+2H2SO4
通电
4AgNO 3 +2H2O 4Ag+O2↑+4HNO3
少量单质乙过量单质乙
少量O2过量O2 CO 2 C 2CO2
少量Fe 过量Fe
在溶液中:FeCl3Cl2FeCl2 ( FeBr3 Br2 FeBr2 )
化合物B 少量单质乙
单质甲化合物
A
少量O2过量O2
Na2O 2 Na 2Na2O2型的反应:
电解生成三种物质的反应。
必修一物质转化关系图示
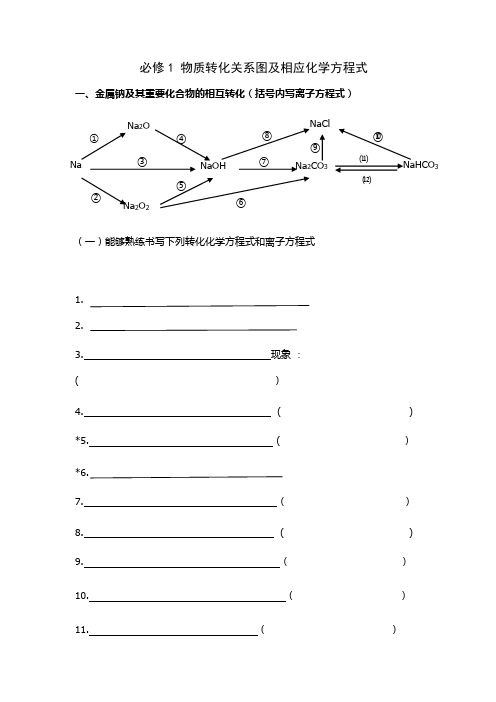
必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)(一)能够熟练书写下列转化化学方程式和离子方程式1. 2.3. 现象 : ( )4. ( ) *5. ( ) *6.7. ( ) 8. ( ) 9. ( ) 10. ( ) 11. ( )Na 2O Na ①NaCl NaHCO 3Na 2CO 3NaOH Na 2O 2②③④⑤⑥⑦⑧ ⑨ ⑩⑾⑿[NaHCO 3固体](二) 熟记下列物质的颜色状态Na: Na 2O: Na 2O 2: NaHCO 3: Na 2CO 3:(三) 熟记下列信息溶解度: NaHCO 3 Na 2CO 3溶液碱性强弱: NaHCO 3 Na 2CO 3 俗名: NaHCO 3: Na 2CO 3: Na 的保存: Na 2O 2的用途:二、金属铝及其重要化合物的相互转化(括号内写离子方程式)1. 2.3. ( )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3 ①② ③ ④ ⑤ ⑥ ⑦ ⑧5. ( ) 6. ( ) 7. ( ) 8. ( ) 9.实验制取Al (OH )3:( ) 10.Al 2O 3的用途:三、金属铁及其化合物的相互转化(括号内写离子方程式)1.2. ( )3. ( )4. ( )5. ( )①Fe 3O 4②23⑿7. ( )8. ( )9. ( )10.属于化合反应的 ( )印刷腐蚀电路板的 ( )11.12.白色沉淀,然后迅速变为灰绿色,最后变为红褐色13.离子颜色:Fe2+ Fe3+四、非金属氯及其化合物的相互转化(括号内写离子方程式)1.2.3.4. NaCl23AgCl⑤⑥⑦⑧6. ( )7. ( )8. ()9. ()10. ()11. ()12. ()13. ()()14.五、非金属硫及其化合物转化关系1.2.3.9.10111213182021六、氮及其化合物相互转化。
初中化学物质转化关系图

↙↗―――――――↘↖ CaCO3→CaO→Ca(OH)2→CaCl2
↖CO2↙
..
.
5、氧化钡、氢氧化钡与硫酸钡
↗BaCl2→BaSO4↓〔白〕 BaO→Ba(OH)2↗
↘ + CuSO4 ↘Cu(OH)2↓〔蓝〕
6、硫酸铜、碳酸氢钙、碳酸氢钠、碳酸氢铵
一初中化学物质的转化关系11氧气氧化物酸氢气水hh22ookmno44coco22so22hh22so44hh22oo22oo22pp22oo55mgalznfehh22hh22oomgohclkclo33al22oo3fe33oo4422碳与碳的化合物33氢氧化钠碳酸钠氯化钠co22na22ssoo44baso44白naohna22co33caco33白变质naclagcl白44含钙化合物的关系
.
一、初中化学物质的转化关系
1、氧气、氧化物、酸、氢气、水 H2O
KMnO4↘↓↑↗CO、CO2 ↗SO2H2SO4
H2O2→O2→P2O5+ MgAlZnFe→H2→H2O ↘MgOHCl
KClO3↗↓↘Al2O3 Fe3O4
2、碳与碳的化合物
3、氢氧化钠、碳酸钠、氯化钠 + CO2↗Na2SO4→BaSO4↓〔白〕 NaOH → Na2CO3→CaCO3↓〔白〕
CuO↗CO2 ↙↘Ca(HCห้องสมุดไป่ตู้3)2→CaCO3→CaO CuSO4.5H2O→CuSO4→ Cu↘H2O
↗Na2CO3↗NH3 →NH3.H2O NaHCO3 →CO2NH4HCO3→ H2O
↘H2O → H2CO3↘ CO2→H2CO3
7、铝、镁、锌、铁、铜与其化合物
金属钠及其化合物的性质

△
4 Li + O2 = 2Li2O
△
2Na+O2 = Na2O2
2Li + 2H2O = 2LiOH+H2↑
2、差异性原因:随着核电荷数的增加, 碱金属元素原子的电子层数___________, 原子逐核渐对增最多外层电子的引力___________, 所以逐碱渐金减属弱元素的性质也有差异。从锂到 铯,原子的失电子能力 ____逐__渐__增__强_________,元素的金属性 __逐__渐__增__强___,具体表现在:
不稳定 2Na2O+O2=∆2Na2O2
较稳定
保存
隔绝空气、密封保存 隔绝空气,密封保存
用途
————
氧化剂、供氧剂、 漂白剂、杀菌剂
1、氧化钠与过氧化钠用化学的方法如何鉴别 (选择简易可行的)
2、过氧化钠逐渐撒入酚酞的水溶液中,有关现 象是什么?若用石蕊代替酚酞会有什么不同?
(二)、氢氧化钠
1、化学式:NaOH
电子式:Na+
•• ••
••
O•• H
-
2、物理性质
俗名烧碱、火碱、苛性钠,是一种白色固 体,易吸收空气中的水分而潮解,易溶于 水并放热,水溶液有涩味,有强腐蚀性。
注:可做干燥剂 碱性气体 (NH3) 中性气体 (H2、O2、N2等)
(三)、碳酸钠和碳酸氢钠
化学式
俗 名
状 态
颜 色
溶解度 比较
NaHCO3 小苏打 细小晶体 白色 易溶于水
HCl + NaHCO3 === NaCl + CO2 ↑ + H2O
注:利用此现象可不用其他试剂鉴别Na2CO3溶液和盐酸
2、与碱反应 A、与NaOH一类碱反应 NaHCO3 + NaOH === Na2CO3 + H2O B、与Ca(OH)2一类碱反应 Na2CO3 + Ca(OH)2 === 2NaOH + CaCO3↓
