抗体酶
抗体酶

抗体酶的研究,为人们提供了一条合理途径去 设计适合于市场需要的蛋白质,即人为地设计 制作酶。它是酶工程的一个全新领域。利用动 物免疫系统产生抗体的高度专一性,可以得到 一系列高度专一性的抗体酶,使抗体酶不断丰 富。随之出现大量针对性强、药效高的药物。 立体专一性抗体酶的研究,使生产高纯度立体 专一性的药物成为现实。以某个生化反应的过 渡态类似物来诱导免疫反应,产生特定抗体酶, 以治疗某种酶先天性缺陷的遗传病。抗体酶可 有选择地使病毒外壳蛋白的肽键裂解,从而防 止病毒与靶细胞结合。抗体酶的固定化已获得 成功,将大大地推进工业化进程。
其它名称 反应可逆 二烯合成 [4+2]环加成 二烯 dienes 亲二烯体 dienophiles
环己烯衍生物
R
O C R(H) W CO2R(H) CN NO2
(吸电子基)
有利因素:
G
OR NHR
(给电子基)
Diels-Alder反应机理
G W + G G
六员环过渡态 协同机理
G
G W
W
2、抗体结合位点化学修饰法: 抗体酶和酶一样也可以用化学修 饰法加以改造。对抗体酶进行结 构修饰的关键是找到一种温和的 方法在抗体结合位置或附近引入 具有催化功能的基团。游离巯基 就是适合的基团之一,它具有高 亲核性,易于氧化,及能通过二 硫化物进行交换反应或亲电反应 而选择性修饰的特点
3 . 引入辅助因子法
结果按这种设想所得到的抗体不仅使酯 的水解速度增加了103~104倍,而且还具 备专一性、 pH依赖性及被抑制剂抑制等 酶的基本特性。抗体酶的催化活性虽然 仍比天然酶小,但这意味着可按人的意 愿来设计和生产具有已知结合专一性的 蛋白质,在理论上和实践上均有重要意 义。美国已将抗体酶技术商品化,在第 一批具有应用价值的抗体酶中有与蛋白 酶相似的抗体,可在特定的氨基酸序列 上切割蛋白质,从而建立具有各种专一 性的切割蛋白质抗体酶库,就像限制性 核酸内切酶库一样供研究者选用。
抗体酶
制备方法
• 1、杂交瘤技术 • 经体内免疫后再进行细胞融合是制备抗体酶的一种传统方法。 杂交瘤技术的基本原理是用不能在培养液中生长的但能产生抗 体的脾脏细胞,与能在培养液中生长的骨髓瘤细胞进行融合, 融合得到的杂交细胞既能产生抗体又能在体外培养,通过选择 培养,以获取能产生单克隆抗体的杂交瘤细胞。再把这些细胞 单克隆化,即繁殖成母体的同一细胞或形成菌落。这些菌落能 够产生单一均匀的抗体,可用于进行单克隆抗体的扩大生产。 对这些菌落用酶联免疫吸附法等方法加以筛选。该制备方法的 关键是要有合适而稳定的过渡态模拟物作半抗原,以产生与过 渡态高度亲和的抗体酶。由于大多数反应过渡态类似物的分子 量较低,即所谓的半抗原,他们本身免疫原性很弱,必须与某 种载体偶联才能表现免疫原性。本方法所得到的抗体酶的催化 能力的高低,在很大程度上取决于化学模型物的设计,现在应 用的设计策略包括:诱导和转化设计,反应免疫,“潜过渡态” 半抗原设计等等。
• 2、抗体结合部位修饰法 • 将催化基团或辅助因子引入到抗体的抗原结合部位,一 般可采用两种方法:即选择性化学修饰法和基因工程定 点突变法。抗体酶和酶一样也可以用化学修饰的方法加 以改造。对抗体酶进行结构修饰的关键,是找到一种吻 合的方法在抗体结合位置或附近引入酶的催化基 空间排布恰到好处,就能产生高活力的抗体酶。为提高 抗体酶的催化能力,可采用邻近效应,静电催化,应变, 功能团催化等方法,在抗体结合位点引入催化基团。基 因工程定点突变法是利用位点专一性突变引起抗体结合 部位氨基酸的改变,能在抗体结合部位换上有催化作用 的氨基酸,进而改变抗体酶的催化效率。目前,定点突 变的方法己成为提高抗体酶活性的一种常规方法。
• 3、克隆免疫反应因子的基因 • 通过PCR技术克隆出全套免疫球蛋白的可变位点 使它们随机地将基因的轻重链结合,这些含上利用了免疫因子的多样性, 通过这种方法我们可从上百万种可能性中选择 抗体酶。[1]
抗体酶及其应用

抗体酶是具有催化性质的抗体,它同时具备抗体和酶的特征,可催化多种化学反应,如酰基转移、酯水解、酰胺水解、重排反应、光诱导反应、氧化还原分应、金属螯合反应等。
用人工方法合成的抗体酶,可作为研究酶作用机理的有力工具,用于催化大量天然酶不能催化的立体专一性反应,更为开发具有高度选择性的药物指明了方向。
本文对抗体酶的研究开发思路和历史、催化反应类型、制备方法及发展前景作了综述。
关键词抗体酶过渡态类似物催化反应抗体酶是具有催化性质的抗体。
1986年,Lerner和Schultz [1] 同时在美国《Science》周刊上发表了他们各自独立领导的研究组对抗体酶的研究报告,并将之命名为Abzyme。
Abzyme 本质为免疫球蛋白(Ig),只是在易变区被赋予了酶的属性,故又被称为催化抗体(Catalytic antibody)。
抗体有极高的亲和力,解离常数在10 ~10 mol/L,这与酶相似,但无催化活力。
酶的催化机制在于它能结合底物产生过渡态,降低能垒,改变化学反应的速度。
抗体酶同时具备了抗体和酶的特征,应用前景十分广阔。
一、抗体酶设计的研究思路及历史过程1946年,Pauling用过渡态理论阐明了酶催化的实质,即酶之所以具有催化活力是因为它能特异性结合并稳定化学反应的过渡态(底物激态),从而降低反应能级。
他指出,酶通过某种方式与高能、短寿命的过渡态结合而起催化作用。
这个过渡态构型中某些键在形成,另一些键在断裂,存在时间极短,半衰期约为10 ~10 s,实际中极难捕获。
同时,Pauling又指出酶和抗体的根本不同在于前者选择性的结合一个化学反应的过渡态,而抗体则是结合一个基态分子。
既然过渡态分子难以捕获,而过渡态类似物是能够模拟一个酶催化反应过渡态的结构的稳定物质,于是人们就设想,只要寻找到与反应中决定性步骤的相应酶紧密结合的酶竞争性抑制剂,就等于发现了过渡态类似物;还有一种思路,就是这种类似物也能根据化学反应机制推测设计出来。
抗体酶

抗体的精细识别使其能结合几乎任何天然的或合 成的分子 抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具稳定性。 脱羧反应中介质效应:有机溶剂引起脱羧反应速率增 加。
ห้องสมุดไป่ตู้
酰基转移反应中介质效应 :在疏水溶剂中,活性较高。
抗体酶的制备
将抗体转变为酶可通过诱导法、拷贝法、引入法、化学修饰法等 途径。
1999年,Okamoto报道多克隆 的抗体酶41s-2-L能够特异识别艾 滋病病毒gp41的一段十分保守的 氨基酸序列并将其降解。 2010年,Haggag阐明了DNA酶 的抗体酶中分子模型中结构和功能 之间的关系。 如今,抗体酶已经在新肿瘤药物的 开发,手性药物的拆分,毒品的戒 除,复杂天然产物的合成方面显示 出巨大的潜在价值
Thank you!
用酶作为抗原免疫动物得到抗 酶的抗体,再将此抗体免疫动 物并进行单克隆化,获得单克 隆的抗抗体。 对抗抗体进行筛选,获得具有 原来酶活性的抗体酶。
引入法
用基因工程方法改造和制备全新的抗体酶是一种很 有前途和发展潜力的抗体酶制备方法。 将催化基因引入到特异抗体的抗原结合位点上,也 可以针对性地改变抗体结合区的某些氨基酸序列, 以获得高效的抗体酶。
—— 洪维剑, 蔡发国, 朱丽如. 抗体酶研究的新进展[J]. 饲料研究, 2009,(10)
1) 存在的问题及解决策略: 问题1:目前, 抗体酶技术工业化面临的最大困难是生产 出的一些抗体酶的底物专一性、反应选择性和催化效率不 如天然酶。 抗体酶催化活性较低的可能原因是:
1.设计出的半抗原与真实过渡态之间总会存在细微的差别; 2.抗体酶的结合位点易受底物抑制和环境因素的影响; 3.同一种类的不同细胞产生的抗体酶的活性有差异,多数特异性的 抗体酶并不是单一的分子种类,这使得抗体酶的分离纯化较为困难。 4.抗体酶多为鼠源性的单克隆抗体, 在诱导中机体内可能会产生抗 催化抗体的蛋白, 使抗体酶失活。
抗体酶知识讲解

第七章 抗体酶 Chapter 7 Abzyme
第七章 抗体酶
一 概述 二 机制 三 制备 四 应用
一、抗体酶的发现与研究思路
酶的催化机理是降低活化能。
1946年,诺贝尔奖二次得主 美国化学家Linus Pauling 提 出酶催化反应的过渡态理论。
在酶催化的反应中,与酶的活性中心形成复合物 的实际上是底物形成的过渡状态,
基因工程的技术使得建立抗体基本的组合,并 根据需要构建适当序列的基因片段已成为可能。利用抗 体库技术,在将来也许有可能绕开免疫,产生完全由基 因工程构建的全新抗体酶。
(3) 拷贝法
用已知酶作为抗原免疫动物,通过单克隆技术, 制得抗该种酶的抗体。再以此种抗体免疫动物,再次采 用单克隆技术,经筛选与纯化,就可获得具有原来酶活 性的抗体酶(因为抗原与该抗产生的抗体具有互补性,经 过上述两次拷贝,就把酶的活性部位的信息翻录到抗体 酶上,使该抗体酶能高选择性地催化原酶所催化的反应)。
寻找过渡态类似物作为半抗原产生的抗体
可能具有酶活性
以稳定的过渡态类似物作为半抗原,诱导与其互补 构像的抗体,这样产生的抗体就能识别反应过程的真正过 渡态,该抗体即有酶催化反应的基本特征,可能成为一种
具有酶活性的抗体。
半抗原:能与对应抗体结合出现抗原-抗体反应、又不 能单独激发人或动物体产生抗体的抗原。它只有反应原 性,不具免疫原性,又称不完全抗原。
2、有更强的专一性和稳定性 抗体的精细识别使其能结合几乎任何天然的或合成的 分子
抗体酶催化反应的介质效应
酯解反应中介质效应 : 抗体酶在有机溶剂中具稳定性。 脱羧反应中介质效应:有机溶剂引起脱羧反应速率增加。 酰基转移反应中介质效应 :在疏水溶剂中,活性较高。
抗体酶

(二)在前药设计中的应用
抗体酶38C2 是根据I 型缩醛酶的烯胺机理, 通过反应免疫方法得到 的。通过位于底物结合部位疏水口袋的活性赖氨酸残基 , LYS, 抗体酶 38C2 可催化醇醛缩合, 逆醇醛和逆Michael 反应, 以及接受宽范围的底 物, 因而可用作为前药的激活剂。Shabat 等设计了一种全新的前药释放 系统, 利用有次序的逆醛醇缩合和逆Michael 反应可除去前体药物中的保 护基, 释放出活性药物。这种策略已成功地用于喜树碱(Camptothecin), 阿霉素(Doxorubicin), 依托泊甙(Etoposide等抗肿瘤药以及降血糖药胰岛 素(Insulin)的前药设计(如图)。
抗体酶在生物催化领域的应用
LICME
演讲内容
简介 作用 原理
问题及 展反应
抗体(antibody):指机体的免疫 系统在抗原刺激下,由B淋巴细胞或 记忆细胞增殖分化成的浆细胞所产 生的、可与相应抗原发生特异性结 合的免疫球蛋白。
酶(enzyme):具有生物催化功 能的高分子物质。
B.基因工程定点突变法
随着基因工程技术的发展。用基因工程方法改造和制备全 新的抗体酶是一种很有前途和发展潜力的抗体酶制备方法。 对于已产生的单抗,分析抗体结合部位的氨基酸顺序或对 应的碱基顺序,然后通过对抗体酶结合部位氨基酸对应的 基因序列进行定点突变,在抗体结合部位加上有催化作用 的氨基酸,进而改变抗体酶的催化效率. 这就是基因工 程法生产抗体酶的原理。
六.一种催化甲状腺素脱碘的抗体酶
3 , 5 , 3′, 5′-四碘甲状腺原氨酸又称甲状腺素(T4)。在人和 动物体中, 它对机体的生长发育、基础代谢与脑和器官的形成发挥 重要调节功能, 这主要通过其降解产物3 , 5 , 3′-三碘甲状腺原氨 酸(T3)和受体的相互作用来完成。生物体内的T3 主要由T4 在脱碘 酶催化下脱碘产生,这个转变主要由含硒的碘甲状腺原氨酸脱碘酶 同源家族来完成。其中I 型碘甲状腺原氨酸脱碘酶(DI)起主要作用 , 缺乏DI 将导致严重的甲状腺疾病。研究发现I 型脱碘酶的酶学性 质、催化机制、空间结构和生理功能等进行了系统研究, 证实它为 一种分子量27 ku 的含硒酶, 含有一个硒代半胱氨酸催化基团, 能催 化T4 降解为T3 和rT3 。研究表明, 若将硒代半胱氨酸突变为其它 氨基酸, 则酶的活性几乎全部丢失。 本文以脱碘酶的结构和初步催化机制为基础, 采用单克隆抗体 技术和化学修饰法制备了一种新的具有脱碘作用的抗体酶, 并对其 动力学性质进行了研究。
抗体酶PPT课件
Claisen重排
单克隆抗体制备技术
抗体酶的化学及酶学特征
抗体酶与天然酶相同点: (1)都是依赖于分子间的极性互补及立体互补进行识别。 (2)它们都遵守米氏动力学方程; (3)在研究活性部位方法相同
解离常数Kd (抗原—抗体) 和Km(抗体—底物) 来比较分子 识别程度,从而改进分子设计。
(3)酶分子底物识别部位所占有的氨基酸一般为7 个左右, 但抗体酶底物识别部位的氨基酸约为15~20 个。抗体酶识 别部位所含有的氨基酸数量较多,并且识别部位与水解部位 相距较远,因而增强了催化反应的底物特异性。抗体酶的这
(5)天然酶的种类是在物种的长期进化过程中形成的,因 此其数量相对稳定;而抗体酶则是运用化学、免疫学、分子
生物学、分子遗传学等技术人工制备的与天然酶具有相似
酶活性的抗体,甚至可以产生自然界中不存在的新酶即超自 然酶,这对于酶的催化反应机制研究及实验应用都有重要意 义。
抗体酶与天然酶不同点:
(1)酶催化作用机制是“锁钥学说”(lock and ey) 及“诱 导契合学说”(induced - fit);而抗体酶的催化机制目前还没 有完全搞清楚,Janda曾提出“诱饵开关”(bait and switch) 机制。
(2)酶与底物结合程度பைடு நூலகம்亲和力,用Km表示;而抗体可用
些特点在医学上具有重要意义
(4)对于天然酶来说,在研究催化机制时,需要分析蛋白的晶
体结构,探索其空间、电荷分布的情况。如果只用化学修饰、
蛋白质工程技术很难确切知道活性部位的空间结构;而对抗 体酶来说,因为采用事先设计的化合物做为半抗原,根据抗体 和抗原间的互补关系,直接推测抗体酶活性部位的结构,对其 催化机制进行研究。
酶工程 抗体酶
抗体酶摘要:抗体酶是一种具有催化活性的免疫球蛋白,它既有抗体的高度选择性,又有酶的高效性。
因此它的发现不仅提供了研究生物催化过程的新途径,而且能为生物学、化学和医学提供具有高度特异性的人工生物催化剂,并可以根据需要使人们获得具有某些不能被酶催化或较难催化的化学反应催化剂。
抗体酶的出现,意味着有可能出现简单有效的方法,从而人们可凭主观愿望来设计蛋白质。
这一发现是利用生物学和化学成果在分子水平上交叉渗透研究的产物。
本文总结了抗体酶的结构、性质、产生方法、筛选方法、酶学特征及研究的最新进展。
关键词:抗体酶酶学特征筛选性质抗体酶(Abzyme)或催化抗体(Catalytic antibody)是一种新型人工酶制剂,它是依据对酶分子催化反应机制的理解,结合免疫球蛋白的分子识别特性,应用免疫学、细胞生物学、化学、分子生物学、等技术制备的具有高度底物专一性及特殊催化活力的新型催化抗体。
由于抗体酶的多样性、特异性和稳定性已经形成了生物界中的一个崭新的超分子体系它把免疫学酶学理论的发展和抗体在医药工业等领域的应用推向一个新水平。
近年来对抗体酶的制备,催化反应特性及分子结构等已进行了一些阐明下面介绍抗体酶的基本性质和研究进展。
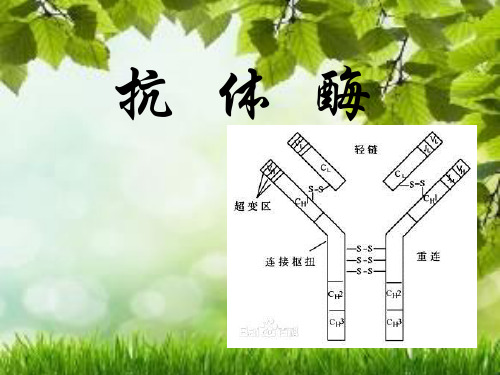
1 抗体的结构抗体和酶一样是大分子蛋白质,由2条相同的轻链(大约2500D)和2条相同的重链(大约5000D)组成。
轻链由VL(可变区)和CL(不变区)组成,重链也由VH(可变区)和CH(不变区)组成。
重链和重链及重链和轻链之间通过二硫键相连,此外重链还有一连接枢扭抗体的结合部位由6个超变区组成对同类型抗体CL和CH部分氨基酸的序列相同,然而VL和VH是非常专一的,可变区大约由110个氨基酸组成,至少可产生108个不同抗体它是抗体多样性的基础。
Fab片段由轻链和重链VH及CH1组成抗体-抗原复合物是借助范得华力疏水作用静电作用及氢键作用而形成。
2 抗体酶的基本结构及性质抗体酶主要来自IgG抗体分子。
抗体酶
抗体酶的研究,为人们提供了一条合理途径去设 计适合于市场需要的蛋白质,即人为地设计制作 酶。它是酶工程的一个全新领域。 构建有别于天然功能酶的新酶类,是酶工程研究 的又一前沿领地。
2013-11-13
拷贝法
用已知酶作为抗原免疫动物,通过单克 隆技术,制得抗该种酶的抗体。再以此种抗 体免疫动物,再次采用单克隆技术,经筛选 与纯化,就可获得具有原来酶活性的抗体酶 (因为抗原与该抗产生的抗体具有互补性, 经过上述两次拷贝,就把酶的活性部位的信 息翻录到抗体酶上,使该抗体酶能高选择性 地催化原酶所催化的反应)。 这种方法对自然界来源稀少的紧缺酶, 不失为一种有价值的有潜力的方法。
2013-11-13
既然过渡态分子难以捕获,而过渡态类似物 是能够模拟一个酶催化反应过渡态的结构的 稳定物质,于是人们就设想,只要寻找到与 反应中决定性步骤的相应酶紧密结合的酶竞 争性抑制剂,就等于发现了过渡态类似物; 还有一种思路,就是这种类似物也能根据化 学反应机制推测设计出来。然后,以过渡态 类似物为半抗原,利用哺乳动物的免疫系统, 诱导与其互补构象的抗体产生,这种抗体即 具有催化活性——这就是 1969 年Jencks 提出的,他发展了 Pauling 的理论;接着, Kohler 和Milstein 于 1975 年发明了具有 历史意义的单克隆技术,使抗体酶的生产成 为可能。
2013-11-13
诱导法
诱导法是选择适当的化学模型物与载 体蛋白连接后给动物免疫,通过杂交瘤技术 筛选和分离单克隆抗体(所得抗体催化效果 的好坏很大程度上取决于化学模型物的设 计)。
2013-11-13
基因工程法
对于已经获得的单抗,分析其氨基酸 序列和相应基因的碱基序列,将抗原结合部 位的基因换上编码有催化作用的氨基酸的基 因,这就是基因工程法制备抗体酶的主要内 容。为可能。利用抗体库技术,在将来也 许有可能绕开免疫,产生完全由基因工程构 建的全新抗体酶。
抗体酶
3、熵阱法
熵阱是指催化剂以有利的定位方向结合底物的能力, 因此限制了底物平动和旋转自由度,结果导致活性部位中 底物的有效浓度增加。
4、多底物类似物法
即将辅因子(包 括金属离子、血红素、 硫胺素、黄素和吡哆 醛等)引入到抗体结 合部位。 用多底物类似物 对动物进行一次免疫, 可产生既有辅因子结 合部位,又有底物结 合部位的抗体。
抗体酶和所有的抗体一样,都是由两条轻链和两条重链构成, 抗原与轻链和重链的可变区特异性结合,因此可变区的氨基酸 的排列顺序决定了抗体分子的特异性,其本质是一类具有催化 活性的免疫球蛋白,可变区赋予其酶的属性,所以也称为催化 抗体。
抗体酶催化反应类型
目前,已成功开发出天然酶所催
化的6种酶促反应和数十种类型的常 规反应的抗体酶,催化类型包括酰基 转移反应,酯和酰胺键的水解,金属
5、抗体结合部位修饰法
抗体酶和酶一样也可以用化学修饰的方法加以改造。 对抗体酶进行结构修饰的关键是找到一种温和的方法, 在抗体结合位置或附近引入具有催化功能的基团。
游离巯基就是适合的基团之一,它具有高亲核性,易 于氧化,及能通过二硫化物进行交换反应或亲电反应而 选择性修饰的特点。
6、蛋白质工程法
2、能与过渡态结合的体也具有酶的性质 根据Pauling理论 ,William Jencks于1969年 预言:若能找到对应某反应过渡态的抗体,将其加 入该反应体系中,就可观测到这个抗体对该反应的 催化效应。 这就意味着,抗体一旦能与过渡态相结合,它 就具有酶的性质。
1975年,Kohler和Milstein开创了单克隆抗体技 术,为抗体酶的诞生创造了技术条件。
7、抗体库法
用基因克隆 技术将全套抗体 重链和轻链可变 区基因克隆出来, 重组到原核表达 载体,通过大肠 杆菌直接表达有 功能的抗体分子 片段,从中筛选 特异性的可变区 基团。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
抗体酶综述陈璇【摘要】抗体酶是一类以过渡态类似物,为半抗原,可诱导免疫系统产生具有类似天然酶催化活性的免疫球蛋白。
抗体酶既具有抗体的高效选择性,又能像酶那样高效催化化学反应,开创了催化剂研究的崭新领域。
本文从抗体酶的发展历史、作用原理、制备、应用及研究展望多个角度进行综述。
【关键词】抗体酶;发现史;作用原理;制备;现状及应用前景抗体酶抗体酶(abzyme),又称催化抗体(cat·alytic antibody),是指通过一系列化学与生物技术方法制备出的具有催化活性的抗体,它除了具有相应免疫学性质,还类似于酶,能催化某种活性反应。
抗体与酶相似,它们都是蛋白质分子.酶与底物的结合及抗体与抗原的结合都是高度专一性的,但这两种结合的基本区别在于酶与高能态的过渡态分子相结合,而抗体则与抗原(基态分子)相结合。
抗体与天然酶相比,最大的优点在于抗体的种类是巨大的,免疫系统可以拥有10 种抗原特异性不同的抗体分子。
制备成功的抗体酶不但能催化一些天然酶能催化的反应,而且还能催化一些天然酶不能催化的反应。
抗体酶的发现早在l948年,美国斯坦福大学荣誉退休化学教授l』_波林(LinusPaulin'f)就提出过渡态理论(transition state theory) [2]。
这一理论认为,酶之所以具有催化能力,是因为它与反应分子(底物)的牢固结合的方式,有利于反应中的过渡态(transition state)的结构。
而这种结构会迅速重新排列成该反应的产物。
任何有利于过渡态,而不是其它可能的结构的因素,都能加快化学反应速度。
1 969年,布兰戴斯大学生物化学家w ·詹克斯(w ·Jenks)进一步发展了这一理论。
他和几位美国科学家认为,如果波林的观点是正确的话,那么利用某一反应过渡态的模拟物作为免疫原,则会得到催化该反应的抗体。
这种抗体能特异地识别化学反应的过渡态,并利用其结合能降低反应的活化能。
那么,适当的抗体也就能够以一种方式与真正的酶反应物结合.成为“酶家族”中新成员,去催化正常情况下由酶来完成的化学反应。
1986年以后,抗体酶研究进入一个新的阶段。
这一年的12月,R.A.Lerner和P.G.SChutz两个小组同时在《科学》(Science)杂志上报道,他们已成功地得到了具有酶活性的抗体酶。
SChutz等人认为对硝基苯酚磷酸胆碱酯(PNPPC)作为相应羧酸二酯水解反应的过渡态类似物,推测用这个类似物作为半抗原诱导产生的单克隆抗体可能对羧酸二酯的水解反应有催化活性。
通过对单克隆抗体的筛选,找到了一株MOPC167单抗,后来又找到一株抗体酶T15,经证明该催化反应的动力学行为满足米氏方程。
[3]Lerner等人,从金属肽酶的研究成果中得到启发,合成了一个含有吡啶甲酸的膦酸酯类似物为半抗原诱导产生一个单抗6D4,用来催化不含吡啶甲酸的相应羧酸酯化合物的水解反应,使反应加速近1000倍,并表现出底物专一性和对介质pH的依赖性等。
[3]抗体酶的基本结构及性质抗体酶主要来自IgG抗体分子[4]。
对抗体结构分析表明.IgG分子s是由两条相同的重链及两条相同的轻链靠二硫键连接而成。
木瓜蛋白酶作用抗体后,产生三个片断,其中相同的二个片断为抗原结合片断(Fab);在抗原结合片断中与抗原结合的部位,是“高度可变区”(Fv),该部位广泛的结构及顺序变化决定了抗体对外来物质的识别特性,其中电荷互补及立体互补是其分子识别的主要特征。
抗体酶催化的反应及其原理抗体酶能催化酯水解反应,Oxy—Cope重排反应,还原反应,环氧化及氧化物开环反应, Diels—Alder反应,Claisen重排反应。
[5]而在抗体催化的反应中,研究最广泛的是酯水解反应,所以在这里只介绍一下酯水解反应的原理。
酯水解反应的过渡态是带负电荷的四面体结构。
7以MOPCI67催化碳酸脂水解为例说明。
首先通过化学合成过渡态磷酸脂的类似物——硝基苯磷酰胆碱脂,利用过渡态类似物作为半抗原,并将其与牛血清蛋白偶合,制成抗原注入动物体内,动物体的血液中就会产生可以和过渡态碳酸脂特异性结合的抗体MOPCl67,然后采用单克隆技术分离纯化出MOPCI67。
在抗体催化碳酸脂反应中,MOPCI67和过渡态碳酸脂结合后,提高了反应物过渡态的稳定性,降低了反应的活化能,从而加速了水解反应的进程。
该反应的产物生成速度常数l(c 达到了(o.40±0.04)/min,米氏常数Km为208±431mol/L。
)抗体酶的制备酶与其催化的活性化合物之间具有结构互补的性质,即酶分子与“反应过渡态”化合物互补,从分子识别角度来看,这种互补关系类似于抗体抗原间的互补作用。
抗体酶最初的产生手段是按以下步骤进行的:首先合成稳定的反应过渡态类似物,将此化合物做为半抗原与载体蛋白相连,免疫动物制备单克隆抗体,由它诱导产生的抗体,可以按预定方向取得催化活性。
该方法中最重要的是半抗原的分子设计和合成。
近年来,抗体酶的产生途径又有新的进展。
主要有以下途径和方法:1直接引入天然或合成的催化基团[5]①化学诱变法一将合成的或天然的具有催化活性的基团通过化学修饰法引入分子中;②蛋白质工程技术一通过蛋白质工程技术使抗体结合部位的氨基酸残基产生定向改变,既可以直接产生酶活性.也可以对初步具有酶活性的抗体进行进一步改造,构建高活性体。
2 基因工程技术由免疫学可知.对独特的分子抗原,动物可有5~10000个不同的B细胞产生抗体,而通过细胞融合产生的单克隆抗体一般只有上百个。
因此重组抗体分子在细菌E.coli中的表达,可以提供抗体库。
基因工程抗体库得到的抗体数量比免疫技术得到的抗体要高几个数量级。
但该方法中筛选抗体的技术还需进一步完善3 相似分子诱导法在反应过渡态类似物难以合成的条件下,采用化学结构相似的舒子如酶的抑制剂分子做半抗原,也可筛选到抗体酶因为免疫系统对一个半抗原可以产生一些结构大致相同.但却存在细微差别的抗体,因此用含有与半抗原类似结{旬的化台物筛选单克隆抗体.也会找到所需要的有特殊识别功能及催化作用的抗体酶4 共价抗原免疫法这是在亲和标记抑制剂基础上发展起来的新的抗体酶制备方法。
如果以亲和标记剂为半抗原,则抗体结合部位将产生与亲和基团电荷性质相反的基团,如亲核性、亲电性氨基酸,酸性氨基酸、碱性氯基酸等。
该途径适用于产生一些晤性部位中含有上述氨基酸的酶。
5细胞融合法 [6]其过程如下:要得到一特定抗原的抗体,如果抗原是小分子,必须将其和载体蛋白相联。
然后对此抗原进行免疫,使宿主有机体针对抗原产生抗体,产生抗体的脾细胞与骨髓细胞相融合。
融合得到的杂交细胞既能产生抗体又能在体外培养。
通过选择培养,杂交细胞得以存留。
将杂交体克隆化,即繁殖成母体的同一细胞或分离成菌落。
这些菌落能产生单一均匀的抗体。
对这些菌落用酶联免疫吸收试验加以筛选,以评价其选择性结合抗原的能力。
然后把抗原结合到一种固体支撑物上,再加入含有抗体的介质,这样抗原一抗体复合物随即形成,经过提纯就得到AB—AG复合物。
抗体酶的应用及前景1.抗体酶的应用(一)在有机合成领域的应用目前,已成功筛选出可催化6种类型酶促反应和几十种化学反应的抗体酶,可催化许多困难和能量不利的反应.催化类型包括底物异构化反应、酯水解、酰胺水解、酰基转移、Claisen重排反应、光诱导反应、氧化还原、金属螯合、环化反应等,抗体酶还可以作为手性助剂控制光加成反应产物的立体化学,用于手性化合物的拆分,还可用于探索化学反应机制.(二)在医学领域的应用利用抗体酶催化药物在体内的还原,有利于机体对药物的吸收,并降低药品的毒副作用;将抗体酶技术和蛋白质融合技术结合在一起,设计出既有催化功能又有组织特异性的嵌合抗体,用于切割恶性肿瘤;将抗体酶直接作为药物,以治疗酶缺陷症患者¨.(三)在戒毒领域的应用抗体酶可以拮抗可卡因等麻醉剂的成瘾性,使可卡因失去刺激功能,以帮助瘾君子戒除毒瘾.抗体酶还可以水解清除血液中的毒素,如分解可卡因、有机磷毒剂等.(四)在前药设计中的应用[7]前药(prodrug)是指为降低药物毒性而设计的一类自身无活性或活性较低,需在体内经代谢转化为活性药物以发挥作用的化合物.抗体酶在正在发展的ADEPT体系中成功地对前药进行活化,提高了肿瘤治疗的选择性,显示出很好的应用前景[8].ADEPT 体系,即抗体靶向的酶前药治疗(antibody directed enzyme prodrug therapy ADEPT )体系.将能催化前药转化为肿瘤细胞毒剂的酶,与肿瘤细胞专性抗体相偶联,酶通过与肿瘤抗体的结合而存在于肿瘤细胞表面,当前药扩散至肿瘤细胞表面或附近时,抗体酶就会将前药迅速水解,释放出抗肿瘤药物.这样大大提高了肿瘤细胞附近局部药物的浓度,增强对肿瘤细胞的杀伤力,减少对正常细胞的杀伤作用[9].经过科学家们的不断努力,抗体酶在ADEPT 体系中的应用将日益完善,有可能成为癌症化疗的重要武器.2.前景抗体酶的研究是当今科学前沿多学科研究的交汇点,吸引着合成化学家、生物学家、免疫学家、化学动力学家、催化学家的格外关注。
它突破了传统的束缚、大分子、配位化合物等模拟酶的框框,开辟了崭新的模拟酶研究的方向,开辟了催化剂研究的新领域,无论是在理论探索方面或是实践应用方面,都具有极其广阔的前景。
它将在医学、化学、生物学、免疫学、制药学等诸多学科中发挥重要的作用。
(1)可以使不可能发生的化学反应变为可能。
(2)可以使苛刻条件下的化学反应在温和条件下实现。
(3)可以选择性地催化平行反应中的某一反应,从而大大增加产品的产率。
它可以实现有机化学家梦寐以求的不对称合成,只催化生成某一光学异构体的反应,使原料的利用率大大提高。
(4)在不久的将来,有可能研究成功蛋白质氨基酸序列快速分析的抗体酶,从而大大简化和加速蛋白质氨基酸序列的测定。
(5)病毒蛋白在水解过程中的过渡态相似物诱发的抗体酶,可作为医学上的接种疫苗。
(6)指导未知酶的寻找。
有些反应,如Cope重排和Dids- Alter反应,明明知道是酶催化的,但时至今日,人们对催化上述反应的酶仍一无所知,对这些反应的抗体酶的结构和功能的研究无疑会对未知酶的寻找提供方向性的提示。
(7)通过对抗体酶的研究,对其过渡态相似物结构的研究,无疑对确定基元反应的过渡态提供十分有用的信息,为确定化学反应机理提供依据。
[10]短短的10来年,抗体酶的研究获得了迅猛的发展,取得了长足的进步。
人们常常感叹裁缝手艺的精巧绝伦,而现今,科学家正在使动物的免疫系统成为制造催化剂的“高级裁缝”,使它根据过渡态相似物的几何形状、电性结构、酸碱性质等“量体裁衣式”地制造抗体酶,使科学迈向催化剂制备的自由王国,这将使人类朝实现控制化学反应的目标不断逼近。
