元素 核素 同位素
高考化学复习考点元素核素同位素

考点46 元素核素同位素聚焦与凝萃1.了解元素、核素和同位素的含义;2.了解同位素的性质及其应用,掌握核素的表示方法。
解读与打通常规考点1.元素:具有相同核电荷数的同一类原子的总称。
例:氧(O)元素,氢(H)元素。
特性:主要通过形成的单质或化合物来体现。
2.核素:具有一定数目的质子和一定数目的中子的一种原子如1H(H)、2H(D)、3H(T)就各为一种核素。
特性:不同的核素可能质子数相同,或中子数相同,或质量数相同,或各类数均不相同3.同位素:质子数相同而中子数不同的用一元素的不同原子互称为同位素如16O、17O、18O是氧元素的三种核素,互为同位素。
特性:同位素质量数不同,化学性质相同;天然同位素所占原子百分比一般不变;同位素构成的化合物如H2O、D2O、T2O,物理性质不同但化学性质相同4.元素、核素、同位素之间的关系如下图所示:隐性考点1.同位素的六同和三不同2.元素、核素和同位素的概念的比较元素核素同位素(1)元素是宏观概念,对同类原子而言,元素的种类和原子的种类不相等,原子的种类多于元素的种类。
决定元素种类的因素是质子数。
质子数相同的核素属于同一种元素。
一种元素可以有多种核素。
化学变化中不会产生新元素。
(2)同位素是微观概念,对某种元素的几种原子间的关系而言。
同位素的描述对象是原子,即核素。
质子数相同的不同核素互为同位素。
(3)核素是微观概念,对某种元素的原子而言. 4.同位素、同素异形体、同系物、同分异构体的比较18e -Ar HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6、CH3OH、CH3FCl-、S2-、HS-、O2-2K+、Ca2+融合与应用例1.地球上氦元素主要以4He形式存在,而月球土壤中吸附着数百万吨3He,据估算3He核聚变所释放的能量可供人类使用上万年。
下列说法正确的是( )①3He、4He的化学性质基本相同②3He、4He具有相同的中子数③3He核聚变是化学变化④3He液化是物理变化A.①② B.①④ C.②③ D.③④【答案】B【解析】3He中子数为1,4He中子数为2,②错;核聚变既不属于物理变化,也不属于化学变化,③错。
高中化学中的同位素与核素概念

高中化学中的同位素与核素概念在高中化学的学习中,同位素与核素是两个重要且基础的概念。
理解它们对于深入学习化学、特别是原子结构和元素性质方面的知识,具有至关重要的作用。
首先,让我们来了解一下什么是核素。
核素,简单来说,就是具有一定质子数和一定中子数的原子。
比如,氢元素常见的有三种核素,分别是质子数为 1、中子数为 0 的氕(H),质子数为 1、中子数为 1的氘(D),以及质子数为 1、中子数为 2 的氚(T)。
每种核素都有其特定的质子数和中子数,这就决定了它们的核性质和化学性质。
而同位素呢,指的是质子数相同而中子数不同的同一元素的不同原子。
还拿氢元素来说,氕、氘、氚就是氢元素的同位素。
同位素在自然界中的存在是非常普遍的,许多元素都有同位素。
为什么要研究同位素和核素呢?这是因为它们在很多领域都有着重要的应用。
在医学领域,同位素被广泛用于诊断和治疗疾病。
例如,碘-131常用于治疗甲状腺疾病。
因为甲状腺会吸收碘,通过摄入碘-131,其释放的放射线可以有针对性地破坏病变的甲状腺组织。
在考古学和地质学中,同位素测年法是一种常用的手段。
碳-14同位素测年法就是通过测量古代有机物中碳-14 的含量来确定其年代。
在工业生产中,同位素也发挥着重要作用。
比如,利用放射性同位素进行示踪,可以追踪化学反应的过程和物质的流动。
了解同位素和核素的概念,对于理解元素的性质也很有帮助。
虽然同位素的中子数不同,但由于它们质子数相同,所以化学性质相似。
然而,由于质量的差异,它们在物理性质上可能会有所不同。
在核反应中,同位素的行为也有所不同。
一些同位素容易发生裂变,而另一些则相对稳定。
这种性质对于核能的利用和核安全都有着重要的影响。
再从原子结构的角度来看,同位素和核素的存在反映了原子核的复杂性。
质子数决定了元素的种类,而中子数的不同则导致了同一元素的不同核素和同位素。
在高中化学的学习中,我们要通过具体的例子来加深对同位素和核素概念的理解。
课时3 核素、元素和同位素

三、元素、核素、同位素 H (氢) 、D (重氢) 、T(超重氢)
35 17
Cl , , ,
37 17
Cl , ,
14 6 C 18 8 O
制造氢弹的材料
12 6 C 16 8 O 235 92 U
13 6 C 17 8 O 238 92 U
相对原子质量标准
制造原子弹和核反 应堆的材料
1、医学中于显影、诊断、治疗、消毒等; 2、农业上的辐射育种技术,提高了农产品 的质量和数量; 3、14 6 C的放射性被应用于考古断代
二、核素、元素、同位素
1.定义:具有一定质子数和一定中子数的 一种原子。 2.元素: 具有相同的核电荷数(即质子数) 的同一类原子的总称 3.同位素:质子数相同而中子数不同的 核素互称为同位素. 物理性质:不同,因其质量不同; 化学性质:相似,因其核电荷数、核外电 子层结构都相同 存在特点:天然存在元素,不论游离态还是 化合态,各种同位素所占的原子 百分比一般是不变的。
第三单元
人类对原子结构的认识
第3课时 核素、元素和同位素
1 1H, (氕)
2 1H, (氘)
3 1H (氚)
阅读p32-33 什么是核素?什么是同位素?
1H ①1
②12 C 6 ⑥1H
3
③16 8O ⑦8O
18
④2 H 1 ⑧6 C
14
⑤8 O
17
8种 上述的粒子中有几种核素________ , 元素有_____ 种;其中互为同位素的有 3 ① ⑥、 ② ⑧、 ③ ⑤ ⑦ _ ④______________ 。
3H是制造氢弹的材料;… 4、 2 H 、 1 1
1、 6 C-NMR(核磁共振)可用于含碳化合物 13 的结构分析,有关 6 C的说法正确的是( A ) A、质子数为6 C、中子数为6 B、电子数为13 D、质量数为6
考点13 原子核的构成、核素、同位素-(解析版)

考点13 原子核的构成、核素、同位素【知识梳理】一、人类认识原子结构的历程1.德谟克利特的古代原子学说认为万物都是由间断的、不可分割的微粒即原子构成的,原子的结合和分离是万物变化的根本原因。
2.道尔顿的近代原子学说英国科学家道尔顿——原子学说,他认为原子是实心球体,原子不能被创造,也不能被毁灭,在化学变化中不可再分割并保持本性不变。
3.汤姆生的“葡萄干面包式”的原子结构模型他认为原子是由更小的微粒构成的,电子的发现使人们认识到原子是可以再分的。
4.卢瑟福的带核原子结构模型英国物理学家卢瑟福根据α粒子散射现象,指出原子是由原子核和核外电子构成的,原子核带正电荷,它几乎集中了原子的全部质量,但只占有很小的体积,核外电子带负电荷,在原子核周围空间作高速运动。
5.玻尔的轨道原子结构模型丹麦物理学家玻尔指出:原子核外电子在原子核外空间内一系列稳定的轨道上绕核作高速运动,每个轨道都具有一个确定的能量值,运动时,既不放出能量,也不吸收能量。
6.20世纪末和21世纪初——新的飞速发展(量子力学模型)。
二、原子核的构成、核素、同位素1.原子是由带正电的原子核和带负电的核外电子构成的,原子核又是由质子和中子构成的,质子带正电,中子不带电。
2.质量数:将原子核内所有的质子和中子的相对质量取整数值,加起来所得的数值。
3.原子的表示符号:A Z X表示质子数是Z,质量数为A的一种X原子。
4.存在数据关系(1)质量关系:质量数(A)=质子数(Z)+中子数(N)。
(2)电性关系:原子:原子序数=核电荷数=质子数=核外电子数;阴离子:质子数=核外电子数-电荷数;阳离子:质子数=核外电子数+电荷数。
5.核素和同位素(1)核素:具有一定数目质子和一定数目中子的一种原子。
(2)同位素:质子数相同,质量数(或中子数)不同的核素互称为同位素。
【核心归纳】1.解读b a X 、X +c、X d +、X e 中各个字母的含义①a 表示元素X 的质子数;①b 表示元素X 的质量数;①+c 表示元素X 的化合价为+c ; ①d +表示该离子带有d 个单位的正电荷;①e 表示1个分子中含有e 个X 原子。
化学必修二第一章第二节核素和同位素

= + ≈ 原子的
质量
原子核 的质量
核外电子 的质量
原子核 的质量
所以
≈ 原子的质量
质子的质量
+
中子的质量
+ 质子的质量
中子的质量
≈ + 原子的质量
质子的质量
中子的质量
原子的相对质量≈ 质子的相对质量+中子的相对质量
相对原子质量 ≈ 质子数 + 中子数 =质量数
原子序数 质子数 = 核电荷数 = 电子数 =
Z
元素的性质与原子的最外 层电子数和电子层数有密 切关系。那么元素的性质 和原子核有关系吗?
碳14是什么样的原子?
任务一:
01 02 03
单击此处添加小标题
回忆原子的结构,根据下面的表格思考: 每种原子的质子数、中子数、电子数之间有什么关系?
单击此处添加小标题
质子数 = 核电荷数 = 电子数
单击此处添加小标题
即:同种元素的不同核素(或原子)互称为同位素
一. 天然、稳定存在的同位素,无论是游离态还是化合态各同位素所占的原子个数的分数一般是不变的,如氯元素有两种同 位素,35Cl占75.77%、37Cl占24.23%
二. 在相同状况下,各同位素的化学性质基本相同(几乎完全一样),但物理性质有所不同。 三. 考古时用碳14,2H、3H用于制造氢弹,射线育种,治疗恶性肿瘤等。
核素(原子)的近似相对原子质量=质量数
(2)元素的相对原子质量等于各同位素的相对原 子质量的平均值:
元素的相对原子质量=A·a%+B·b%+C·c%+…
如Cl的相对Biblioteka 子质量:Ar(Cl)= 34.969×75.77%+36.966×24.23% =35.453
核素和同位素

同位素
• 定义:质子数相同而中子数不同的同一元素的不同原子互 称为同位素 • 同位素中子数一定不同,质子数相同 • 应用: 14 用于测定文物年代,氘和氚用于制造氢弹,
C 6
• 放射性 X的相对原子质量
• 定义:一个核素原子的实际质量与一个C-12原子的实际 质量的1/12的比值 • 公式: 一个核素原子的质量 • 核素的相对原子质量=
元素
• 定义:具有相同核电荷数或质子数的同一 类原子的总称 • 决定元素种类的因素:原子核内的核电荷 数
核素
• 定义:具有一定数目的质子和一定数目的中子的一种原子。 每一种核素都是一种原子,不同的核素是不同的原子。如 氕、氘、氚是三种不同的核素。 • 决定核素种类的因素:质子数和中子数共同决定核素的种 类
一个C-12原子的实际质 量×1/12
A
• 核素的近似相对原子质量=质量数
元素的相对原子质量
• 定义:元素的相对原子质量是按照该元素各种核 素原子所占一定百分比算出的平均值 • 计算公式: Ar=Ar1*a%+Ar2*b%+......(a%+b%+...=1)
元素的近似相对原子质量
• 定义:用该元素各核素的质量数及其所占的百分比计算出 来的平均值 • 公式:Ar=A1*a%+A2*b%+...(a%+b%+...=1)
元素、核素、同位素、同素异形体之间的区别
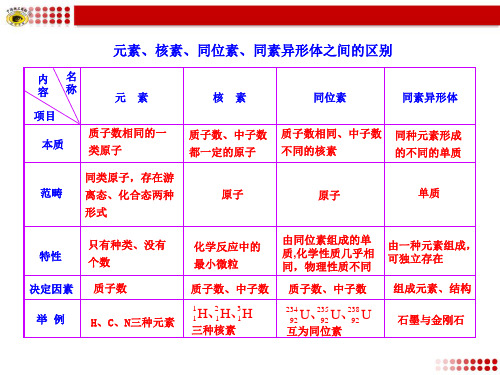
个数
质子数 H、C、N三种元素
由同位素组成的单 质,化学性质几乎相 同,物理性质不同
由一种元素组成, 可独立存在 组成元素、结构 石墨与金刚石
决定因素
举 例
质子数、中子数
1 1 2 3 H、 1 H、 1H
质子数、中子数
234 92 235 238 U、 U 、 92 92 U
三种核素
互为同位素
元素、核素、同位素、同素异形体之间的区别
内 容 项目 质子数相同的一 本质 质子数、中子数 都一定的原子 质子数相同、中子数 不同的核素 同种元素形成 的不同的单质 名 称 元 素 核子,存在游
范畴
离态、化合态两种 形式 只有种类、没有
原子
原子
单质
特性
化学反应中的 最小微粒
同素异形体,同位素,核素

同素异形体,同位素,核素 同位素: 1.元素,同一种原子形成一种元素; 2.原子,同一种元素的所有原子,都是一样的意思,是指它们都含有相同的质子数,相同的电子数;同一种元素的原子,又分成好多种同位素;不同的同位素的差别在于每个原子内的中子数不一样。换句话说,只要原子内的质子数一样,就是同一种元素;同一种元素,根据原子的核内有多少种不同的中子数,就分成多少中同位素。 同位素,就是在周期表上在同一个位置,有同样多的质子、同样多的电子,但是不一样多的中子,这些原子形成了同一种元素的同位素。所有的元素都有同位素。最简单的氢,也有氕、氘、氚三种同位素;稍微复杂一点点的氦,有九种同位素。 核素: 质子数相同的元素,通称为同位素; 中子数相同的元素,通称为同中素,它们其实由是不同的元素组成; 核子数相同的元素,通称为同量素,它们其实也是由不同的元素组成。只要核子数相同,而不管是什么元素的原子,它们在一起就属于同一种核数。由于一种元素有几种同位素,就有几种核数。 同素异形体: 是由同一种元素所构成的单质 这些同种元素的原子不是混合在一起,而是形成不同的立体结构。 最典型的就是石墨跟金刚石(钻石),都是由碳形成,一个最软,一个最硬。同素异形体的物理性质相差很大,譬如石墨跟金刚石的硬度之差最为典型。再如石墨是导电的,但有方向性;而金刚石一般都是很好的绝缘体。但是, 蓝钻是半导体。有同素异形体的元素,只有少数: 碳、氢、氧、磷、硫、硅、硼、硒、砷、铁、锡、锗、锑。 同素异形体是指相同元素组成、不同形态的单质,定义如此,所以都是单质。 同位素,指具有相同质子数、不同中子数(或不同质量数)的相同元素的不同核素。 同素异形体是针对单质层面的概念,同素异形体是指相同元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素核素同位素
1.元素、核素、同位素的概念及相互关系
2.同位素的性质
同一元素的各种核素的中子数不同,质子数相同,化学性质几乎完全相同,物理性质差异较大。
3.几种重要的核素
核素235 92U 14 6C 21H 31H 18 8O
用途核燃料用于考古断代制氢弹示踪原子
4.相对原子质量
(1)定义:以12C原子质量的1/12(约1.66×10-27 kg)作为标准,其他原子的质量跟它比较所得的值。
其
国际单位制(SI)单位为1,符号为1(单位1一般不写)。
(2)诸量比较
①原子质量:指原子的真实质量,也称绝对质量,是通过精密的实验测得的。
如:一个Cl2分子的m(Cl2)
=2.657×10-26 kg。
②核素的相对原子质量:各核素的质量与12C的质量的1/12的比值。
一种元素有几种同位素,就应有
几种不同的核素的相对原子质量,如35Cl为34.969,37Cl为36.966。
③核素的近似相对原子质量:是对核素的相对原子质量取近似整数值,数值上与该核素的质量数相等。
如:35Cl为35,37Cl为37。
④元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。
如:A r(Cl)
=A r(35Cl)×a%+A r(37Cl)×b%。
⑤元素的近似相对原子质量:用元素同位素的质量数代替同位素相对原子质量与其丰度的乘积之和。
注意(1)核素相对原子质量不是元素的相对原子质量。
(2)通常可以用元素近似相对原子质量代替元素相对原子质量进行必要的计算。
深度思考
1.如下是四位同学学习原子结构知识后,对这节内容的认识,你认为不正确的是()
答案 C
2.(1)1H、2H、3H三种微粒都属于________,因为它们是具有相同______________的同一类原子。
(2)在11H、21H、31H、12 6C、13 6C、14 6C、14 7N、15 7N中,核素、元素的种数分别为______种、______种。
(3)12 6C、13 6C、14 6C的关系为__________,因为它们是具有____________________的同一元素的不同原子。
其化学性质几乎完全相同。
答案(1)氢元素核电荷数(质子数)
(2)8 3
(3)互为同位素相同的质子数和不同的中子数
3.核聚变,因其释放能量大,无污染,成为当前研究的一个热门课题。
其反应原理为21H+31H―→42He+10n,因为有新微粒生成,所以该变化是化学变化,这种说法是否正确?为什么?
答案不正确,化学变化指的是有新物质生成,但原子种类不变;从微观上讲,既有化学键的断裂,也有化学键的生成,所以核变化不是化学变化。
4.已知一个12C的质量为a g,一个P2O3分子的质量为m g,一个P2O5分子的质量为n g,则氧原子的相对原子质量为__________。
答案6(n-m)
a
解析一个氧原子的质量为n-m
2g,根据相对原子质量的定义,氧原子的相对原子质量为
n-m
2
1
12×a
=
6(n-m)
a。
题组一以同位素为核心的概念辨析
1.由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的4526Fe原子,下列说法不正确的是
()
A.可以用KSCN溶液检验4526FeCl3和5626FeCl3
B.4526Fe与5626Fe的电子数相同
C.4526Fe与5626Fe互为同位素
D.4526Fe的中子数小于质子数
答案 A
解析同位素的化学性质基本相同,A项错误;5626Fe和4526Fe的电子数均为26,B项正确;根据同位素的定义,4526Fe与5626Fe互为同位素,C项正确;4526Fe的中子数为45-26=19,D项正确。
2.具有广泛用途的6027Co放射源首次实现了国内批量生产。
另外,钴还有多种原子,如5627Co、5727Co、5827Co 和5927Co。
下列关于钴原子的说法正确的是()
A.5627Co、5727Co、5827Co、5927Co和6027Co是摩尔质量不同的五种同素异形体
B.6027Co放射源可以用来治疗癌症,其中子数与电子数之差等于6
C.5627Co、5727Co、5827Co、5927Co和6027Co互为同位素,物理性质几乎相同,化学性质不同
D.5627Co、5727Co、5827Co、5927Co和6027Co互为同分异构体
答案 B
解析5627Co、5727Co、5827Co、5927Co和6027Co互为同位素,物理性质不同,化学性质几乎完全相同,A、C、D错误;6027Co的中子数为60-27=33,与电子数之差为33-27=6,B正确。
题组二相对原子质量的含义及辨析
3.16O中的“16”表示的含义是()
①氧元素的相对原子质量
②氧元素的一种同位素的近似相对原子质量
③氧元素的近似相对原子质量
④氧元素的一种同位素的质量数
A.①③B.②④C.①④D.②③
答案 B
解析元素的相对原子质量是该元素的各种同位素的相对原子质量(M r)与其丰度(n%)乘积的和的值,故①错误;同位素的相对原子质量是该同位素一个原子的绝对质量与12C原子质量的1/12的比值。
同位素的近似相对原子质量是该同位素一个原子的绝对质量与12C原子质量的1/12的比值的近似整数倍,在数值上与同位素的质量数相等。
因此,②、④正确;元素的近似相对原子质量是各同位素的近似相对原子质量(即质量数)与其丰度乘积的和的值,③错误。
4.某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。
下列叙述中错误的是()
A.它是副族元素
B.它是第6周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
答案 D
解析核外电子数等于其质子数,C项正确;用质子数分别减去各周期所含有的元素种类数,63-2-8-8-18-18=9,显然其是第6周期从左到右的第9种元素,而第6周期中包含镧系,所以它应属于副族,A、B项均正确;由于存在同位素,所以其相对原子质量应是同位素的平均值,而不代表其中一种元素的质量数,故中子数不能用152-63=89来计算,D项错。
易错警示
规避同位素、核素、同素异形体概念理解的4个易错点
(1)一种元素可能有多种核素,也可能只有一种核素;
(2)有多少种核素就有多少种原子;
(3)不同的核素可能具有相同的质子数,如11H与31H;也可能具有相同的中子数,如14 6C与16 8O;也可能具有相同的质量数,如14 6C与14 7N;也可能质子数、中子数、质量数均不相同,如11H与12 6C;
(4)在区别同位素、同素异形体的概念时,可从概念的字面加深理解。
同位素的研究对象是原子,“同位”是指同一种元素的几种核素在元素周期表中的位置相同,即质子数相同,中子数不同;同素异形体的研究对象为单质,“同素”是指元素种类相同。
