有机化学反应机理画法剖析
有机化学基础知识点整理有机反应机构的解析与机理

有机化学基础知识点整理有机反应机构的解析与机理有机化学是研究含碳元素的化合物及其反应的学科。
在有机化学中,了解有机反应机构的解析与机理是非常重要的基础知识。
本文将对几个常见的有机反应进行整理,分析其机构及机理。
一、酯的加水分解反应机构与机理分析酯的加水分解反应是指酯与水反应生成相应醇和酸的化学反应。
该反应机构一般分为酯的裂解和酸水解两步。
首先,酯分子中的酯基团被水裂解,生成相应的醇和酸酐。
接着,酯醇分子再与水反应,生成相应的酸和醇。
例如以甲酸乙酯为例进行分析。
首先,甲酸乙酯的酯基团被水裂解,生成甲醇和乙酸酐。
其反应机构如下所示:CH3COOC2H5 + H2O → CH3OH + CH3COOH接着,甲酸乙酯中的甲醇与水反应,生成甲酸和乙醇。
其反应机构如下所示:CH3OH + H2O → CH3COOH + CH3CH2OH二、醇的氧化反应机构与机理分析醇的氧化反应是指醇分子中的氢原子被氧化剂氧气替代而生成相应的醛或酮的化学反应。
该反应机构主要分为氧化剂的选择性攻击和生成的醛酮分子的去质子化两步。
例如以乙醇为例进行分析。
首先,氧化剂如酸性高锰酸钾会选择性攻击乙醇分子中的氢原子,生成乙醛和水。
其反应机构如下所示:CH3CH2OH + [O] → CH3CHO + H2O接着,乙醛发生去质子化,生成醛分子。
其反应机构如下所示:CH3CHO → CH3CO + H+三、醛和酮的还原反应机构与机理分析醛和酮的还原反应是指醛和酮分子中的碳氧双键在还原剂的作用下被氢原子替代,生成相应的醇的化学反应。
该反应机构一般包括还原剂的氢原子转移和醛酮分子中的氧原子还原两步。
例如以乙醛为例进行分析。
首先,还原剂如氢气在催化剂的作用下,转移氢原子到乙醛的碳氧双键,生成乙醇。
其反应机构如下所示:CH3CHO + H2 → CH3CH2OH这些是有机化学中几个常见反应的机构与机理分析,通过对这些反应进行深入的了解,可以帮助我们更好地理解有机化学的基础知识。
有机反应机理分析

有机反应机理分析一、有机化学反应概述1.有机化学反应的定义:有机化学反应是指有机化合物分子之间或有机化合物与无机化合物之间的相互作用,通过化学变化形成新的有机化合物的过程。
2.有机化学反应的类型:根据反应特点和产物性质,有机化学反应可分为合成反应、分解反应、置换反应、加成反应、消除反应、氧化还原反应等。
3.有机化学反应的条件:反应温度、反应压力、反应物浓度、催化剂、溶剂、光照等条件对有机化学反应的影响。
4.机理分析的基本概念:有机化学反应机理是指反应过程中各个步骤的化学变化顺序和历程。
5.机理分析的方法:(1)经验规律法:根据实验结果和已知反应特点,推测反应机理。
(2)电子效应法:分析反应物和产物中原子或原子团的电子效应,推测反应过程。
(3)过渡态理论:认为有机化学反应过程中存在过渡态,通过计算过渡态的能量和结构,分析反应机理。
(4)动力学方法:通过实验测定反应速率,分析反应机理。
三、有机反应机理的具体分析1.合成反应机理:(1)加成反应机理:有机化合物分子中的不饱和键与其他分子中的原子或原子团相结合,形成新的化合物。
(2)缩合反应机理:两个或多个有机分子结合成一个分子,同时放出小分子,如水、醇等。
2.分解反应机理:(1)热分解反应机理:有机化合物在高温下分解成其他有机物或无机物。
(2)光解反应机理:有机化合物在光照条件下分解成其他有机物或无机物。
3.置换反应机理:(1)取代反应机理:有机化合物中的原子或原子团被其他原子或原子团所取代。
(2)互变异构反应机理:有机化合物分子结构发生变化,生成异构体。
4.加成-消除反应机理:(1)加成-消除反应:有机化合物分子中的不饱和键与其他分子中的原子或原子团相结合,同时消除小分子。
(2)归中反应:有机化合物分子中的两个不饱和键结合成一个双键或三键,同时放出小分子。
有机反应机理分析是对有机化学反应过程中各个步骤的化学变化顺序和历程进行研究的方法。
通过分析有机反应机理,可以深入了解有机化学反应的特点和规律,为有机合成、材料科学、药物化学等领域提供理论依据。
有机化学反应机理画法剖析汇编
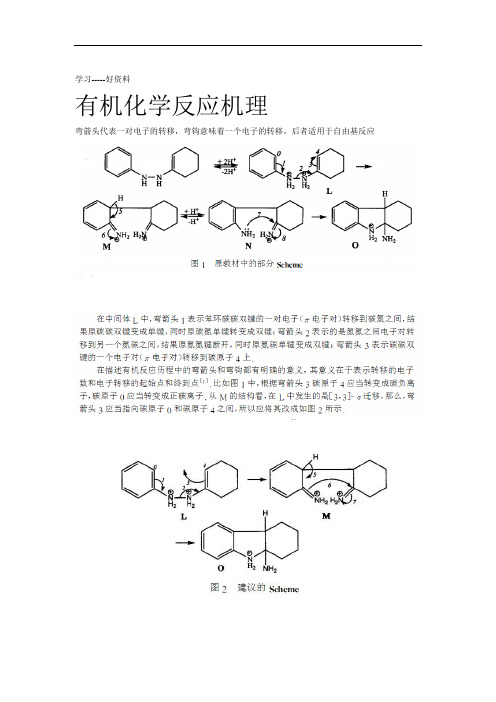
学习-----好资料有机化学反应机理弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应更多精品文档.学习-----好资料更多精品文档.好资料学习-----1 有机反应机理入门 1.1 画路易斯结构式键应准确无误,然后用氢原子完成其余的化学键。
先画出分子的骨架,环和pi 对于有机分子,骨架有时以简化形式给出。
62个;硼、铝和镓画出孤对电子,使每个原子核外满足充满电子的结构:氢个。
最后结构式中的每个原子总的成键电子数可以通过数其核个;其它原子8 )。
外的成键电子获得(包括共享电子提示:画路易斯结构式可参考以下结构特征:氢原子永远在构的外围,因为它只能成一个共价键;(1)碳、氮和氧有特定的键合模式。
(2)代表氢、烷基、芳基或它们的组合,这种变化并不影响成键R在以下的示例中模式。
pi也可以是sigma键与键。
4这4个键可以都是sigma键,①中性的碳原子为 )。
如双键和三键键的组合( 个键。
带有单个正电荷或负电荷的碳有3 ②)氮烯除外有3个键和一对未成对电子。
( ③中性的氮原子键,带有一个正电荷。
正电荷的氮成④ 4更多精品文档.学习-----好资料对未成键电子。
2⑤负电荷的氮成键,带有一个负电荷和2 对孤对电子。
⑥中性的氧原子成2键,带有2 带正电荷的氧成3键,带有1对孤对电子。
⑦轨道,可d(3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有个电子。
以扩展而容纳10 Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。
1.2 电负性或部分)的分子与带有负电荷(多数有机反应依赖于带有正电荷(或部分正电荷部分电荷的产生依赖于)的分子的相互作用而发生。
在中性有机分子中,负电荷电负性的差异。
年确定。
其数值越大,表明其吸电1960Linus 电负性的数值最初由Pauling在子能力越强,所以氟是吸电子能力最强的元素,见表:成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷电子受原子核的束缚小,pi比单键结构的部分电荷密度更大,这是因为双键上的更易于流动。
有机化学反应机理(总结最好的) (共143张PPT).ppt

CH3
OH
C-O+ CCHH33 -H+
CH3
O
C-OCH3 CH3
CH3
CH3 78%
仅有少量空阻大的羧酸按此反应碱性水解
双分子反应一 步活化能较高
O
H+
CH3C-OH
+OH CH3C-OH HOC2H5
按加成--消除机理进行 反应,是酰氧键断裂
加成
OH CH3-C-OH
HO+ C2H5
质子转移
四面体正离子
OH CH3-C-O+ H2
OC2H5
-H2O 消除
+OH
-H+
CH3C-OC2H5
O CH3C-OC2H5
*2 碳正离子机理
实例:卤代烃溶剂解反应的反应机理(SN1)
进攻C+
CH3 CH3 C Br
CH3
慢 -Br-
CH3
CH3 C+
CH3
C2H5OH
快
-H+
CH3 +
CH3 C HOC2H5 CH3
CH3
CH3 C OC2H5
CH3
3 酯化反应
定义:羧酸与醇在酸的催化作用下失去一分子水 而生成酯的反应称为酯化反应
常用的催化剂有盐酸 、硫酸、苯磺酸等
n-C6H13 HO C H
CH3
(S)-2-辛醇
[]D= + 9.9o
构型翻转
n-C6H13 H C OH CH3
(R)-2-辛醇
[]D= - 9.9o
构型保持
如果一个反应涉及到一个不对称碳原子上的一根键的变化,则将新
键在旧键断裂方向形成的情况称为构型保持,而将新键在旧键断裂的相 反方向形成的情况称为构型翻转。这种构型的翻转也称为Walden转换。 在SN2反应中,得到构型翻转的产物。
化学反应机理的解析方法

化学反应机理的解析方法化学反应机理是指描述化学反应过程中发生的分子、原子、离子之间的变化方式和速率的详细步骤。
深入了解化学反应机理对于理解和控制化学反应过程具有重要意义。
本文将介绍几种常用的化学反应机理解析方法,帮助读者更好地理解和研究化学反应机理。
一、动力学研究法动力学研究法是通过实验数据和数学模型研究化学反应过程的速率规律,从而推测出反应的机理。
其基本原理是根据实验测得的反应速率与反应物浓度、温度等相关因素之间的关系,推导出反应的速率方程。
根据速率方程的形式和反应物的性质,可以初步确定反应的机理步骤和物质间的相互作用方式。
二、分子动力学模拟法分子动力学模拟法利用计算机模拟分子和原子之间的相互作用,以及它们在不同条件下的运动轨迹,来揭示化学反应的机理。
通过分子动力学模拟,可以模拟出化学反应发生时分子的结构变化、能量变化以及反应中间体的生成过程。
这种方法在有机合成、催化反应等领域得到了广泛应用,并取得了许多重要的研究成果。
三、同位素示踪法同位素示踪法是一种利用同位素标记研究化学反应机理的方法。
通过将反应物中的某种原子或分子用同位素进行标记,进而追踪标记原子或分子在反应过程中的转化情况。
通过测量同位素的分布和比例变化,可以得到反应中间体的生成和反应路径的信息。
同位素示踪法在生物化学、环境科学等领域的研究中被广泛应用。
四、谱学方法谱学方法是通过测量反应物和产物在不同能量和频率范围内的光谱数据,以及对光谱数据进行定量分析,来解析化学反应机理的方法。
包括红外光谱、拉曼光谱、质谱等多种谱学技术。
这些光谱方法可以用于研究反应中间体的结构、反应路径的选择以及发生的速率等信息。
五、X射线晶体学方法X射线晶体学方法是通过测定反应物和产物中的晶体结构,来解析化学反应机理的方法。
通过确定分子在空间中的排列方式和结构特征,可以揭示反应过程中键断裂、键生成等细节信息。
X射线晶体学在有机反应、配位化学等领域得到了广泛应用。
有机化学反应机理解析

有机化学反应机理解析有机化学是研究碳元素化合物的科学,它涉及了大量的反应和机理。
了解有机化学反应的机理对于有机化学的学习和应用非常重要。
本文将对有机化学反应机理进行解析,希望能够帮助读者更好地理解有机化学反应。
一、酯水解反应的机理酯水解反应是有机化学中常见的一种反应,它是酯与水反应生成醇和羧酸的过程。
这个反应的机理可以分为两步:首先是酯的酯键被水攻击,生成酯中间体;然后是中间体被水继续攻击,生成醇和羧酸。
具体来说,酯的酯键被水攻击时,酯中间体的形成是通过亲核进攻的机制进行的。
水中的氢氧根离子(OH-)是亲核试剂,它攻击酯的羰基碳,将酯中间体形成。
然后,中间体再次被水攻击,生成醇和羧酸。
二、醇的氧化反应的机理醇的氧化反应是有机化学中常见的一种反应,它是醇与氧化剂反应生成醛或酮的过程。
这个反应的机理可以分为两步:首先是醇失去氢原子,生成醛或酮中间体;然后是中间体被氧化剂进一步氧化,生成醛或酮。
具体来说,醇失去氢原子的过程是通过氧化剂的作用进行的。
氧化剂可以是氧气、过氧化氢等。
醇中的氢原子被氧化剂夺取后,生成醛或酮中间体。
然后,中间体再次被氧化剂氧化,生成醛或酮。
三、芳香化反应的机理芳香化反应是有机化学中常见的一种反应,它是烯烃或炔烃与芳香化试剂反应生成芳香化产物的过程。
这个反应的机理可以分为两步:首先是烯烃或炔烃与芳香化试剂发生电子亲和反应,生成芳香化中间体;然后是中间体发生质子化或亲核取代反应,生成芳香化产物。
具体来说,烯烃或炔烃与芳香化试剂发生电子亲和反应时,烯烃或炔烃中的π电子与芳香化试剂中的空位轨道发生相互作用,形成芳香化中间体。
然后,中间体可以发生质子化反应,即失去一个质子,生成芳香化产物。
或者中间体可以发生亲核取代反应,即被亲核试剂攻击,生成芳香化产物。
四、酮的加成反应的机理酮的加成反应是有机化学中常见的一种反应,它是酮与亲核试剂反应生成加成产物的过程。
这个反应的机理可以分为两步:首先是酮的羰基碳被亲核试剂攻击,生成酮中间体;然后是中间体发生质子化或亲核取代反应,生成加成产物。
有机化学反应机理解析

有机化学反应机理解析有机化学反应的机理研究是化学领域中的重要领域之一,其主要内容是研究反应中电子的迁移和化学键的形成和断裂。
有机化学反应机理解析是深入探究反应机理的过程,它不仅可以用于对反应的解释,还可以为反应的设计与控制提供指导。
有机化学反应机理解析的方法主要包括实验和理论计算两种方式。
实验方法是通过分析反应物和产物的结构、反应条件和反应动力学特性等多个角度来揭示反应机理。
理论计算方法则是通过分子建模、计算化学和量子化学等手段,以理论预测为基础,结合实验验证来推断反应机理,并提供反应路径和反应中间体的结构性质等重要信息。
实验方法实验方法是研究有机化学反应机理的经典方法。
其主要通过实验手段来探究反应过程中的分子间相互作用、复合物的形成和断裂过程、过渡态的形态和识别过渡态等关键步骤,确立反应机理。
对于一般的有机化学反应,实验方法可以采用以下步骤:(1)研究反应动力学:反应动力学研究是研究反应机理的重要手段,其可以通过监测反应物消耗和产物生成的速率变化来探明反应的速率常数和反应机理。
(2)利用同位素标记法:同位素标记法是通过标记反应物或产物的一种方式,标记成为异位素的反应物会在反应中发生一系列的过程,从而揭示反应机理。
例如利用放射性标记法研究化学反应,可以通过对标记物的辐射测定来定量反应过程中中间体的形成和消失,为揭示反应机理提供重要的实验数据。
(3)利用电化学技术:电化学技术是一种重要的实验手段,它可以利用电解法控制反应速率,探析反应中离子和电子的行为,从而揭示反应机理。
例如利用电化学技术可以研究氧化还原反应中电子传递的机制,以及酸碱催化反应的机制。
理论计算方法理论计算方法是揭示有机化学反应机理的重要工具之一,其通过计算机程序分析反应物、中间体、过渡态等模型的几何构型和电子结构,在理论水平上推导反应机理并表明反应路径,对实验方法产生补充。
目前,常用的理论计算方法包括密度泛函理论(DFT)、分子力场(MM)和量子化学等。
化学教学有机化学反应机理

化学教学有机化学反应机理化学教学——有机化学反应机理引言:有机化学反应机理是有机化学中的核心内容之一,它涉及到有机化学反应的步骤、中间产物和反应条件等方面。
掌握有机化学反应机理对于理解有机化学的本质和应用具有重要意义。
本文将从有机化学反应机理的概念、分类、研究方法以及相关实例展开阐述。
一、概念及分类有机化学反应机理是指有机化合物在反应中发生的各种步骤以及中间产物的生成和消耗过程。
根据反应的机理不同,可以将有机化学反应分为以下几类:1. 加成反应:加成反应是指在有机化合物中的双键或三键上加入一个原子团或基团的反应,分为电子亲和性试剂的加成反应和亲电试剂的加成反应。
2. 消除反应:消除反应是指有机化合物中某些原子或基团被消去的反应,常见的消除反应有氢化消除、脱水杂化消除、氮气杂化消除等。
3. 变位反应:变位反应是指有机化合物中的一个原子或基团发生位置变化的反应,常见的变位反应有分子间和分子内的氢原子迁移反应、烯烃的异构化反应等。
4. 取代反应:取代反应是指有机化合物中一个原子或基团被另一个原子或基团所取代的反应,包括取代反应、亲核取代反应和芳香亲核取代反应等。
5. 重排反应:重排反应是指有机化合物中的一部分或全部原子或基团重新排列形成不同结构的新化合物的反应。
二、研究方法研究有机化学反应机理的方法主要包括实验研究和计算化学研究。
1. 实验研究:实验研究主要通过对反应物、产物及反应条件的变化进行控制和分析,来推断反应机理。
常用的实验方法包括动力学研究、同位素标记法、中间体的观察和分离等。
2. 计算化学研究:计算化学研究通过构建反应的分子模型,运用量子力学和密度泛函理论等方法,计算反应的能垒、活化能和反应速率等参数,从而得到反应机理的信息。
三、相关实例以下列举几种常见的有机化学反应机理及其实例。
1. 亲电加成反应:例如醇的酸催化酯化反应,反应物醇和酸催化剂通过质子化生成活化的羟基离子,然后羟基离子与酯化试剂亲电结合形成酯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学反应机理弯箭头代表一对电子的转移,弯钩意味着一个电子的转移,后者适用于自由基反应1 有机反应机理入门1.1 画路易斯结构式先画出分子的骨架,环和pi键应准确无误,然后用氢原子完成其余的化学键。
对于有机分子,骨架有时以简化形式给出。
画出孤对电子,使每个原子核外满足充满电子的结构:氢2个;硼、铝和镓6个;其它原子8个。
最后结构式中的每个原子总的成键电子数可以通过数其核外的成键电子获得(包括共享电子)。
提示:画路易斯结构式可参考以下结构特征:(1) 氢原子永远在构的外围,因为它只能成一个共价键;(2) 碳、氮和氧有特定的键合模式。
在以下的示例中R代表氢、烷基、芳基或它们的组合,这种变化并不影响成键模式。
①中性的碳原子为4键。
这4个键可以都是sigma键,也可以是sigma键与pi键的组合(如双键和三键)。
②带有单个正电荷或负电荷的碳有3个键。
③中性的氮原子(氮烯除外)有3个键和一对未成对电子。
键,带有一个正电荷。
4正电荷的氮成④.⑤负电荷的氮成2键,带有一个负电荷和2对未成键电子。
⑥中性的氧原子成2键,带有2对孤对电子。
⑦带正电荷的氧成3键,带有1对孤对电子。
(3) 有时磷原子和硫原子可有10个成键电子,这是因为磷和硫具有d轨道,可以扩展而容纳10个电子。
Lewis结构式是价键理论的重要内容,也是学习反应机理的基础。
1.2 电负性多数有机反应依赖于带有正电荷(或部分正电荷)的分子与带有负电荷(或部分负电荷)的分子的相互作用而发生。
在中性有机分子中,部分电荷的产生依赖于电负性的差异。
电负性的数值最初由Linus Pauling在1960年确定。
其数值越大,表明其吸电子能力越强,所以氟是吸电子能力最强的元素,见表:成键后,电负性大的元素的原子拥有部分负电荷,而且,双键结构的部分电荷比单键结构的部分电荷密度更大,这是因为双键上的pi电子受原子核的束缚小,更易于流动。
电负性是很基础的知识,但很有用,很重要。
通过电负性,可以解释为什么硼烷加成到烷基取代的不对称烯烃上不服从Markovnikov规则,为什么含活泼氢的羰基化合物去质子后主要以烯醇式存在...1.3 共振结构当分子中成键电子的分布不能用一个路易斯结构充分表达时,可由若干个仅仅在电子的位置上有差别的路易斯结构的组合来表达。
这种仅仅在电子的位置上有差别的路易斯结构称为共振结构。
共振结构表达了分子中电子的离域。
.画共振结构对于给定的分子或中间体,画共振结构的简单方法是先画出一个路易斯结构,然后用箭头表示电子的流动,画出一个仅仅是电子分布不同的结构。
这种电子流动只是形式上的,而分子中并没有真正的流动发生。
实际的分子就是这些共振结构的某些特征的杂化体。
所以,共振结构并不代表分子或中间体的实际结构,而只是一种帮助我们预测实际分子中电子分布的形式结构。
例如:提示:化学家常用以下几种箭头:①双向箭头用来联结共振结构:两个单箭头表示平衡:②③弯箭头表示一对电子沿箭头方向从起点流动到终点:半弯箭头表示一个电子沿箭头方向从起点流动到终点:④共振结构的规则①所有参与离域的电子都是pi电子或孤对电子,因为它们很容易进入p轨道。
②每个参加离域的电子一定要与其它电子有一定程度的交盖。
这意味着如果轨道之间是90o定向的,将不会交盖,最好的交盖发生在0度定向的情况下。
个,因为2个;三键计2电子数。
双键计pi每个共振结构必须要有相同的③.三键中只有一个pi键可与相邻的pi体系交盖;pi体系带有电荷时,负电荷计2个,正电荷计0个。
④每个结构中必须具有相同数目的成对pi电子。
以下两个结构不是共振结构,第一个结构中有两对pi电子:一对pi键电子和一对负离子的孤对电子;在第二个结构中没有成对的pi电子而只有未成对电子(图中点所示)。
⑤所有的共振结构必须具有一致的几何构型,否则它们就不能代表相同的分子。
例如以下结构(杜瓦苯)就不是苯的共振结构,因为它不是平面构型,而且少2个pi电子。
由于几何构型是同杂化状态联系在一起的,这意味这所有的共振结构中的原子的杂化状态不能变。
⑥依赖电荷分离的共振结构能量很高,对共振结构的贡献较不依赖电荷分离的共振结构小。
⑦通常,负电荷集中在电负性大的原子上,正电荷集中在电负性小的原子上,这样的结构对共振结构贡献大。
所以说含活泼氢的羰基化合物去质子产物主要以烯醇式为主,称其为碳负离子有失严密。
单个共振结构并不代表真正存在的化学实体,重要性在于可以帮助阐明化学物种(分子、中间体、过渡态等)的电子分布;一般而言,共振结构越多,其化学物种就越稳定,据此可以解释为什么在芳环的亲电取代中硝基钝化芳环,并成为第二类定位基。
互变异构体与平衡1.4互变异构体是那些仅在单、双键及小原子(通常为氢)的安排上不同的异构体。
适当条件下,上述异构体可通过简单的机理达到平衡。
平衡存在于正、逆反应速率相等的过程中。
提示:以下因素可帮助区分共振结构与互变异构体:①互变异构体是容易互相转化的异构体。
它们仅在单、双键及氢的安排上不同。
互变异构体间的平衡用一对半箭头表示。
②不同的共振结构代表不同的sigma键模式,而不是不同的化学物种。
共振结构用双箭头联结。
③对于给定的化合物,所有的共振结构都有一致的sigma键键合模式和一致的几何构型。
而在互变异构体中,sigma键模式则不同。
1.5 酸和碱(1) 布朗斯太德(Bronsted)酸和碱布朗斯太德酸是质子供体;而布朗斯太德碱是质子受体:如果上述反应可逆,反过来定义也一样:(2) 路易斯(Lewis)酸和碱路易斯酸是孤对电子或pi电子的受体,是缺电子体。
换言之,路易斯酸上的原子由于与一个或多个电负性较大的原子相连而具有正电荷或部分正电荷。
路易斯碱是孤对电子或pi电子的供体。
具有负电荷的路易斯碱的碱性较没有负电荷的路易斯碱的碱性强。
.因此,有机反应也被认为是路易斯酸碱之间的反应:1.6 亲核试剂与亲电试剂亲核试剂是寻找缺电子中心的反应物种。
它们含有带有负电荷或部分负电荷的原子(亲核性原子)。
缺电子中心称为亲电试剂,这些缺电子中心通常带有正电荷或部分正电荷,但缺电子物种也可以是中性分子。
提示:一些基本概念①共价键断裂时,如果原来由两个原子共享的电子保留在一个碎片上,这种方式称为共价键的异裂。
尽管异裂过程常常与离子中间体有关,但也有例外。
②对多数反应而言,称其中的一个反应物为底物而另一个为进攻试剂常常比较方便。
为新键提供碳原子的分子常被指定为底物。
而形成碳碳键时,则需要主观指定哪个是底物哪个是进攻试剂。
③在异裂反应过程中,进攻试剂有时带给底物一对电子,有时从底物带走一对电子。
带来一对电子的称为亲核试剂,这样的反应称为亲核反应;带走一对电子的称为亲电试剂,这样的反应称为亲电反应。
④对于底物分子被异裂切断的反应,其断裂的一部分通常称为离去基团。
带着一对电子离去的称为离核基团,而留下一对电子的离去基团称为离电基团。
这些概念看来枯燥,但若能熟练运用,对于讨论问题十分方便。
1.7 反应机理的表达反应机理应一步一步地给出反应过程中化学键(电子)重新组合、安排的过程。
这些机理并没有真正的实体存在,只是为了表达反应是如何发生的一种尝试。
尽管实验可以证明某些机理合理而另一些不合逻辑,但对多数反应而言,并没有证据支持其机理。
因此,在遵从公认的准则的情况下,我们可以任意地描述一个反应的机理。
配平方程式1.7.1从有机化学的观点来看,只要碳和电荷平衡,就可以认为一个反应方程式已经配平了。
不必配平反应过程中的无机物。
1.7.2 用弯箭头表示电子的流动在表达机理时,旧键的断裂和新键的形成一般用弯箭头表示。
这些箭头是表达反应过程中电子的重新分布的方便的工具。
这些说明电子重新分布的箭头是从电子云密度高的位点画向缺电子(电子云密度低)的位点。
也就是从负电荷或部分负电荷(孤对电子)的位点画向正电荷或部分正电荷的位点(偶极矩的正极点)。
换言之,是从亲核试剂(路易斯碱)画向亲电试剂(路易斯酸)。
而且一般只是一些在非常反应中才会出现两个箭头从同一原子同出(或同入)的情况。
例酰氯和氨生成酰胺的反应机理:附:弯箭头简史弯箭头的发明者被认为是Robert Robinson (1886-1975),1947年Nobel化学奖得主。
The first use of curly arrows to represent the movement of electrons is An Explanation of the Property of Induced Polarityin a paper entitledof Atoms and an Interpretation of the Theory of Partial Valences on an Electronic Basis, by William Ogilvy Kermack and Robert Robinson, published in The Journal of the Chemical Society, 1922, 121: 427.酸、碱介质中的反应机理对于酸性介质中进行的反应,首先在反应物中找到碱性最强的原子,然后使其质子化,再给这个正离子寻找合适的反应。
对于碱性介质中的反应,先在反应物中找到酸性最强的质子,去质子后得到一个负离子,再给这个负离子寻找合适的反应。
如果这个负离子有合适的离去集团,就可以发生消除反应。
如果形成的负离子是良好的亲核试剂,就寻找亲电物种使之反应。
例 Claisen缩合的反应机理:1.7.3 化学反应的推动力化学反应可以由焓减、熵增或这两个过程联合推动。
由少数分子生成多数分子的反应是熵增推动的;而生成更稳定分子的过程则主要是焓减推动的。
考虑一个化学反应的机理时,应提出这样的问题:反应为什么这样进行?什么因素有助于反应进行?(1) 离去基团对于亲核取代反应,离去基团的性质常常成为该反应能否发生的关键。
一般而言,离去基团的离去能力与其碱性的强弱相反。
例如水(H2O)是比羟基(OH-)更更好的离去基团。
离去基团能力:(F-)是比氟离子(I-)好的离去基团;碘离子.如果反应涉及到差的离去基团,要使反应发生,常常需要很强的亲核试剂。
(2) 生成稳定的小分子生成稳定的小分子既是焓减过程也是熵增过程,因此成为化学反应的很好的推动力。
这些稳定的小分子包括:氮、二氧化碳、一氧化碳、水、二氧化硫和无机盐等。
例在四苯基环戊二烯酮和顺丁烯二酸酐的反应中,生成一氧化碳成为反应的推动力:1.7.4 反应原料与产物间的结构关系:标号法给反应原料和生成物的原子标号,可以帮助我们确定产物分子中原子与原料分子中原子之间的关系,并由此了解反应是如何进行的。
方法:首先给原料分子中的原子编号;然后通过寻找原子的共同序列和键合模式,确定产物分子中与原料分子中原子相对应的原子,并依原编号进行相应编号;最后用尽可能少的化学键变化来补足剩余的编号。
