布鲁氏菌病疫苗(S2株)免疫羊抗体消长规律的研究
布鲁氏菌疫苗A19与S2株免疫奶牛抗体消长规律与4种检测方法比较
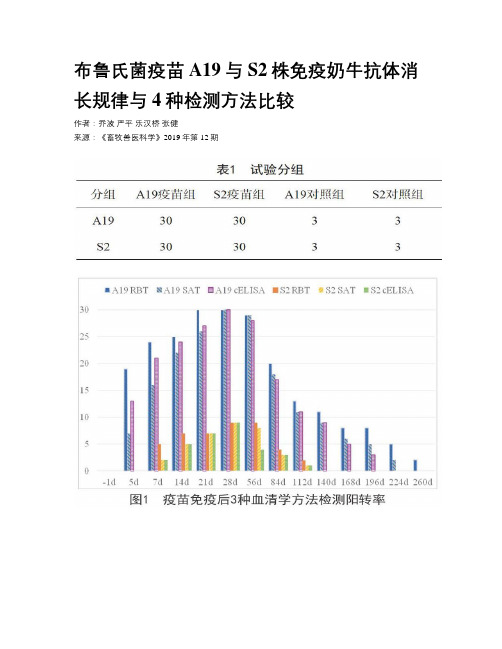
布鲁氏菌疫苗A19与S2株免疫奶牛抗体消长规律与4种检测方法比较作者:乔波严平乐汉桥张健来源:《畜牧兽医科学》2019年第12期摘要:为了解奶牛免疫A19疫苗和S2疫苗后的抗体消长规律,比较目前地市级实验室常用的3种血清学检测方法的效果,研究分别按厂家说明书对分别对60头试验奶牛进行免疫,使用虎红平板凝集试验(RBT)、试管凝集试验(SAT)和竞争ELISA(cElisa)对免疫前1d 至免疫后260d的血清样品进行检测。
结果:2组奶牛血清样品经RBT、SAT、cELISA检测,抗体在28d达到峰值,且在21~56d保持较高水平,A19疫苗组260d仍未全部转阴,S2疫苗组在免疫后140d已全部转阴。
A19疫苗的阳转率明显高于S2疫苗组并且抗体持续时间更长。
关键词:布鲁氏菌病;奶牛;A19和S2疫苗;血清学检测中图分类号:S855.12文献标识码:Bdoi:10.3969/j.issn.2096-3637.2019.12.0010引言布鲁氏菌病(Brucellosis)是由布鲁氏菌引起的人兽共患传染病,病原是革兰氏阴性菌、兼性胞内寄生菌[1]。
该病以公畜睾丸炎、母畜流产、产奶量下降等为主要症状[2]。
布鲁氏菌进人机体被巨噬细胞吞噬,会有10%以上的细菌在巨噬细胞内定植。
该菌根据形态差异分为粗糙型(rough,R)和光滑型(smooth,S)2种,光滑型具有完整的外膜结构,能刺激机体产生针对脂多糖(lipopolysaccharide,LPS)中的O-侧链的抗体,粗糙型布鲁氏菌没有O-侧链抗原[3]。
常用的血清学检测方法中虎红平板凝集试验(RBT)是以布鲁氏菌细胞壁脂多糖上的O 链抗原作为诊断位点,试管凝集试验(SAT)抗原检测光滑脂多糖抗体(S-LPS),ELISA方法主要以光滑型布鲁氏菌脂多糖抗原检测布鲁氏菌抗体[4-6]。
我国常用的布病疫苗包括牛种布鲁氏菌A19疫苗、猪种S2疫苗、羊种M5疫苗,均为光滑型[7]。
不同布氏菌病活疫苗免疫抗体消长规律试验

试验研究 | Experimental research0 引言布鲁氏菌病(brucellosis 又称布氏菌病或布氏杆菌病,简称“布病”)是由布鲁氏菌(brucella)引起的人畜共患传染病,广泛分布于世界各地,多种动物和禽类对布鲁氏菌均有不同程度的易感性[1]。
自然感染以羊、牛和猪常见,其特征为生殖器官、胎膜及多种器官组织发炎、坏死和肉芽肿的形成,在临床上主要表现为波浪热、流产、不孕、睾丸及关节炎等症状[2]。
但近年羊布氏菌病感染率呈明显上升趋势,不但严重危害我国畜牧业(包括养羊业在内)的健康发展,还严重威胁国内部分地区人们的健康、食品安全以及全社会的公共卫生安全。
1 材料与方法1.1 疫苗 实验室制备的布氏菌病活疫苗(Rev.1株),批号为53003,布氏菌病活疫苗(S2株),批号为5393032,均由金宇保灵生物药品有限公司提供。
1.2 检测试剂 布鲁氏菌病试管凝集试验抗原、阳性对照、阴性对照、布鲁氏菌病虎红凝集试验抗原,均购自中国兽医微生物菌种保藏管理中心。
1.3 试验动物 试验动物来源于定点供应基地,经布鲁氏菌病虎红平板凝集试验检测为阴性的绵羊70只。
1.4 试验分组与免疫第1组为布氏菌活病疫苗(Rev.1株)免疫组,共计30只绵羊。
将疫苗用布氏菌活病疫苗(Rev.1株)专用稀释液溶解稀释至20头份/mL(按每头份为1滴,1滴约0.05 mL计算),用专用滴眼器进行眼结膜接种,每只羊滴眼1头份(0.05 mL),含1×109CFU/头份。
第2组为布氏菌病活疫苗(S2株)免疫组,共计30只绵羊。
将疫苗用生理盐水溶解稀释至1头份/mL,进行口服免疫,每只羊口服1头份,含1×1010 CFU/头份。
第3组为空白对照组,共计10只,不接种疫苗,相同条件下隔离饲养。
1.5 试验步骤所有试验羊分别于免疫前、免疫后14、21、28、49、60、90、120、150 d采血,分离血清,采用虎红平板凝集试验(RBT)和试管凝集试验(SAT)试验进行抗体测定。
布鲁氏菌病疫苗S2株免疫成年绵羊的抗体消长规律试验

布鲁氏菌病疫苗S2株免疫成年绵羊的抗体消长规律试验樊生平;齐守军;李连平;韩小军;曹春红【摘要】[目的]探索成年绵羊经布鲁氏菌病疫苗S2株免疫后血清抗体的消长规律.[方法]采用"灌服100亿菌""灌服200亿菌"和"肌注50亿菌"三种不同免疫方法,对试验羊进行布鲁氏菌病S2株疫苗的免疫接种.在接种前和接种后不同时间点分别采集试验羊血清样品,用虎红凝集试验(RBT)和试管凝集试验(SAT)进行血清抗体检测.[结果]肌注组抗体上升较快,于免疫后10天达到峰值,然后快速下降,90天后下降速度减缓,但在180天时RBT和SAT阳性率仍分别为63.2%和84.2%,SAT平均凝集效价为1:178.9.2个口服组均在免疫20天后抗体达到最高,以后下降,分别于90天和120天降到最低,然后有所回升并维持在低水平波动;至180天时,口服组的RBT阳性率均下降为0,SAT阳性率分别下降为40.9%和23.1%,SAT平均凝集效价分别降至1:40.9和1:18.2.[结论]对采用布鲁氏菌病S2株活疫苗口服免疫6个月以后的羊群,可用虎红凝集试验进行布鲁氏菌病检疫的初筛.【期刊名称】《中国动物检疫》【年(卷),期】2017(034)002【总页数】3页(P88-90)【关键词】成年绵羊;布鲁氏菌病;S2株疫苗;免疫抗体;检测;检疫【作者】樊生平;齐守军;李连平;韩小军;曹春红【作者单位】山西省大同市动物疫病预防控制中心,山西大同 037004;山西省大同市动物疫病预防控制中心,山西大同 037004;山西省大同市动物疫病预防控制中心,山西大同 037004;山西省大同市动物疫病预防控制中心,山西大同 037004;山西省灵丘县动物疫病预防控制中心,山西灵丘 034400【正文语种】中文【中图分类】S851.3布鲁氏菌病(Brucellosis,以下简称布病)是由布鲁氏菌属细菌引起的一种人兽共患传染病。
牛羊布鲁氏菌疫苗免疫后抗体水平消长规律分析

X u m u s h o u y i布鲁氏菌病是一种由布鲁氏菌引发的传染性疾病,该病菌主要寄生在网状的淋巴细胞中,除了会攻击免疫系统外,还会引起菌血症,对动物的骨骼系统带来严重的损伤,导致母畜流产,生殖能力下降。
现阶段接种疫苗是控制和预防布鲁氏菌病的主要途径,因此,相关的工作人员应重视牛羊布鲁氏菌疫苗的研究工作,加强对疫苗抗体的评估,为后续疫苗的研制工作夯实基础。
一、牛羊布鲁氏菌疫苗实验分析为了准确评价牛羊布鲁氏菌疫苗的接种情况,本文以我省某市牛羊布病接种的抗体疫苗情况为例,该市接种的是哈药六厂研发的S2疫苗,生产批号为201814、201716以及201717,另外,还使用了该企业生产的A19株疫苗,实验还调查了其他6个试验点疫苗的接种情况。
该试验中肉牛标本数量为84头,肉羊为38头,可以充分观察抗体消长规律。
另外,本试验中使用的检测试剂是PBRP。
二、牛羊布鲁氏菌免疫后抗体水平消长规律的实验方法研究1、抗体的筛查分析需要对牛羊开展布病抗体的筛查工作,本实验中主要利用布病阴性场的方式进行免疫实验,每头牛均需要先口服500亿的S2活菌疫苗,每只羊则需要口服100亿的S2活菌疫苗,而A19疫苗则需要采用皮下注射的方式,本实验中对肉牛84头、肉羊38只进行了注射。
在抗体筛查时发现,其中有50头牛对于A19疫苗免疫,36只羊对S2疫苗免疫。
另外,为了保证实验结果的科学性,本实验还在该省份其他6个地区,也进行了牛羊布鲁氏菌疫苗的免疫实验。
2、样品的采集分析在样品的采集过程中,在对肉牛采集时,除了在免疫前采集血液外,同时在接种后的15天、30天以及45天均分别采集了血液,并将血清进行分类;在对羊采集时,也采集了免疫前的血液,同时在免疫后的7天、15天、30天、45天以及135天均采集了血液,用于提取血清。
3、抗体的检测方法分析本实验根据相关的标准,采用RBPT方式对抗体进行检测,首先工作人员取用布病虎红平板凝集抗原30μL放在玻璃平面上,然后再将其和30μL的血清混合均匀,观察其在4分钟内是否存在凝结的现象,一旦出现凝集的颗粒,则表示布病的抗原体呈现阳性。
浅谈人畜共患传染病——布鲁氏菌病综合防控措施

浅谈人畜共患传染病——布鲁氏菌病综合防控措施摘要:布鲁氏菌病(以下简称“布病”)是由布鲁氏菌属细菌感染引起的人畜共患传染病,又称之为波状热、地中海热,马其他热,《动物防疫法》规定其为二类疫病,《传染病防治法》规定其为乙类传染病。
牛羊感染后严重影响生产性能,造成大量牲畜流产、死胎等,给畜牧业生产带来巨大损失。
人感染后轻则引起人发热、多汗、头痛、关节疼痛、疲乏无力、单侧性睾丸炎等,重则可致不孕不育、丧失劳动力,可引起孕妇流产等,严重损害人类健康,是当前我国重点防控的人畜共患传染病之一。
此病在发病早期不易与其他发热性疾病进行鉴别,容易被误诊,因此,防控形势十分严峻。
作为一名长期在基层工作的兽医人员,本人针对当前豫西农村地区牛羊布病流行态势、临床症状和防控措施,浅谈一下自己的实践体会,以期为促进畜牧业健康发展,维护人民群众身体健康贡献力量。
关键词:布鲁氏菌;人畜共患病、防控措施一、布病传染源感染布病的牛、羊和猪,是人患布病的主要传染源,鹿、犬等其它动物居次要地位。
感染布病牛羊的流产物、阴道分泌物、乳汁、肉类、皮毛、尿、粪便及被污染的土壤、水、饲料等均含有布氏菌,布病母畜的流产物是造成布病流行的主要传播因子。
养殖、兽医、皮毛收购等直接从业人员因接触病畜多,感染和患病也多,该病具有明显的职业性。
二、布病临床症状人畜感染布病后通常会发展成肉芽肿性炎性病变,这种病变经常在淋巴组织和生殖器官、乳房、乳房上淋巴结,关节和滑膜中发现。
同时,还会出现坏死性胎盘炎、可触及的睾丸改变、坏死性睾丸炎、附睾炎、坏死性精囊炎、前列腺炎和急性乳腺炎。
羊感染后,以母羊发生流产和公羊发生睾丸炎为主要特征。
公羊主要表现为附睾和睾丸的病变,精液质量显著下降,少部分病羊发生角膜炎和支气管炎。
附睾肿大可为单侧或双侧,睾丸可能出现纤维萎缩。
母羊主要表现为流产和死胎。
流产一般发生在怀孕后的3-4个月。
患病母羊易发生关节炎和滑液囊炎而致跛行。
三、布病传播方式1、传播途径一般来说,牛羊布病主要传播途径是流产或足月分娩后受感染牛羊排出的胎盘、胎液和阴道分泌物。
绵羊不同途径免疫S2株、Rev.1布鲁氏菌病活疫苗后抗体消长规律

试验研究 | Experimental research0 引言布鲁氏菌病是一种世界性的人畜共患病,对经济和公共健康都有重大影响。
牛、羊感染流产布鲁氏菌和羊种布鲁氏菌,是人类疾病的共同来源,该病主要危害人畜生殖系统,人与人之间几乎不传播,患病动物是主要的传染源,其中病羊感染人的比例较高。
目前疫苗免疫是布鲁氏菌病防控的重要手段之一,尤其布鲁氏菌病高发地区。
我国在《国家布鲁氏菌病防治计划(2016—2020年)》中明确提出一类地区对羊采取全面免疫措施。
我国羊使用的布鲁氏菌病疫苗主要有Rev.1羊种和S2猪种。
羊种Rev.1是应用最广泛的羊种布病活疫苗,可对羊实施有效的免疫[1]。
猪种的S2株弱毒疫苗具有良好的免疫效果,但目前仍无法判断区分野毒及接种疫苗产生的抗体,主要从抗体在体内存续时间的长短判断,存续时间短的是疫苗免疫,时间长的为野毒感染[2]。
M5菌株是一株由我国从羊种布鲁氏菌中分离并自行培育致弱的菌株,对牛、羊均可产生较好的免疫力[3]。
由于该菌株毒力较强且存在毒力返强的风险,同时因其对妊娠动物有毒力增强的现象,更不能用于怀孕羊,目前市场已经不进行生产销售[4]。
1 试验材料1.1 样品琥红平板凝集试验和试管凝集试验结果均为:阴性的健康羊血清样品212份,采自河北省境内某地区规模化养殖场,均免疫过布病疫苗S2株,但已超过18个月。
1.2 试剂布病阴性羊40只(20只/组),猪种布鲁氏菌S2弱毒疫苗(中牧)、Rev.1疫苗(国外小量购进)。
2 试验方法使用布鲁氏菌S2疫苗以口服方式对羊进行免疫,使用Rev.1疫苗以滴眼方式对羊进行免疫,免疫后分别在特定时间点使用虎红平板凝集试验(RBT)和试管凝集试验(SAT)对羊群抗体阳性率进行监测[5]。
3 结果与分析应用RBT及SAT试验方法检测羊免疫后在第14、21、28、58、90、122天的血清40份,免疫后不同天数布病特异性抗体检出率见图1、图2。
六种布鲁菌病疫苗对绵羊与山羊免疫效果的比较

Chinese Journal of Animal Infectious Diseases中国动物传染病学报收稿日期:2023-12-27作者简介:李鑫,男,本科,高级兽医师,主要从事动物疫病预防控制研究通信作者:李鑫,E-mail:139****************2024,32(1):88-95·研究论文·六种布鲁菌病疫苗对绵羊与山羊免疫效果的比较摘 要:为了比较不同布鲁菌病疫苗对乌拉特草原以放牧为主的山羊与绵羊的免疫效果,我们在乌拉特草原6个苏木/镇,随机选取80~100日龄并经过布鲁菌病检测阴性的乌拉特土种绵羊羔385只、二狼山绒山羊羔275只,用6种布鲁菌病疫苗进行免疫效果比对试验。
采用琥红平板凝集试验(RBPT )和试管凝集试验(SA T )分别对试验组羊接种疫苗后7、14、21、35、60、120、150、180、210、240、270 d 进行转阳率和抗体效价检测;免疫后270 d 进行攻毒试验。
RBPT 和SA T 结果显示,M5-90Δ26和S2接种绵羊与山羊后抗体产生快,持续时间长;免疫后攻毒试验结果显示,A19点眼绵羊和A19-ΔVirB12株皮下注射绵羊保护比例均为4/6;M5-90Δ26绵羊皮下注射和ReV .1山羊点眼的保护比例均为4/5;本试验为乌拉特草原建立牛羊免疫无布鲁菌病区筛选理想疫苗,以及为创建全国首个牛羊免疫无布鲁菌病区制定合理的免疫程序提供了科学依据,同时对布鲁菌病疫苗的研制及国内其他地区布鲁菌病防治具有参考价值和指导作用。
关键词:布菌病疫苗;免疫效果;比较中图分类号:S859.797文献标志码:A文章编号:1674-6422(2024)01-0088-08Comparison of the Immunization Eff ects of Six Kinds of Brucellosis VaccinesWorked on Sheep and GoatsLI Xin 1, XU Wentao 1, JI Yatu 1, DUAN Liping 1, ZHAO Bei 1, YANG Dan 2, DONG Kexue 3,DI Dongdong 4, FAN Weixing 5(1. Animal Disease Prevention and Control Center of Wulate Town, Bayannaoer 015000, China; 2. Comprehensive Support and Techonology Promotion Center of Wengeng Town, Bayannaoer 015000, China; 3. Post-immunization challenge test, Tiankang Biopharmaceutical Co., Ltd., Suzhou 215000, China ; 4. Post-immunization challenge test, Jinyu Biotechnology Co, Ltd,. Huhehaote 010000, China ; 5. China AnimalHealth and Epidemiology Research Center, Qingdao 266000, China)李 鑫1,徐文涛1,吉雅图1,段丽萍1,赵 贝1,杨 丹2,董科学3,狄栋栋4,范伟兴5(1.乌拉特后旗动物疫病预防控制中心,巴彦淖尔015000;2.乌拉特中旗温更镇综合保障和技术推广中心,巴彦淖尔015000;3.天康生物制药有限公司,苏州215000;4.金宇生物技术股份有限公司,呼和浩特010000;5.中国动物卫生与流行病学中心,青岛266000)Abstract: In order to compare immunization eff ects of diff erent Brucellosis vaccines worked on goats and sheep, 385 sheep of native species aged 80-100 days and 275 Erlang Mountain goats aged 80-100 days were randomly selected among 6 towns of the Wulate grassland, they all tested negative of brucellosis, comparative immunization eff ect tests were carried out with six kinds of brucellosis vaccines. RBPT and SA T were adopted to detect the positive conversion rate and antibody titer respectively on 7, 14, 21, 35, 60, 120, 150, 180, 210, 240 and 270 days of experimental group after vaccination. The challenge experiment was carried out 270 days after immunization. The results of RBPT and SA T showed that M5-90Δ26 and S2 were inoculated for sheep and goats obtained fast antibody production, and long duration; The results of the challenge test after immunization showed that the protection ratio of A19 dripped in sheep’s eyes and the protection ratio of A19-ΔVirB12· 89 ·李 鑫等:六种布鲁菌病疫苗对绵羊与山羊免疫效果的比较第32卷第1期with subcutaneous injection of sheep were all 4/6; The protection ratio of M5-90Δ26 with subcutaneous injection of sheep was 4/5, and ReV .1 dripped in goats’ eyes got the same result in 4/5. The ultimate purpose of this experiment is to screen out the ideal vaccine for the establishment of cattle and sheep immunization-free area without brucellosis in the Wulate grassland, and to develop a reasonable immunization program and provide scientifi c basis for the creation of the country's fi rst cattle and sheep immunization-free area without Brucellosis, at the same time, to give reference and guidance for the development, improvement and promotion of brucellosis vaccines and the prevention and treatment of Brucellosis in other regions of China.Key words: Brucellosis vaccines; immunization effect; comparison 布鲁菌病(Brucellosis)是由布鲁菌引起的人、畜共患传染病。
羊布鲁氏菌S2疫苗免疫与自然感染鉴别方法

2021年(第42卷)第2期下半月究研S HI Y AN Y A NJ IU布鲁氏菌病是由布鲁氏菌感染引起的人或多种动物共患的急性或慢性传染病,临床上主要表现为妊娠家畜流产、关节肿大等症状。
疫苗接种是目前控制重点疫区布病流行的一种方法,但是接种活疫苗以后,布病感染的疫情被掩盖了,而不是消失了,因为疫苗接种动物与自然患病动物无法甄别,法定检疫措施严重受阻。
笔者应用荧光微球抗体检测试纸条进行了羊布鲁氏菌S2疫苗免疫与自然感染鉴别试验,随机对应用试管凝集试验结果进行复核,结合样品相应的免疫背景,经分析,效率高,准确率高,建议将该方法推广应用于羊布鲁氏菌免疫或感染的筛查、辅助诊断等。
1试验原理荧光标记物采用的是镧系元素及其螯合物经特殊包裹加工而成的荧光微球,荧光强度远高于普通荧光标记物,大大提高了检测的灵敏度。
镧系元素及其螯合物的激发波长和发射波长间有一个较大的Stokes 位移,减少了由激发光引起的特异杂散光对检测的干扰,提高荧光检测稳定性;同时荧光寿命长,消除了环境中荧光物质对待测物的干扰,而且荧光激发波长较宽,发射波长较窄,具有本底低、分辨率高、特异性强的优势。
2试验步骤样品选择:选择试管凝集试验结果阴性羊血清10份,阳性羊血清20份(结合样品采集登记表选择免疫S2疫苗羊血清10份,自然感染羊血清10份),分成阴性对照组、S2疫苗免疫组、自然感染组,每组10份羊血清。
样本稀释:用吸管取9滴样本稀释液,再吸取1滴羊血清在1.5ml 离心管中做10倍稀释并混匀。
撕开检测试纸铝箔包装袋,取出检测试纸,放于平整、洁净的台面上。
用配套吸管吸取已稀释好的样本,垂直而缓慢地滴加2~3滴(约80ul )到加样孔内。
室温下放置15min ,读数前先将产品配套ID 卡插入便携式荧光免疫分析仪,之后将反应到时间的检测试纸加样孔朝里插入便携式荧光免疫分析仪,点击“快速检测”进行读数。
3结果判定阴性:当LPS 检测值<0.1时,判为阴性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
布鲁氏菌病疫苗(S2株)免疫羊抗体消长规律的研究申捷;郝璐;郭金贵;菊花;刘志伟;毛开荣;申之义;赵心力;宝音达来;马立峰;戴晓光;马晓雪;苏胜杰;萨茹拉;云涛;双燕【摘要】为探讨羊经布鲁氏菌病疫苗免疫后的血清抗体消长规律,本研究分别对绵羊和山羊进行布鲁氏菌S2株疫苗不同剂量的灌服,于免疫前和免疫后不同时间采集血清样品,采用虎红平板凝集试验和试管凝集试验进行血清抗体检测。
结果表明,绵羊及山羊均在免疫后20d时血清抗体阳性率达到最高峰,之后呈下降趋势,免疫后90天降至低点。
免疫后90至360d,绵羊组抗体阳性率几乎一直维持在14%以下,各时段无显著性差异(P>0.05);山羊组抗体阳性率在免疫后90至360d期间时高时低,起伏较大,无明显规律。
试验期间,山羊的抗体阳性率普遍高于绵羊,且降升幅度较大。
同时,研究表明,同种羊100亿和200亿两个免疫剂量组的抗体阳性率差异不大。
%To investigate the pattern of increasing or decreasing of serum antibody in sheep and goats immunized with brucellosis vaccine,RPST and tube agglutination test were used in the study to determine the level of serum antibody in sheep and goats before and after immunization with Brucella strain S2 vaccine. The results indicated that the serum antibody positive rate in sheep reached the highest level 20 DPI,then started to decrease and remained relatively low level 90-360 DPI,mostly below 6%,and relatively higher in few individuals,up to 14%. The positive rate in goats reached the highest 20 DPI,then decreased and remained low or relatively low level 90-360DPI,but with decreasing or increasing sometimes. Comparatively,antibody positive rate in goats was generally higher than in sheep,and thedescending and ascending range was bigger. It was also shown that there was no significant difference in antibody posi-tive rate between 10 billion CFU dose group and 20 billion CFU dose group in same species.【期刊名称】《中国动物检疫》【年(卷),期】2015(000)001【总页数】6页(P68-73)【关键词】绵羊;山羊,布鲁氏菌病;免疫;抗体监测【作者】申捷;郝璐;郭金贵;菊花;刘志伟;毛开荣;申之义;赵心力;宝音达来;马立峰;戴晓光;马晓雪;苏胜杰;萨茹拉;云涛;双燕【作者单位】内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;中国兽医药品监察所,北京 100081;内蒙古农业大学,内蒙古呼和浩特市 010018;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010;内蒙古自治区动物疫病预防控制中心,内蒙古呼和浩特市 010010【正文语种】中文【中图分类】S858.26布鲁氏菌病(brucellosis),简称布病,是由布鲁氏菌属细菌(Brucella spp)引起的人畜共患的变态反应性传染病。
牛、羊、猪等家畜最易感。
对人有高度感染性和致病性[1]。
据统计资料表明,全世界每年因布鲁氏菌病造成的经济损失近300亿美元。
目前我国该病流行严重,正威胁着人类健康,损害着畜牧业经济。
当前布病的诊断方法多种多样且各具特色,但都存在一定的局限性,尚无成熟、科学的可鉴别布鲁菌免疫和自然感染抗体的方法。
因此,采用综合诊断技术比较适宜当前布病防控诊断,采用诸如虎红平板凝集试验(RBT)等快速诊断方法对人和动物进行初步的布病筛选,发现阳性后可进一步进行CFT、ELISA、PCR 综合诊断技术进行判断,确保检测结果可靠、准确[2]。
我国用于预防牲畜布鲁氏菌病的疫苗有牛种布鲁氏菌A19菌株弱毒菌苗、羊种布鲁氏菌M5菌株弱毒菌苗和猪种布鲁氏菌S2菌株弱毒菌苗。
这些疫苗虽然具有良好或较好的免疫效果,但均存在一个共同弊端,即现有的血清抗体检测方法均不能从定性上区分疫苗接种动物和自然感染动物,从而影响防疫工作的效果。
目前主要通过疫苗免疫抗体和自然感染抗体存续时间的不同鉴别疫苗免疫动物和自然感染动物,一般情况下自然感染动物的抗体存续时间较长,而疫苗免疫动物的抗体存续时间较短。
关于S2疫苗免疫家畜的抗体存续时间,已有的报道说法不一,为此本研究对S2疫苗免疫绵羊及山羊采用虎红平板凝集试验和试管凝集试验进行血清抗体分阶段的检测,探究S2疫苗免疫后绵羊和山羊的抗体消长规律,为布病防疫工作提供科学指导。
1.1 主要材料1.1.1 试验疫苗布鲁氏菌病S2株活疫苗,中牧实业股份有限公司兰州生药厂生产。
1.1.2 抗体检测试剂虎红平板凝集抗原及阴阳性血清、试管凝集抗原及阴阳性血清购自中国兽药监察所。
1.1.3 试验动物未检出布鲁氏菌病且无布鲁氏菌病感染史的246只山羊和250只绵羊。
试验羊群分别来源于鄂尔多斯市棋盘井镇和阿拉善盟阿左旗。
试验地点选取在相对比较偏远,试验羊群与其他畜群无直接接触的草场进行。
1.2 方法1.2.1 试验羊群分组见表1。
1.2.2 免疫方法灌服免疫。
1.2.3 抗体检测在免疫前及免疫后20d、50d、90d、120d、150d、180d、210d、240d、270d、300d、330d、360d对两个试验点所有试验动物进行采血并分离血清,采用虎红平板凝集试验、试管凝集试验检测免疫抗体水平。
虎红平板凝集试验、试管凝集试验操作按产品说明书进行。
2.1 绵羊各试验组检测结果空白对照组各次抗体检测均为阴性。
绵羊各试验组结果统计见表3和图1。
2.2 山羊各试验组检测结果空白对照组各次抗体检测均为阴性。
山羊各试验组结果统计见表4和图2。
2.3 100亿剂量免疫各试验组检测结果空白对照组各次抗体检测均为阴性。
试验组结果统计见表5和图3。
2.4 200亿剂量免疫各试验组检测结果空白对照组各次抗体检测均为阴性。
试验组结果统计见表6和图4。
两地绵羊的抗体升降情况基本一致,在免疫后20d时血清抗体阳性率达到最高峰,之后呈下降趋势;免疫后90d,抗体阳性率降到6%以下。
阿拉善免疫羊此状况一直维持到约180d,期间多次为0,最高达6%;210d以后个别试验组、个别时段抗体阳性率有所回升,最高达14%。
鄂尔多斯免疫羊免疫后90至360d一直维持低水平抗体阳性率,期间多次为0,最高为6%。
田素梅的研究表明,绵羊经S2疫苗免疫,免疫后15d凝集抗体达到最高值,至9个月时仍有可检测到的凝集抗体[3]。
高红霞的研究结果也表明,羊经S2疫苗免疫后,一个月时凝集抗体达峰值[4]。
两地山羊的抗体升降情况基本一致,在免疫后20d后,血清中的抗体阳性率达到最高峰,之后呈下降趋势,免疫后90至360d维持低水平或较低水平的抗体阳性率,但其间抗体阳性率有升有降,且两地的消长曲线有一定差异。
党富德进行奶山羊断奶后连年两次口服布鲁氏菌S2菌苗后免疫抗体消长规律研究,结果显示,免疫后25d,试管凝集抗体、平板凝集抗体和虎红平板凝集抗体均达高峰,以后逐渐下降,到第6个月时阳率分别为8.3%、4.16 %、4.16 %,到第7个月时略有上升,到8个月时,试管凝集抗体阳性率又上升到3 5.4%,以后又趋于下降[5]。
与绵羊相比,山羊的抗体阳性率普遍偏高,并且降升幅度较大,这可能与山羊的品种有关,有待于进一步研究。
无论是山羊还是绵羊,在免疫后150或180d以后的不同时段,都有抗体阳性率回升、下降、再回升现象,这除与羊个体因素有关外,还可能与虎红平板凝集试验和试管凝集试验的特异性和敏感性有关,国内外很多学者认为虎红平板凝集试验和试管凝集试验的特异性和敏感性均不高[6-8]。
总体看,虎红平板凝集试验和试管凝集试验抗体阳性率曲线基本一致,说明这两种方法的吻合率较高。
在本研究中,100亿和200亿两种免疫剂量的抗体阳性率差异不大,所以在达到免疫效果的前提下,从节省成本考虑,可以在今后的免疫工作中对羊群进行布氏杆菌S2株活疫苗100亿剂量的免疫。
[2] Seleem MN,Boyle SM,Sriranganathan N. Brucellosis areemerging zoonosis[J].Vet Microbiol,2010,140(3/4):392-398.[3] 田素梅,周红菊,温都苏,等.绵羊杭布鲁氏菌特异性IgG,IgA和IgM抗体的观察[J]. 中国人兽共患病杂志,1993,9(3):53.[4] 高红霞.不同血清学方法检测牛羊布鲁氏菌疫苗免疫抗体消长规律的比较研究[J].畜牧兽医杂志,1990(4):17-18.[5] 党富德,何玉财.奶山羊断奶后连年两次口服布鲁氏菌S2菌苗后免疫抗体消长规律试验观察[D].哈尔滨:东北农业大学,2010:28-29.[6] Nielsen K,Gall D,Smith P,et al. Comparison of Serological tests for the detection of ovine and caprine antibody to Brucella melitensis[J].Rev Sci Tech,2004,23(3):979-987.[7] 李慧,范伟兴,关平原.布鲁菌病血清学检测方法的比较[J].畜牧与饲料科学,2012,33(3):21-22.[8] 范伟兴,钟旗,何倩倪,等. 几种布鲁氏菌病血清学诊断方法的比较研究[J]. 中国动物检疫,2006,23(6):31-33.【相关文献】[1] 陆承平.兽医微生物学[M].4版.北京:中国农业出版社,2005:265-271.。
