产品技术报告-一次性使用无菌注射器 带针
产品技术报告-一次性使用无菌注射器带针范文

产品技术报告-一次性使用无菌注射器带针范文
一次性使用无菌注射器
技术报告
一、简介
无菌注射器是一种用于给药或注射病人的医疗器械,它利用一次性的或多次使用的注射装置,在医院或家庭护士等护理场所中使用。
无菌注射器的设计目标是为患者提供安全、准确的注射服务,以防止服务过程中传播病毒或病原体。
二、特点
1.安全性:无菌注射器有着独特的创新性设计,能够有效保护放射医学和诊疗方案中患者的安全和健康,防止服务过程中传播病毒或病原体。
2.灵活性:无菌注射器的蒸汽密封装置使得每次使用都能保持良好的渗透效果,无菌状态,同时可以根据病人的不同情况对注射器进行灵活调整,以满足各种不同的使用需求。
3.稳定性:无菌注射器使用的材料非常稳定,有足够的韧性和强度来确保注射过程中无菌的要求,在注射过程中可以保持稳定性,以确保注射过程的准确和安全。
三、优势
1.易操作:无菌注射器采用了自动注射机械部件的设计,无菌过程主要由机械操作完成,不需要医生或护士的手操作,大大降低了操作复杂性和难度,可以提高工作效率。
2.清洁性:无菌注射器采用了特殊的蒸汽灭菌装置,采用自动清洗程序,可以保证每次使用时都能。
生物学评价报告

一次性使用无菌溶药器带针生物学评价报告评价者:评价产品:一次性使用无菌溶药器带针1 产品简介1.1本产品合用于临床加药和溶药使用。
1.2本产品型式为偏头式,其结构为三件式,由外套、芯杆、橡胶活塞组成。
溶药针由针座、针管、护套组成。
1.3 产品与人体直接接触需进行生物学评价部分为:本产品不与人体直接接触,只是与药液接触。
采用医用聚丙烯、天然橡胶和医疗器械用不锈钢针管304 ( 0Cr18Ni9 ) 为主要原料、选用符合医用要求的聚二甲基硅氧烷润滑剂制成。
2 材料组成部份供方为XXXXX有限公司,该公司为塑料粒子的专营公司,其经营的聚丙烯符合YY/T0242 —2022 《医用输液、输血、注射器用聚丙烯专用料》的聚丙烯。
该材料采用医用级无毒塑料,对人体无害并能满足标准规定。
2.1原料型号:牌号为701.2.2原料来源: XXXX有限公司2.3技术要求各项性能指标应符合YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准中有关规定。
每批次进料,粒料供方均提供符合YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准3.1、3.2、3.3、3.4条要求的出厂检验报告,我公司对每批进料按YY/T0242—2022 《医用输液、输血、注射器用聚丙烯专用料》标准 3.1、3.2、3.3、3.4 条的规定进行检验。
3 材料理化特性信息3.1外观要求按SH/T1541进行,医用级聚丙烯为本色粒料。
3.2包装要求医用聚丙烯专用料应至少采用双层包装,包装应保证在产品运输、贮存时不被污染。
(聚丙烯的供方资质及《检验报告》见附件3。
针管不锈钢在最新标准中称为06Cr19Ni10 号钢。
0Cr18Ni9 钢(AISI304) 是奥氏体不锈钢,是在最初发明的18-8 型奥氏体不锈钢的基础上发展演变的钢种,该钢是不锈钢的主体钢种,钢的奥氏体结构赋予了它的良好冷、热加工性能、无磁性和好的低温性能。
配药器技术要求190709
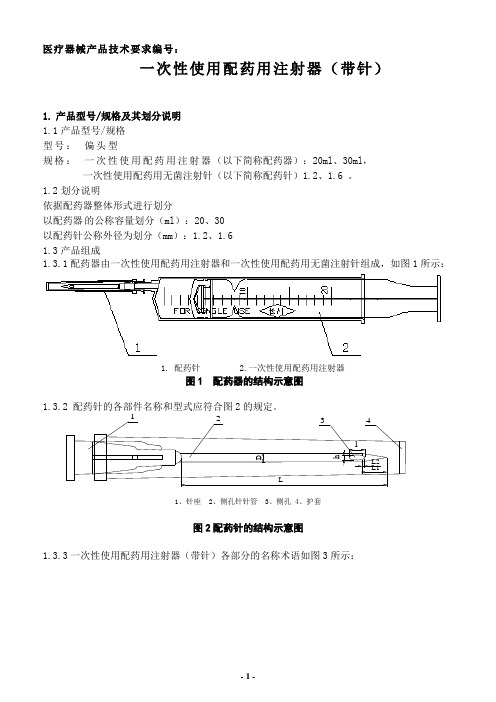
L1L2LDhl1234医疗器械产品技术要求编号:一次性使用配药用注射器(带针)1. 产品型号/规格及其划分说明 1.1 产品型号/规格 型号: 偏头型规格: 一次性使用配药用注射器(以下简称配药器):20ml 、30ml ,一次性使用配药用无菌注射针(以下简称配药针)1.2、1.6 。
1.2 划分说明依据配药器整体形式进行划分以配药器的公称容量划分(ml ):20、30 以配药针公称外径为划分(mm ):1.2、1.6 1.3 产品组成1.3.1配药器由一次性使用配药用注射器和一次性使用配药用无菌注射针组成,如图1所示:1. 配药针2.一次性使用配药用注射器1.3.2 配药针的各部件名称和型式应符合图2的规定。
1-按手;2-芯杆;3-外套卷边;4-公称容量刻度线;5-分容量线;6-标尺;7-外套;8-活塞;9-零刻度线;10-锥头;11-针座;12-针管;13-护套;注:本示意图仅说明配药器的结构,并非为规定的唯一型式。
图3一次性使用配药用注射器的结构示意图1.3.4一次性使用配药用注射器的形式为偏头式,其结构为三件。
1.3.5一次性使用配药用注射器应选用符合医用要求的润滑剂。
1.3.6产品的标记配药针产品的标记以针管公称外径和针管标称长度表示。
标记示例:1.2×33L):33mm针管公称外径(D):1.2mm1.4材料要求1.4.1配药针材料:针管应采用符合表1、表2及表3中X5CrNi18-9奥氏体不锈钢的材料制成。
序号ISO/TR 15510:1997 C Si Mn P S Cr Mo Nb Ni 其他1 X5CrNi18-9 ≤0.07 ≤1.0 ≤2.0 ≤0.045 ≤0.030 17.0~19.0 --- --- 8.0~11.0 ---序号ISO/TR 15510:1997 ISO 683—13:1986 ISO 4954:1993 ISO 4955:1994 ISO 6931—1:1994 ISO 9328-5:1991 1 X5CrNi18-9 11 X5CrNi18 9E X7CrNiNb18 10 --- X5CrNi18-9序号ISO/TR15510:1997欧洲EN 10088:1995EN 10088—1:1995中国GB 1220-1992日本JIS美国AISI ASTM英国BS 970BS 1449德国DIN 17440DIN 17224法国NFA 35-572苏联POCT 56321X5CrNi18-9X5CrNi18-10 0Cr18Ni9 SUS304 304 S30400 304S15 X5CrNi189 Z6CN18.0908X18H10 1.4.2外套、芯杆、针座、护套材料:采用M1600E、K4912或物理机械性能、化学、生物性能均符合YY/T 0242-2007标准的医用聚丙烯专用材料制造。
一次性使用无菌注射器带针与不带针残留容量的比较

作者简介:杨文萍 ( 9 1 ,女 .贵州籍 ,本科 ,助理 工程师。 18 一)
4 3
品的监 管 ,很 多医疗 器械在 临床 实际使 用过 程 中不是 单独使 用的 ,要做到真 正 的监督 管理 ,就应 该模拟 临床 实际使 用过
程进行监督 管理。
关 键 词 : 注射 器 ;残 留 容 量
D I { .9 9 Js . 6 1 6 9 .0 O 0 . I O : O 5 6 / .s 1 7 — 5 62 . 70 9 {n 1
; r } 5 2B I 。 0 S4 8 . 6O S3 . ; 3 iO .1 2 1 0 I l ; 8D 2 . 0 ;2 O .06
;3 翦 T
;3 7 26 ;5 6 07 ;3 8 44 ; l3 . 2 ;6 8 43 ; 3 O3 .4
】o T ‘ 2 )们 ∞ 】 0‘ . ∞ ) ; . ∞ 】O 81 ● 】0 丁 . 4g
.8 0盯
0 '8 1 4 . 1 8 0' 1 3 0/ ' ." 01 . ' " 0t / 3 0 0 Tt .1 3 0' 9
)O 毫 . 3 跫
) 玎5 . ) 0 口 . 3l ) 0 9 . , n2 . 3‘ ,啪 . )渊 . 口
l 引 言
被擦掉 。②在注射 器残 留容量实验 过程中一直 存在一个 问
题 : 在 排 除 水 后 , 残 留 在 圆 锥 锥 头 的 没 有 自然 掉 下 的 水 珠 ,标 准 中 没 有 明 确 规 定 是 否 保 留 。 但 凭 借 我 多 年 来 的检
在临床 实际使用过 程 中,注 射器并 不单独使 用 ,而 是
注射器(针)技术报告

一次性使用无菌注射器(针)产品技术报告一次性使用无菌注射器(带针),是按照YZB/国××××—2006标准规定生产制造而成。
用于给患者注射用输送药液,该产品以无菌状态提供给用户,仅供一次性使用,可有效避免患者之间的交叉感染。
产品均采用符合医用级要求的材料及零部件,芯杆、外壳由医用级聚丙烯加工而成,橡胶活塞选用天然橡胶、配套用针采用医用级不锈钢针管等,产品经检验和试验均符合标准要求,一、产品用途、性能:主要用于预防和临床肌肉静脉注射用。
产品性能主要有:滑动性能、器身密合性、残留容量、可萃取金属含量、酸碱度、易氧化物、环氧乙烷残留量、急性全身毒性、溶血、无菌、无致热原等。
二、产品的基本结构形式:结构:由芯杆、外套、胶塞、配套用注射针组成。
形式:中头式,偏头式。
三、产品的基本规格:1ml, 2ml, 5ml,10ml,20ml,30ml,50ml。
四、产品的主要原辅材料:1.符合YY0242《医用输液、输血、注射用聚丙烯专用料》标准的PP料。
2.符合YYT0243《一次性使用无菌注射器用橡胶活塞》的活塞。
五、产品执行标准:执行YZB/国××××---2006《一次性使用无菌注射器针》六、适用范围、用途:本产品适用于供抽吸液体或注射液体用。
本产品只适用于皮下或肌肉注射和静脉抽血检验,由医务人员使用,禁止作其它用途和非医务人员使用。
七、物理指标:1、注射器有良好的滑动性能,其推、拉作用力符合下表的规定。
2.器身密合性将注射器吸入公称容量的水,用下表规定的轴向压力及侧向力,对芯杆作用30s,外套与活塞接触的部位无漏液现象。
在88kPa负压作用下保持60s±5s外套与活塞接触部位不产生漏气现象,且活塞与芯杆不脱离。
3.容量允差:小于二分之一公称容量和大于二分之一公称容量的最大允差符合上表中的有关规定。
4.残留容量:当芯杆完全推入到外套封底时,其残留在外套内的液体体积不超过上表的规定。
一次性使用配药用注射器(带针)产品技术要求changchuan

一次性使用配药用注射器(带针)产品技术要求changchuan一次性使用配药用注射器(带针)适用范围:本产品适用于溶药、加药、配药或抽取药液时使用。
1.产品型号/规格及其划分说明1.1产品型号/规格型号:偏头型规格:一次性使用配药用注射器(以下简称配药器):20ml、30ml,一次性使用配药用无菌注射针(以下简称配药针)1.2、1.6 。
1.2划分说明依据配药器整体形式进行划分以配药器的公称容量划分(ml):20、30以配药针公称外径为划分(mm):1.2、1.61.3产品组成1.3.1配药器由一次性使用配药用注射器和一次性使用配药用无菌注射针组成,如图1所示:1. 配药针2.一次性使用配药用注射器图1 配药器的结构示意图1.3.2 配药针的各部件名称和型式应符合图2的规定。
1、针座2、侧孔针针管3、侧孔4、护套图2配药针的结构示意图1.3.3一次性使用配药用注射器(带针)各部分的名称术语如图3所示:1-按手;2-芯杆;3-外套卷边;4-公称容量刻度线;5-分容量线;6-标尺;7-外套;8-活塞;9-零刻度线;10-锥头;11-针座;12-针管;13-护套;注:本示意图仅说明配药器的结构,并非为规定的唯一型式。
图3 一次性使用配药用注射器的结构示意图1.3.4一次性使用配药用注射器的形式为偏头式,其结构为三件。
1.3.5一次性使用配药用注射器应选用符合医用要求的润滑剂。
1.3.6产品的标记配药针产品的标记以针管公称外径和针管标称长度表示。
1.4材料要求1.4.1配药针材料:针管应采用符合表1、表2及表3中X5CrNi18-9奥氏体不锈钢的材料制成。
1.4.2外套、芯杆、针座、护套材料:采用M1600E、K4912或物理机械性能、化学、生物性能均符合YY/T 0242-2007标准的医用聚丙烯专用材料制造。
1.4.3 胶塞:材料采用对人体无毒副作用的高分子材料。
若活塞外表涂有润滑剂应符合医用要求(除粘度外)。
无源注册证有效期内产品质量分析报告模版

损
中,产品防护不当产Fra bibliotek的。自动组装机装配
注 射 器 缺 少 部 运行不正常时,员
4
件
工未进行自检及
互检。
注册证有效期内产品分析报告 NO:XXXXXXX
求员工做好自检、互检工作;同时,要求生产过程检 验员加强生产过程检验及生产现场管理; ②对于零担运输外包第三方,在运输合同或协议内说 明,要求对产品做到足够安全的产品防护; ③对于在使用过程中发现的不良品,本们会安排销售 人员到现场换回,并给予一定补偿奖励,杜绝不良品 被误用。 ①安排生产操作员工培训及运输司机并进行考核,要 求员工做好自检、互检工作;同时,要求生产过程检 验员加强生产过程检验及生产现场管理; ②对于零担运输外包第三方,在运输合同或协议内说 明,要求对产品做到足够安全的产品防护; ③对于在使用过程中发现的不良品,本们会安排销售 人员到现场换回,并给予一定补偿奖励,杜绝不良品 被误用; ④单包装标识提示“包装破损,严禁使用”。
瓶胶塞时,产生的 员到现场换回,并给予一定补偿奖励,杜绝不良品被
误用。
胶屑。
2 注 射 器 外 套 断 ① 一 定 的 外 力 作 ①安排生产操作员工、运输司机进行培训并考核,要
1
一次性使用无菌注射器 带针
裂或变形
用下产生; ②产品运输过程 中,产品防护不当 产生的。
①一定的外力作
用下产生;
3
注射器包装破 ②产品运输过程
此次延续注册,由注册产品标准YZB/国 XXXX-XXXX转化为产品技术要求《一次性使用 无菌注射器 带针》,根据医疗器械延续注册申报资料要求,特此进行注册证有效期内产
品分析报告,具体情况见以下几个方面。 一、产品临床应用情况,用户投诉情况及采取的措施。
一次性使用无菌耐辐照溶药用注射器 带针产品技术要求威海威高

批准日期:2019年07月31日
医疗器械产品技术要求编号:鲁械注准20152140133
一次性使用无菌耐辐照溶药用注射器带针
1 产品型号/规格及其划分说明
1.1 一次性使用无菌耐辐照溶药用注射器带针 (以下简称“耐辐照溶药注射器”)由外套、芯杆、活塞、溶药针组成,各部分的名称术语如图1所示。
图1 一次性使用无菌耐辐照溶药用注射器带针
批准日期:2019年07月31日
1.2 针管按针尖型式分斜面针管(XZ)、侧孔针管(CZ);按管壁分薄壁(TW)、正常壁(RW)。
1.3 产品标记:耐辐照溶药注射器的标记以公称容量、针管公称外径、针管标称长度、针管管壁类型和针尖型式表示。
标记示例:1.2×33 TW CZ
溶药针针尖型式:侧孔溶药针
溶药针管壁类型:薄壁
溶药针标称长度:33mm
溶药针公称外径:1.2mm
1.4 材料
耐辐照溶药注射器和溶药针采用的主要材料见下表。
一次性使用无菌耐辐照溶药用注射器带针材料表
1.5 规格型号
耐辐照溶药注射器型式为中头式、偏头式。
耐辐照溶药注射器的公称容量为5mL、10mL、20mL、30mL、50mL。
溶药针的规格按公称外径分别为0.9mm、1.1mm、1.2mm、1.4mm、1.6mm、1.8mm、2.1mm、2.4mm、2.7mm、3.0mm、3.4mm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常州金龙医用塑料器械有限公司产品技术报告
2.与已上市的产品比较
序号项目内容春光已注册的一次性使用无菌注射器带针本公司申报的一次性使用无菌注射器带针
01 标准医疗器械注册产品标准医疗器械注册产品标准
02 材质
主材:聚丙烯、活塞、不锈钢针管主材:聚丙烯、活塞、不锈钢针管
辅材:ES-2单组分针头胶、油墨、二甲硅油辅材:ES-2单组分针头胶、油墨、二甲硅油
03 结构组成芯杆、外套、活塞、注射针芯杆、外套、活塞、注射针
04 工作原理 1.去护套,抽吸药液,排尽管内气体;2.进行皮下注射等。
1.去护套,抽吸药液,排尽管内气体;2.进行皮下注射等。
05 制造工艺流程
注:1.本图为一次性使用无菌注射器带针工艺流程图;2.绿色□为十万级洁净区;3.□为一次性使用注射器配套用注射针生产工艺流程;4.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;
5.注塑、印刷、粗洗、组装为关键工序控制点;
6.精洗、封口、灭菌为特殊过程
7.原材料选择与组成见下表。
注:1.本图为一次性使用无菌注射器带针工艺流程图;2.绿色□为十万级洁净区;3.□为一次性使用注射器配套用注射针生产工艺流程;4.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;5.注塑、印刷、粗洗、组装为关键工序控制点;6.精洗、封口、灭菌为特殊过程7.原材料选择与组成见下表。
3.产品命名
一次性使用无菌注射器带针在国际、国内均属成熟产品,国际、国内标准化组织未制定一次性使用无菌注射器带针的相关标准;
根据《中华人民共和国标准化法》规定,参照GB15810一次性使用无菌注射器修订稿、GB15811-2001一次性使用无菌注射针标准特制定《一次性使用无菌注射器带针医疗器械注册产品标准》,作为企业组织生产和经营活动的依据。
满足医疗器械行业及企业的检测及有效控制。
4.原材料控制
4.1聚丙烯
原材料名称聚丙烯供应商编号2011004
化学结构式/分子式
原材料代号GM1600E 符合标准YY/T0242-2007
商品名聚丙烯树脂分子量分布不详
供应商名称中国石化上海石油化工股份有限公司组成比例不详
物理性能
外观色粒0个/kg 弯曲模量:≥1.250Mpa 熔体质量流动速率±0.2n 悬臂梁缺口冲击强度(23℃) ≥2.0kj/m2密度≤0.91g/cm3雾度≤15拉伸屈服应力≥30Mpa
化学性能生物性能重金属含量≤1.0镉含量<0.1
细胞毒性、皮肤致敏、皮内反应、急性全身毒性、热原、溶血酸碱度≤1.0紫外吸光度≤0.08
4.2活塞
原材料名称活塞供应商编号2011020 符合标准YY/T0243-2003 原材料代号不详化学结构式/分子式不详分子量分布不详商品名一次性使用无菌注射器用活塞原材料组成比例供应商名称常州京林医疗器械有限公司材料名称分子式比例% 材料名称分子式比例%
物理性能
外观
1.不得有胶丝、胶屑、外来杂质、喷霜;天然橡胶(C5H8)n 55 氧化锌ZnO 3.0
2.外观色泽应均匀,表面不得有明显气泡、缺胶、
切损、偏心;
碳酸钙CaCO335
抗氧剂
2246
C23H32O20.8
3.密封圈侧面顶部应有清晰的边缘基准线、基准线
应完整、与注射器外套内表面接触应紧密;
炭黑 C 4.0
促进剂
TMTM
C6H12N2S30.5
4.修边部位的直径应不大于活塞密封圈直径;硫磺S 1.7
5.无泛黄现象。
化学
可萃取金属含量
铅锌锡铁重金属的总含量应≤5µg/mL,镉含量
≤0.1µg/mL;
机械性能
硬度(卲尔A型) 60(+5,-3) 酸碱度PH≤0.1
压缩永久变形/(%) ≤40易氧化物≤0.4mL
老化后(70℃×72h)/(%) ±20 生物毒性、热原、溶血、急性全身毒性
图1一次性使用无菌注射器工艺流程图图2一次性使用无菌注射器带针工艺流程图
注:1.本图为一次性使用无菌注射器不带针工艺流程图;2.绿色□为十万级洁净区;
3.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;3.注塑、印刷、粗洗、组装为关键工序控制点;
4.精洗、封口、灭菌为特殊过程;注:1.本图为一次性使用无菌注射器带针工艺流程图;2.绿色□为十万级洁净区;3.□为一次性使用注射器配套用注射针生产工艺流程;4.外购协件为:PE包装、仿透析纸、PP、PE共挤医用包装膜、橡胶活塞;
5.注塑、印刷、粗洗、组装为关键工序控制点;
6.精洗、封口、灭菌为特殊过程
6.产品包装
详见最终灭菌医疗器械包装验证资料,验证编号:JL/YZ2011-002。
7.产品灭菌
详见环氧乙烷灭菌验证资料,验证编号:JL/YZ2011-001。
8.产品稳定性要求(有效期验证)
详见产品有效期和产品包装有效期验证资料,验证编号:JL/YZ2011-101。
9.一般性能要求
9.1物理性能:清洁度、酸碱度、可萃取金属含量、润滑剂、容量允差、标尺、外套、活塞/芯杆组合、锥头、性能[残留容量、器身密合性]、配套注射针[外观、尺寸、针管、针座、锋利度])。
9.2化学性能:易氧化物、环氧乙烷残留量。
9.3生物性能:无菌、细菌内毒素、溶血、急性全身毒性、致敏、刺激、细胞毒性。
9.4管理类别确定的依据:按《医疗器械分类规则》,一次性使用无菌注射器带针属于III类器械,属于6815注射穿刺器械。
9.5主要技术条款确定的依据
一次性使用无菌注射器带针产品,是在一次性使用无菌注射器和一次性使用无菌注射针的基础上发展而来,根据产品的使用特点来分析,注射器带针的注射器部分和普通一次性使用无菌注射器无明显差别,故各项物理性能、化学性能、生物性能技术指标均等同采用GB15810《一次性使用无菌注射器第1部分:手动注射器》和GB15811《一次性使用无菌注射针》两个标准的条款。
10.特殊性能要求
不存在。
11.本次注册原因的说明
该产品注册证为公司的新研发产品,故本次提出产品首次注册;
12.总体评价
本企业生产的一次性使用无菌注射器带针各项指标均能够保证达到标准要求。
公司并编制了一次性使用无菌注射器带针生产运行过程中的工艺文件。
综上所述,本企业已具备批量生产一次性使用无菌注射器带针的条件,批量投产后,企业将进一步加强管理,提高产品质量,以满足用户需求。
13.本公司生产八批试样,对制定的产品技术要求进行验证,具体验证情况见下表。
验证证明:本公司制定的一次性使用无菌注射器带针技术要求是合理可行的。
