一次性使用无菌注射器系列产品相关技术标准清单
一次性使用无菌注射器等种医疗器械生产环节风险清单和检查要点

一次性使用无菌注射器等种医疗器械生产环节
风险清单和检查要点
Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
食药监械监〔2016〕37号附件
一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点
目录
一、一次性使用无菌注射器生产环节风险清单和检查要点
二、一次性使用输液器生产环节风险清单和检查要点
三、一次性使用静脉留置针生产环节风险清单和检查要点
四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)
一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)
五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点
六、脊柱内固定金属植入物生产环节风险清单和检查要点
七、人工关节风险清单和检查要点
八、人工晶状体生产环节风险清单和检查要点
九、血管支架生产环节风险清单和检查要点
十、乳房植入体生产环节风险清单和检查要点
十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点。
一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点 (1)二、一次性使用输液器生产环节风险清单和检查要点 (7)三、一次性使用静脉留置针生产环节风险清单和检查要点 (13)四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1) (17)一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2) (20)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点 (23)六、脊柱内固定金属植入物生产环节风险清单和检查要点 (27)七、人工关节风险清单和检查要点 (31)八、人工晶状体生产环节风险清单和检查要点 (36)九、血管支架生产环节风险清单和检查要点 (38)十、乳房植入体生产环节风险清单和检查要点 (40)十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点 (43)十二、同种异体骨植入物生产环节风险清单和检查要点 (46)十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 (52)十四、血液净化用设备生产环节风险清单和检查要点 (57)十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点 (59)十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点 (63)十七、透析粉、透析浓缩液生产环节风险清单和检查要点 (66)十八、中心静脉导管生产环节风险清单和检查要点 (69)十九、封堵器系统产品生产环节风险清单和检查要点 (73)二十、角膜接触镜生产环节风险清单和检查要点 (76)二十一、麻醉系统生产环节风险清单和检查要点 (80)二十二、医用防护服生产环节风险清单及检查要点 (83)二十三、医用防护口罩生产环节风险清单及检查要点 (89)二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点 (94)二十五、定制式义齿生产环节风险清单和检查要点 (96)一、一次性使用无菌注射器生产环节风险清单和检查要点二、一次性使用输液器生产环节风险清单和检查要点三、一次性使用静脉留置针生产环节风险清单和检查要点四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点六、脊柱内固定金属植入物生产环节风险清单和检查要点七、人工关节风险清单和检查要点八、人工晶状体生产环节风险清单和检查要点九、血管支架生产环节风险清单和检查要点十、乳房植入体生产环节风险清单和检查要点十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点十二、同种异体骨植入物生产环节风险清单和检查要点。
无菌医疗器械质量检验相关标准

无菌医疗器械质量检验相关标准(一)医疗器械生物相容性试验GB/T 16886.3 医疗器械生物学评价第 3部分:遗传毒性、致癌性和生殖毒性试验GB/T 16886.4 医疗器械生物学评价第 4部分:与血液相互作用试验选择GB/T 16886。
5 医疗器械生物学评价第 5部分:体外细胞毒性试验GB/T 16886。
6 医疗器械生物学评价第 6部分:植入后局部反应试验GB/T 16886.7 医疗器械生物学评价第 7部分:环氧乙烷灭菌残留量GB/T 16886.8 医疗器械生物学评价第 8部分:生物学试验参照样品的选择和定性GB/T 16886。
10 医疗器械生物学评价第 10 部分:刺激与致敏试验GB/T 16886.11 医疗器械生物学评价第 11 部分:全身毒性试验GB/T 16886.12 医疗器械生物学评价第 12 部分:样品制备和参照样品GB/T 16886.13 医疗器械生物学评价第 13 部分:聚合物医疗器械降解产物的定性与定量GB/T 16886。
14 医疗器械生物学评价第 14 部分:陶瓷降解产物的定性与定量分析GB/T 16886。
15 医疗器械生物学评价第 15 部分:金属与合金降解产物的定性与定量GB/T 16886。
16 医疗器械生物学评价第 16 部分:降解产物与可溶出物的毒代动力学研究设计)GB/T 16886.17 医疗器械生物学评价第 17 部分:根据健康风险评价确定可溶出物允许极限的方法GB/T 16886.18 医疗器械生物学评价第 18 部分:材料化学定性GB/T 16886.19 医疗器械生物学评价第 19 部分:材料理化、机械和形态定性GB/T 16886.20 医疗器械生物学评价第 20 部分:医疗器械免疫毒理学试验原理和方法GB/T16175 医用有机硅材料生物学评价试验方法GB/T 16886。
9 医疗器械生物学评价第 9部分:潜在降解产物的定性与定量总则YY/T 0473 外科植入物聚交酯共聚物和共混物体外降解试验YY/T 0474 外科植入物用聚L-丙交酯树脂及制品体外降解试验YY/T 0567。
一次性使用输液器标准

SMIC/检测(班)医疗器械注册产品标准SMIC/检测(班)00000-2010一次性使用输液器重力输液式Infusion sets for single use, gravity fee2010-12-10发布2010-12-13实施上海医疗器械高等专科学校发布SMIC/检测(班)00000-2010前言本标准是SMIC/检测(班) 00000-2010的初定版。
本标准中华人民共和国国家标准GB 8368-2005(一次性使用输液器重力输液式)。
本标准的附录A,附录B和附录C是规范性附录,附录NA和附录NB是资料性附录。
本标准由上海医疗器械高等专科学校归口。
本标准由检测技术及应用肖婷组起草。
本标准主要起草人:肖婷、徐一君、吴维纶。
本标准主要资料检索人:吴维纶、薛国瑞。
本标准主要实验规划人:薛圣、薛子鸣、温景麟。
本标准首席发布于2010年。
SMIC/检测(班)00000-2010一次性使用输液器1 范围本标准规定了一次性使用医用输液器的要求,以保证与输液容器和静脉器具相适应。
本标准的第二个目的是为输液器所用材料的性能及质量规范提供指南,并给出了输液器组件的标记。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T8368-2005一次性使用输液器重力输液式(GB/T8368-2005,idt ISO 8536-4:2004((医用输液器具—第4部分:一次性使用输液器,重力输液式)。
GB/T1962.1-2001注射器、注射针及其他医疗器械6%锥度(鲁尔)圆锥接头第1部分:通用要求(GB/T1962.1-2001,idtISO594-1:1986)GB/T1962.2-2001注射器、注射针及其他医疗器械6%锥度(鲁尔)圆锥接头第2部分:锁定锥头(GB/T1962.2-2001,idtISO594-2:1998)GB/T6682-1992 分析实验室用水规范和试验方法(neqISO3696:1987)GB/T14233.1医用输液、输血、注射器具检验方法第1部分:化学分析方法GB/T14233.2医用输液、输血、注射器具检验方法第2部分:生物学试验方法GB15811-2001一次性使用无菌注射针(eqvISO7864:1993)YY0466 医疗器械用于医疗器械标签、标记和提供信息的符号(YY0466-2003,ISO15223: 2000,IDT)ISO14644-1:1999 洁净室和相关控制环境—第1部分:空气洁净度分级3 通用要求3.1 输液器组件的命名输液器组件的名称如图1所示,输液器进气器件如图2所示。
医疗器械产品技术要求 编号
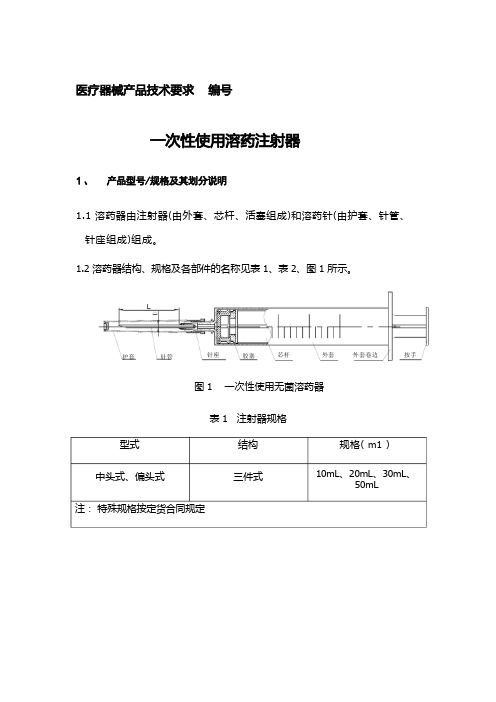
1.1 溶药器由注射器(由外套、芯杆、活塞组成)和溶药针(由护套、针管、 针座组成)组成。
1.2 溶药器结构、规格及各部件的名称见表 1、表 2、图 1 所示。
图 1 一次性使用无菌溶药器表 1 注射器规格型式中头式、偏头式注: 特殊规格按定货合同规定规格( m1 )10mL 、20mL 、30mL 、50mL结构三件式外套卷边 护套胶塞针管外套 针座按手芯杆表 2 溶药针基本尺寸及极限偏差 单位: mm2.1.1 注射器外观要求应符合 GB 15810-2001 中 5.1 条规定。
2.1.2 注射器标尺要求应符合 GB 15810-2001 中 5.2.1 条规定。
2.1.3 注射器附加标尺要求应符合 GB 15810-2001 中 5.2.2 条规定。
2.1.4 注射器标尺的刻度容量线应符合 GB 15810-2001 中 5.3 条规定。
2.1.5 注射器标尺上的计量数字应符合 GB 15810-2001 中 5.4 条规定。
2.1.6 注射器标尺的印刷应符合 GB 15810-2001 中 5.5 条规定。
2.1.7 注射器外套应符合 GB 15810-2001 中 5.6 条规定。
2.1.8 注射器按手间距应符合 GB 15810-2001 中 5.7 条规定。
2.1.9 注射器活塞应符合 GB 15810-2001 中 5.8 条规定。
2.1.10 注射器锥头要求D极限偏 差 ±0.03直孔针、侧孔针—-2.5注: 特殊规格按定货合同规定。
极限偏 差±0.03尺寸 尺寸规格 型式+1.51.201.603032351612 L2.1.10.1 锥头直径应符合GB 15810-2001 中5.9.1 条规定。
2.1.10.2 锥头外圆锥接头应符合GB 15810-2001 中5.9.2 条规定。
2.1.10.3 中头式注射器,锥头应符合GB 15810-2001 中5.9.3 条规定。
次性使用无菌注射器等5种医疗器械生产环节风险清单和检查要点

食药监械监〔2016〕37号附件一次性使用无菌注射器等25种医疗器械生产环节风险清单和检查要点目录一、一次性使用无菌注射器生产环节风险清单和检查要点...................................二、一次性使用输液器生产环节风险清单和检查要点 ....................三、一次性使用静脉留置针生产环节风险清单和检查要点 ................四、一次性使用真空采血系统-采血管生产环节风险清单和检查要点(1)..............................................................一次性使用真空采血系统-静脉采血针生产环节风险清单和检查要点(2).......................................................五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点......................................................六、脊柱内固定金属植入物生产环节风险清单和检查要点 ................七、人工关节风险清单和检查要点....................................八、人工晶状体生产环节风险清单和检查要点 ..........................九、血管支架生产环节风险清单和检查要点 ............................十、乳房植入体生产环节风险清单和检查要点 .......................... 十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点............................................................ 十二、同种异体骨植入物生产环节风险清单和检查要点 .................. 十三、天然胶乳橡胶避孕套生产环节风险清单和检查要点 ................ 十四、血液净化用设备生产环节风险清单和检查要点 .................... 十五、血液净化用器具(接触血液的管路)生产环节风险清单和检查要点............................................................ 十六、血液净化用器具(过滤/透析/吸附器械)生产环节风险清单和检查要点........................................................ 十七、透析粉、透析浓缩液生产环节风险清单和检查要点 ................十八、中心静脉导管生产环节风险清单和检查要点 ...................... 十九、封堵器系统产品生产环节风险清单和检查要点 .................... 二十、角膜接触镜生产环节风险清单和检查要点 ........................ 二十一、麻醉系统生产环节风险清单和检查要点 ........................ 二十二、医用防护服生产环节风险清单及检查要点 ...................... 二十三、医用防护口罩生产环节风险清单及检查要点 .................... 二十四、一次性使用非电驱动式输注泵生产环节风险清单和检查要点....... 二十五、定制式义齿生产环节风险清单和检查要点 ......................一、一次性使用无菌注射器生产环节风险清单和检查要点二、一次性使用输液器生产环节风险清单和检查要点三、一次性使用静脉留置针生产环节风险清单和检查要点四、一次性使用真空采血系统——采血管生产环节风险清单和检查要点(1)一次性使用真空采血系统——静脉采血针生产环节风险清单和检查要点(2)五、骨接合植入物(金属接骨板、金属接骨螺钉)生产环节风险清单和检查要点六、脊柱内固定金属植入物生产环节风险清单和检查要点七、人工关节风险清单和检查要点八、人工晶状体生产环节风险清单和检查要点九、血管支架生产环节风险清单和检查要点十、乳房植入体生产环节风险清单和检查要点十一、医用透明质酸钠凝胶(鸡冠提取法)生产环节风险清单和检查要点十二、同种异体骨植入物生产环节风险清单和检查要点。
浅谈无菌医疗器械标准及检验要求

• YY114《医用输液、输血、注射器用
聚乙烯专用料》标准—聚乙烯(PE)
技术要求 材料名称
医用PVC (分为MF 薄膜料MT 导管料MD 滴管料)
生物性能
无热原、溶血率≤5%、 无急性全身毒性、细胞毒 性不大于2级、家兔经皮 内注射浸提72小时内无 明显红斑或水肿、过敏反 应小于11级、过敏率不 大于28% 对MF料:血液保存试验 应合格
在EO灭菌过程的常规控制中,生物指示菌片放置 的位置一定要与灭菌确认时完全一致。
EO残留量
EO残留影响因素 • 与材料、灭菌工艺的好坏有关,与包装材料 的材质和季节、通风等有关。 • 材料对EO的吸附性大小顺序依此为:天然橡 胶,涤纶树脂,聚氨酯,聚氯乙烯,聚丙烯,聚 乙烯 • 残留部位 • EO的毒副作用
• • • • • • •
检验方法》
金属离子 易氧化物(还原物质) 蒸发残渣 酸碱度 紫外吸收 材料鉴别 血液及输液包装的产品还应有醇溶出物(DE HP)的要求
检查项目
• 易氧化物(还原物质)
• 1)原料中的DOP中含有醇,而醇的还原性比较强; • 2)环氧乙烷(EO)处理不净,EO转化为醇; • 3)环己酮用量过大也影响还原性 • 注射件及胶塞,在加工过程中若工艺控制不当,其材料和助剂
无菌:灭菌过程的确认
残存有微生物的器械概率小于10-6, 即一百万件中不多于1件。这就是医疗器械 公认的无菌保证水平。 对一个灭菌批而言,要证明达到这样的无 菌保证水平,势必要对每件产品进行检验, 这在实际中是行不通的,因为试图“证明 某事件不存在是不可能的”。更何况,即 使是最优秀的实验室,在产品上做无菌检 验出现假阳性的概率最低也只能控制在千 分之一。
医疗过程 DEHP剂量 (mg/kg/天) 成人(70kg) 盐水输液 药媒溶药输液 按生产厂说明 混药储存或室温储存24小时 全营养输液 0.04 0.15 0.03 0.005 婴儿(4kg) 0.03
一次性使用无菌注射器国家标准编制说明

《一次性使用无菌注射器》国家标准编制说明一、任务来源本标准是根据国家标准化管理委员会下达的2006年第一批制修订国家标准项目计划通知(国标委计划[2006]48号)而修订的。
计划项目编号是20065424-Q-464。
本标准由全国医用注射器(针)标准化技术委员会归口管理,由上海康德莱企业发展集团股份有限公司、成都市新津事丰医疗器械有限公司、山东威高集团医用高分子制品股份有限公司、江西洪达医疗器械集团有限公司、上海市医疗器械检测所负责起草。
二、修定标准的目的及意义一次性使用无菌注射器是目前应用最广泛的无菌医疗器械之一。
其产品标准在国内应用已近三十年,最近一版距今已有十六年。
随着科学技术的发展和对临床安全不断提高,原国家标准已经不适应这种需求。
ISO国际标准化组织已于2017年修订了ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》的发行稿。
该标准对原ISO标准进行了较大修订。
它更多考虑的是在设计上充分保证产品的安全性要求。
为适应这种变化,相对应的国家标准有必要进行修订。
三、产品适用范围本标准规定了一次性使用无菌注射器(以下简称注射器)的分类与命名、要求、试验方法、包装、标识等。
本标准适用于供抽吸液体或抽吸液体后立即注射用的手动注射器。
本标准不适用于胰岛素注射器、玻璃注射器、永久带针注射器、带有动力驱动注射泵的注射器、自毁型固定剂量疫苗注射器、带防止再次使用特性的注射器、由制造厂预装药液的注射器以及与药液配套的注射器等。
本标准规定的不带针注射器应与符合GB 15811要求的一次性使用无菌注射针配套使用。
四、关于技术指标的说明本标准修改采用ISO 7886-1:2017《一次性使用无菌皮下注射器第1部分:手动注射器》本标准与GB15810-2001相比主要技术差异如下:1.修改了适用范围。
修定原因:与ISO 7886-1:2017标准保持一致。
一次性使用无菌注射器作为一个单器械,必须联合一次性使用无菌注射针组成组合器械应用于临床。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一次性使用无菌注射器系列产品相关技术标准清单
序号
标准号
标准名称
1
GB601-1988
《化学试剂滴定分析(容量分析)用标准溶液的制备》
2
GB602-1988
《化学试剂试验方法中所用制剂及制品的制备》
3*
GB1962.1
《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第1部分:通用要求》
4*
GB1962.2
14
GB/T16294-1996
《医药工业洁净室(区)沉降菌的测试方法》
15
GB/T16886.1-1997
《医疗器械生物学评价第1部分:试验选择指南》
16
GB/T19002-1994
《质量体系、生产、安装和服务的质量保证模式》
17
GB18279-2000
《医疗器械椈费跻彝槊鹁 啡嫌氤9婵刂啤?/FONT>
23
YY/T0243-1996
《一次性使用无菌注射器用橡胶活塞》
24
YY/T0288-1996
《质量体系-医疗器械GB/T19002-ISO9002应用的专用要求》
25
YY/T0296-1997
《一次性使用注射针识别色标》
26
YY/T0313-1998
《医用高分子制品包装、标志、运输和贮存》
27
JGJ71—1990
9
GB/T14233.2-1993
《医用输液、输血、注射器具检验方法第2部分:生物试验方法》
10*
GB15810
《一次性使用无菌注射器》
11*
GB15811
《一次性使用无菌注射针》
12
GB/T16292-1996
《医药工业洁净室(区)悬浮粒子的测试方法》
13
GB/T16293-1996
《医药工业洁净室(区)浮游菌的测试方法》
《注射器、注射针及其他医疗器械6%(鲁尔)圆锥接头第2部分:锁定接头》
5
GB2828-1987
《逐批检查计数抽样程序及抽样表》
6
GB2829-1987
《周期检查计数抽样程序及抽样表》
7
GB6682-1992ห้องสมุดไป่ตู้
《分析实验室用水规格和试验方法》
8
GB/T14233.1-1998
《医用输液、输血、注射器具检验方法第1部分:化学分析方法》
18
GB18280-2000
《医疗保健产品灭菌认确和常规控制要求椃 涿鹁?/FONT>
19*
GB
《制造医疗器械用不锈钢针管》
20
YY0033-2000
《无菌医疗器具生产管理规范》
21
YY/T0047~0052-1991
《医疗器械产品图样及设计文件》
22
YY0242-1996
《医用输液、输血、注射器用聚丙烯专用料》
《洁净室施工及验收规范》
28
《中华人民共和国药典》(2000版)
纯化水、注射用水、二甲硅油(二甲基有机硅氧烷)
29
YY0114-93
《医用输液、输血、注射器专用聚乙烯专用料》
注:带*的为正在报批中的标准。
