范文工业用合成盐酸
工业盐酸生产方法

工业盐酸生产方法“哎呀,这管道怎么又出问题了!”我一边抱怨着,一边看着工厂里那有些破旧的设备。
我在这家化工厂工作已经有些年头了,对于工业盐酸的生产那可是再熟悉不过。
工业盐酸啊,那可是在好多领域都有着重要作用呢!先来说说生产工业盐酸的步骤吧。
首先得有氯气和氢气,这两种气体通过合成炉进行燃烧反应,生成氯化氢气体。
这可是关键的一步啊,就好比做菜时要把握好火候一样,氯气和氢气的比例可得精确控制,不然那可就容易出问题啦!然后呢,氯化氢气体再经过冷却、吸收,最后就得到我们需要的工业盐酸啦。
这里面的注意事项可不少呢!比如说,设备的密封性一定要好,不然气体泄漏了那可不得了。
还有啊,温度和压力的控制也至关重要,就像人得保持良好的身体状态一样。
那工业盐酸都有啥应用场景和优势呢?它的用途可广泛啦!在金属加工行业,它能帮忙除锈呢,就像给金属洗了个干净的澡。
在化工生产中,也是不可或缺的原料,没有它好多反应都没法进行呢。
它的优势也很明显呀,成本相对较低,效果又好,性价比超高的!记得有一次,我们接到一个大订单,要生产大量的工业盐酸供应给一家大型工厂。
那段时间,我们整个团队都紧张而又忙碌地工作着。
“嘿,大家加把劲啊,可不能耽误了交货时间!”我在车间里大声喊着。
“放心吧,头儿,我们一定行!”同事们也都干劲十足。
经过大家的努力,我们顺利地完成了任务,看着那一瓶瓶盐酸被运走,心里别提多有成就感了。
工业盐酸就像是我们化工厂的宝贝,虽然它看起来普普通通,但却有着巨大的能量。
它能让金属焕然一新,能推动化工行业的发展,能为我们的生活带来便利。
我们的生活中处处都有工业盐酸的影子,只是我们平时可能没有留意罢了。
它就像一个默默奉献的幕后英雄,虽然不被大众所熟知,但却在自己的领域里发挥着重要的作用。
所以啊,可别小看了这小小的工业盐酸,它的作用可大着呢!它让我们的生活变得更加丰富多彩,让这个世界变得更加奇妙。
怎么样,是不是对工业盐酸有了新的认识呢?是不是也对我们化工厂的工作有了更多的兴趣呢?哈哈!。
GB320_2006工业用合成盐酸
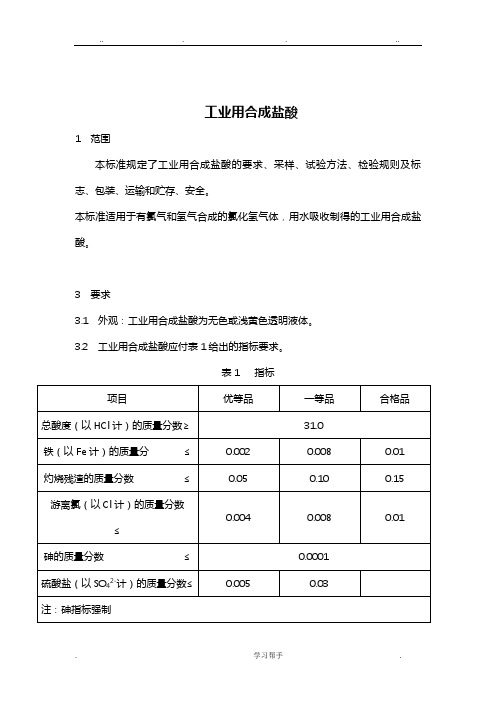
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定滴定法5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H++OH-→H2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c(NaOH)=1mol/L5.2.2.2 溴甲酚绿指示液:1g/L。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL(具磨口塞)。
工业制盐酸的方法

工业制盐酸的方法
工业制盐酸是一项重要的化工生产过程,盐酸广泛应用于化工、医药、冶金等领域。
下面将介绍工业制盐酸的方法。
首先,工业制盐酸的原料主要是氯化氢气体和水。
氯化氢气体是一种无色有刺激性气味的气体,可以通过氯化铵和盐酸反应得到。
而水是氯化氢气体的溶剂,也是制备盐酸的重要原料之一。
其次,工业制盐酸的方法主要有两种,气相法和液相法。
气相法是将氯化氢气体通过水中,使氯化氢气体与水发生反应生成盐酸的方法。
液相法是将氯化氢气体通过盐酸溶液中,使氯化氢气体与盐酸溶液发生反应生成盐酸的方法。
然后,工业制盐酸的方法还需要考虑反应条件。
在气相法中,需要控制氯化氢气体的流量和水的温度,以及反应器的设计和操作。
在液相法中,需要控制氯化氢气体的流量和盐酸溶液的浓度,以及反应器的设计和操作。
此外,工业制盐酸的方法还需要考虑产品的纯度和产量。
在生产过程中,需要对反应条件和操作进行调整,以提高盐酸的纯度和产量。
同时,还需要对废气和废水进行处理,以减少对环境的影响。
最后,工业制盐酸的方法需要进行质量控制和产品分析。
在生产过程中,需要对原料和产品进行质量检验和分析,以确保产品符合标准和规定。
综上所述,工业制盐酸的方法是一个复杂的化工生产过程,需要考虑原料、方法、条件、纯度、产量、环保和质量控制等方面的问题。
只有全面考虑这些因素,才能有效地进行工业制盐酸的生产。
GB3202006工业用合成盐酸
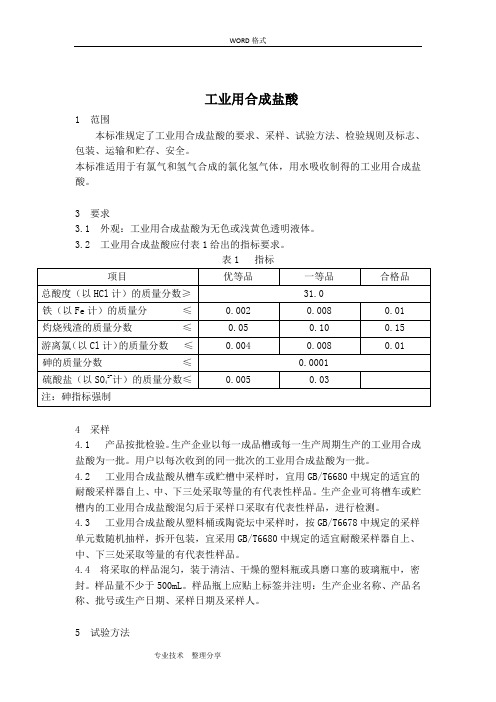
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定 滴定法 5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H ++OH -→H 2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c (NaOH )=1mol/L 5.2.2.2 溴甲酚绿指示液:1g/L 。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL (具磨口塞)。
合成盐酸使用协议书模板

合成盐酸使用协议书模板甲方(提供方):_____________________地址:_____________________法定代表人:_____________________联系电话:_____________________乙方(使用方):_____________________地址:_____________________法定代表人:_____________________联系电话:_____________________鉴于甲方是合成盐酸的合法生产者,乙方因业务需要使用合成盐酸,甲乙双方本着平等互利、诚实信用的原则,经友好协商,就乙方使用甲方提供的合成盐酸事宜达成如下协议:第一条产品信息1.1 产品名称:合成盐酸1.2 产品规格:____________________1.3 产品数量:____________________1.4 产品用途:仅限于乙方合法的工业生产活动1.5 产品交付地点:_____________________1.6 产品交付时间:_____________________1.7 产品价格:_____________________1.8 产品质量标准:_____________________1.9 产品包装:_____________________1.10 产品运输方式:_____________________1.11 产品验收标准:_____________________1.12 其他约定:_____________________1.13 产品安全数据表(MSDS):_____________________第二条交付与验收2.1 甲方应按照本协议约定的时间、地点、数量、规格向乙方交付产品。
2.2 乙方应在产品交付后____天内对产品进行验收,如发现产品不符合约定的质量标准,应书面通知甲方,并提供相应的证明材料。
2.3 甲方应在接到乙方通知后____天内对不合格产品进行更换或修复,由此产生的费用由甲方承担。
工业制取盐酸的流程

工业制取盐酸的流程嘿,朋友们!今天咱来聊聊工业制取盐酸那点事儿。
盐酸啊,那可是在好多工业领域都有着重要地位呢!你想想看,就好像我们生活中离不开柴米油盐一样,好多工业生产也少不了盐酸呀。
那工业上是怎么制取盐酸的呢?这就像是一场奇妙的旅程。
首先呢,是氢气和氯气这俩“小伙伴”登场啦。
氢气从哪儿来呀?一般是通过电解食盐水得到的哦。
氯气呢,则可以通过一些化学反应弄出来。
这就好比是两个小伙伴要一起去完成一个大任务。
然后呢,这氢气和氯气就碰面啦,它们在特定的条件下发生反应,就生成了氯化氢气体。
这氯化氢气体可有意思啦,就像个调皮的孩子,到处乱跑。
接下来,就是关键的一步啦!要把这氯化氢气体变成我们想要的盐酸。
这就好像要把一个调皮的孩子抓住,让他乖乖听话。
这时候,就会用到水啦,氯化氢气体溶到水里,不就成了盐酸嘛!哎呀,你说这过程是不是挺神奇的?就像变魔术一样。
你看啊,从一些普通的物质,经过一系列的步骤,就变成了我们需要的盐酸。
这盐酸用处可大了去了,能帮我们处理好多问题呢。
想象一下,如果没有盐酸,那好多工业生产不就乱套啦?就好像做饭没有盐一样,那味道能好吗?盐酸在金属加工、化工生产等好多方面都发挥着重要作用呢。
制取盐酸的过程虽然不复杂,但是每一步都得精心操作哦,就像我们做一件重要的事情一样,得认真对待。
要是哪个环节出了差错,那可就不好啦。
所以说啊,工业制取盐酸可真是个有趣又重要的过程呢!它就像是一个默默工作的小能手,为我们的生活和工业发展贡献着自己的力量。
咱可得好好珍惜这个过程,让它更好地为我们服务呀!这就是我对工业制取盐酸流程的理解啦,大家觉得是不是这么个理儿呢?原创不易,请尊重原创,谢谢!。
工业制取hcl

工业制取hcl工业制取HCl主要有三种方法:盐酸法、氯化法和电解法。
下面将对这三种方法进行详细介绍。
盐酸法是工业上生产HCl的主要方法之一。
该方法主要是通过盐酸和硫酸的反应制取。
首先,在反应器中加入一定量的盐酸和硫酸。
然后,将MgCl2加入反应器中,与盐酸进行反应生成MgCl2• nH2O沉淀物,并放热。
反应完成后,将所得沉淀物进行过滤和洗涤。
最后,通过蒸发和冷凝操作,得到高纯度的HCl。
氯化法是另一种制备HCl的方法。
该方法主要是通过还原铁和盐酸之间的反应制取。
首先,在反应器中加入一定量的盐酸和一定浓度的硫酸。
然后,将铁粉加入反应器中,与盐酸反应生成FeCl2和H2气体。
反应完成后,通过控制冷却和冷凝操作,得到液态HCl。
最后,通过蒸馏等操作,得到高纯度的HCl。
电解法是最常用的制取HCl的方法之一。
该方法主要是通过电解NaCl(食盐)溶液制取。
首先,将NaCl溶解在水中,得到NaCl溶液。
然后,将溶液放入电解槽中,并加上电压。
在电解过程中,NaCl溶液中的Cl-离子会向阳极移动,而Na+离子则向阴极移动。
当Cl-离子达到阳极时,会接受电子,生成氯气和OH-离子。
而Na+离子则在阴极接受电子,生成Na固体。
同时,OH-离子会与溶液中的H+离子结合,生成H2气体和水。
最后,通过冷凝和脱水操作,得到高纯度的HCl。
以上是工业制取HCl的三种主要方法,每种方法都有其特点和适用范围。
盐酸法适用于高纯度要求不高的情况,氯化法适用于一些小型化工厂,而电解法则适用于大规模生产HCl的工厂。
无论哪种方法,都需要严格控制操作条件以及后续的处理步骤,以保证制取出的HCl的质量和纯度。
请注意,本文中并不提供具体操作步骤和详细参数,如果需要在实际操作中使用这些方法,请参考相关的文献或咨询专业人士,以确保安全和有效性。
合成盐酸的生产技术

目录摘要 (3)1 生产原料的来源 (4)1.1 氯气的来源及性质 (4)1.1.1 氯气的来源 (4)1.1.2 氯气的性质 (4)1.2氢气的来源及性质 (4)1.2.1氢气的来源 (4)1.2.2氢气的性质 (4)1.3原料及中间体规格 (5)2 合成盐酸的生产技术 (5)2.1 盐酸的概要 (5)2.1.1盐酸的性质 (5)2.2.2盐酸的用途 (5)2.2.3盐酸的生产方法 (6)2.2盐酸的生产原理及特点 (6)2.3合成工艺条件 (6)2.4工艺流程简述 (6)3 合成炉及工艺控制条件 (7)3.1合成炉的结构 (7)3.2生产工艺控制条件 (8)4 异常现象产生原因和处理方法 (8)4.1异常现象产生原因及处理方法 (9)结论 (11)参考文献 (12)致谢 (13)摘要氯碱工业是基本化学工业之一。
氯碱工业的主要产品是烧碱、盐酸和液氯。
盐酸的生产主要有两种方式,一种是直接合成法,另一种是无机或有机产品生产的副产品。
而我们氯化氢工段采用的是电解产品氯气和氢气直接合成盐酸的。
在国民经济各部门中,盐酸的用途很广,它是重要的无机化工原料,广泛用于染料、医药、食品、印染、皮革、冶金等行业。
关键词:盐酸,氢气,氯气,生产工艺1 生产原料的来源1.1 氯气的来源及性质1.1.1氯气的来源:合成盐酸所用的氯气是由离子膜工段电解食盐水制得的,再经氯气总管送至氯干燥工序处理后,送到氯化氢工序来生产盐酸的。
1.1.2 氯气的性质(1)物理性质:①颜色,气味,状态:通常情况下为有刺激性气味的黄绿色的气体②密度:比空气密度大③易液化,熔沸点较低,压强为101kPa、温度为-34.6℃时易液化。
液态氯为金黄色。
如果将温度继续冷却到-101℃时,液氯变成固态氯。
④溶解性:易溶于有机溶剂,难溶于饱和食盐水。
1体积水在常温下可溶解2体积氯气,形成氯水,产生的次氯酸具有漂白性,且可使蛋白质变质,且易见光分解。
(2)化学性质:①毒性氯气是一种有毒气体,它主要通过呼吸道侵入人体并溶解在黏膜所含的水分里,生成次氯酸和盐酸,对上呼吸道黏膜造成有害的影响:次氯酸使组织受到强烈的氧化;盐酸刺激黏膜发生炎性肿胀,使呼吸道黏膜浮肿,大量分泌黏液,造成呼吸困难,所以氯气中毒的明显症状是发生剧烈的咳嗽。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
工业用合成盐酸1 范围本标准规定了工业用合成盐酸的要求、采样、试验方法、检验规则及标志、包装、运输和贮存、安全。
本标准适用于有氯气和氢气合成的氯化氢气体,用水吸收制得的工业用合成盐酸。
3 要求3.1 外观:工业用合成盐酸为无色或浅黄色透明液体。
3.2 工业用合成盐酸应付表1给出的指标要求。
表1 指标4 采样4.1 产品按批检验。
生产企业以每一成品槽或每一生产周期生产的工业用合成盐酸为一批。
用户以每次收到的同一批次的工业用合成盐酸为一批。
4.2 工业用合成盐酸从槽车或贮槽中采样时,宜用GB/T6680中规定的适宜的耐酸采样器自上、中、下三处采取等量的有代表性样品。
生产企业可将槽车或贮槽内的工业用合成盐酸混匀后于采样口采取有代表性样品,进行检测。
4.3 工业用合成盐酸从塑料桶或陶瓷坛中采样时,按GB/T6678中规定的采样单元数随机抽样,拆开包装,宜采用GB/T6680中规定的适宜耐酸采样器自上、中、下三处采取等量的有代表性样品。
4.4 将采取的样品混匀,装于清洁、干燥的塑料瓶或具磨口塞的玻璃瓶中,密封。
样品量不少于500mL。
样品瓶上应贴上标签并注明:生产企业名称、产品名称、批号或生产日期、采样日期及采样人。
5 试验方法除非另有说明,在分析中仅使用确认为分析纯试剂和GB/T6682中规定的三级水或相当纯度的水。
试验中所需标准溶液、制剂及制品,在没有其他规定时,均按GB/T601、GB/T602、GB/T603规定制备。
5.1 外观目视观察5.2 总酸度的测定 滴定法 5.2.1 原理试料溶液以溴甲酚绿为指示液,用氢氧化钠标准滴定溶液滴定至溶液由黄色变为蓝色为终点。
反应式如下:H ++OH -→H 2O5.2.2 试剂5.2.2.1 氢氧化钠标准滴定溶液:c (NaOH )=1mol/L 5.2.2.2 溴甲酚绿指示液:1g/L 。
5.2.3 仪器一般的实验室仪器和以下仪器。
5.2.3.1 锥形瓶,100mL (具磨口塞)。
5.2.3.2 滴定管,50mL ,有0.1mL 分度值。
5.2.4 分析步骤 5.2.4.1 试料量取约3ml 实验室样品,置于内装约15ml 水并已称量(精确到0.0001g )的锥形瓶(5.2.3.1)中,混匀并称量(精确到0.0001g )。
5.2.4.2 测定向试料(5.2.4.1)中加入(2~3)滴溴甲酚绿指示液(5.2.2.2),用氢氧化钠标准滴定溶液(5.2.2.1)滴定至溶液由黄色变为蓝色为终点。
5.2.5 结果计算总酸度以氯化氢(HCl )的质量分数ω1计,数值以%表示,按式(1)计算:01m 10100c )1000/(M V m MV C =⨯=ω (1)式中:V ——氢氧化钠标准滴定溶液的体积的数值,单位为毫升(mL );C ——氢氧化钠标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L );M——试料的质量的数值,单位为克(g);M——氯化氢的摩尔质量的数值,单位为克每摩尔(g/mol)(M=36.461)。
5.2.6允许差平行测定结果之差的绝对值不大于0.2%。
取平行测定结果的算术平均值为报告结果。
5.3 铁含量的测定 1,10-菲啰啉分光光度法5.3.1 原理用盐酸羟胺将试料中Fe3+还原成Fe2+,在pH为4.5缓冲溶液体系中,Fe2+与1,10-菲啰啉反应生成橙红色络合物,用分光光度计测定吸光度。
反应式如下:4Fe3++2NH2OH→4Fe2++N2O+4H++H2OFe2++3C12H8N2→[Fe(C12H8N2)3]2+5.3.2 试剂5.3.2.1 盐酸溶液:1+10。
5.3.2.2 氨水溶液:1+1。
5.3.2.3 盐酸羟胺溶液:100g/L。
称取10.0g盐酸羟胺,溶于水,用水稀释至100mL。
5.3.2.4 乙酸-乙酸钠缓冲溶液:pH值为4.5。
5.3.2.5 铁标准溶液:0.1g/L。
5.3.2.6 铁标准溶液:0.01g/L。
准确量取铁标准溶液(5.3.2.5),用水稀释10倍。
该溶液使用前配制。
5.2.3.7 1,10-菲啰啉溶液:2g/L。
该溶液应避光保存,仅使用无色溶液。
5.3.3 仪器一般的实验室仪器和分光光度计。
5.3.4 分析步骤5.3.4.1 标准曲线绘制5.3.4.1.1 按表2量取铁标准溶液(5.3.2.6)分别置于6个50mL容量瓶中。
表25.3.4.1.2 向每个容量瓶中加入10mL 盐酸溶液(5.3.2.1),加水至约20mL ,用氨水(5.3.2.2)调至溶液pH 值为2~3,然后加入1mL 盐酸羟胺溶液(5.3.2.3)、5mL 乙酸-乙酸钠缓冲溶液(5.3.2.4)和2mL1,10-菲啰啉溶液(5.3.2.7),用水稀释至刻度,摇匀。
静置15min 。
5.3.4.1.3 用适宜的比色皿,在波长510nm 处,用空白溶液调整分光光度计零点,测定溶液吸光度。
5.3.4.1.4 以铁含量(μg )为横坐标,与其对应的吸光度为纵坐标绘制标准曲线。
5.3.4.2 试样溶液制备量取约8.6mL 实验室样品,称量(精确到0.01g )置于内装约50mL 水的100mL 容量瓶中,用水稀释至刻度,摇匀。
5.3.4.3 试料量取10.0mL 试样溶液(5.3.4.2)置于50mL 容量瓶中。
5.3.4.4 空白试验不加试料,加10mL 盐酸(5.3.2.1)采用与测定试料完全相同的分析步骤、试剂和用量进行空白试验。
5.3.4.5 测定5.3.4.5.1 向试料(5.3.4.3)中加水至约20mL,用氨水(5.3.2.2)调至溶液pH 为2~3,然后加1mL 盐酸羟胺溶液(5.3.2.3)、5mL 乙酸-乙酸钠缓冲溶液(5.3.2.4)和2mL1,10-菲啰啉溶液(5.3.2.7),用水稀释至刻度,摇匀。
静置15min 。
5.3.4.5.2 用适宜的比色皿,在波长510nm 处,用空白溶液调整分光光度计零点,测定溶液吸光度。
5.3.5 结果计算铁含量以铁(Fe )的质量分数ω2计,数值以%表示,按式(2)计算:132162210100100/10m 10m m m --⨯=⨯⨯⨯=ω ........(2) 式中:m 1——试样质量的数值,单位为克(g )m 2——由标准曲线上查得的试料中铁质量的数值,单位为微克(μg )。
5.3.6允许差平行测定结果之差的绝对值不大于0.0005%。
取平行测定结果的算术平均值为报告结果。
5.4 灼烧残渣的测定重量法5.4.1 原理蒸发一份称好的试料,用硫酸处理,使盐类转变为硫酸盐,在(800±50)℃下灼烧后,称量。
5.4.2 试剂硫酸5.4.3 仪器一般的实验室仪器和以下仪器。
5.4.3.1 瓷坩埚,100mL5.4.3.2 高温炉,可控温度(800±50)℃。
5.4.4 分析步骤5.4.4.1 试料将瓷坩埚(5.4.3.1)在(800±50)℃下灼烧15min,冷却,置于干燥器内冷却至室温,称量(精确到0.0001g)。
用此瓷坩埚称取约50g实验室样品(精确到0.01g)。
5.4.4.2 测定小心加热盛有试料(5.4.4.1)的瓷坩埚(在砂浴上),蒸发掉大部分试料(最后体积约5mL~10mL),冷却至室温,加1mL硫酸(5.4.2)加热至干,然后将瓷坩埚放入高温炉(5.4.3.2)中,炉温控制(800±50)℃,灼烧15min。
取出瓷坩埚,冷却,置于干燥器内冷却至室温,称量(精确到0.0001g)。
5.4.5 结果计算灼烧残渣以残渣的质量分数ω3计,数值以%表示,按式(3)计算:100m 343⨯=m ω ............(3) 式中:m 3——试料的质量的数值,单位为克(g ); m 4——灼烧残渣的质量和数值,单位为克(g )。
5.4.6 允许差平行测定结果的绝对值之差不大于0.005%。
取平行测定结果的算术平均值为报告结果。
5.5 游离氯含量的测定 滴定法5.5.1 原理试料溶液加入碘化钾溶液,析出碘,以淀粉为指示液,用硫代硫酸钠标准滴定游离出来的碘。
反应式如下:2I --2e →I 2I 2+2S 2O 32-→S 4O 62-+2I -5.5.2 试剂5.5.2.1 碘化钾溶液:150g/L 。
称取15.0g 碘化钾,溶于水,用水稀释至100mL 。
5.5.2.2 硫代硫酸钠标准滴定溶液:c (Na 2S 2O 3)=0.1mol/L 5.5.2.3 淀粉指示液:10g/L 。
本溶液只能保留两周。
5.5.3 仪器一般的实验室仪器和以下仪器。
5.5.3.1 锥形瓶,500mL(具磨口塞)。
5.5.3.2 微量滴定管。
5.5.4 分析步骤 5.5.4.1 试料量取实验室样品约50mL,置于内装约100mL 水并已称量(精确到0.01g )的锥形瓶(5.5.3.1)中,冷却至室温,称量(精确到0.01g )。
5.5.4.2 测定向试料(5.5.4.1)中加10mL 碘化钾溶液(5.5.2.2),塞紧瓶塞摇动,在暗处静置2min 。
加1mL 淀粉指示液(5.5.2.3),用硫代硫酸钠标准滴定溶液(5.5.2.2)滴定至溶液蓝色消失为终点。
5.5.5 结果计算游离氯以氯(Cl )的质量分数ω4计,数值以%表示,按式(4)计算。
554m 10c 100c 1000/MV m M V =⨯=ω (4)式中:V ——硫代硫酸钠标准滴定溶液的体积的数值,单位为毫升(mL );C ——硫代硫酸钠标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L ); m 5——试料的质量的数值,单位为克(g );M ——氯的摩尔质量的数值,单位为克每摩尔(g/L )(M=35.453)。
5.5.6 允许差平行测定结果之差的绝对值不大于0.001%。
取平行测定结果的算术平均值为报告结果。
5.6 砷含量的测定 二乙基二硫代氨基甲酸银分光光度法(仲裁法) 5.6.1 原理在酸性介质中,用碘化钾与氯化亚锡将As 5+还原为As 3+,加锌粒与酸作用,产生新生态氢,使As 3+进一步还原为砷化氢,被二乙基二硫代氨基甲酸银[Ag(DDTC)]吡啶溶液吸收,生成紫红色胶体溶液,用分光光度计测定吸光度。
反应式如下:AsH 3+6Ag(DDTC)=6Ag ↓+3H(DDTC)+As(DDTC)35.6.2 试剂和材料所用试剂均不含砷。
5.6.2.1 盐酸。
5.6.2.2 三氧化二砷。
危险——三氧化二砷为剧毒品。
5.6.2.3 锌粒:粒径(0.5~1)mm。
5.6.2.4 碘化钾溶液:150g/L称取15.0g碘化钾,溶于水,用水稀释至100mL。
5.6.2.5 氯化亚锡盐酸溶液:400g/L。
