反应工程作业及答案汇总
作业课后答案化学反应工程第四

解:由题意知,此为二级反应
dN A dW
kw
f (c); dN A dS
kS
f (c); dN A dVC
kVC
f (c)
又dS SgdW ; PdVC dW 所以kw kS Sg ;kvc kw P
所以,rA 7.696 105 P PA2
7.696 105 P (106 RT )2 (106 CA )2 mol / (cm3 s)
k p1 C4H8
k2
p C4
H6
p H2
1 b p b p C4H8 C4H8
C4H6 C4H6
第3页/共17页
(2)丁烯反应级数判断
=
b p C4H8 C4H8
1+b p +b p C4H8
C4H8 C4H8
C4H6 C4H6
1
由题设知反应属于化学反应控制,根据平衡近似假设:
p C4 H8
kVC 0.09s1; Deff 7.04 104 cm2 / s
对于不同形状的催化剂颗粒,西勒模数均可表示为:
Vp p Sgks Vp kVC
Sp
Deff
S p Deff
(2.5 103 )2 (5 103 ) 2 (2.5 103 )2 2 (2.5 103 ) (5 103 )
2-13 乙烯直接水合制乙醇可视为对乙烯的一级不可逆反应, 在300 ℃ 、7.09MPa下,k=0.09s-1,Deff=7.04×10-4cm2/s,采用直 径与高均为5mm的圆柱形催化剂,求内扩散有效因子。
解: 由 已 知 条 件 :
T 300 273.15K 573.15K; P 7.09MPa;
107 / 2ra = 108
反应工程期末试题及答案

反应工程期末试题及答案[正文]一、选择题1. 下列哪个是关于反应速率的正确说法?A. 反应速率与物质的浓度成正比。
B. 反应速率与反应物的摩尔质量成负相关。
C. 反应速率与温度的关系是线性的。
D. 反应速率与反应物的物理状态无关。
答案:A2. 以下哪个因素对反应速率没有影响?A. 压力B. 催化剂C.温度D.浓度答案:A3. 以下哪个因素对于 SN1 反应没有显著影响?A. 催化剂B. 反应物浓度C. 反应温度D. 溶剂极性答案:B4. 以下哪种反应是可逆反应?A. 电解水生成氢气和氧气B. 酶催化的生物代谢反应C. 燃烧反应释放热能D. 溶解氨气到水中答案:A5. 对于一个一级反应,当初始浓度减少一半,反应速率会发生怎样的变化?A. 减少一半B. 不变C. 增加一倍D. 无法确定答案:A二、解答题1. 请简要解释反应速率的定义以及其与速率常数的关系。
答案:反应速率是指单位时间内反应物浓度变化的大小。
速率常数则是特定反应条件下,反应速率与反应物浓度之间的比例关系,它体现了反应物浓度对于反应速率的影响程度。
根据速率常数的定义,速率常数越大,说明单位时间内反应物浓度变化越大,反应速率也就越快。
2. 简要描述连续稀释法对于确定反应级数的步骤。
答案:连续稀释法用于确定反应级数,其步骤包括:1) 准备一系列具有相同体积的浓度不同的反应物溶液。
2) 将这些溶液按照从浓到稀的顺序加入反应容器中。
3) 进行反应,并记录反应物浓度随时间的变化。
4) 根据反应物浓度随时间的变化曲线,判断反应级数。
3. 解释穆斯林算法在反应工程中的应用。
答案:穆斯林算法是一种基于自适应机制的粒子群优化算法,其应用于反应工程领域可以用于解决复杂反应系统的优化问题。
通过建立反应动力学模型和限制条件,穆斯林算法能够找到最优的反应条件和操作策略,从而实现反应系统的高效运行和产出品质的优化。
4. 解释反应路径图中的过渡态和活化能。
答案:反应路径图是用来描述反应过程中反应物转化为产物的过程,其中过渡态表示反应物转化为产物的变化状态,活化能指的是反应物在进行反应时需要克服的能垒。
反应工程考试习题库及答案

第一章 绪论1. 化学反应工程是一门研究______________的科学。
(化学反应的工程问题) 2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。
(化学反应、工程问题) 3. _______是化学反应工程的基础。
( 三传一反)4. 化学反应过程按操作方法分为_______、_______、_______操作。
(分批式操作、连续式操作、半分批式)5. 化学反应工程中的“三传一反”中的三传是指_______、_______、_______。
(传质、传热、动量传递)6. 不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称_______。
(数学模型)7. 在建立数学模型时,根据基础资料建立物料、热量和动量衡算式的一般式为_______。
(累积量=输入量-输出量)8.“三传一反”是化学反应工程的基础,其中所谓的一反是指_______。
(D )A .化学反应 B. 反应工程 C. 反应热力学 D. 反应动力学 、9.“三传一反”是化学反应工程的基础,下列不属于三传的是_______。
(A ) A. 能量传递 B. 质量传递 C. 热量传递 D. 动量传递 第二章 均相反应动力学1. 均相反应是指_。
(参与反应的物质均处于同一相)2. aA + bBpP + sS 对于反应,则=P r _______)(A r -。
(ap)3.着眼反应组分K 的转化率的定义式为_______。
(00K KK K n n n -=χ)4.当计量方程中计量系数的代数和等于零时,这种反应称为_______,否则称为_______。
(等分子反应、非等分子反应)5.化学反应速率式为βαB A C A C C K r =-,用浓度表示的速率常数为C K ,假定符合理想气体状态方程,如用压力表示的速率常数P K ,则C K =_______P K 。
反应工程作业及答案汇总
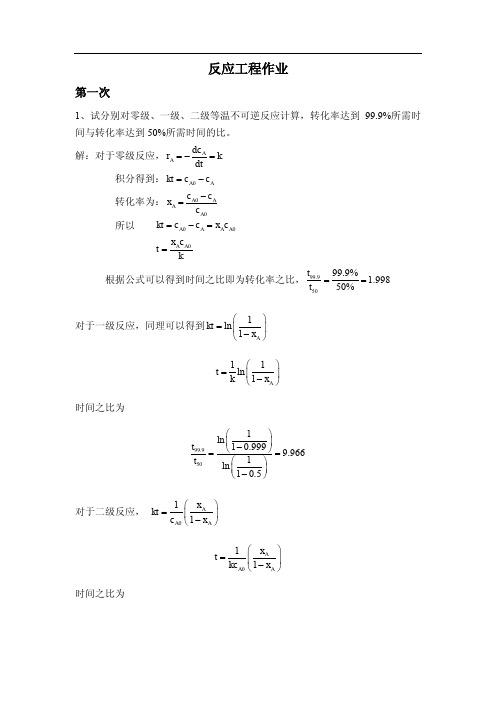
反应工程作业第一次1、试分别对零级、一级、二级等温不可逆反应计算,转化率达到99.9%所需时间与转化率达到50%所需时间的比。
解:对于零级反应,AA dc r k dt=-= 积分得到:0A A kt c c =- 转化率为:00A AA A c c x c -=所以 00A A A A kt c c x c =-= 0A A x c t k=根据公式可以得到时间之比即为转化率之比,99.95099.9%1.99850%t t == 对于一级反应,同理可以得到1ln 1A kt x ⎛⎫= ⎪-⎝⎭11ln 1A t k x ⎛⎫=⎪-⎝⎭时间之比为99.9501ln 10.9999.9661ln 10.5t t ⎛⎫ ⎪-⎝⎭==⎛⎫ ⎪-⎝⎭对于二级反应, 011A A A x kt c x ⎛⎫=⎪-⎝⎭011A A A x t kc x ⎛⎫=⎪-⎝⎭时间之比为99.9500.9990.599910.99910.5t t ⎛⎫⎛⎫== ⎪ ⎪--⎝⎭⎝⎭2、对某均相反应,在初始浓度相同的情况下,为达到相同的转化率,在100℃下需10min ,在120℃需2min ,试求活化能。
解:因初始浓度相同,为达到相同的转化率,有()kt c =常数,不同的温度由于反应速率常数k 不同,所以时间也不同 根据Arrhenius 公式E RT k Ae -=37337339339320.210E ER R k e k ---===,其中R 为气体常数,为()8.314J mol K 计算得到98.07E KJ mol =3、以乙酸(A )和正丁醇(B )为原料在间歇反应器中生产乙酸丁酯,操作温度为100℃,每批进料1kmol 的A 和 4.96kmol 的B ,已知反应速率()()231.045A A Vr c kmol m h =,试求乙酸转化率A x 分别为0.5、0.9、0.99所需的反应时间。
化学反应工程作业答案

化学反应工程作业答案3-2 在等温间歇反应器中进行皂化反应325325CH COOC H NaOH CH CHCOONa C H OH +→+ 该反应对乙酸乙酯和氢氧化钠均为一致,反应开始时乙酸乙酯和氢氧化钠的浓度均为0.02mol/L ,反应速率常数为5.6L/(min ·mol ),要求最终转化率为0.95,试求当反应器体积为31m 、32m 时,所需的反应时间是多少? 解: A B C D +=+A AB r kC C =⋅⋅ 设A 的转化率为A x ,B 的转化率为B x000A A A A A A n n n x n n --∆== 000B B BB B B n n n x n n --∆== ∵ 00A B n n = , A B n n ∆=∆ , ∴ A BC C =t=0Afx AA adx C r ⎰=020Afx AA A dx C k C ⋅⎰=01(1)A Af kC x --01A k C =169.6 min t 与反应体积无关。
∴31m 、所需反应时间均为169.6min3-3 在平推流反应器中进行等温一级反应,出口转化率为0.9,现将该反应移到一个等体积的全混流反应器中进行,且操作条件不变,问出口转化率是多少? 解:对于平推流反应器: 1ln1Af k x τ=- 0Bv v τ= 对于全混流反应器: ''1Af Afx k x τ=- 0Rv v τ=∴ 1ln1Af x -='1Af Afx x -=2.3 ∴ 'Af x =0.6973-6 已知某均相反应,反应速率2,17.4A A r kC k ml ==/(mol ﹒min ),物料密度恒定为0.75g/ml ,加料流量为7.14L/min ,0A C =7.14mol/L ,反应在等温下进行,试计算下列方案的转化率各为多少?(1) 串联两个体积0.253m 的全混流反应器。
(完整版)反应工程课后答案完整版.
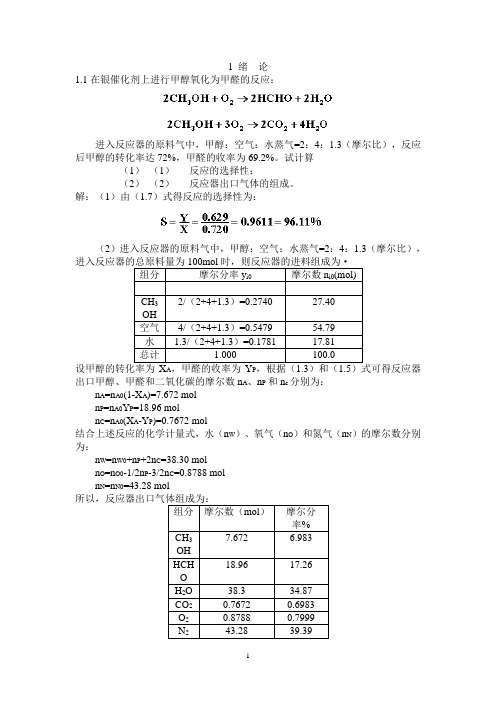
1 绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)(1)反应的选择性;(2)(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),组分摩尔分率y i0 摩尔数n i0(mol)CH32/(2+4+1.3)=0.2740 27.40OH空气4/(2+4+1.3)=0.5479 54.79水 1.3/(2+4+1.3)=0.1781 17.81总计 1.000 100.0A P出口甲醇、甲醛和二氧化碳的摩尔数n A、n P和n c分别为:n A=n A0(1-X A)=7.672 moln P=n A0Y P=18.96 moln C=n A0(X A-Y P)=0.7672 mol结合上述反应的化学计量式,水(n W)、氧气(n O)和氮气(n N)的摩尔数分别为:n W=n W0+n P+2n C=38.30 moln O=n O0-1/2n P-3/2n C=0.8788 moln N=n N0=43.28 mol组分摩尔数(mol)摩尔分率%7.672 6.983CH3OH18.96 17.26HCHOH2O 38.3 34.87CO2 0.7672 0.6983O2 0.8788 0.7999N2 43.28 39.392 反应动力学基础2.4在等温下进行液相反应A+B→C+D,在该条件下的反应速率方程为:若将A和B的初始浓度均为3mol/l的原料混合进行反应,求反应4min时A的转化率。
解:由题中条件知是个等容反应过程,且A和B的初始浓度均相等,即为1.5mol/l,故可把反应速率式简化,得由(2.6)式可知代入速率方程式化简整理得积分得解得X A=82.76%。
2.6下面是两个反应的T-X图,图中AB是平衡曲线,NP是最佳温度曲线,AM是等温线,HB是等转化率线。
化学反应工程课后习题解答全解
min)
3-5 在等温全混流釜式反应器中进行下列液相反应:
A + B → P(目的)rP = 2cA [kmol/(m3.h)
2A → R
rR= 0.5cA [kmol/(m3.h)
cA0 = cB0 = 2kmol/m3.
试计算反应2h时A的转化率和产品P的收率。
解:A组分的总消耗速率
(-rA )= rP + 2rR = 2cA + cA = 3cA 将其代入CSTR设计方程
pA 1000 800 666.75 446.75 306.8 206.8 -dpA/dt 82.305 66.844 53.581 33.647 22.503 20.149
(4)对
rA
dpA dt
~
pA
分别取自然对数,得到数据如下表
pA 1000 800 666.75 446.75 306.8 206.8 -dpA/dt 82.305 66.844 53.581 33.647 22.503 20.149
nH2O 17.8082 x 2 y
Y x x 0.692,即 nC0H3OH 27.3979
x 18.961
又nCH3OH
27.3979 x
y
n0 CH3OH
(1
xCH3OH
)
7.6714
y (27.397918.961 7.6714) 0.768
rA k1cAcB k2cRcS 7cAcB 3cRcS
7cB0 (1 xB )(cA0 cB0 xB ) 3(cB0 xB )2
只能指定B的转化率为75%,计算空间时间
VR cB0 xBf
化学反应工程习题及答案
题目:全混流连续操作反应器,反应器内温度、浓度处处均匀一致,故所有物料粒子在反应器内的停留时间相同。
正确答案:错题目:相同条件下,分别用下列反应器处理物料,比较反应器有效容积的大小。
①单段全混流反应器(V R1)②四个体积相同的全混流反应器串联(V R2)③两个体积相同的全混流反应器串联(V R3)④平推流反应器(V R4)则(V R4)>(V R2)>(V R3)>(V R1)正确答案:错题目:设备放大,造成微元停留时间分布和返混程度改变,放大时反应结果恶化。
正确答案:对题目:生产能力是相同条件下,单位时间、单位反应器体积所能获得的(产物量),或完成相同生产任务,所需反应器的(体积)。
题目:化工生产中应用于均相反应过程的化学反应器主要有(釜式)反应器和(管式)反应器。
题目:釜式反应器的基本结构主要包括反应器(壳体)、(搅拌器)、(密封装置)和(换热装置)等。
题目:手孔或人孔的安设是为了检查(内部空间)以及安装和拆卸设备(内部构件)。
题目:釜式反应器中夹套式换热器适用于传热面积(较小),传热介质压力(较低)的情况。
题目:基元反应的级数即为化学反应式的(计量系数),对非基元反应的级数通过(实验)确定。
题目:单一反应利用(转化率)可以确定反应物转化量与产物生成量之间的关系。
题目:间歇反应,只要C AO相同,无论处理量多少,达一定(转化率)每批所需的(反应时间)相同。
题目:对同一反应在相同条件下,达到相同转化率,全混釜反应器所需有效体积(最大),平推流反应器所需有效体积(最小),多釜串联全混釜所需有效体积(介于其间)。
题目:一级不可逆反应,其反应速率方程为(-r A =kC A a ),反应时间与转化率的关系为(kt )x 11ln(A =-)。
题目:复合反应动力学为由两个以上(化学反应计量式)或(动力学方程式)表示的化学反应过程。
题目:间歇釜式反应器有效体积不但与(反应时间)有关,还与(非生产时间)有关。
反应工程题库(答案自己做的,仅供参考)
一、是非题:(正确的打“√”,错误的打“×”) 1.对化学反应来说,温度越高,反应速率越大,因此高温操作,可使反应器体积最小。
(× )2.多个PFR 串联或多个CSTR 串联,其流型仍为活塞流或全混流。
( × ) 3.对于零级反应,由于反应速率与反应物浓度无关,因此催化剂内扩散阻力对宏观反应速率无影响。
( × )4.在进行均相反应动力学实验时,既可以在间歇反应器中进行,也可以在连续流动反应器中进行,但由于反应器操作方式不同,因此所得的反应动力学方程形式也是不同的。
( × )5. 间歇釜式反应器改成连续操作后,由于省去了辅助时间,因此一定能提高产量。
( × )6.在绝热式固定床反应器中进行一级不可逆反应,由于西勒(Thiele )模数与反应物浓度无关,因此内扩散有效因子在床内为常数。
( × )7.由于全混釜的停留时间分布比任意非理想流动反应器的都宽,因此NFR t CSTR t )()(22σσ>。
( × )8.在一绝热反应器中,仅当进行一级反应时,其反应温度和转化率的关系才呈线性。
( × )9.在任意转化率下,一级不可逆连串反应在全混流反应器中进行的收率总是低于在间歇釜中进行的收率。
√10.在相同的温度下,一级连串不可逆反应A →P →Q ,在间歇反应器中进行时P 的收率总是高于在全混流中进行的P 的收率。
( √ )11.在全混流釜式反应器中进行液相反应,由于返混程度最大,故反应速率一定最小。
( × )12.因为单一反应就是基元反应,因此反应级数与化学计量系数相同。
( × )13.一自催化反应P A k−→−,若(-R A )=kC A C P ,由于反应级数大于零,则在达到相同的转化率时,所需的V PFR 总是小于V CSTR 。
( ) 14.在间歇反应器(BR )中和活塞流反应器(PFR )中等温进行同一反应,若C A0、x Af 相同时,则t BR = τPFR 。
反应工程课后习题参考答案
反应工程课后习题参考答案1绪论1.1在银催化剂上进行甲醇氧化为甲醛的反应:2CH3OHO22HCHO2H2O2CH3OH3O22CO24H2O进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),反应后甲醇的转化率达72%,甲醛的收率为69.2%。
试计算(1)反应的选择性;(2)反应器出口气体的组成。
解:(1)由(1.7)式得反应的选择性为:S0.961196.11%(2)进入反应器的原料气中,甲醇:空气:水蒸气=2:4:1.3(摩尔比),当进入反应器的总原料量为100mol时,则反应器的进料组成为2由甲醇的转化率达72%某y某=72%;=69.2%227.4解得某=18.96;y=0.77所以,反应器出口气体组成为:CH3OH:27.4某y100%=6.983%某y10022某3y100%=40.19%空气:某y1002217.81某2y水:100%=34.87%某y10022某HCHO:100%=17.26%某y10022yCO2:100%=0.6983%某y1002254.791.2工业上采用铜锌铝催化剂由一氧化碳和氢合成甲醇,其主副反应如下:CO2H2CH3OH2CO4H2(CH3)2OH2OCO3H2CH4H2O4CO8H2C4H9OH3H2OCOH2OCO2H2由于化学平衡的限制,反应过程中一氧化碳不可能全部转化成甲醇,为了提高原料的利用率,生产上采用循环操作,即将反应后的气体冷却,可凝组份变为液体即为粗甲醇,不凝组份如氢气及一氧化碳等部分放空,大部分经循环压缩机后与原料气混合返回合成塔中。
下图是生产流程示意图放空气体Akmol/h原料气和冷凝分离后的气体组成如下:组分原料气冷凝分离后的气体COH2CO226.8268.251.4615.4969.780.82CH40.553.62N22.9210.29粗甲醇的组成为CH3OH89.15%,(CH3)2O3.55%,C3H9OH1.10%,H2O6.20%,均为重量百分率。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对于一级不可逆反应 rA kcA kcA0 1 xA ,代入积分得到
x A dx xA dx A V 1 A cA0 ln 1 x A 0 0 v0 rA k 1 x A k
特点:连续进料,连续出料,连续操作,不存在返混。 相互转化: 间歇反应器若无辅助操作时间可转化为平推流反应器,多个全混流反 应器串联可转化为平推流反应器, 当循环管式反应器的循环比无限大时可以转化 为全混流反应器。
k1 k2
rA k1c A k2 cP
根据范特霍夫方程
K H r d ln K H r ,积分有: ln 2 2 dT RT K1 R
1 1 T2 T1
对于吸热反应, H r 0 ,温度升高,平衡常数增大,对正反应有利。 对于放热反应, H r 0 ,温度升高,平衡常数减小,对正反应不利; 可逆反应速率 rA k1 k2 cA0 xAe xA 其中根据可逆反应的正逆反应速率相等得到:
反应工程作业
第一次
1、试分别对零级、一级、二级等温不可逆反应计算,转化率达到 99.9%所需时 间与转化率达到 50%所需时间的比。 解:对于零级反应, rA
dcA k dt
积分得到: kt c A0 c A 转化率为: xA 所以
c A0 c A c A0
kt c A0 c A x Ac A0
x A dx V A c A0 0 v0 rA
x A dx xA dxA V 1 A c A0 cA0 2 0 r 0 kc x v0 kc A0 A A 0 A 1 x A 0.98
xA
0
dxA x A 1 x A
0.98 dxA x 1 2 5 103 ln A 10 2 0 xA 1 xA 1 xA 0
0
特点:一次性加料,一次性出料,间歇操作,不存在返混 全混流反应器:对于全混流反应器,整个反应器对物料 A 做物料衡算。 进入反应器中的物料 A 的量( FA0 v0 c A0 )=排出反应器物料 A 的量( FA )+反 应消耗掉的物料 A 的量( rAV )+反应器中物料 A 的积累量(0) 故
E E k373 2 373 R 393 R e 0.2 ,其中 R 为气体常数,为 8.314 J mol K k393 10
计算得到 E 98.07 KJ mol 3、以乙酸(A)和正丁醇(B)为原料在间歇反应器中生产乙酸丁酯,操作温度 为 100 ℃ , 每 批 进 料 1kmol 的 A 和 4.96kmol 的 B , 已 知 反 应 速 率
xAe K 1 K
x Ae
K 1 K
进一步分析反应速率的温度效应。 可逆吸热:温度升高,k 和 K 都增加,反应速率增加。 可逆放热:温度升高,K 减小、k 增加,rA 存在极值,存在最佳反应温度 1. 可逆反应速率的温度效应受速率常数和平衡常数双重影响;
2. 不同温度效应的反应有不同的特征; 3. 可逆反应速率的浓度效应与简单反应相同; 平行反应:总速率方程:
对于 E1 E2 的反应,升高温度,选择性增加;相反,降低温度,选择性减小; 对于 E1 E2 的反应,升高温度,选择性减小;相反,降低温度,选择性增加。
当 cP c A 增大时,选择性减小,当 cP c A 减小时,选择性增大。 温度高有利于活化能高的反应; 任何使反应物浓度下降、 产物浓度上升的因素, 对串连反应都是不利的。故不能盲目追求高转化率。 2、以一级不可逆反应为例推导间歇反应器、全混流反应器以及平推流反应器的 基础设计式, 用初始浓度与转化率进行表示。 并在此基础上分析比较三种反应器 的特点和区别?不同形式的反应器之间是否可以相互转变,如何实现? 解:间歇反应器,对整个反应器进行物料衡算,对于物料 A,由于反应期间没有 物料加入反应器或从反应器中取出物料, 故可以写出微元时间 dt 的物料衡算式。 单位时间进入反应器中的物料 A 的量 (0) =单位时间排出反应器物料 A 的量 (0) +单位时间反应消耗掉的物料 A 的量( rAV )+单位时间反应器中物料 A 的积累 dn 量( A ) dt dn 0=0+ rAV A dt nA0 1 x A dnA d dx nA0 A dt dt dt dnA dxA rAV nA0 dt dt 整理并积分得到
t
x Ac A0 k
t99.9 99.9% 1.998 t50 50%
根据公式可以得到时间之比即为转化率之比,
1 对于一级反应,同理可以得到 kt ln 1 xA t 1 1 ln k 1 xA
时间之比为
1 ln 1 0.999 9.966 1 ln 1 0.5
FA0 xA rA V
整理得到:
x V V A FA0 v0 c kcA kcA0 1 xA ,代入整理得到:
V cA0 xA v0 rA
cA0 xA xA kc A 0 1 x A k 1 x A
2、对某均相反应,在初始浓度相同的情况下,为达到相同的转化率,在 100℃ 下需 10min,在 120℃需 2min,试求活化能。 解:因初始浓度相同,为达到相同的转化率,有 kt c 常数 ,不同的温度由于 反应速率常数 k 不同,所以时间也不同 根据 Arrhenius 公式 k Ae E RT
0.0194s
所以反应器的体积为: V v0 0.0194 0.002 3.89 105 m3 0.0389 L
第二次
1、 从平衡常数, 选择性角度分析可逆, 平行, 串联反应的温度效应和浓度效应。 可逆反应: A 平行反应:
k1 k2
P
k1 A P k2 A S
k1 k2 串联反应: A P S
解:可逆反应:总反应速率方程: 主反应的速率方程: r1 k1c A 平衡常数 K
rA k1c A rP k1c A k2cP rS k2 cP
选择性为: S
rP k c k c k c 1 A 2 P 1 2 P rA k1c A k1 c A
根据阿伦尼乌斯公式 k k0e E RT ,代入方程有
E2 k02 E1RT k2 cP c S 1 1 e P k1 cA k01 cA
V cA0 xA v0 rA
2 已知速率方程为 rA kcAcP k 代入设计方程 cA0 1 xA cA0 xA kcA0 xA 1 xA , 并代入数据进行计算得到:
c x V cA0 xA 1 1 2 A0 A 2 0.25s v0 rA kc A0 x A 1 x A kc A0 1 x A 10 2 1 0.98
t nA0
xA 0
在恒容条件下,对于一级不可逆反应 rA kcA kcA0 1 xA ,代入积分得到
t nA0
xA xA dx A dx A 1 cA0 ln 1 x A 0 kc k rA V A 0 1 x A
dx A rA V
对于 E1 E2 的反应,升高温度,选择性增加;相反,降低温度,选择性减小; 对于 E1 E2 的反应,升高温度,选择性减小;相反,降低温度,选择性增加。 对于 的反应,反应物 A 的浓度增加,选择性增加;相反,选择性则减小; 对于 的反应,反应物 A 的浓度增加,选择性减小;相反,选择性则增加; 温度高有利于活化能高的反应;浓度高有利于级数高的反应。 串联反应:速率方程为
rA V
2 1.045cA kmol m3 h ,试求乙酸转化率 x A 分别为 0.5、0.9、0.99 所需的反
应时间。已知乙酸与正丁醇的密度分别为 960 kg m3 和 740 kg m3 。 解:对于每批进料,1kmol A 是 60kg,体积为 VA 60 960 0.0625 m3 ;4.96kmol B 是 368kg,体积为 VB 368 740 0.497 m3 , 该反应为液相反应,反应过程体积不变,每次投料体积
特点:连续进料,连续出料,连续化操作,返混达到最大。 平推流反应器:取长度为 L,体积为 dV 的任一微元管段对物料 A 做物料衡算。 进入反应器中的物料 A 的量( FA )=排出反应器物料 A 的量( FA dFA )+反应 消耗掉的物料 A 的量( rA dV )+反应器中物料 A 的积累量(0)
t99.9 t50
对于二级反应, kt
1 xA c A0 1 x A t 1 xA kcA0 1 xA
时间之比为
t99.9 0.999 0.5 999 t50 1 0.999 1 0.5
3、液相自催化反应 A P ,反应速率 rA kcA cP , k 102 m3 kmol s ,进料体
cP 0 0 , 积流量 V0 0.002 m3 s , 进料浓度 c A0 2 kmol m3 , 当转化率 xA 0.98 时,
下列各种情况下的反应器体积。 (1)单个全混流反应器; 解:全混流反应器的设计方程为:
所以反应器的体积为: V v0 0.25 0.002 5 104 m3 0.5 L 。 (2)单个平推流反应器。 解:平推流反应器的设计方程为:
2 已知速率方程为 rA kcAcP k 代入设计方程 cA0 1 xA cA0 xA kcA0 xA 1 xA , 并代入数据进行计算得到:
