4-多组分系统热力学
合集下载
第4章 多组分热力学

第四章 多组分系统热力学
前面所讨论的是:单组分单相(两相)系统或多 组分组成恒定的系统。 但常见系统绝大部分是:多组分变组成系统。因 此必须研究处理多组分系统。
多组分系统除了两个变量之外,还需确定各组分 的物质的量才能确定系统的状态。 多组分系统分为:单相、多相
本章主要讨论多组分单相系统。
1
第四章 多组分系统热力学
B
dA SdT pdV BdnB
B
•适用条件 W ' 0 ,单相系统
31
2.多组分单相系统的热力学公式
•广义定义
B
U nB
S ,V ,nC
H nB
S , p,nC
A nB
T ,V ,nC
G nB
T , p,nC
保持特征变量和除B以外其它组分不变,某热力
学函数随其物质的量 nB的变化率称为化学势。
2 偏摩尔量相对于某一组分而言,本身是强度量;
3 偏摩尔量与浓度有关,与系统的总量无关。
4 偏摩尔量 X B ( nX,B )下T ,标p,n必C 须是
。T , p, nC
15
2.偏摩尔量
•偏摩尔量的物理意义
•两种理解 1 在恒温恒压下,于极大量的某恒定组成的系统中加
入1mol组分B时所引起系统广度量X的改变量。
混合物的摩尔体积:
Vm
xB M B /
B
Vm xBVB
B
21
5.吉布斯—杜亥姆方程
X
X
dX
( T
) p,nB
dT
(
p
)T ,nB
dp
B
X BdnB
•恒温恒压多组分系统
dX X BdnB
B
前面所讨论的是:单组分单相(两相)系统或多 组分组成恒定的系统。 但常见系统绝大部分是:多组分变组成系统。因 此必须研究处理多组分系统。
多组分系统除了两个变量之外,还需确定各组分 的物质的量才能确定系统的状态。 多组分系统分为:单相、多相
本章主要讨论多组分单相系统。
1
第四章 多组分系统热力学
B
dA SdT pdV BdnB
B
•适用条件 W ' 0 ,单相系统
31
2.多组分单相系统的热力学公式
•广义定义
B
U nB
S ,V ,nC
H nB
S , p,nC
A nB
T ,V ,nC
G nB
T , p,nC
保持特征变量和除B以外其它组分不变,某热力
学函数随其物质的量 nB的变化率称为化学势。
2 偏摩尔量相对于某一组分而言,本身是强度量;
3 偏摩尔量与浓度有关,与系统的总量无关。
4 偏摩尔量 X B ( nX,B )下T ,标p,n必C 须是
。T , p, nC
15
2.偏摩尔量
•偏摩尔量的物理意义
•两种理解 1 在恒温恒压下,于极大量的某恒定组成的系统中加
入1mol组分B时所引起系统广度量X的改变量。
混合物的摩尔体积:
Vm
xB M B /
B
Vm xBVB
B
21
5.吉布斯—杜亥姆方程
X
X
dX
( T
) p,nB
dT
(
p
)T ,nB
dp
B
X BdnB
•恒温恒压多组分系统
dX X BdnB
B
第四章 多组分系统1

由集合公式:X =
B B B B B
B
(2)
此式与前式相减得:
n dX 0 除以 n= n → x dX 0
等TP,
B
B
B
B
B
B
B
——吉布斯-杜亥姆方程
B
例:
二组分系统, nAdX A nB dX B =0
或
xAdX A xB dX B =0
5.偏摩尔量间函数关系
H B = U B p VB
G=G(T,P,nA,nB,……nk)
G G ) P ,n dT + ( )T , n dP dG= ( T P
+
B A
k
G ( )T , P,nC dnB nB
G G 组成不变:有 ( ) P,n S, ( )T ,n V T p
dG=-SdT+VdP+
B
G 定义式:μ B= ( )T , P ,nC nB
X 引起系统容量性质 dX 的改变值 ( )T , p ,nC nB
注意:
1)必须在等 TP 下的偏微商
其它条件下不是偏摩尔量
X XB =( )T , p ,nC nB
GB
X ( )T ,V ,nC ≠ X B nB
G ( )T ,V ,nC nB
=
G ( )T , p ,nC nB
k
Z Z dp dZ= ( ) p ,nA ,nB ,n C nk dT + ( ) p T Z Z )T , p ,nA ,nC nK dnB +( ) p ,nB ,n C nk dnA + ( nB nA Z + ……+ ( )T , p ,nA ,nB , nk 1 dnk nk
B B B B B
B
(2)
此式与前式相减得:
n dX 0 除以 n= n → x dX 0
等TP,
B
B
B
B
B
B
B
——吉布斯-杜亥姆方程
B
例:
二组分系统, nAdX A nB dX B =0
或
xAdX A xB dX B =0
5.偏摩尔量间函数关系
H B = U B p VB
G=G(T,P,nA,nB,……nk)
G G ) P ,n dT + ( )T , n dP dG= ( T P
+
B A
k
G ( )T , P,nC dnB nB
G G 组成不变:有 ( ) P,n S, ( )T ,n V T p
dG=-SdT+VdP+
B
G 定义式:μ B= ( )T , P ,nC nB
X 引起系统容量性质 dX 的改变值 ( )T , p ,nC nB
注意:
1)必须在等 TP 下的偏微商
其它条件下不是偏摩尔量
X XB =( )T , p ,nC nB
GB
X ( )T ,V ,nC ≠ X B nB
G ( )T ,V ,nC nB
=
G ( )T , p ,nC nB
k
Z Z dp dZ= ( ) p ,nA ,nB ,n C nk dT + ( ) p T Z Z )T , p ,nA ,nC nK dnB +( ) p ,nB ,n C nk dnA + ( nB nA Z + ……+ ( )T , p ,nA ,nB , nk 1 dnk nk
物理化学:第4章_多组分系统热力学_
Vm*,B Vm*,C Vm*,B xC
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
真实混合物:实曲线
Vm xBVB xCVC VB (VC VB)xC
当混合物组成改变时,两组 分偏摩尔体积随之改变,且二者 变化相互关联。
组成接近某纯组分,其偏摩 尔体积也接近该纯组分摩尔体积。
5. 吉布斯 − 杜亥姆方程
对广度量 X (T , p, nB, nC , nD ,) 求全微分:
dX
X T
p,nB
dT
X p
T ,nB
dp
B
X nB
dnB T , p,nC
恒温、恒压
另一方面,由加和公式
,恒温恒压下求导:
比较两式,得
或
或
吉布斯-杜亥姆方程--在一定温度压力下,当混合物
组成变化时,各组分偏摩尔量变化的相互依赖关系。
➢ 系统中各组分的偏摩尔量并非完全独立,而是相 互依存的。
➢ 例:固体溶解、过饱和溶液析出、…
组分B在α、β两相中迁移达平衡的条件:该组分
在两相中的化学势相等。
➢ 物质总是从其化学势高的相向化学势低的相迁移, 直至物质迁移达平衡时为止,此时系统中每个组分在 其所处的相中的化学势相等。
化学势 判据
② 化学平衡
<0:自发不可逆; =0:平衡、可逆
任一化学反应,假定系统已处于相平衡,
任一组分B在每个相中的化学势都相等: Bα B
B
B
整个系统中B组分物质的量的变化量: dnBα dnB
α
BdnB
B
化学平衡时
平衡条件:与化学反应达到平衡的方式无关。
§4.3 气体组分的化学势
1、纯理想气体的化学势 2、理想气体混合物中任一组分的化学势 3、纯真实气体的化学势 4、真实气体混合物中任一组分的化学势
大学物理化学--第四章

由两种或两种以上物质以分子,原子或离子为 基本单元相互均匀混合而成的均匀系统。
混合物(mixture):对系统中的各组分采用同样 的标准态和研究方法,系统中的各组分是平等的。
溶液(solution): 各组分区分为溶剂(solvent) 和溶质(solute ),并对二者采用不同的标准态和研 究方法;系统中的各组分是不平等的。
偏摩尔量
XB
(
X nB
)T
,
p
,
,下标必须是
nC
T
,
p。, nC
只有广度量才有偏摩尔量(质量除外)。
偏摩尔量是强度量。
偏摩尔量随温度、压力、组成(浓度)变化而变, 与系统的总量无关。
上一内容 下一内容 回主目录
返回
2020/8/23
§4.1 偏摩尔量
偏摩尔量的加和公式
X nB X B
B
它的含义是:在一定温度、压力下,一定组成混合
物理化学电子教案—第四章
多组分系统热力学
上一内容 下一内容 回主目录
返回
2020/8/23
第四章 多组分系统热力学
目录
§4.1 偏摩尔量 §4.2 化学势 §4.3 气体组分的化学势 §4.4 逸度及逸度因子 §4.5 拉乌尔定律和亨利定律 §4.6 理想液态混合物 §4.7 理想稀溶液
§4.8 活度及活度因子 §4.9 稀溶液的依数性
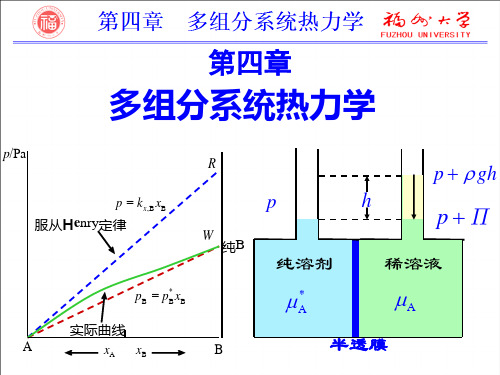
标准态 kb,B ( p p )
实际溶液 pB - bB 关系曲线
pB
O
b
上一内容 下一内容 回主目录
bB
返回
2020/8/23
4.7 理想稀溶液
理想稀溶液中溶质的化学势
B(溶 质)
0 B(溶 质)
混合物(mixture):对系统中的各组分采用同样 的标准态和研究方法,系统中的各组分是平等的。
溶液(solution): 各组分区分为溶剂(solvent) 和溶质(solute ),并对二者采用不同的标准态和研 究方法;系统中的各组分是不平等的。
偏摩尔量
XB
(
X nB
)T
,
p
,
,下标必须是
nC
T
,
p。, nC
只有广度量才有偏摩尔量(质量除外)。
偏摩尔量是强度量。
偏摩尔量随温度、压力、组成(浓度)变化而变, 与系统的总量无关。
上一内容 下一内容 回主目录
返回
2020/8/23
§4.1 偏摩尔量
偏摩尔量的加和公式
X nB X B
B
它的含义是:在一定温度、压力下,一定组成混合
物理化学电子教案—第四章
多组分系统热力学
上一内容 下一内容 回主目录
返回
2020/8/23
第四章 多组分系统热力学
目录
§4.1 偏摩尔量 §4.2 化学势 §4.3 气体组分的化学势 §4.4 逸度及逸度因子 §4.5 拉乌尔定律和亨利定律 §4.6 理想液态混合物 §4.7 理想稀溶液
§4.8 活度及活度因子 §4.9 稀溶液的依数性
标准态 kb,B ( p p )
实际溶液 pB - bB 关系曲线
pB
O
b
上一内容 下一内容 回主目录
bB
返回
2020/8/23
4.7 理想稀溶液
理想稀溶液中溶质的化学势
B(溶 质)
0 B(溶 质)
物理化学4 多组分体系热力学 1

几点说明
(1)偏摩尔量只对体系中某组分才具有的,对整体而 言无所谓偏摩尔量的概念; (2)只有体系的广度性质才有偏摩尔量(质量除外) ; (3)偏摩尔量本身是强度性质; (4)注意右下角标的条件; (5)任何偏摩尔量都是T、p、组成的函数; (6)纯物质的偏摩尔量就是摩尔量; (7)偏摩尔量可能是负值。 (8)偏摩尔量是1mol B对整体热力学性质的贡献量, 而不应该理解为它在混合体系中所具有的量。
分类
气态混合物:空气 混合物液态混合物:甲醇 + 乙醇 固态混合物:Cu + Ni 气态溶液:萘溶解于高压CO 2中 非电解质溶液:糖水 − − − 本章 溶液液态溶液 电解质溶液:盐水 - - -电化学 固态溶液:单体溶解于聚合物中 − − − 又称固溶体
§4-2 化学势 化学势μ μB
• 4-2-1 化学势定义 • 4-2-2 平衡判据与平衡条件 • 4-2-3 理想气体的化学势表达式
4-2-1 化学势定义
混合物或溶液中,组分B的偏摩尔吉布斯函数 GB在化学热力学中有特殊的重要性,又把它叫 做化学势,用符号μB表示。
∂G µ B = GB = ∂nB T , p ,nc≠B
dX = ∑ X B dnB
B =1 k
( 2)
• 可得Gibbs-Duhem方程:
∑ n dX
B B=1
k
B
=0
∑ x dX
B B=1
k
B
=0
Gibbs-Duhem方程的意义: (1) 某一偏摩尔量的变化可从其它偏摩尔量的变 化中求得。 (2) 对一个含有K个组分的均相体系,K个偏摩 尔量Xi中,只有 K-1个是独立的。
如果在溶液中不按比例地添加各组分,则溶液浓 度会发生改变,这时各组分的物质的量和偏摩尔量均 会改变。 根据集合公式
物理化学 第四章 多组分系统热力学

Vm
T,p一定
V*m,C VC
V*m,B VB
d c· b·
0 B
a xC
C
图4.1.2 二组分液态混合物的 偏摩尔体积示意图
若B,C形成真实液态混合物: 则混合物体积为由V*m,B至V*m,C的曲线。对于任一 组成a时,两组分的偏摩尔体积可用下法表示: 过组成点a所对应的系统体积点d作Vm-xC曲线的 切线,此切线在左右两纵坐标上的截距即分别 为该组成下两组分的偏摩尔体积VB,VC。
B
系统中各广度量的偏摩尔量: 对于多组分系统中的组分B,有: 偏摩尔体积: VB=(ƽV/ƽnB)T,p,n C 偏摩尔热力学能: UB=(ƽU/ƽnB)T,p,n C 偏摩尔焓: HB=(ƽH/ƽnB)T,p,n C 偏摩尔熵: SB=(ƽS/ƽnB)T,p,n C 偏摩尔亥姆霍兹函数:AB=(ƽA/ƽnB)T,p,n C 偏摩尔吉布斯函数: GB=(ƽG/ƽnB)T,p,n
C
几点说明: (1)偏摩尔量为两个广度性质之比,所以为强度 性质; (2)偏摩尔量的定义中明确是在恒温、恒压及系 统组成不变的条件下,偏导数式的下标为T,p 时才是偏摩尔量; (3)同一物质在相同温度、压力但组成不同的多 组分均相系统中,偏摩尔量不同; (4)若系统为单组分系统,则该组分的偏摩尔量 与该组分的摩尔量相等,即: XB=X*B,m
C
=VB (数学知识:二阶偏导与求导的顺序无关) 得证。
4.2化学势 4.2化学势
1.化学势的定义 混合物(或溶液中)组分B的偏摩尔吉布斯函数GB 定义为B的化学势,用符号μB表示:
μB = GB=(ƽG/ƽnB)T,p,n
def
C
对于纯物质,其化学势等于它的摩尔吉布斯函 数。
04多组分体系热力学

B
B
吉布斯–杜亥姆方程
xBdXB 0
B
二元系统: xAdX A xBdXB 0
Gibbs-Duhem公式可以表明在温度、压力恒定下,混合物的组 成发生变化时,各组分偏摩尔量变化的相互依赖关系。某一偏 摩尔量的变化可从其它偏摩尔量的变化中求得,即一组分的偏 摩尔量增大,另一组分的偏摩尔量就减小,且增大或减小的比 例与混合物中两组分的摩尔分数成反比。
( nB
)T , p,nC (CB)
B
3.偏摩尔量的测定法举例
以二组分体系的偏摩尔体积为例,说明 测定偏摩尔量的方法原理
Vm
V n1 n2
n1V1,m n2V2,m n1 n2
X1V1,m
X V2 2,m
偏摩尔量的实验测定
以偏摩尔体积为例:
T、P一定,向物质的量 为nC的液体C中,不断 加入B形成混合物,以混 合物体积V和B的物质的 量nB作图。图中任一点 作曲线的切线,其斜率
适用于只做体积功时的任何可逆或不可逆过程:包括封闭或开 放的多组分多相系统发生PVT变化、相变化和化学变化过程。
3.化学势判据及应用举例
dG SdT Vdp B ( )dnB ( )
B
适用于恒温恒压
下封闭系统只做
B ( )dnB ( ) 0
B
体积功时相变化 和化学变化的平
衡判据
dAT ,V dGT , p
混合物中对体积的贡献量VB,等于在无限大量该组成的 混合物中加入单位物质的量的B(混合物组成未变)引起系
统体积的增加值,也等于在有限量的该组成的混合物中
加入dnB的B (混合物组成未变)引起系统体积增加量dV折
合成加入单位物质的量的B时的增量,称为物质B的偏摩
04章 多组分系统热力学及其在溶液中的应用

– 数值上等于每 100g 溶液中所含溶质的 克数(无量纲)。
在溶液中,表示溶质浓度的方法有:
(4)溶质B的当量浓度
组分 B的当量浓度:NB(N),每升溶液含B
的当量数(在分析化学中常用)。
• 物理化学中最常用的溶液浓度表示法为: – 摩尔分数(xB); – 质量摩尔浓度(mB); – 质量分数 ( WB) ;重量百分数( WB )。
§4.1 引言
多组分系统 两种或两种以上的物质(或称为组分)所形 成的系统称为多组分系统。 多组分系统可以是均相的,也可以是多相的。
混合物(mixture) 多组分均匀系统中,各组分均可选用相同的方 法处理,有相同的标准态,遵守相同的经验定律, 这种系统称为混合物。
混合物有气态、液态和固态之分。
溶体
若固体的晶型在温度变化范围内不变,则 溶解度-温度变化曲线是光滑连续的;
若在某温度点发生晶型转变,则在该温度 处其溶解度会突变,溶解度-温度曲线不连 续。
注意:
• 溶液中的所谓溶质和溶剂也是相对的。习 惯上: – 气体或固体溶于液体中时,后者称为溶 剂,前者称为溶质; – 如果是液体溶于液体时,量多者为溶剂, 量少者为溶质。
• 要确定该体系的强度性质(如密度),也 须规定各组分的浓度。
• 由此需要引入一个新的概念 —— 偏摩尔量
§4.3 偏摩尔量
多组分系统与单组分系统的差别
单组分系统的广度性质具有加和性
若1 mol单组分B物质的体积为
V* m,B
则2 mol单组分B物质的体积为
2
V* m,B
而1 mol单组分B物质和1 mol单组分C物质混合,
系统中任一容量性质Z(代表V,U,H,S, A,G等)除了与温度、压力有关外,还与各
在溶液中,表示溶质浓度的方法有:
(4)溶质B的当量浓度
组分 B的当量浓度:NB(N),每升溶液含B
的当量数(在分析化学中常用)。
• 物理化学中最常用的溶液浓度表示法为: – 摩尔分数(xB); – 质量摩尔浓度(mB); – 质量分数 ( WB) ;重量百分数( WB )。
§4.1 引言
多组分系统 两种或两种以上的物质(或称为组分)所形 成的系统称为多组分系统。 多组分系统可以是均相的,也可以是多相的。
混合物(mixture) 多组分均匀系统中,各组分均可选用相同的方 法处理,有相同的标准态,遵守相同的经验定律, 这种系统称为混合物。
混合物有气态、液态和固态之分。
溶体
若固体的晶型在温度变化范围内不变,则 溶解度-温度变化曲线是光滑连续的;
若在某温度点发生晶型转变,则在该温度 处其溶解度会突变,溶解度-温度曲线不连 续。
注意:
• 溶液中的所谓溶质和溶剂也是相对的。习 惯上: – 气体或固体溶于液体中时,后者称为溶 剂,前者称为溶质; – 如果是液体溶于液体时,量多者为溶剂, 量少者为溶质。
• 要确定该体系的强度性质(如密度),也 须规定各组分的浓度。
• 由此需要引入一个新的概念 —— 偏摩尔量
§4.3 偏摩尔量
多组分系统与单组分系统的差别
单组分系统的广度性质具有加和性
若1 mol单组分B物质的体积为
V* m,B
则2 mol单组分B物质的体积为
2
V* m,B
而1 mol单组分B物质和1 mol单组分C物质混合,
系统中任一容量性质Z(代表V,U,H,S, A,G等)除了与温度、压力有关外,还与各
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
多 组 分 单 相 系 统
混合物
聚集
状态
气态混合物 液态混合物 √ 固态混合物
溶液
聚集 状态
液态溶液 √ 固态溶液
导电 性能
电解质溶液 非电解质溶液 √
本章只讨论混合物及非电解质溶液。
§ 4.1 偏摩尔量
一、问题的提出
结果: 恒温、恒压下混 合后,混合物的体积 不等于混合前纯组分 体积之和。 一般来说,真实液态混合物 在混合前后体积发生变化
x dX
B B
B
0
xAdX A xBdX B 0
Gibbs-Duhem公式可以表明在温度、压力恒定下,混
合物的组成发生变化时,各组分偏摩尔量变化的相互依赖
关系。
四、同一组分的各种偏摩尔量之间的关系
对纯物质或组成不变的系统: H=U+pV A=U-TS G=H-TS =U+pV -TS=A+pV
n
B B
B
nBGB
=B 化学势
偏摩尔吉布斯函数
三、吉布斯–杜亥姆Gibbs-Duhem方程
X X (T , p, nB , nC , )
X X X dX d T d p dnB B nB T , p , n T p ,nB ,nC. . . . p T ,nB ,nC. . . . C
B
B
( )dnB ( ) 0
化学势判据
1、化学势判据
B
B
( )dnB ( ) 0
< 自发 相平衡 = 平衡 化学平衡
2、化学势判据的应用:
举例:化学势在相ห้องสมุดไป่ตู้衡中的应用
dnB ( ) dnB ( )
B
B
( )dnB ( )
恒T、恒p且W´=0 因此,物质总是
§4.2
一、化学势的定义:
化学势
混合物(或溶液)中组分B的偏摩尔吉布斯函数GB定义为
B的化学势
B GB
G ( )T , p ,nC (C B) nB
保持温度、压力和除B以外的其它组分的物质的量不变,体
系的Gibbs函数随组分B的物质的量的变化率。所以化学势就是偏
摩尔Gibbs函数。
* 纯物质的化学势即为其摩尔吉布斯函数: mB = G m, B。
B
d H TdS Vdp B dnB dU TdS pdV B dnB
B B
B
G B n B
A n T , p ,nC B
H n T ,V ,nC B
U n S , p ,nC B
B
d H TdS Vdp B dnB dU TdS pdV B dnB
B B
B
这是一组适用于均匀系统的更为普遍的热力学基本方程, 不仅适用于变组成的封闭系统,也适用于开放系统。
dG SdT Vdp B dnB
d A SdT pdV B dnB
V n V
* B m, B
n V
* C m ,C
这说明真实多组分系统的体积与系统中各组分物质的量与该
纯组分的摩尔体积的乘积不再具有加和关系。系统的其他广度量
也存在同样的结论。这显然给混合物的研究带来了不方便。
二、偏摩尔量
1、偏摩尔量的定义
对一个由B,C,D,……组成的单相多组分体系,各组分的物质
B
B
dG SdT Vdp B ( )dnB ( )
B
适用于封闭的多组分多相系统发生pVT变化、相变化和化学 变化过程,当然也适用于开放系统。
3、化学势判据及应用举例
dG SdT Vdp B ( )dnB ( )
B
dGT , P 0
θ 该状态下的化学势称为标准化学势,以µ B (g)表示。
对于纯气体,则省略下脚标B。
一、纯理想气体的化学势
今使某纯理想气体B在温度T下由标准压力pθ变为某一压力
θ(g)变成µ *(pg) p,其化学势由µ
B(pg, p ) B(pg, p)
B GB ( G )T , p ,n (CB)
B ( )dnB ( ) B ( )dnB ( )
B ( )dnB ( ) B ( )dnB ( )
( B ( ) B ( ))dnB ( ) 0
dnB ( )<0
B ( ) B ( ) B ( ) B ( )
AB B pVB B p B p T
B VB p T
H B B TS B B T B T p
B B U B AB TS B B p T p T p T
< 自发 = 平衡
从化学势高的向化学
势低的相迁移,直至 组分在其所处的相中
化学势相等。
此相变化能自发进行
两相平衡
判断化学势的大小
1)25°C、101325Pa条件下:
H O ( g )
2
> H O (l )
2
2)固体蔗糖与相同条件下不饱和蔗糖水溶液中的蔗糖
蔗糖 ( s )
>
蔗糖 (不饱和水溶液)
X n B T , p , nC
2、偏摩尔量的物理含义: 偏摩尔量XB是在恒温、恒压及除组分B以外其余各组分的物
质的量均保持不变的条件下,系统广度量X随组分B的物质的量的
变化率
3、偏摩尔量的加和公式
X nB X B
B
X XB n B T , p , nC
3)固体蔗糖与相同条件下过饱和蔗糖水溶液中的蔗糖
蔗糖 ( s )
<
蔗糖 (过饱和水溶液)
§4.3
气体组分的化学势
物质B的化学势即其偏摩尔吉布斯函数,因为吉布斯函数
没有绝对值,所以化学势也无绝对值。因此,在表示化学势 时必须规定一个标准(标准化学势)。
气体的标准态是在标准压力pθ=100KPa下,具有理想 气体性质的纯气体。对温度没有规定。
多组分单相系统 :由两种或两种以上物质分子水平上混合而
成的均匀系统 多组分单相系统按照处理方法的不同分为: 混合物 (mixture) : 对于混合物中每种组分选用同样的标准态 加以研究 溶 液 (solution): 将组分区分为溶剂(solvent) 和溶质(solute), 且对二者选用不同的标准态加以研究
系统的各热力学函数则由偏摩尔量的加和公式得到。
二、多相多组分系统的热力学基本方程
1、 单相多组分系统
G G( T , p , nB , nC , n D )
dG SdT Vdp
G G G dG d nB dT dp B nB T , p , n T p , nB p T ,nB C
G S T p , nB G V p T ,nB
dG
SdT Vdp BdnB
B
1、 单相多组分系统 热力学基本方程:
dG SdT Vdp B dnB
d A SdT pdV B dnB
G p V T
G S T p
对多组分系统,偏摩尔量之间同样有上述关系: HB=UB+pVB AB=UB-TSB
G B p
GB=HB-TSB=AB+pVB
VB T
G B SB T p
nc表示除B组分外,其他各组分的物质的量保持不变。
X X X dX dT dp dnB B nB T , p , n T p ,nB ,nC. . . p T ,nB ,nC. . . C
偏摩尔量
XB
def
def
多组分系统的广度量X为系统各组分的物质的量与其偏摩尔量 XB乘积的加和。
V n V
* B m, B
n V
* C m ,C
各组分的摩尔体积
V nBVB nCVC
各组分的偏摩尔体积
偏摩尔量: 4、对XB理解应注意的几点
XB
def
X n B T , p , nC
nB
C
(g)
* (pg)
对于纯物质:
* * Gm
d * dGm * S m * dT Vm *dp Vm * dp
(pg) (g)
HB=UB+pVB
AB=UB-TSB
G B p
GB=HB-TSB=AB+pVB
VB T
G B SB T p
化学势是最重要的热力学函数之一,系统中其它偏摩尔 量均可通过化学势、化学势的偏导数或它们的组合表示:
B SB T p
的量分别为nB, nc, nD, ….. 。对系统任一广度量X:
X X (T , p, nB , nC , )
X X X dX dT dp dnB B nB T , p , n T p ,nB ,nC. . . p T ,nB ,nC. . . C
def
U H A S G
n
B B
B
UB
UB
U ( )T , p , nC (C B ) nB H )T , p , nC (C B) nB
