分子动理论气体分子平均动能
分子动理论气体分子平均动能
32 103 26 m 5 . 31 10 kg 23 N A 6.02 10 (3)
3 3 k kT 1.38 10 23 ( 27 273) 6.21 10 21 J 2 2
3 – 3 理想气体分子的平均平动动能与温度的关系
第三章气体动理论
子数相等。
分子数 密度
k=R/NA=1.38×10-23J· K-1
称为玻耳斯曼常量
3 – 3 理想气体分子的平均平动动能与温度的关系
第三章气体动理论
二、理想气体分子的平均平动动能与温度的关系
阿伏加德罗定律:
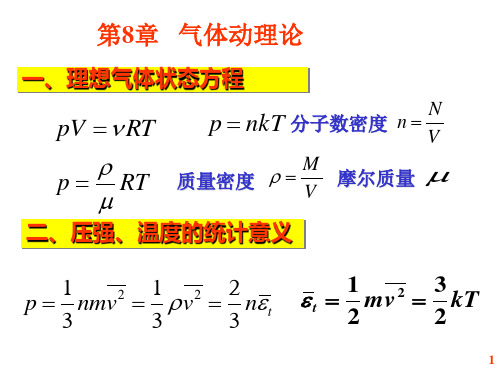
p nkT
2 1 2 理想气体压强公式 p n mv 3 2 1 3 2 k m v kT 分子平均平动动能 2 2
容器内不同气体的温度相同分子的平均平动动能也相同即kknkk?????????????????21而分子数密度满足????inn故压强为??????????????????????????????????????????????ikiikikikpnnnnp????????32323232即容器中混合气体的压强等于在同样温度体积条件下组成混合气体的各成分单独存在时的分压强之和
例 利用理想气体的温度公式说明Dalton 分压定律。
解:容器内不同气体的温度相同,分子的平均平动动能也 相同,即
k1 k 2 kn k
而分子数密度满足
n ni
故压强为 2 2 2 2 P n k ni k ni k ni ki Pi 3 3 3 3 即容器中混合气体的压强等于在同样温度、体积条件下组成 混合气体的各成分单独存在时的分压强之和。这就是Dalton 分压定律。
分子热运动理论与气体的平均动能计算方法

分子热运动理论与气体的平均动能计算方法分子热运动理论是描述气体分子运动规律的理论模型。
根据这一理论,气体分子以高速不规则运动,并具有随机的碰撞,从而产生了气体的性质。
通过分子热运动理论,可以计算出气体的平均动能。
本文将介绍分子热运动理论的基本原理,并详细讨论气体平均动能的计算方法。
一、分子热运动理论的基本原理分子热运动理论是基于统计物理学的原理,通过对大量气体分子运动的统计分析,得出了一系列关于气体性质的理论结论。
它的基本假设包括:1. 气体分子是微观粒子,其直径远小于气体容器的尺寸;2. 气体分子之间相互碰撞,碰撞时没有能量的损失;3. 气体分子之间相互碰撞是完全随机的;4. 气体分子的运动速度符合高斯分布。
根据这些基本假设,分子热运动理论推导出了许多关于气体性质的数学表达式,其中包括气体的平均动能计算方法。
二、气体的平均动能计算方法气体的平均动能是指气体分子的平均动能,可以表示为气体分子速度平方的平均值。
根据分子热运动理论,可以通过下列公式来计算气体的平均动能:平均动能 = (1/2)m·v²其中,m是气体分子的质量,v是气体分子的速度。
对于单原子气体,每个气体分子只有一个质点,其动能只有平动动能,由此可得出公式:平均动能 = (3/2)kT其中,k是玻尔兹曼常数,T是气体的绝对温度,单位均为国际单位制(SI单位制)。
对于多原子气体,由于分子能够既有平动动能又有转动动能,在计算平均动能时需要考虑这两部分动能的贡献。
根据分子热运动理论,可以将多原子气体的平均动能计算分为两个部分:1. 平动动能的计算:平动动能 = (3/2)kT该部分动能是由气体分子的平动运动引起的,与分子的转动无关。
2. 转动动能的计算:对于涉及转动的分子,转动动能可以表示为:转动动能 = (1/2)Iω²其中,I是转动惯量,ω是分子的角速度。
通过将平动动能和转动动能相加,即可得出多原子气体的平均动能。
气体分子平均平动动能大小的量度

气体分子平均平动动能大小的量度
平均平动动能:ε=3kT/2。
其中:玻尔兹曼恒量k=1.38×10^-23J/K,T是人力学温标,换算关系为T(K)=t(℃)+273.15。
气体的温度是分子平均平动动能的量度是正确的。
从气体动理论的观点来看,理想气体是最简单的气体,其微观模型有三条假设:
1、分子本身的大小比分子间的平均距离小得多,分子可视为质点,它们遵从牛顿运动定律。
2、分子与分子间或分子与器壁间的碰撞是完全弹性的。
3、除碰撞瞬间外,分子间的相互作用力可忽略不计,重力的影响也可忽略不计。
因此在相邻两次碰撞之间,分子做匀速直线运动。
单个分子在一次碰撞中对器壁上单位面积的冲量。
气体平均平动动能公式和分子平均平动动能

气体平均平动动能公式和分子平均平动动能气体是由大量分子组成的物质,这些分子不断地做无规律的热运动。
在热学中,我们常常关注气体内部的平均平动动能,这对于研究气体性质和行为具有重要意义。
本文将从气体平均平动动能公式和分子平均平动动能两个方面展开讨论。
一、气体平均平动动能公式1.1 动能的定义在物理学中,动能是描述物体运动状态的物理量,它与物体的质量和速度有关。
对于气体内部的分子而言,它们具有的平均平动动能可以通过以下公式来表示:\[KE_{avg} = \frac{3}{2} kT\]其中,\(KE_{avg}\)表示气体分子的平均平动动能,\(k\)是玻尔兹曼常数,\(T\)是气体的绝对温度。
1.2 推导过程这个公式的推导过程可以通过统计力学的方法进行。
由分子动能定理可知,一个分子的平均平动动能大小与温度成正比。
而对于气体而言,由于分子具有三个独立的平动方向,因此气体分子的平均平动动能为3kT。
气体内部所有分子的平均平动动能可以表示为3kT的总和,即\(KE_{avg} = \frac{3}{2} kT\)。
1.3 公式意义这个公式的意义在于,它揭示了气体分子的平均平动动能与温度之间的关系。
从宏观角度来看,气体的温度越高,分子的平均平动动能就越大,这也说明了温度对气体热运动的影响。
二、分子平均平动动能2.1 分子速度的分布气体分子的速度分布是描述气体分子热运动状态的重要物理量。
根据麦克斯韦-玻尔兹曼分布律,气体分子在热平衡状态下的速度分布可以用以下公式来表示:\[f(v) = \sqrt{\frac{m}{2\pi kT}} e^{-\frac{mv^2}{2kT}}\]其中,\(f(v)\)表示速度为\(v\)的分子的概率密度函数,\(m\)为分子的质量,\(k\)为玻尔兹曼常数,\(T\)为气体的绝对温度。
2.2 分子平均平动动能气体分子的平均平动动能可以通过速度分布函数来进行求解。
根据统计力学的理论,气体分子的平均平动动能可以表示为:\[KE_{avg} = \int_0^\infty \frac{1}{2}mv^2 f(v) dv\]将速度分布函数带入上式,可以得到气体分子的平均平动动能。
理想气体与气体状态方程的推导

理想气体与气体状态方程的推导理想气体指的是在常温常压下服从理想气体状态方程的气体。
理想气体状态方程描述了理想气体的物理性质与状态,它是气体物理学中的基本方程之一。
1. 理想气体的假设理想气体的状态方程的推导基于以下假设:(1)气体分子之间相互作用力可以忽略不计;(2)气体分子的体积可以忽略不计。
2. 推导过程假设一个理想气体的体积为 V,温度为 T,压强为 P,气体的物质量为 m,分子数为 N。
根据状态方程推导的基本原理,可以得到以下推导过程:步骤一:分子动理论根据分子动理论,气体分子的平均动能与温度成正比,即:1/2 m v^2 = k_B T其中,m 为气体分子的质量,v 为分子的速率,k_B 为玻尔兹曼常数。
步骤二:气体分子的动量公式根据气体分子动量的定义,可以得到:p = m v其中,p 为气体分子的动量。
步骤三:气体分子的动能公式将步骤一和步骤二的结果结合,可以得到气体分子的动能公式:1/2 p^2/m = k_B T步骤四:单位体积的分子数假设单位体积内的分子数为 n,总分子数 N 可以表示为:N = n V步骤五:单位体积的分子动能将步骤三的结果乘以单位体积内的分子数 n,可以得到单位体积的分子动能:1/2 n p^2/m = n k_B T步骤六:单位体积的动能密度单位体积的动能密度可以表示为单位体积的分子动能除以单位体积:E = 1/2 n p^2/m V = n k_B T步骤七:单位体积的动能密度与内能的关系内能 U 是单位体积的动能密度乘以体积 V:U = n k_B T V步骤八:理想气体状态方程的推导根据理想气体状态方程的定义,内能与温度成正比,压强与温度成正比,体积与温度成反比,可以得到:U ∝ TP ∝ TV ∝ 1/T将步骤七的结果代入上述关系式,可以得到理想气体状态方程:P V = n k_B T3. 总结理想气体与气体状态方程的推导基于理想气体的假设,通过分子动理论和动量公式的推导,最终得到了理想气体状态方程 P V = n k_B T。
分子动理论知识点总结

分子动理论知识点总结分子动理论知识点总结11.分子动理论(1)物质是由大量分子组成的分子直径的数量级一般是10-10m。
(2)分子永不停息地做无规章热运动。
①扩散现象:不同的物质相互接触时,可以彼此进入对方中去。
温度越高,扩散越快。
②布朗运动:在显微镜下看到的悬浮在液体(或气体)中微小颗粒的无规章运动,是液体分子对微小颗粒撞击作用的不平衡造成的,是液体分子永不停息地无规章运动的宏观反映。
颗粒越小,布朗运动越明显;温度越高,布朗运动越明显。
(3)分子间存在着相互作用力分子间同时存在着引力和斥力,引力和斥力都随分子间距离增大而减小,但斥力的改变比引力的改变快,实际表现出来的是引力和斥力的合力。
2.物体的内能(1)分子动能:做热运动的分子具有动能,在热现象的讨论中,单个分子的动能是无讨论意义的,重要的是分子热运动的平均动能。
温度是物体分子热运动的平均动能的标识。
(2)分子势能:分子间具有由它们的相对位置决断的势能,叫做分子势能。
分子势能随着物体的体积改变而改变。
分子间的作用表现为引力时,分子势能随着分子间的距离增大而增大。
分子间的作用表现为斥力时,分子势能随着分子间距离增大而减小。
对实际气体来说,体积增大,分子势能增加;体积缩小,分子势能减小。
(3)物体的内能:物体里全部的分子的动能和势能的总和叫做物体的内能。
任何物体都有内能,物体的内能跟物体的温度和体积有关。
(4)物体的内能和机械能有着本质的区分。
物体具有内能的`同时可以具有机械能,也可以不具有机械能。
3.转变内能的两种方式(1)做功:其本质是其他形式的能和内能之间的相互转化。
(2)热传递:其本质是物体间内能的转移。
(3)做功和热传递在转变物体的内能上是等效的,但有本质的区分。
4.★能量转化和守恒定律5★.热力学第肯定律(1)内容:物体内能的增量(U)等于外界对物体做的功(W)和物体汲取的热量(Q)的总和。
(2)表达式:W+Q=U(3)符号法那么:外界对物体做功,W取正值,物体对外界做功,W取负值;物体汲取热量,Q取正值,物体放出热量,Q取负值;物体内能增加,U取正值,物体内能减削,U取负值。
气体的分子速率与平均动能计算

气体的分子速率与平均动能计算气体是由大量分子组成,分子以高速不规则运动着。
本文将探讨气体分子的速率以及如何计算气体的平均动能。
一、气体分子的速率气体分子的速率是指分子在气体中运动的速度。
根据动理论,气体分子的速率服从Maxwell-Boltzmann速度分布曲线。
Maxwell-Boltzmann速度分布曲线描述了不同速率下分子数的分布情况。
为了更好地理解气体分子的速率分布,我们可以引入分子平均速率的概念。
分子平均速率是指所有分子速率的平均值,可以通过以下公式计算:平均速率 = 总速率 / 分子数其中,总速率是所有分子速率的总和,分子数是气体中的分子总数。
通过计算分子平均速率,我们可以更好地描述气体分子的运动情况。
二、气体分子的平均动能气体分子的平均动能是指同一温度下的气体分子平均的动能大小。
根据动理论,气体分子的动能与其速率有关。
分子的动能可以通过以下公式计算:动能 = 1/2 * m * v^2其中,m是分子的质量,v是分子的速率。
通过计算所有分子的动能,并求其平均值,就可以得到气体分子的平均动能。
三、气体的平均动能计算示例假设我们有一瓶装有氢气(H2)的容器,温度为300K。
我们可以通过以下步骤计算气体分子的平均动能:1. 确定氢气分子的质量。
根据元素周期表,氢的相对原子质量为1。
由于氢气分子由两个氢原子组成,因此氢气的相对分子质量为2。
2. 计算气体分子的速率。
根据Maxwell-Boltzmann速度分布曲线,我们可以获得不同速率下分子数的分布情况。
然后,根据公式计算分子平均速率。
3. 计算气体分子的动能。
根据上述公式,将氢气分子的质量和速率代入,计算每个分子的动能。
然后,求得所有分子动能的总和。
4. 计算气体分子的平均动能。
将总动能除以分子数,即可得到气体分子的平均动能。
通过以上步骤,我们可以计算出气体分子在给定温度下的平均动能。
结论本文讨论了气体分子速率与平均动能的计算方法。
了解气体分子的速率分布以及平均动能有助于我们更好地理解气体分子的性质和行为。
气体动理论公式总结
1.自由度i=t+r
单原子分子 i=t=3
刚性双原子 i=t+r=3+2 刚性三原子i=t+r=3+3
2.分子平均平动动能
t
t 2
kT
3 2
kT
3.分子平均转动动能
r
r 2
kT
4.分子平均动能
k
i kT 2
5.气体内能
E
i RT
2
i pV 2
2
四、麦克斯韦速率分布律
1.速率分布函数: f (v) dN Ndv
3、均匀带电无限长直导线
E 2 0 r
4.半径为R的均匀带电球面
E外
q
4 0r 2
E内 0
q
q
U外 4 0r U内 40R
5.无限大均匀带电平面
E
2 0
15
七、静态平衡时的导体 1. 导体内部场强为0。导体表面附近场强方向与导
体表面垂直。 2.导体为等势体(电势处处相等)。
3. 导体内无电荷,所有电荷分布于表面。
(1)
D dS q0 电场的高斯定律
(2)
E dl
L
S
B
d
S
电 场 的
环路定理
t
(变化的磁场激发电场)
(3) B d S 0
磁场的高斯定律
(4)
S
H dl
L
Ic
d D
dt
Ic
D dS t
磁 场 的 环 路 定 理 (变化的电场激发磁场)
27
第13 章量子物理
一、黑体辐射
v2 b v2 f (v)dv / b f (v)dv
a
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
4)气体分子运动的方均根速率
——分子速率的一种统计平均值
k
1 m 2
2
3 2
kT
2 3kT 3kN AT
m
mN A
3 R度下,不同气体 的平均平动动能相同,但方 均根速率不同!
讨论
一瓶氦气和一瓶氮气密度相同,分子平均平动动 能相同,而且它们都处于平衡状态,则它们
(A)温度相同、压强相同。
(B)温度、压强都不同。
(C)温度相同,但氦气的压强大于氮气的压强.
(D)温度相同,但氦气的压强小于氮气的压强.
解
p nkTNkTkT
V
m
m (N 2)m (H)e p(N 2)p(H)e
(2)
(3)mN A63 .0 2 2 110 3 2035.3 110 2k 6 g
k 2 3 k T 2 3 1 .3 1 8 20 3 ( 2 2 7) 7 6 .2 3 1 1 20 J 1
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
例 利用理想气体的温度公式说明Dalton 分压定律。
解:容器内不同气体的温度相同,分子的平均平动动能也 相同,即
k1k2k n k
而分子数密度满足
nni
故压强为
2 2
P 3 n k 3
n i k 3 2 n i k 3 2 n i k iP i
即容器中混合气体的压强等于在同样温度、体积条件下组成 混合气体的各成分单独存在时的分压强之和。这就是Dalton 分压定律。
NnV pV kT
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
例 一容器内贮有氧气,压强为P=1.013×105Pa,温 度t=27℃,求(1)单位体积内的分子数;(2)氧分 子的质量;(3)分子的平均平动动能。 解:
(1)有P=nkT
n k P T 1 .3 8 1 1 .0 2 0 3 1 1 25 3 0 7 27 2 .3 4 5 120 m 5 3
理想气体压强公式 分子平均平动动能
p 2n 1mv2
3 2
k
1mv2 2
3kT 2
微观量的统计平均值
宏观可测量量
温度的统计意义
该公式把宏观量温度和微观量的统计平均值(分子的平 均平动动能)联系起来,从而揭示了温度的微观本质。
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
平均效果的物理量。
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
3-3 理想气体的温度公式
一、理想气体状态方程的分子形式
设一个分子的质量为m,质量为m’的理想气体的分
子数为N,1摩尔气体的质量为M,则m’=Nm,
M=NAm。代入理想气体的物态方程
pV m RT pV mNRT NRT
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
在相同温度下,由两种不同分子组成的混合气体,它 们的方均根速率与其质量的平方根成正比
12m1v12 12m2v22
v
2 1
m2
v
2 2
m1
据此可设计过滤器来分离同位素,例235U, 238U
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
温度 T 的物理意义
k
1mv2 2
3kT 2
1) 温度是分子平均平动动能的量度 k T
(反映热运动的剧烈程度).
2)温度是大量分子的集体表现,个别分子无意义.
3)在同一温度下,各种气体分子平均平动动能均 相等。
注意
热运动与宏观运动的区别:温度所反 映的是分子的无规则运动,它和物体的整
体运动无关,物体的整体运动是其中所有 分子的一种有规则运动的表现.
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
例 理想气体体积为 V ,压强为 p ,温度为 T , 一个分子 的质量为 m ,k 为玻尔兹曼常量,R 为摩 尔气体常量,则该理想气体的分子数为:
(A) pV m (C) pV(RT)
(B)pV(kT)
(D)pV(mT)
解 pnkT
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
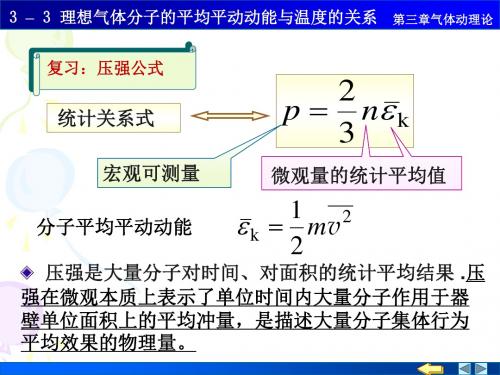
复习:压强公式
统计关系式
p
2 3
n k
宏观可测量
微观量的统计平均值
分子平均平动动能
k
1 mv2 2
压强是大量分子对时间、对面积的统计平均结果 .压
强在微观本质上表示了单位时间内大量分子作用于器
壁单位面积上的平均冲量,是描述大量分子集体行为
M P N R T
mNA 在相同N温A度和压强
p nkT 下,各种理想气体
V NA
在相同的体积内分
子数相等。
分子数 密度
k=R/NA=1.38×10-23J·K-1
称为玻耳斯曼常量
3 – 3 理想气体分子的平均平动动能与温度的关系 第三章气体动理论
二、理想气体分子的平均平动动能与温度的关系
阿伏加德罗定律: p nkT
