第三章 烯烃和炔烃
大学有机化学 烯烃和炔烃PPT优质课件

C + Br
C
极性 Br
C
Bδr+
δBr
慢
C B+r + Br-
C
C
π- 络合物
.
σ- 络合物 (溴鎓离子)
第二步: 背面
Br
Br- +
C B+r
快
C
C
C
Br
.
第三章 烯烃和炔烃 第一节 烯烃 (三、烯烃的性质)
2. 加卤化氢 (HX)
X
C C + HX
CC
H
烯烃与卤化氢同样发生分步的、亲电性加成反应
.
3个sp2杂化轨道取平面正
三角形分布,与未杂化的
p 轨道垂直。sp2 杂化轨
道之间的夹角为 120o.
第三章 烯烃和炔烃 第一节 烯烃 (一、烯烃的结构)
头碰头重叠形成C—Cσ 键
键: 284 kJ/mole
.
肩并肩重叠形
成键,重叠
程度较小, 键 较不牢固,不 能自由旋转。
键键能 357kJ/mole
第三章 烯烃和炔烃
第一节 烯 烃
一 烯烃的结构 二 命名和异构 三 烯烃的性质 四 共轭烯烃
第二节 炔 烃
一 炔烃的结构 二 异构和命名 三 炔烃的性质
.
第三章 烯烃和炔烃
第三章 烯烃和炔烃
(Alkenes and Alkynes)
分子中含C=C双键的叫烯烃; 而含C≡C叁键的叫炔烃。烯烃 和炔烃都是不饱和烃 (Unsaturated hydrocarbons)。
.
诱导效应: 多原子分子中,由于原子和基团电负性的不同,引起 键的极性并通过通过静电诱导作用依次影响分子中不 直接相连的键,使之发生极化,从而引起整个分子中 电子云分布发生改变的作用。用符号 I 表示。
烯烃和炔烃的命名

CH2CH3
2 CH3HC CH C CCH3
.
CH3
•如双键位置在第一个碳上,双键位置数据可省.
CH3
32 1
CH3CCH=CH2
C4 H2C5 H3
1
23 4 5 6
(CH3)2C=CHCH2CHCH3
CH3
3,3-二甲基-1-戊烯
2,5-二甲基-2-己烯
3,3-dimethyl-1-pentene 2,5-dimethyl-2-hexene
烯基:烯烃去掉一个氢,称某烯基,编号从自由价的碳开始。
CH2 CH
CH3CH CH
CH2 CHCH2
普通命名: 乙烯基 IUPAC命名:乙烯基
Vinyl
丙烯基 1-丙烯基 1-propenyl
烯丙基 (allyl) 2-丙烯基 2-propenyl
CH2 C CH3
异丙烯基 isopropenyl
3.1.2 炔烃的异构和命名
CH3CHC CH CH3 3-甲基-1-丁炔
(2) 炔烃的命名 • 系统命名:
炔烃的系统命名法与烯烃相似;以包含叁键在内的最长碳链为 主链,按主链的碳原子数命名为某炔,代表叁键位置的阿拉伯数 字以取最小的为原则而置于名称之前,侧链基团则作为主链上的 取代基来命名.
含有双键的炔烃在命名时,一般 先命名烯再命名炔 .碳
34 5 6 7
CH3CH2CH2-C-CH2CH2CH2CH3 2 CH 1 CH3 3-丙基-2-庚烯
• (2)碳链编号时,应从靠近双键的一端开始; • (3)烯前要冠以官能团位置的数字(编号最小);即双键的
位次写于母体名称之前,并加一短线。n-某烯 • (4)其它同烷烃的命名规则,如取代基位次及名称写于
3章-烯烃和炔烃

H
O H C H H
H C H H C C H H C H H H
H C C H H C H H H
H
1
2
3
4
CH3 H3C
1 H HO H HH C H 3C H H C C C C C
CH2OH * CH3 CH2Cl
2 C H H H H C C H H 3 4
H C
HH H H H Cl H
1) 催化加氢
a. 提高汽油的稳定性
植物油
人造黄油
b. 改良油脂的性质
c. 判断烯烃的稳定性(氢化热的测量)
CH3CH2CH CH2 CH3 H CH3 H C C CH3 C C CH3 H H -115.5 H2 -126.8 kJ/mol -119.7 CH3CH2CH2CH3
故稳定性:反-2-丁烯 > 顺-2-丁烯 > 1-丁烯 同理有: R2C=CR2 > R2C=CHR > RCH=CHR > RCH=CH2 > CH2=CH2
1)定义:分子因共轭而产生的各种效应, 称做共轭效应。 具有单双(重)键交替出现的分 子,称为 共轭分子。如
CH2=CH-CH=CH-CH-CH=CH 2 O
2)特点和表示:
(1)π 键电子是离域的。
(2)共轭效应的影响可沿着共轭体系传递很 远,并出现极性交替现象。如
dCH2
d+
d-
d+
d-
d+
CH
公差为CH2
通式为:CnH2n(n = 2,3,4…..正整数)
1. 乙烯的结构
C原子的sp2 杂化
激发 2px,2py,2pz 2s 2px,2py,2pz
第三章-烯烃、炔烃、二烯烃

以反式加成产物为主
Br
Br
CH2 CH2 + Br2 NaCl水溶液 CH2 CH2 + CH2 CH2
Br
Cl
亲电试剂:试剂带有正电荷,或者电子云密度较低,在
反应中进攻反应物上带部分负电荷的位置,这种试剂叫
做亲电试剂,例如X+(卤素)、R+、H +等。详见课本 P54-56。
亲电加成反应:由亲电试剂进攻而引起的加成反应。
1埃 = 0.1纳米(nm) = 10-10米(m)
1
键的特点: 1.成键原子不能绕两核连线自由旋转。
2.键比键易断裂。
3.电子云易极化。
PS:极化(polarization),指事物在一定条件下发生两极 分化,使其性质相对于原来状态有所偏离的现象
烯烃的同分异构
构造异构:碳链异构;官能团位置异构 构型异构:顺反异构 (几何异构or立体异构)
链终止 CH3CH· CH2Br +Br· CH3CHBrCH2Br
注:过氧化物只对HBr有影响,不影响HCl和HI。
诱导效应:受分子中电负性不同的原子或基团的影响,整个分 子中成键的电子云向着一个方向偏移,分子发生极化的效应。
δ+ δ- δ+ δH3C CH CH2 + HBr
CH3CHCH2 Br
电负性差别:O:3.5 Cl:3.1 O> Cl
由于次氯酸不稳定,反应中常用氯气和水代替次氯酸
Cl2 + H2O HOCl + HCl
H2C CH2 + Cl2 + H2O
CH2 CH2 OH Cl
(2) 臭氧化反应
O
CH3CH CH2 O3 CH3HC O
第六讲 第三章 不饱和烃:烯烃和炔烃(2)
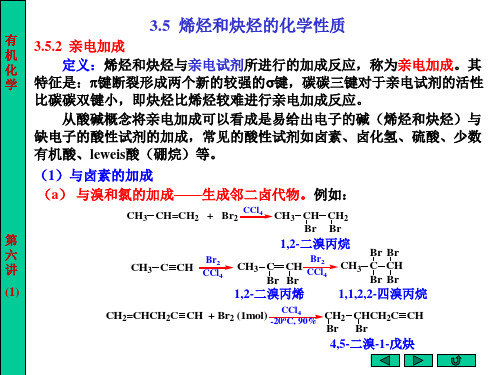
C C
+
H-X
-X -
C=C H
+
+X快
C=C X H
乙烯基碳正离子
由于卤素的吸电子作用, 阶段。 几 1 由于卤素的吸电子作用,反应能控制在加一分子 HX 阶段。 加成, 加成 常用汞盐和铜盐做催化剂。 点 2 与HCl加成,常用汞盐和铜盐做催化剂。 讨 3 与卤化氢的加成,在相应卤离子(如:(CH3 )4N+Cl-)存在下, 与卤化氢的加成,在相应卤离子( 存在下, 论 通常进行反式加成。例如: 通常进行反式加成。例如:
*1. Markovnikov规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 氢原子总是加到含氢较多的双键碳原子上, 氢原子总是加到含氢较多的双键碳原子上,氯原子或其它原子或基团则加 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 例如
CH3CH2CH=CH2 + HBr HAc 80% (CH3)2C=CH2 + HCl CH3CH2CH2CH2Br
~100%
(CH3)2C CH3 Cl
第 六 讲 (6)
*2. 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 Br 例如 (CH3)2CHC CH HBr (CH3)2CHC=CH2 HBr (CH3)2CH C CH3
NaCl CH2=CH2 + Br2 水溶液
Br H2C CH2 Br 1,2-二溴乙烷 二溴乙烷
Cl H2C CH2 Br 1-氯-2-溴乙烷 氯 溴乙烷
有机化学3--- 烯烃和炔烃

3.4 烯烃和炔烃的化学性质
◇ 反应机理和烯烃与卤素的加成相似: 第一步:
第二步:
H X 慢 C C H X
C C
H
X
快
C C
H X
不同的是: 第一步进攻的是H+, 且不生成鎓离子; 第二步X- 的进攻也不一定是反式加成。 ◇ 烯、炔与HX等的加成反应以用于工业生产:
CH2 CH2 HCl AlCl3 130~250℃ CH3CH2Cl
C
Br
速度控制步骤
溴鎓离子
C Br
C
Br
快 Br
Br C C
反式加成产物
3.4 烯烃和炔烃的化学性质
◇ 反应经历溴鎓离子、反式加成。
Br
H C CH 3 C CH3 H Br 2 H3 C H C
+ -
Br H CH 3 H Br
-
H 3C C C
H
C Br
CH 3 CH 3 H C Br C
Br
H2
H
H
C2 H4
H
H
CH2=CH2
H-CH2-CH2-H
3.4 烯烃和炔烃的化学性质
R-C C-R' H2 Pd
R C C
R'
H2 Pd
H
H
RCH2CH2R'
常用催化剂:Pt , Pd , Ni,一般难控制在烯烃阶段。 林德拉(Lindlar)催化剂,一种部分毒化的Pd催化剂,能降 低活性,选择性氢化炔键而不影响烯键,且得顺式烯烃。
同碳数烯烃顺反异构体,因几何形状(结构)不同,物理 性质不同。
CH3 C
H
CH3
H C C
H
有机化学 第三章讲解

CH 2 =CH 2
+ HO Cl
Cl-CH 2 -CH 2 -OH
-氯乙醇
实际操作时,常用氯和水直接反应。例:
Cl CH 2 =CH 2
Cl 2 -Cl
-
CH 2 Cl
+
CH 2
H 2O -H
+
CH 2
CH 2 (主) OH
Cl -
Cl CH 2
-氯乙醇
CH 2 (副) Cl
33
b a CH 3 -CH=CH
CH 3 CH 3 -C CH-CH 3
30
3 碳正离子
。
H
Cl H
重 排 产 物 (主 )
(d) 过氧化物效应
但有过氧化物存在时:
CH 3 -CH=CH
2
+ HBr
hor
过氧化物
CH 3 CH 2 CH 2 Br (反马)
只能是HBr (HCl、HI都不反马)
31
(丙) 与硫酸加成
烯烃与H2SO4的加成反应也是亲电加成反应,加成方向 遵循马氏规则。例:
2
+ HCl
CH 3 -CH-CH Cl
2-氯丙烷 主要产物
乙酸 80%
3
+ CH 3 CH 2 CH 2 Cl
1-氯丙烷 次要产物
CH 3 CH 2 CH=CH
2
+ HBr
CH 3 CH 2 CH CH Br
HBr
2
H
2-溴丁烷
Br
CH 3 CH 2 CH 2 C CH
HBr
CH 3 CH 2 CH 2 C=CH 2 Br
2
(一) 烯烃和炔烃的结构
大学有机化学第三章 烯烃和炔烃

CH3 → CH=CH2 + HX
CH3CH—CH3 X
马代规则是 不对称试剂与双键发生亲电性加成时, 试剂中正电性部分主要加到能形成较稳定正碳离子 的那个双键碳原子上。 + CH3CHCH3 δ+ δ-
CH3—CH=CH2 + H+
HX分子中的氢以H+ 质子形式发生反应,因此称为亲电试剂
CH3CH2CH2
CH3
顺反异构命名与Z .E命名规则不相同,不能混为一 谈,两者之间没有固定的关系
例如:
Cl Cl C=C CH3 H (Z)-1 , 2-二氯丙烯 顺-1 , 2-二氯丙烯 H C H ‖ C H H 大 Br
Cl
C=C
CH3
Cl 大
Cl C COOH ‖ C Br Cl
(E)-1 , 2-二氯-1-溴丙烯 顺--1 , 2-二氯-1-溴丙烯 CH3 C H ‖ C H H
次产物
因此 1.1.1-三氟-3-氯丙烷是主要产物
2. 加硫酸
R-CH=CH2 + HOSO2OH H3PO4 300℃ 7Mpa R-CHCH3 H2O RCH-CH3 OSO2OH OH (间接水化法制备醇) CH3CH2OH
CH2=CH2 + H2O
3. 加卤素
CH2 = CH2 + X2
CH2 = CH2 + Br2/CCl4 Br2/H2O CH2—CH2 X X CH2-CH2 Br Br
如遇到含多个双键化合物而主链编号有选择时,则编号应从 顺型双键的一端开始 4 1 如 3 2 CH3 H 6 5 CH2 C=C 7 C=C H H H CH3 顺· 反-2.5-庚二烯
四、物理性质 五. 化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章烯烃和炔烃
授课对象:应用化学、制药工程、化学工程与工艺、药学
学时安排:5-6h
一、教学目的与要求:
1、掌握烯烃和炔烃的结构特征和命名;烯烃的顺反异构。
2、掌握烯炔的化学性质的异同点;烯烃的亲电加成反应和氧化反应;
3、熟悉烯炔的系统命名规则;
4、了解立体选择反应和立体专一反应;
5、了解烯炔烃的物理性质;反应过渡态及反应活化能与反应速率的关系;
二、教学重点
1、烯烃的结构特征:π键的形成和特点;顺反异构的构型标记及次序规则;
2、烯烃亲电加成反应和反应机理,马氏规则及理论解释;烯烃的氧化反应;
3、炔氢的活性;
三、教学难点:
1、烯烃亲电加成反应机理;
2、立体选择反应和立体专一反应的区别;
3、反应过渡态及反应活化能与反应速率的关系;
四、教学方法
讲授法。
为突出重点,突破难点,拟采用如下教学方法:
1、关于烃的命名法则因中学的基础较好,应精选例题,边讲边练。
2、对于碳碳双键和叁键的形成和特点,应充分利用模型和课件动画,帮助学生树立立体形象。
3、从实验现象或实验数据出发,引导学生理解亲电加成反应机理,运用诱导效应和共轭效应解释马氏规则。
5、用模型对照说明溴与顺、反-2-丁烯加成的立体化学产物;举例说明立体选择反应和立体专一反应的区别。
五、教具
电脑、投影仪、Powerpoint课件、球棒模型,教鞭。
六、教学步骤及时间分配
导言:烷烃分子中各原子均以σ键相连,而烯炔烃分子中分别含有碳碳双键和叁键官能团,均为不饱和烃,双键和叁键均σ键和π键组成。
介绍本章学习的重点要求。
1.1 烯烃
一、结构特征
以乙烯的形成为例,讲解:π键和π电子的概念。
演示:乙烯分子模型,结合键长、键角等参数
强调:双键C——sp2杂化,平面构型;叁键C——sp杂化
与σ键比较,分析π键的特点:
①只能与σ键共存;
②肩并肩重叠,不能自由旋转;
③重叠程度小;键较不稳定,易于极化。
指出:C=C双键和是烯烃的官能团。
二、命名和异构现象
(一)命名
精选2-3个例子,分析命名规则的要点:
①选主链(含双键,最长);
②编号(近双键,位最小);
③表达(双键位,要标明)
列举常见的烯基:乙烯基、烯丙基和丙烯基,并指出烯丙基和丙烯基的不同。
指出:英文命名的后缀“ene”
举例说明烯炔的命名规则:
(二)异构现象
以C4H6为例,师生共同写出它的所有的异构体,指出哪些是碳链异构体,哪些是位置异构体;重点分析2-丁烯,结合π键的特点(不能自由旋转),说明顺反异构的概念和产生的原因和条件:
①分子中存在限制旋转的因素;
②被限制旋转的两个碳原子上连接两个原子或基团必须不同。
思考:化合物CH3CH=CH2与CH3CH=CH-CH=CHCH3是否存在顺反异构想现象,如有,有几个顺反异构体?
介绍顺反异构构型的两种标记法,强调:顺、反,Z、E是不同的命名系统。
举例说明:顺反异构体的性质差异,强调生理活性的差异。
练习:写出2,4-庚二烯所有顺反异构体,并用两种方法标记构型。
三、烯烃的物理性质(课后自学)
四、烯烃的化学性质
结构决定性质,紧扣碳碳双键结构特点,重点讲解亲电加成和氧化反应。
(一)加成反应
1、催化加氢(略讲,指出氢化热可解释相似结构化合物的稳定性,如反-2-丁烯比顺式要稳定;存在共轭体系的分子稳定性较大)
2、亲电加成(重点)
(1)加卤素
活性:F2>Cl2>Br2>I2(常见加Cl2和Br2)
应用:加溴,鉴别烯烃。
反应机理:以加溴的经典实验现象和结果引出。
①须在极性条件下进行
②分两步进行:
第一步,带部分正电荷的溴进攻π电子形成环状溴正离子(是反应中间体);
第二步,溴负离子从环状溴正离子反面进攻形成产物。
反应特点:
①共价键异裂,产生正、负离子,属于离子型反应;
②第一步为决速步骤,亲电试剂进攻底物,以此称亲电加成反应。
溴正离子(通常指Br2)为亲电试剂。
③溴负离子从反面进攻。
分析:环状溴正离子的构型,电子结构和活泼性,。
示投影:顺、反-2-丁烯与溴的加成
讨论:立体专一和立体选择反应(立体化学的研究结果反证机理的合理性)。
(2)加HX等不对称的试剂
反应活性:HI>HBr>HCl
马氏规则:试剂中带正电的部分(H+)主要加到含氢较多的双键碳上。
反应机理:第一步,H+进攻π电子,形成碳正离子(决速步骤);
第二步,X—与碳正离子结合形成产物(无立体选择性)分析:碳正离子的构型——平面构型
各级碳正离子的稳定性:叔>仲>伯
强调:马氏规则产物的实质:形成较稳定的碳正离子的必然结果。
说明:为什么只有加溴才形成环状溴正离子?
(3)加H2SO4
主要产物:遵循马氏规则,
应用:所得硫酸氢酯可水解得到醇(选择不同取代的烯烃,可得伯、仲、叔醇);硫酸氢酯溶于硫酸,可除去混杂在烷烃中的少量烯烃。
思考题:
比较1-丁烯、2-丁烯、异丁烯与H2SO4加成的反应活性。
3、自由基加成反应(HBr与烯烃加成的过氧化物效应)
实例:在过氧化物存在下,丙烯与溴化氢的加成,主要产物违反马氏规则。
为什么?因遵循不同反应机理。
自由基加成反应机理:
①过氧键较不稳定,易均裂形成自由基RO·;
②RO·与HBr反应,产生Br·——链引发
③Br·与烯烃CH3CH=CH2加成,主要形成2°自由基(说明为什么)。
④HBr与2°自由基反应,得到反马氏加成产物——链增长。
设问:为什么HCl和HI与烯烃的加成,不存在过氧化物效应?(从H—X 和C—X键的键能来分析)。
(二)氧化反应(Oxidation)
1、KMnO4氧化
强调:条件不同,产物不同。
(1)中性和碱性条件——邻二醇(π键断裂)
(2)酸性条件/加热——酮、酸、CO2(C=C键断裂,可采用断裂一个键,两端加羟基,再脱水的思路来帮助写出氧化产物)。
应用:根据颜色变化,鉴定不饱和烃;根据产物结构的分析,判断烯烃的结构。
例题:某烃A(C10H18),催化加氢得B(C10H22),经氧化得CH3COCH3,CH3COCH2COOH,CH3COOH。
试推断A可能的结构式。
2、臭氧氧化
与KMnO4氧化比较,产物只是醛或酮,没有酸和CO2(从反应机理和条件解释)
强调:先O3氧化,在Zn/H2O。
应用:烯烃结构的鉴定。
思考:①上例结构,如果经历臭氧氧化/锌粉-水解,其产物是什么?
②有一个化合物A(C8H12),可加2摩尔H2,A经臭氧化-锌粉水解,得一个二醛,试推断A的结构。
(三)烯烃的聚合和医用高分子材料(自学)
五、烯烃的制备(自学)
1.2 炔烃
一、炔烃的异构和命名
举例说明烯炔的命名规则:
选主链(含双键和叁键);编号(近重键),两端距重键等距时,优先双键。
表达:先烯后炔,重键位置要标明。
二、炔烃的物理性质(略炔烃的结构)
三、炔烃的结构
C的杂化状态——sp;
π键的形成:两个π键相互垂直,呈圆筒状;
反应活性:比烯烃较小。
如:CH≡C-CH2CH=CH2低温下与等摩尔的Br2加成,生成CHBr=CBr-CH2CH=CH2。
四、炔烃的制备(略)
五、炔烃的化学性质
1、加HX:按马氏规则,以丙炔为例说明。
2、炔烃的水化:先生成烯醇式,再异构化成醛或酮。
3、炔淦的生成
末端炔烃的特性反应,用来检验端炔。
分析:末端炔氢为什么有一定的酸性?(比较三种杂化碳的电负性大小)强调:炔氢酸性很弱(如乙炔pKa=25),而炔负离子是一强碱。
练习:用简便的化学方法鉴别下列化合物:丁烷、1-丁烯、1-丁炔、环丙烷
复习总结:
①强调本章的重点
②精选几个思考题进行复习总结;课堂分析几个有代表性的习题:第3题第
7 、1 3、14题。
点做习题:第1题 :(2)(4); 第2题(2)(7);第4题(2)(3)(7)(8);
第11、12题
参考资料:
①邢其毅主编《基础有机化学》(第二版)上册
②王积涛主编《有机化学》。
