第三章 烯烃和炔烃 亲电加成反应
第六讲 第三章 不饱和烃:烯烃和炔烃(2)
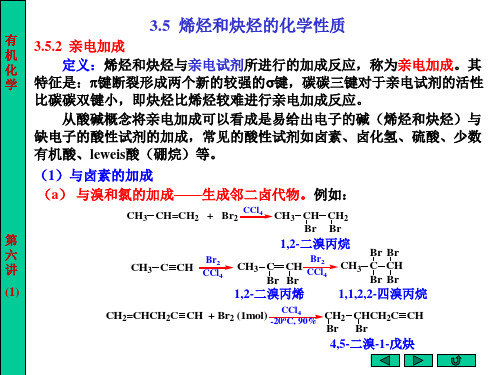
C C
+
H-X
-X -
C=C H
+
+X快
C=C X H
乙烯基碳正离子
由于卤素的吸电子作用, 阶段。 几 1 由于卤素的吸电子作用,反应能控制在加一分子 HX 阶段。 加成, 加成 常用汞盐和铜盐做催化剂。 点 2 与HCl加成,常用汞盐和铜盐做催化剂。 讨 3 与卤化氢的加成,在相应卤离子(如:(CH3 )4N+Cl-)存在下, 与卤化氢的加成,在相应卤离子( 存在下, 论 通常进行反式加成。例如: 通常进行反式加成。例如:
*1. Markovnikov规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 规则 不对称烯烃与氯化氢等极性试剂进行加成反应时, 氢原子总是加到含氢较多的双键碳原子上, 氢原子总是加到含氢较多的双键碳原子上,氯原子或其它原子或基团则加 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 到含氢较少的或不含氢的双键碳原子上。这条经验规则简称马氏规则。 例如
CH3CH2CH=CH2 + HBr HAc 80% (CH3)2C=CH2 + HCl CH3CH2CH2CH2Br
~100%
(CH3)2C CH3 Cl
第 六 讲 (6)
*2. 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 不对称炔烃与卤化氢等极性试剂进行加成反应时,也符合马氏规则。 Br 例如 (CH3)2CHC CH HBr (CH3)2CHC=CH2 HBr (CH3)2CH C CH3
NaCl CH2=CH2 + Br2 水溶液
Br H2C CH2 Br 1,2-二溴乙烷 二溴乙烷
Cl H2C CH2 Br 1-氯-2-溴乙烷 氯 溴乙烷
第三章烯烃和炔烃

(2)编号:从最靠近双键的一端开始,将主链 碳原子依次编号 (使双键具有最低位次,使取 代基具有较低位次)。
1 23 4 5 6
H CH3 C CH CH2 C
CH3
CH3
2,5-二甲基-2-己烯
CH3
2,5-dimethyl-2-hexene
(3)命名:将双键的位次标明在烯烃名称的前
面(只写出双键碳原子中位次较小的一个),
棕色褪去。
Br
作为烯烃的鉴别
CCl4 0℃
CHCH3
Br
加成活性:氟﹥氯﹥溴﹥碘
立体选择性:主要得到反式加成产物
2.加氢卤酸
C C + HX
(1)对称烯烃的亲电加成反应
CC HX
CH3CH2 C
H
CH2CH3 C
H
+ HBr
CH3Cl -30℃
CH3CH2CH2CHCH2CH3
Br
(2)不对称烯烃的亲电加成
R CH CH2 + HBr
R CHCH3
Br 主要产物
RCH2CH2Br
马氏规则(Markovnikov)
马氏规则(Markovnikov)
当不对称烯烃与不对称试剂(卤化氢等) 加成时,不对称试剂中带正电荷的部分总是加 到碳碳双键中含氢较多的碳原子上,带负电荷 的部分则是加到碳碳双键中含氢较少的碳原子 上,这一规则称为马氏规则。
低”。 若分子中同时含有双键和三键,应从最先 遇到双键和三键的一端开始;若在主链两 端等距离处遇到双键和三键,应从最靠近 双键的一端开始。
3.命名: 标出三键位次(含有双键时,应标出
双键位次;命名时写成 “ 几烯几炔”)。 取代基的位次及排列顺序同烷烃命名法。
大学有机化学第三章 烯烃和炔烃

CH3 → CH=CH2 + HX
CH3CH—CH3 X
马代规则是 不对称试剂与双键发生亲电性加成时, 试剂中正电性部分主要加到能形成较稳定正碳离子 的那个双键碳原子上。 + CH3CHCH3 δ+ δ-
CH3—CH=CH2 + H+
HX分子中的氢以H+ 质子形式发生反应,因此称为亲电试剂
CH3CH2CH2
CH3
顺反异构命名与Z .E命名规则不相同,不能混为一 谈,两者之间没有固定的关系
例如:
Cl Cl C=C CH3 H (Z)-1 , 2-二氯丙烯 顺-1 , 2-二氯丙烯 H C H ‖ C H H 大 Br
Cl
C=C
CH3
Cl 大
Cl C COOH ‖ C Br Cl
(E)-1 , 2-二氯-1-溴丙烯 顺--1 , 2-二氯-1-溴丙烯 CH3 C H ‖ C H H
次产物
因此 1.1.1-三氟-3-氯丙烷是主要产物
2. 加硫酸
R-CH=CH2 + HOSO2OH H3PO4 300℃ 7Mpa R-CHCH3 H2O RCH-CH3 OSO2OH OH (间接水化法制备醇) CH3CH2OH
CH2=CH2 + H2O
3. 加卤素
CH2 = CH2 + X2
CH2 = CH2 + Br2/CCl4 Br2/H2O CH2—CH2 X X CH2-CH2 Br Br
如遇到含多个双键化合物而主链编号有选择时,则编号应从 顺型双键的一端开始 4 1 如 3 2 CH3 H 6 5 CH2 C=C 7 C=C H H H CH3 顺· 反-2.5-庚二烯
四、物理性质 五. 化学性质
烯烃炔烃的反应

CH CH2 n CH3
CH CH2 n
PP
是一种半结晶的热塑性塑料。具有较高的 耐冲击性,机械性质强韧,抗多种有机溶
剂和酸碱腐蚀。在工业界有广泛的应用,
是平常常见的高分子材料之一。澳大利亚
的钱币也使用聚丙烯制作。
PS 聚苯乙稀 是一种无色透明的塑料材料。具 有高于100摄氏度的玻璃转化温度,因此 经常被用来制作各种需要承受开水的温度 的一次性容器,以及一次性泡沫饭盒等。
α-氢原子的反应
(a)卤化反应
烯烃与 X2反应的两种形式(例:丙烯+Cl2):
H3C CH CH2 + Cl2
CCl4 液相
Cl Cl H3C CH CH2
双键上的亲电加成
烯丙位
500 ~ 600oC 气相
Cl H2C CH CH2
烯丙位氯代的条件: 高温(气相)、Cl2低浓度
饱和碳上的自由基取代
H
R R" R' C C H
OH OH
酮、醛 邻二醇
R
R"
CC
R'
H
O
环氧化物
氧化反应,氧化产物随氧化剂和氧化条件的不同而异。
用KMnO4溶液来鉴 定不饱和烃。
用低温,中性或碱性稀KMnO4氧化,生成顺式α -二醇
3RCH
CH2 + 2KMnO4 + 4H2O 中碱性性介或质3RCH CH2 + OH OH
C(
CH2) 7COOH
KMnO4, H2O, 常温 pH 7.5 , 92%~96%
CH3( CH2)7C C( CH2)7COOH OO
在强烈条件下氧化时,非端位炔烃生成羧酸(盐),端位炔烃生成羧酸(盐)、 二氧化碳和水。
第3章答案

F
Br
C=C
H
CH2CH2CH3
C=C
(3) ↑Cl
I↑
(4) ↑CH3
CH(CH3)2 ↑
(Z)-1-氟-1-氯-2-溴-2-碘乙烯
(Z)-3-异基-2-己烯
(二) 写出下列化合物的构造式,检查其命名是否正确,如有错误予以改 正,并写出正确的系统名称。
(1) 顺-2-甲基-3-戊烯
CH3
1
CH3 CH 3 2 CH3 5 4 C=C
分子内亲电加成
CH3
CH3
(十一) 预测下列反应的主要产物,并说明理由。
HCl
解:(1) CH2=CHCH2C CH HgCl2
Cl CH3 CHCH2C CH
双键中的碳原子采取sp2杂化,其电子云的s成分小于采取sp杂化的叁
键碳,离核更远,流动性更大,更容易做为一个电子源。
所以,亲电加成反应活性:C=C>C C
32 1
CH3CHCH2CHC CH
(4)
CH3 C4 H=C5 HC6H3
3-异丁基-4-己烯-1-炔
(一) 用Z,E-标记法命名下列各化合物:
Cl
CH3
C=C
(1) ↓CH3
Cl ↑
(E)-2,3-二氯-2-丁烯
F
CH3
C=C
(2) ↑Cl
CH2CH3↑
(Z)- 2-甲基-1-氟-1-氯-1-丁烯
第三章 烯烃和炔烃习题
用系统命名法命名下列各化合物:
2
34
CH3CH2C CHCH3
(1)
1 CH2 CH3
3-甲基-2-乙基-1-丁烯
(2) 对称甲基异丙基乙烯
1
2
第三章 烯烃和炔烃

课堂作业:P74 习题3.3
3.4 烯烃和炔烃的物理性质
H 3C H H CH3 H3C H3C H H
:
0
0.33 0 /10-30 c.m
b.p.
m.p.
1oC
-105.6oC
4oC
-138.9oC
HOOC
H
H
COOH
O O O
C-H:
110.2pm (Csp3-Hs)
轨道形状: 碳的电负性: pka:
狭
随 S 成 份 的 增 大, 逐 渐 增 大。 ~50 ~40 ~25
1 烯双键碳是sp2杂化。 2 键是由p轨道侧面重叠形成。
3 由于室温下烯双键不能自由 旋 转,所以有Z,E异构体。
3.2 烯和炔的异构现象
CH3CH2CH CH2
3.5 烯和炔的化学性质
反应部位:
氧化反应 (亲电)加成反应
C C C H
C C H C H
α–氢的反应 炔氢的反应
由于π键易于断裂,加成反应是 烯烃和炔烃的主要反应: 烯烃:
X Y+ C C C C X Y
炔烃:
X Y+ C C C X C Y
X C X
Y C Y
试剂的两部分分别与重键两端的C原子 结合,形成新的σ键反应——加成反应
3.5.1 加氢(催化氢化)
烯烃和炔烃在催化剂存在下,与氢气 进行加成反应,生成烷烃:
H H C C +
催化剂 H2 室温
C
C
催化剂:Pt, Pd, Ni
H H R C CH + 2H2
Ni 室温
R C C H H
第三章 烯烃 炔烃 二烯烃
第三章烯烃炔烃二烯烃Ⅰ学习要求1. 了解不饱和烃的结构特点,熟练掌握烯烃、炔烃、二烯烃及烯烃顺反异构体的系统命名。
2. 掌握不饱和烃的化学反应及其应用,熟练掌握应用亲电加成反应历程,马氏规则及其影响因素判断加成反应的主要产物(或方向)。
3. 了解共轭体系的类型,掌握应用诱导效应和共轭效应判断亲电加成反应的速率。
4. 掌握鉴别烯烃、炔烃的化学方法。
5. 掌握各类碳正离子的稳定性顺序。
Ⅱ内容提要一.不饱和烃的结构1. 烯烃的官能团是碳碳双键,形成双键的两个碳原子是sp2杂化。
碳碳双键是由一个碳碳σ键和一个碳碳π键组成,具有刚性,不能绕碳碳双键自由旋转。
π键的键能较小,易被极化,容易和亲电试剂发生亲电加成反应。
2. 在炔烃分子中碳碳叁键是官能团,形成叁键的两个碳原子是sp杂化,碳碳叁键是直线型,其中两个π键相互垂直。
sp杂化的碳原子的电负性较sp2杂化的碳原子电负性大,所以炔烃中的π键比烯烃的π键较难极化,亲电加成反应炔烃较烯烃难。
3. 共轭二烯烃在结构特征上是指碳碳单键和碳碳双键交替排列的情况。
即分子中有四个sp2杂化的碳原子依次相连,称做共轭链。
共轭二烯烃的四个sp2碳原子共存在于同一平面,形成两个π键的四个p轨道相互平行,π键电子可在共轭链上离域,这种共轭体系的π键又称离域大π键。
它更易极化,亲电反应活性高于独立的π键。
4. 共轭体系是指在分子、离子或自由基中能够形成π键或p轨道离域的体系,在共轭体系中π键电子或p轨道电子不是定域,而是离域的。
这种电子在共轭体系中离域并传递的电子效应称共轭效应。
共轭体系与非共轭体系相比较,具有较低的热力学能,有较高的化学反应活性和特有的化学性质,存在有键长平均化现象。
共轭体系又具体分为:π–π共轭体系、p–π共轭体系、p–p共轭体系、σ–π超共轭体系和σ–p超共轭体系。
5. 共轭效应是指π键电子或p轨道电子在共轭体系中间离域并传递而产生的电子效应,仅存在于共轭体系中;诱导效应则是指σ键电子在σ键中偏移并传递的电子效应,存在于所有的极性σ键中。
chapt 3烯烃 炔烃和二烯烃
CH3
CH
CH2
+
Cl2
500。 C
α
CH2 Cl
CH
CH2
(四) 聚合反应
nCH2=CH2 高 温 高 压
CH2-CH2 n
(五) 金属炔化物的生成
HC CH + 2AgNO3 + 2NH3.H2O
AgC
HC
CAg
+ 2NH4NO3 + 2H2O
乙炔银(白色)
CH + Cu2Cl2 + 2NH3.H2O CuC CCu + 2NH4Cl + 2H2O
HBr
有过氧化物
C H3C H2C H C H2 H Br
反―马氏规则‖
注意:氯化氢、碘化氢无过氧化物效应
该反应不使用HX的水溶液,以避免烯烃与水加成。
HX对烯烃加成的相对活性:
HI HBr HCl HF
因为:在HF中,F的原子半径小,但电负性大, 故对H原子的束缚力较大,不易离解出H+和F-。 3.加 H2SO4
CH 2=CH
CH 3CH=CH
CH 2=CHCH 2
乙 基 烯
丙烯基
烯 基 丙
三 烯烃和炔烃的物理性质
与烷烃的不同之处:
不同碳原子的电负性: 三键碳原子>双键碳原子>饱和碳原子。 偶极矩:端炔>端烯(但极性较弱)。如: CH3CH2C≡CH
μ 2.67×10-30 C· m
CH3CH2CH=CH2
C C2H5
P-2 催化剂
C2H5 C H C
C2H5 H
采用Na(或Li)/液NH3还原炔烃将得到反式烯烃。
Na , 液 NH3 。 - 78 C C2H5 C H C (CH )3CH3 2 H
第三章-烯烃和炔烃-亲电加成反应
2S2
2Px1 2Py1 Pz
3SP2 Pz
.
a)SP2杂化轨道由1/3s轨道和2/3p轨道组成;
b)成键能力较sp3杂化轨道弱,但比未杂化轨道强
c)杂化轨道对称轴在同一平面,夹角120°,未杂化 2p轨道垂直这一平面。
3、π键:
未杂化的p轨道沿对称轴平行方向(“肩并肩”)重 叠成形成π键,构成π键的电子叫做π电子。
C2H5C CC2H5 P-2 催化剂
C2H5 C
H
C2H5 C
H
液氨钠与二取代乙炔反应得反式产物
C2H5C
Na , 液NH3
C(CH2)3CH3
- 78 。C
C2H5 C
H
H
C (CH2)3CH3
烯炔与氢加成优先发生在三键上
H2 RC C (CH2)n-CH=CH2 Pt-BaSO4 喹啉 CHR CH (CH2)n-CH=CH2
CH2 CHCH2C CH
+ Br2
-C20C。lC4
CH2 CHCH2C CH Br Br
4,5-二溴-1-戊炔
(2)加卤化氢 烯烃与卤化氢加成生成一卤代烷
C = C + HX
C-C
HX的反应活性:
HX
HI > HBr > HCl > HF (HF加成无实用价值 )
如乙烯的加成
CH2=CH2 + HX → CH3CH2X
C
C
4. 键与 键的差异: 键
①存在的情况
键
a.可以单独存在
键必须与键共存仅存
b.存在于任何共价键中 在于不饱和键如双键等
②成键方式 沿对称轴平行方向“肩并
沿轴向“头碰头”重叠 肩”重叠
小议烯烃和炔烃的加成反应
小议烯烃和炔烃的加成反应13031417 杨春怀内容摘要:烯烃和炔烃在结构上的共同点都表现在碳碳双键、碳碳叁键的不饱和牲上。
在一定条件下都能和氢、卤素等试剂发生一系列的加成反应。
但是两者又有较明显的区别,炔烃比烯烃难发生亲电加成,易发生亲核加成反应。
本文从烯烃和炔烃的结构上进行比较来寻找性质差别的原因。
关键词:烯烃 炔烃 亲电 亲核 加成反应烯烃和炔烃都属于不饱和的链状碳氢化合物,都有易断裂的兀键,能发生加成反应。
当亲电试剂存在时,炔烃的加成反应比烯烃缓慢。
如:乙烯能使溴的四氯化碳溶液立即退色。
而乙炔需要几分钟以后才能褪色。
又如当分子中同时存在双键和叁键时,与溴反应首先进行的是双键的加成反应:炔烃虽然较难发生亲电加成,.但是炔烃能发生一系列的亲核加成。
如乙炔在NaoH 或KOH 存在下,可以和醇、硫醇、酚等含有“活泼”氢的有机化合物发生亲核加成,生成乙烯基化合物。
C C H H H C H H C C H+Br-Br C Br H H C Br H C H H C C H 90%C H CH R-OH ROC H CH 2C H CH RS C H CH 2RSH C H C H ArO C H CH 2Ar-OH 100℃~200℃ 烯烃和炔烃都属于不饱和烃,为什么同是π键,在发生加成反应时表现出这些差别呢?性质上的差异,必然存在结构上的差异。
我们从烯烃的结构中可知,在碳一碳双键中,原子平面的上下有pai 电子云,这些pai 电子云参与把碳原子核拉拢在一起作用要比sita 电子云小,pai 电子本身被束缚得较松。
这种松散的pai 电子特别容易被寻求电子的试剂所利用。
因此在许多反应中,碳一碳双键是一种电子的来源,也可以说它起着一个碱的作用,与它反应的化合物就是缺电子的化合物,也就是酸,这些寻求一对电子的酸性试剂称为亲电试剂。
烯烃的亲电加成,换句话说是酸性试剂进攻的加成反应。
而在炔烃的不饱和键中,乙炔分子中两个π键构成一个具有很大对称性的圆柱状的π电子云。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5-甲基-1,3,6-庚三烯
5.同时含有叁键和双键的化合物称为烯炔。其命名 选取含双键和叁键最长的碳链作为主链。位次的 编号通常使不饱和键位次最小.
5
4
3
CH3CH =CH
2
C
=C1 H
3 _ 戊烯 _ 1 _ 炔
CH3
= = 7
6 54
3
2
1
Hale Waihona Puke CH3C CCH CH2CH CH2
4 _ 甲基 _ 1 _ 庚烯 _ 5 _ 炔
④键的性质
a.键能:较大 b.旋转:可自由旋转 c.极化度:较小
较小 不能自由旋转 较大
二.炔烃的结构
1.乙炔的结构
乙炔是线形分子,叁键的键长为0.12nm,比C=C
键的键长短。键能为835KJ/mol,比双键键能
610KJ/mol.大,比三倍单键的键能1036KJ/mol.小
得多
0.120nm
HCCH
烯烃是含有碳碳双键(C=C)即烯键的 烃,碳碳双键是烯烃的官能团, (单烯烃、 二烯烃和多烯烃).单烯烃的通式为CnH2n它与 环烷烃互为同分异构体.
炔烃是含有 –C C-叁键的不饱和脂肪烃, 二烯烃是含有两个C=C双键的不饱烃与炔烃互 为同分异构体,两的者通式为CnH2n-2
§3-1 烯烃和炔烃的分子结构
CH2=CHCH2CH3
(a)
CH3CH=CHCH3
(b)
CH2=CCH3 CH3
(c)
位置异构:由于碳-碳双键位置的不同而产生的异构
如a与b
官能团异构: 烯与环烷烃, 如
a、b、c与d
(d)
二、烯烃的顺反异构:
顺反异构:分子中各原子或基团的连接方式和次序 相同,但由于自由旋转受阻而在空间排 列方式不同产生的异构体
180°
0.106nm
2.叁键及电子云形状
sp杂化
激发
2Px 2Py 2Pz
2P
2S
2S
杂化
2P
sp杂化电子云形状和成键情况
SP
3、两个相互垂直的π键
HCCH
围绕两个碳原子核心的圆柱状的π电子云
§3-2 烯烃和炔烃的同分异构
一、构造异构(碳架异构、位置异构和官能团异构)
碳架异构:分子中原子连接次序不同.如a,b与c
碳原子数超过十时,须在烯或炔字前加碳字 叫“某碳烯” 如
CH3(CH2)8CH=CH-CH3 2-十二碳烯
4.分子中含有两个或更多双键或叁键时,合并用
“二、三、四等”字表明,同时尽可能以最低 的
数字标出各自的位置
CH3-C=CH-CH2-CH=CH2 CH C-C C-CH-C CH
CH3
CH3
5-甲基-1,4-己二烯
C
C
4. 键与 键的差异: 键
①存在的情况
键
a.可以单独存在
键必须与键共存仅存
b.存在于任何共价键中 在于不饱和键如双键等
②成键方式 沿对称轴平行方向“肩并
沿轴向“头碰头”重叠 肩”重叠
③电子云分布
a.集中于两原子核中 间,呈圆柱形分布
a. 电子云分布在 键 所在平面的上下,呈块状 分布
b. 键有一个对称轴, 只有对称面,对称面上 轴上电子云密度最大 的电子云密度最小
2S2
2Px1 2Py1 Pz
3SP2 Pz
.
a)SP2杂化轨道由1/3s轨道和2/3p轨道组成;
b)成键能力较sp3杂化轨道弱,但比未杂化轨道强
c)杂化轨道对称轴在同一平面,夹角120°,未杂化 2p轨道垂直这一平面。
3、π键:
未杂化的p轨道沿对称轴平行方向(“肩并肩”)重 叠成形成π键,构成π键的电子叫做π电子。
CH3 H
H
CC 反-2-丁烯 CH3
E-2-丁烯
H3C
CH3
第三章 烯烃和炔烃 亲电加成反应
【教学要求】 ❖ ①熟悉烯烃、炔烃和二烯烃的结构 ❖ ②掌握烯烃、炔烃和二烯烃的命名 ❖ ③了解炔烃的物理性质 ❖ ④熟练掌握烯烃、炔烃的化学性质 ❖ ⑤理解亲电加成、自由基加成反应历程 ❖ ⑥理解共轭体系及共轭效应 ❖ ⑦了解重要烯烃的用途和石油化工
第三章 烯烃和炔烃 亲电加成反应
双键与叁键位次相同时则给双键以最低编号
CH =CCH2CH =CH2
1 _ 戊烯 _ 4 _ 炔
CH=CH2 CH3C =CCH CH2CH=CHCH3
5 _ 乙烯基 _ 2 _ 辛烯 _ 6 _ 炔
几个重要的烯基
烯基:烯烃分子去掉一个氢原子后剩下的一价
基团
CH2=CH CH3CH=CH CH2=CH-CH2 CH2= C–CH3
是)
1.选含有双键的最长碳链为主链,并按主链的碳
原子数称为“某烯”或“某炔”
CH3 CH CH=CH2
CH3 C =CH
CH3CH2CH2 CH2CH3
(CH3)2CH
CH CH3 CH3
2.编号从最靠近不饱和键一端开始,使双键或叁键
的位次最小.
3.书写取代基与烷烃相同,不饱和键的位置标用 位号较小的一个标在主体名称的前面, 如前二例 3 _ 甲基 _ 2 _ 乙基_ 1 _ 己烯 2 , 3 , 5 _ 三甲基 _ 3 _ 己烯
一.烯烃的结构: 1.乙烯的结构
乙烯分子中的所有原子在同一平面键角接 近于120⁰ . 碳碳双键由π键与σ键组成
H
H
C=C
H
H
单双键键长、键能比较表
碳—碳双键
键 长(nm)
0.134
键 能(Kj/mol) 610.0
碳--碳单键 0.154 345.6
2.碳原子的SP2杂化
C: 1S22S22Px12Py1
H3C H
CH3 CC
H 顺式
H3C
H
CC
H 反式 CH3
顺反异构产生的条件:
1.分子中有限制自由旋转的因素,如双键或环平面 2.双键所连的两个碳子各连有不同的原子或基团.
a C
b
c C
d
a≠ b c≠ d
炔烃是直线型分子不存在顺反异构
§3-3 烯烃和炔烃的命名
一.系统命名 法 (烯、炔的命名与烷烃相似,不同的
1.依次对双键碳原子上所连接的原子或基团按 “次序规则”排序。
2.两双键碳原子上优先的原子或基团在同侧为Z 型,在异侧为E型。
a
c
CC
b Z构型 d
a
d
CC
b E构型 c
条件 a>b c>d
CH 3 H
CH 3 CC
H
顺-2-丁烯
Z-2-丁烯
H3C
H
CC
H3CH2C
CH3
反-3- 甲基-2-戊烯
Z-3-甲基-2-戊烯
乙烯基 丙烯基(1-丙烯基) 烯丙基(2-丙烯基) 异丙烯基
二、顺反异构体的命名
顺反标记法:两个双键碳原子上有相同原子或 基团时,相同基在同一侧冠以“顺”字,在异 侧时冠以“反”字。如
H3C
CH3
CH3CH=CHCH 3
CC
2-丁烯
H
H
顺-2-丁烯
H3C
H
CC
H 反-2-丁烯CH3
Z、E标记法:
