工艺流程专题二轮汇总
山东省2023届高考化学二轮复习工艺流程题专项练3解析版

山东省2023届高考化学二轮复习工艺流程题专项练3解析版一、选择题 每小题只有一个选项符合题意,每小题3分,共24分。
1.以下是侯氏制碱法的简单流程,下列说法正确的是( )A .氨和二氧化碳的通入顺序应该调换B .操作X 为过滤,为加快过滤速率,过滤时用玻璃棒搅拌C .侯氏制碱法的主要原理是相同条件下Na 2CO 3易溶于水,NaHCO 3难溶于水D .向溶液B 中通入氨并加入氯化钠粉末可得到副产品NH 4Cl ,通入氨的目的是增大NH +4 的浓度,有利于析出NH 4Cl 并提高纯度【答案】 D【解析】A 项,氨和二氧化碳的通入顺序不能颠倒,因为氨极易溶于水,二氧化碳的溶解度较小,先通入氨可以更多地吸收二氧化碳,反应生成碳酸氢钠,A 错误;B 项,过滤时不能用玻璃棒搅拌,避免弄破滤纸,B 错误;C 项,碳酸钠和碳酸氢钠都易溶于水,但相同温度下碳酸氢钠的溶解度小于碳酸钠,C 错误;D 项,氨溶于水后与水反应生成一水合氨,电离出铵根离子,增大铵根离子浓度,有利于析出氯化铵并提高纯度,D 正确。
2.某工厂用提取粗盐后的盐卤(主要成分为MgCl 2)制备金属镁,其工艺流程如下。
下列说法中错误的是( )A.步骤Ⅰ发生的反应为非氧化还原反应B.若在实验室进行操作①,只需要漏斗和烧杯两种玻璃仪器C.操作②是蒸发浓缩、冷却结晶D.在整个制备过程中,未发生置换反应【答案】B【解析】步骤Ⅰ发生反应MgCl2+Ca(OH)2===Mg(OH)2↓+CaCl2,该反应是非氧化还原反应,A项正确;操作①是过滤操作,用到烧杯、漏斗、玻璃棒三种玻璃仪器,B项错误;操作②是由MgCl2溶液制得MgCl2·6H2O,操作是蒸发浓缩、冷却结晶,C项正确。
3.(2021·山东烟台二模)工业上利用锌焙砂(主要含ZnO、ZnFe2O4还含有少量FeO、CuO等)湿法制取金属锌的流程如图所示。
下列说法错误的是()A.ZnFe2O4与硫酸反应的离子方程式:ZnFe2O4+8H+===Zn2++2Fe3++4H2O B.加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+C.加过量的ZnS可除去溶液中的Cu2+是利用了K sp(ZnS)>K sp(CuS)D.为增大反应速率,“净化Ⅰ”和“净化Ⅰ”均应在较高的温度下进行【答案】D【解析】流程分析如下:ZnFe2O4与硫酸反应生成Zn2+、Fe3+、H2O,离子方程式为ZnFe2O4+8H+===Zn2++2Fe3++4H2O,A正确;加入ZnO的目的是调节溶液的pH以除去溶液中的Fe3+[生成Fe(OH)3沉淀],B正确;加过量ZnS可除去溶液中的Cu2+,是利用了K sp(ZnS)>K sp(CuS),C正确;“净化Ⅰ”中的H2O2在温度较高时会分解,该反应需要控制温度不能太高,D错误。
高考化学二轮备考高频热点特训:化学工艺流程题 (解析版)

化学工艺流程题1.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:回答下列问题:(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。
“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。
此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。
NaClO2的有效氯含量为____。
(计算结果保留两位小数)〖〖答案〗〗(1)+3;(2)2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4;(3)NaOH溶液;Na2CO3溶液;ClO2−(或NaClO2);(4)2:1; O2; (5)1.57。
〖〖解析〗〗(1)在NaClO2中Na为+1价,O为-2价,根据正负化合价的代数和为0,可得Cl的化合价为+3。
(2)NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO2是氧化剂,还原产物为NaCl,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。
(3)食盐溶液中混有Mg2+和Ca2+,可利用过量NaOH溶液除去Mg2+,利用过量Na2CO3溶液除去Ca2+;向NaCl溶液中加入ClO2,进行电解,阳极发生反应2Cl--2e-=Cl2↑,反应产生Cl2,阴极发生反应产生NaClO2,可见“电解”中阴极反应的主要产物是NaClO2;(4)根据图示可知:利用含有过氧化氢的NaOH溶液吸收ClO2气体,产物为NaClO2,则此吸收反应中,氧化剂为ClO2,还原产物为NaClO2,还原剂是H2O2,氧化产物是O2,每1 mol的H2O2转移2 mol电子,反应方程式是:2NaOH+2ClO2+H2O2=2NaClO2+O2+2H2O,可知氧化剂和还原剂的物质的量之比为2:1,该反应中氧化产物为O2。
化学二轮考点突破:微专题——化学工艺流程

微专题:——化学工艺流程【考点透析】1.化工生产的一般工艺流程2.常用化工术语4.循环物质的确定5.副产品的判断【新题特训】1.(2019·全国卷Ⅰ)硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为__________________________________________________________。
(2)“滤渣1”的主要成分有________________。
为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是________。
(3)根据H3BO3的解离反应:H3BO3+H2O H++B(OH)-4,K a=5.81×10-10,可判断H3BO3是_______酸;在“过滤2”前,将溶液pH调节至3.5,目的是______。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为____________,母液经加热后可返回__________工序循环使用。
由碱式碳酸镁制备轻质氧化镁的方法是________________________________。
解析:(1)根据流程图可知硼镁矿粉中加入硫酸铵溶液产生的气体为氨气,用碳酸氢铵溶液吸收。
(2)“滤渣1”为不与硫酸铵溶液反应的Fe2O3、Al2O3、SiO2;检验Fe3+,可选用的化学试剂为KSCN。
(3)由硼酸的解离方程式可知,硼酸在水溶液中是通过与水分子的配位作用产生氢离子,而三价硼原子最多只能再形成一个配位键,且硼酸不能完全解离,所以硼酸为一元弱酸;在“过滤2”前,将溶液pH调节至3.5,目的是将B(OH)-4转化为H3BO3,并促进H3BO3析出。
2023届高考二轮化学工艺流程试题复习之信息型(离子)方程式的书写

上述制备Cl2O的化学方程式为 __2_C__l2_+__H__g_O__=__H_g__C_l_2+___C_l_2O_____。
物质结构与性质和有机化学中的陌生化学方程式
题型一:氧化还原类书写
类型一:直接提供反应物与生成物 将提供的反应物与生成物书写好,然后正确配平,使化学(离子)方程式中的电荷、 原子、得失电子都守恒,同时按要求书写离子方程式、化学方程式或热化学方程式。
【例 1】(2022 年重庆市适应性测试)碳酸锶(SrCO3)是一种重要的工业原料,广泛用 于生产锶铁氧体磁性材料。一种以菱锶矿(含 80~90% SrCO3,少量 MgCO3、CaCO3、BaCO3 等)制备高纯碳酸锶的工艺流程如下:
【例5】(2022年全国甲卷T26)碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中
加入NaIO3溶液,反应得到I2 ,上述制备 的离子方程式为: 2IO3-+5HSO3- =I2+5SO42-+3H++H2O
Na2S 操作II
滤液1
滤渣1
操作III
1200
滤液2
Na2SnO3固体
滤渣2 (含PbS、S)
粗锡
已知:i. 50Sn、82Pb 为 IVA 族元素;ii. SnO 2、PbO2 与强碱反应生成盐和水。
SnO2 与 NaOH 反应的化学方程式为 Sn_O__2+___2_N_a_O__H__=__N__a_2S__n_O__3+__H__2_O________。
2023届山东高考二轮复习工艺流程题热点练4(含解析卷)

2023届山东高考二轮复习工艺流程题热点练4一、选择题每小题只有一个选项符合题意,共8小题,每小题3分,共24分。
1.(2022·山东师范大学附中模拟)利用NaClO氧化尿素制备N2H4·H2O(水合肼),同时可制备Na2SO3,制备流程如图所示:已知:N2H4·H2O有强还原性,N2H4·H2O能与NaClO反应生成N2;0.1mo1/L亚硫酸钠溶液的pH约为9.5。
下列说法错误的是()A.步骤I反应时,若产物中n(NaC1O)∶n(NaC1O3)=5∶1,则n(NaCl)∶n(NaC1O)=2∶1 B.步骤II中须将尿素缓慢加入NaC1O碱性溶液中-C.步骤II反应的离子方程式为C1O-+CO(NH2)2+2OH-=C1-+N2H4·H2O+CO23D.步骤IV中反应过程中控制溶液为碱性,有利于吸收SO22.铝电解厂烟气净化的一种简单流程如下:下列说法错误的是( )A.不宜用陶瓷作吸收塔内衬材料B.采用溶液喷淋法可提高吸收塔内烟气吸收效率C.合成槽中产物主要有Na3AlF6和CO2 D.滤液可回收进入吸收塔循环利用3.MnCO3可用作脱硫的催化剂以及生产金属锰的原料,由含Mn2+的废液(有少量的Fe2+、Fe3+)制备MnCO3的一种工艺流程如下:下列说法错误的是( )A.“沉锰”时加过量NH4HCO3发生反应的离子方程式为Mn2++HCO-=MnCO3↓+H+3B.“氧化”时加入酸化的H2O2的目的是将Fe2+氧化为Fe3+C.“纯化”过程中发生了水解反应,生成Fe(OH)3沉淀D.工艺流程中“一系列操作”为过滤、洗涤、干燥4.以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如图:已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。
下列说法错误的是()A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2OB.沉镁的操作不能在较高温度下进行C.流程中可循环使用的物质只有NH3D.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物K sp的不同5.某含锰废水中主要含有MnSO4,另含H+、Fe2+、Ca2+、Mg2+、Cu2+、Al3+等,某同学为了回收Mn单质设计如下工艺流程,下列说法不正确的是()已知25 ℃时,K sp(CaF2)=1.5×10-10、K sp(MgF2)=7.5×10-11。
高中化学 二轮复习 化学工艺流程图题 专项训练
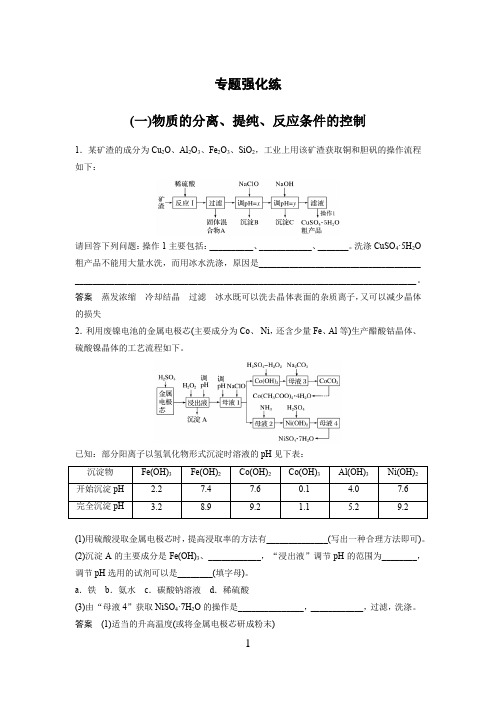
专题强化练(一)物质的分离、提纯、反应条件的控制1.某矿渣的成分为Cu2O、Al2O3、Fe2O3、SiO2,工业上用该矿渣获取铜和胆矾的操作流程如下:请回答下列问题:操作1主要包括:__________、____________、_______。
洗涤CuSO4·5H2O 粗产品不能用大量水洗,而用冰水洗涤,原因是_____________________________________ ______________________________________________________________________________。
答案蒸发浓缩冷却结晶过滤冰水既可以洗去晶体表面的杂质离子,又可以减少晶体的损失2.利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:沉淀物Fe(OH)3Fe(OH)2Co(OH)2Co(OH)3Al(OH)3Ni(OH)2开始沉淀pH 2.27.47.60.1 4.07.6完全沉淀pH 3.28.99.2 1.1 5.29.2(1)用硫酸浸取金属电极芯时,提高浸取率的方法有______________(写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、____________,“浸出液”调节pH的范围为________,调节pH选用的试剂可以是________(填字母)。
a.铁b.氨水c.碳酸钠溶液d.稀硫酸(3)由“母液4”获取NiSO4·7H2O的操作是_______________,____________,过滤,洗涤。
答案(1)适当的升高温度(或将金属电极芯研成粉末)(2)Al(OH)3 5.2≤pH<7.6 bc(3)蒸发浓缩 冷却结晶解析 (2)金属电极芯中的主要成分是Co 、Ni ,还含少量Fe 、Al 等,加入稀硫酸酸浸时,金属单质都转化为金属离子(Ni 2+、Co 2+、Fe 2+、Al 3+),浸出液中加入过氧化氢的作用是氧化亚铁离子为铁离子,由流程图中最终产物可知,调节pH 的作用是除去溶液中的Fe 3+、Al 3+,故沉淀A 的主要成分是Fe(OH)3、Al(OH)3;为了保证Fe 3+、Al 3+沉淀完全而Ni 2+、Co 2+不沉淀,由表格数据可知,要调节pH 的范围为5.2≤pH<7.6;调节pH 时不能加入铁,因为铁能还原铁离子为亚铁离子,不能加入稀硫酸,因为要将溶液的pH 调大,由流程图中后续所加试剂可知,调节pH 选用的试剂可以是氨水、碳酸钠溶液。
2023年中考二轮专题复习流程题

流程题专题复习11.炼铁厂以赤铁矿、焦炭、石灰石、空气等为主要原料来炼铁,主要反应过程如图所示:请根据图示及所学知识判断下列说法错误的是()A.工业炼铁的设备是高炉B.焦炭的作用是提供热量和制取一氧化碳C.生铁属于混合物D.生成铁的主要反应是:CO+Fe2O3高温Fe+CO22.海水中蕴含着丰富的矿物质。
从海水中提取镁的主要过程如下:下列有关说法中正确的是()A.过程Ⅰ发生的是化学变化B.过程Ⅰ~Ⅰ的目的是富集、提纯MgCl2C.过程Ⅰ得到Mg(OH)2沉淀的实验操作为蒸发结晶D.由MgCl2得到Mg也可以通过反应“22MgCl+Fe=Mg+FeCl”来实现3.无机融雪剂,主要成分为“氯盐”又称“化冰盐”,常用工业碳酸钙(含少量NaCl、FeCl3等杂质)为原料生产融雪剂,主要生产流程如下图:有关此流程的说法错误的是()A.操作I和操作II相同B.固体甲和固体C都为混合物C.加过量熟石灰可将Fe3+全部转化为沉淀物D.溶液B无需加盐酸,直接进行操作II也能得到C的固体4.我省正在进行能源结构转型,用煤制取乙二醇的产业化发展已列入石化产业调整和振 兴规划,以下对此生产过程所涉及物质的分析,正确的一项是A .煤属于可再生资源B .煤中主要含C 、H 元素 C .合成气可用作气体燃料D .乙二醇中含有两种元素5.如图所示是一种新型合成氨的方法。
下列说法不正确的是( )A .反应Ⅰ为中224LiOH 4Li+2H O+O 通电B .反应Ⅰ为所有元素的化合价均没有变化C .理论上,整个转化过程无需补充水D .理论上,合成17gNH 3,同时得到24gO 26.白铜是铜、镍(Ni)合金,某学习小组同学欲利用废弃的白铜回收铜、镍两种金属。
(已知:镍与锌性质相似,且在化合物中通常显+2价)(1)分析加入稀硫酸之前须将白铜粉碎的目的______________。
(2)写出步骤Ⅰ中生成镍的化学方程式________________。
2023新教材高考化学二轮专题复习 专题精练(11)化学工艺流程

专题精练(11)化学工艺流程1.[2022·全国甲卷]硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。
硫酸锌可由菱锌矿制备,菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。
其制备流程如下:本题中所涉及离子的氢氧化物溶度积常数如下表:回答下列问题:(1)菱锌矿焙烧生成氧化锌的化学方程式为。
(2)为了提高锌的浸取效果,可采取的措施有、。
(3)加入物质X调溶液pH=5,最适宜使用的X是(填标号)。
A.NH3·H2O B.Ca(OH)2C.NaOH滤渣①的主要成分是、、。
(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为。
(5)滤液②中加入锌粉的目的是________________________________________________________________________。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是、。
2.[2022·福建省厦门市二检]软锰矿—硫铁矿制取电池级二氧化锰的工艺流程如下图:回答下列问题:(1)“浸取”过程主要反应3MnO2+2FeS2+6H2SO4===3MnSO4+Fe2(SO4)3+4S+6H2O,则氧化剂与还原剂物质的量之比为。
(2)“氧化ⅰ”过程软锰矿的作用是。
(3)“除铁”后溶液中残留的c(Fe3+)=mol·L-1。
(25 ℃时,Fe(OH)3的K sp为1.0×10-39)(4)“沉锰”过程Mn2+转化为MnCO3的离子方程式为________________________________________________________________________。
(5)“焙烧”过程MnCO3转化为MnO2的化学方程式为________________________________________________________________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
沉淀的洗涤方法 加入蒸馏水(或其他溶剂)至浸没固体, 滤净,重复2~3次。
检验沉淀是否洗净的方法 分析清楚溶液中的成分—— Cl-、CO32-、SO42-、Fe3+、NH4+
(2)结晶:
蒸发结晶 NaCl 蒸发浓缩、冷却结晶 CuSO4·5H2O、ZnSO4·7H2O、
CaBr2·6H2O、 Al2(SO4)3·18H2O
蒸发浓缩、趁热过滤、冷却结晶
重结晶
2012上海卷—除去CuSO4·5H2O中含有的Cu(NO3)2 2009广东卷—除去Mg(ClO3)2中含有的NaCl 2007广东卷—除去NH4Cl中含有的Na2SO4
针对练习1: 卤块的主要成分是MgCl2,此外还含Fe3+、Fe 2+ 、Mg 2+ 等离子。若以它为原料按下图所示工艺流程进行生产 ,可制得轻质氧化镁
一、核心反应——陌生方程式的书写
连二亚硫酸钠(Na2S2O4) 其可溶于水,但不溶 于甲醇。工业制备流程如下:
(3)流程②步骤中的化学方程式为 ______________。
二、基本理论与实验操作 1、原料的预处理---实验操作
(1)流程①步骤中需在耐高温的坩埚中进行, 常用来制做耐高温坩埚的金属氧化物化学式 为_____________。 (2)向锌液中鼓入M气体,使液态锌雾化,冷 却得到粒度约为180的锌粉(粒度表示晶体或 固体颗粒平均大小程度的数值)。若气体M为 常见的化合物,则M的电子式为______。分 散系A为_______(填“溶液”“胶体”或“ 悬浊液”)。
高三二轮复习
工艺流程专题
【高考题呈现:2015浙江理综化学】某同学采用硫铁矿焙烧取 硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3),不考虑其他 杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
足量酸 烧渣
固体 1 溶液 1
试剂 X
NaOH 溶液 控制 pH
固体 2 溶液 2
卤块
① 加盐酸
② 溶液
加X
溶液
③
加Y pH=9.8
④ 滤液
加Z 过滤
沉淀物
沉淀物 ⑤ 水中煮沸
沉淀物 ⑥ 灼烧
轻质氧化物
气体
如果要求产品尽量不含杂质离子,而且成本较低。流程中所 用试剂或pH控制可参考下列附表确定。
表1 生成氢氧化物沉淀的pH
物质 Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2
理 • 4、了解流程题中产品的分离提纯,准确计
算产品的纯度 • 5、结合生产实际,了解物质的循环利用及
工艺流程的成本与环境保护问题
例题1:(2016青岛一模)(14分)在印染工业中,连 二亚硫酸钠(Na2S2O4)因能使染好的布褪色,而使 布能重新染色,故而俗称保险粉,其可溶于水,但 不溶于甲醇。工业制备流程如下:
(3)流程②步骤中的化学方程式为 ___________________。
(4)流程③步骤中加入NaCl固体的作用为_______。 过滤后用_____洗涤、干燥后可以得到纯净的保险 粉。
一、元素化合物知识(核心反应) ——陌生方程式的书写思路
找物质----关注箭头指向,前后追溯物质 标变价,看变化---氧化还原规律与非氧化还原规律 看环境,配守恒----反应实际
高考中的工艺流程题
以与工业生产和日常生活密切相关的物质制备、分离和提纯 为中心,以流程图为信息背景, 以物质的性质、转化、分离等为考查点, 将元素化合物、反应原理、化学实验等内容有机融合。
两条主线:1、元素化合物知识
2、基本理论与实验操作
学习目标
• 1、掌握流程题中陌生方程式的书写 • 2、了解流程题中原料的预处理方法 • 3、理解掌握流程题中反应条件的控制及原
2、反应条件的控制---基本理论
反应条件的控制小结
温度、pH、保护气
➢温度:
反应速率 物质的溶解度 物质的热分解与挥发 弱离子的水解(平衡)
➢pH: 物质的沉淀与溶解 弱离子的水解
➢保护气: 隔绝空气(主要是O2、H2O) 弱离子的水解
3、产品的分离提纯---实验操作
连二亚硫酸钠(Na2S2O4)可溶于水,但不溶于甲醇。 工业制备流程如下:
开始沉淀 2.7 7.6 8.3 9.6
沉淀完全 3.7 9.6* 9.8 11.1
表2 工业品价格表
工业品 漂液 过氧化氢 烧碱 纯碱 卤块
规
格
含 NaClO 25.2% Nhomakorabea30%
98%
99.5% 含 MgCl2 30%
价格(元/t) 450 2400 2100 600 310
(1)在步骤②中加入的物质X,最佳选择应 是_____,其作用是______。
请回答下列问题:
(1)流程①步骤中需在耐高温的坩埚中进行,常用来制 做耐高温坩埚的金属氧化物化学式为 _____________。 (2)向锌液中鼓入M气体,使液态锌雾化,冷却得到 粒度约为180的锌粉(粒度表示晶体或固体颗粒平均 大小程度的数值)。若气体M为常见的化合物,则M 的电子式为______。分散系A为_______(填“溶液 ”“胶体”或“悬浊液”)。
(4)流程③步骤中加入NaCl固体的作用为 _______。过滤后用_____洗涤、干燥后可 以得到纯净的保险粉。
产品的分离提纯小结
----过滤、结晶、蒸馏、萃取分液
(1)过滤:
沉淀的洗涤——水(冰水、热水)、 有机物(乙醇、乙醚)
(主要考虑溶解度) 降低因溶质的溶解而引起的损耗; 乙醇易挥发,有利于干燥,同时可防 止溶质与水反应生成结晶水合物。
原料的预处理小结
➢研磨,雾化:增大固体样品与液体(或气体)的接触 面积,加快反应速率。
➢灼烧:(焙烧、煅烧) 除去可燃性的杂质(或使原料初步转化)
➢浸出:(水浸、酸浸、碱浸) 使原料中的**溶解(物理溶解或与浸取液 接触反应),可溶性离子进入溶液,不溶 物通过过滤除去。
➢搅拌: 使反应物充分接触,增大反应(或溶解) 速率。
FeSO4·7H2O
下列说法不正确的是( D) A.溶解烧渣选用足量硫酸,试剂X选用铁粉 B.固体1中一定含有SiO2,控制pH是为了使Al3+转化 为Al(OH) 3,进入固体2 C.从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止 其氧化和分解 D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀 用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O
